La bolsa adhesiva perineal es el método más usado en nuestro medio para la recogida de orina para cultivo en el lactante, a pesar de que presenta un alto riesgo de contaminación y de resultados falsos positivos. Nos proponemos cuantificar ambos riesgos a través de una revisión sistemática.
MétodosBúsqueda actualizada a mayo del 2014 en PUBMED, SCOPUS (incluye EMBASE), IBECS; CINHAL, LILACS Y CUIDEN, sin límites de idioma ni tiempo. Se extrajeron porcentajes de orinas contaminadas, falsos positivos, sensibilidad y especificidad (respecto cateterismo o punción vesical).
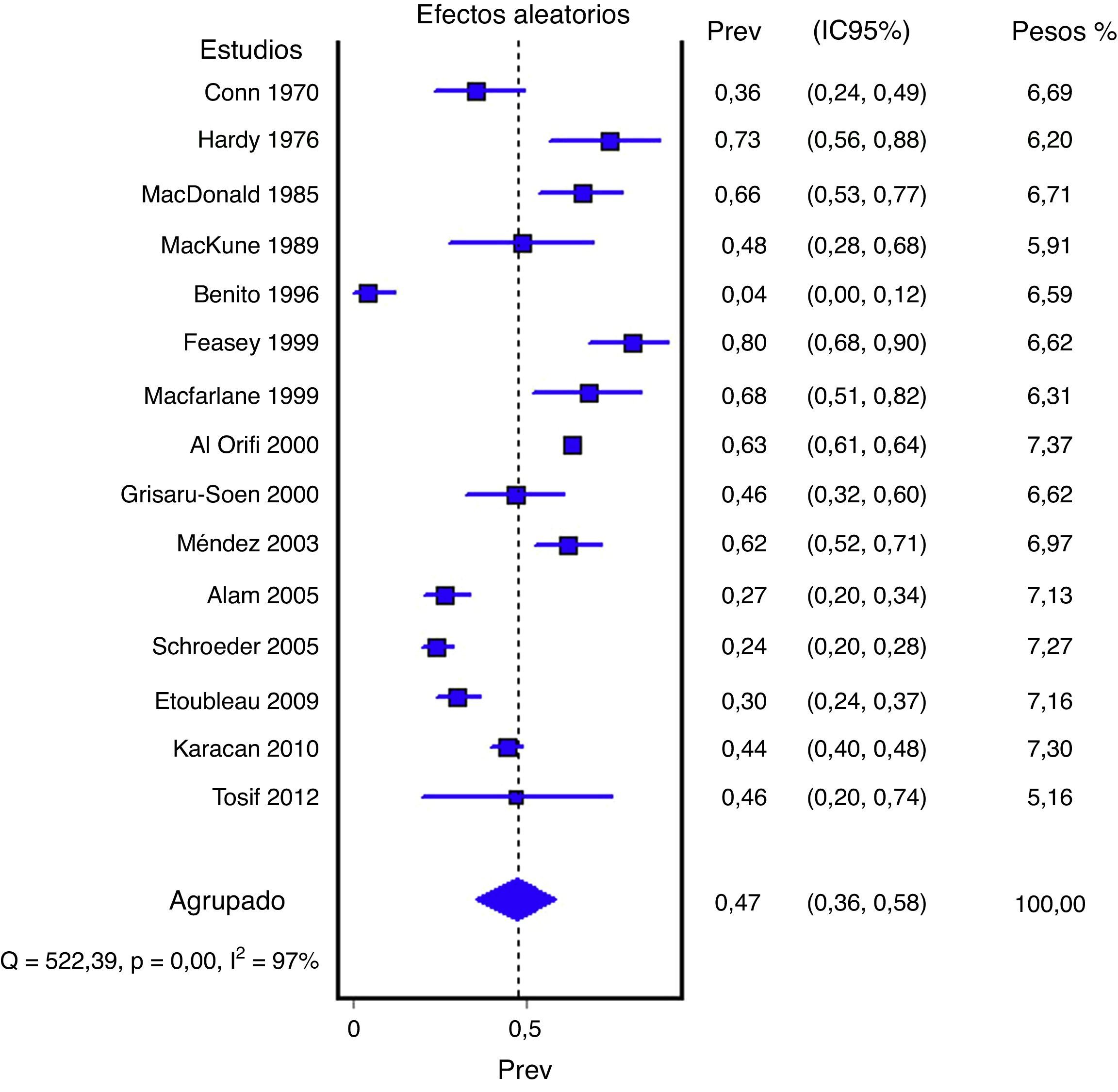
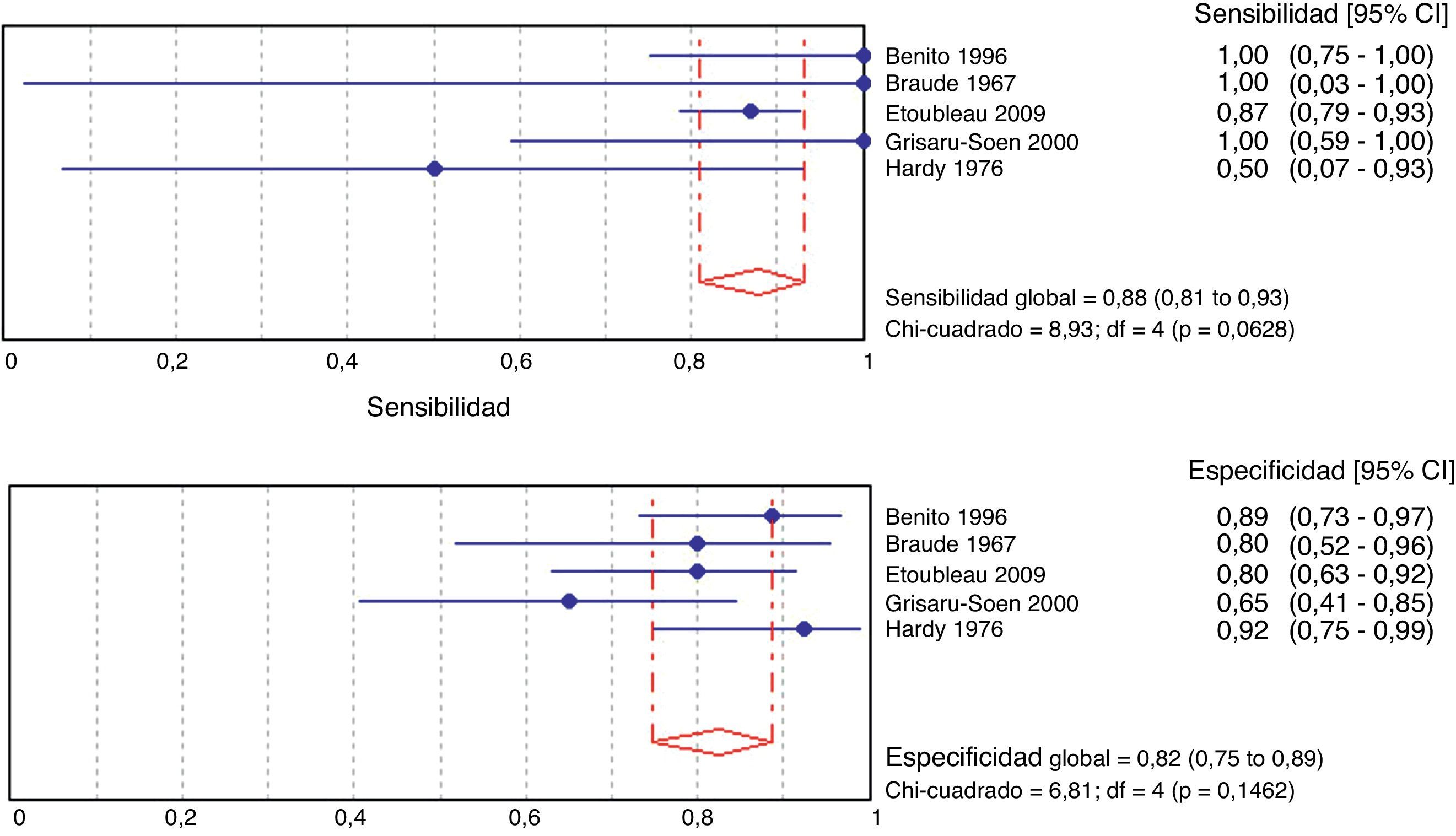
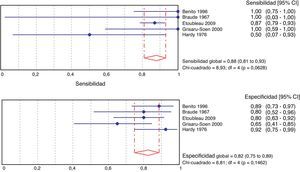
ResultadosSe seleccionaron 21 artículos de calidad media (7.659 muestras). El porcentaje agrupado de orinas contaminadas fue del 46,6% (15 estudios; 6.856 muestras; intervalo de confianza del 95% [IC del 95%], 35,6 a 57,8%; I2: 97,3%). El porcentaje agrupado de falsos positivos fue del 61,1% (12 estudios; 575 muestras; IC del 95%, 37,9 a 82,2%; I2: 96,2%). En 5 estudios se pudieron estimar la sensibilidad (88%; IC del 95%, 81 a 93%; I2: 55,2%) y especificidad (82%; IC del 95%, 75 a 89%; I2: 41,3%), aunque en los recuentos no se incluyeron orinas contaminadas.
ConclusiónLa bolsa adhesiva perineal no es un método suficientemente válido para cultivo de orina porque casi la mitad resultarán contaminados y de los positivos 2 de cada 3 serán falsos. Aun siendo estimaciones imprecisas, por su gran heterogeneidad, deben ser tenidas en cuenta en la elección del método de recogida de orina. Las estimaciones de sensibilidad y especificidad no son aplicables por no considerar el riesgo de contaminación.
The perineal adhesive bag is the most used method in our country for urine culture collection in infants, despite having a high risk of contamination and false-positive results. We aim to quantify both types of risks through a systematic review.
MethodsSearch updated in May 2014 in PUBMED, SCOPUS (includes EMBASE), IBECS; CINAHL, LILACS AND CUIDEN, without language or time limits. Percentages of contaminated urines, false positives, sensitivity and specificity (with respect to catheterization or bladder puncture) were recorded.
ResultsA total of 21 studies of medium quality (7,659 samples) were selected. The pooled percentage of contaminated urines was 46.6% (15 studies; 6856 samples; 95% confidence interval [95% CI]: 35.6 to 57.8%; I2: 97.3%). The pooled percentage of false positives was 61.1% (12 studies; 575 samples; 95% CI: 37.9 to 82.2%; I2: 96.2%). Sensitivity (88%; 95% CI: 81-93%; I2: 55.2%), and specificity (82%; 95% CI: 75-89%; I2: 41.3%) were estimated in five studies, but without including contaminated urines.
ConclusionThe perineal adhesive bag is not a valid enough method for urine culture collection, because almost half are contaminated and, if they are positive, two out of three are false. Although these estimates are imprecise, because of their great heterogeneity, they should be considered when choosing the method of urine collection. The estimates of sensitivity and specificity are not applicable because they do not take into account the risk of contamination.
La infección del tracto urinario (ITU) en pacientes pediátricos es una de las causas más comunes de consulta en el sistema sanitario, tanto en Atención Primaria como en Urgencias, y es motivo frecuente de hospitalización. En el niño pequeño, los síntomas de una infección urinaria suelen ser inespecíficos, tales como fiebre sin foco, rechazo del alimento o detención de la curva ponderal. Por ello es especialmente importante la confirmación diagnóstica con un urocultivo. Para su diagnóstico necesitamos métodos sensibles y rápidos, que nos permitan instaurar un tratamiento precoz y disminuir la morbilidad, pero también específicos, para evitar tratamientos y pruebas complementarias innecesarios.
En la actualidad, disponemos de diversas técnicas para la recogida de muestras de orina en niños. Cuando el niño controla la micción, la técnica habitualmente empleada es la recogida de orina del chorro miccional. En niños que no controlan la micción se emplea de forma mayoritaria en nuestro medio la bolsa adhesiva perineal, a pesar de que las orinas recogidas con esta técnica tienen un alto riesgo de contaminación o falsos positivos. Las orinas recogidas con sondaje vesical o punción suprapúbica tienen menor riesgo de contaminación, aunque son técnicas invasivas que implican cierto riesgo; por ello, se utilizan como pruebas de confirmación o en situaciones urgentes en las que se precisa un diagnóstico o tratamiento inmediato1,2. El uso de compresas estériles, técnica empleada en otros países, es excepcional en nuestro entorno.
En diversos informes técnicos y guías de práctica clínica se citan trabajos en los que se muestran las limitaciones de la bolsa perineal para la recogida de urocultivos1,3-5. Sin embargo, no disponemos de ninguna revisión que haya cuantificado el principal problema de esta técnica de recogida de orina: el alto riesgo de contaminación y de falsos positivos. Nos planteamos realizar una revisión sistemática encaminada a estimar la validez de las orinas recogidas con bolsa perineal, como base sobre la que sustentar la emisión de recomendaciones para la práctica clínica.
Material y métodosBúsqueda bibliográficaSe efectuó una búsqueda actualizada hasta mayo del 2014 en las bases de datos PUBMED, SCOPUS (incluye PUBMED y EMBASE), CINHAL, IBECS Y CUIDEN. En ninguna de ellas se puso límites de tipo de estudio, idioma, ni año de publicación.
Para PUBMED, SCOPUS y CINHAL se emplearon 2 estrategias de búsqueda, una exhaustiva cuyos términos incluyen: «infant»[MeSH Terms] OR «child»[MeSH Terms]) AND («Urinary tract infections»[MeSh] OR («Urine» AND «Culture») OR (Urinary AND Infection)) AND («Specimen Handling»[MeSh] OR Specim* OR «Urine Specimen Collection»[Mesh] OR «Bag» OR «Bags») AND («Urine/microbiology»[Mesh] OR «Contamination» OR «false positive» OR «Diagnosis»[Mesh] OR «Sensitivity and Specificity»[Mesh]», y otra más simplificada: («infant OR child») AND «urine» AND «specimen handling». En IBECS y CUIDEN se emplearon términos en castellano equivalentes. Las referencias de los estudios recuperados fueron examinadas en busca de otros trabajos no detectados.
Se identificaron 935 referencias en las búsquedas realizadas tras la exclusión de duplicados. Se revisaron los títulos y los resúmenes de dichas referencias seleccionando 40 artículos que se recuperaron a texto completo. Se examinaron las citas de los artículos recuperados, encontrando 7 artículos suplementarios no identificados en las búsquedas iniciales. Los 47 trabajos recuperados fueron examinados para valorar su inclusión en la revisión. Todo el proceso de búsqueda y revisión fue realizado por duplicado. Las discordancias de criterio entre los revisores se resolvieron por consenso
Criterios de selección de estudiosSe seleccionaron estudios de evaluación de pruebas diagnósticas, con cualquier tipo de diseño, publicados en cualquier idioma y sin límite de fecha, en los que se analizaran muestras de orina recogidas para urocultivo con bolsa adhesiva perineal de pacientes pediátricos de ambos sexos con sospecha o en riesgo de ITU (excluye estudios en niños sanos), tanto en régimen ambulatorio como ingresados. Los estudios debían contener recuentos o porcentajes de orinas contaminadas (según criterio microbiológico expreso) o falsos positivos (urocultivos con bolsa positivos no confirmados con urocultivos realizados por punción suprapúbica o sondaje vesical). Se incluyeron también estudios con recuentos que permitieran estimar la sensibilidad y la especificidad de urocultivos recogidos por bolsa perineal respecto urocultivos recogidos por sondaje vesical o punción suprapúbica.
Extracción de datos y evaluación de la calidadDe cada estudio se extrajo por duplicado información de tamaño de la muestra, país, ámbito (hospital, urgencias o ambulatorio), características de los pacientes (edad y sexo), criterios de inclusión y de exclusión, pruebas evaluadas, criterios de evaluación, recuentos (orinas contaminadas, verdaderos positivos, falsos positivos, falsos negativos y verdaderos positivos), otros resultados, calidad y limitaciones.
Los criterios de calidad evaluados fueron:
- –
Prueba o estrategia bien definida: si la información aportada permite la reproducción del estudio.
- –
Criterio de evaluación válido: si permite clasificar correctamente las orinas como contaminadas, negativas y positivas.
- –
Muestra representativa: si se asemeja a la que será objeto de aplicación de la prueba o estrategia en la clínica (no haya selección sesgada de orinas positivas o exclusión de orinas contaminadas).
- –
Comparación independiente: si la evaluación o interpretación de la prueba y del criterio de evaluación es independiente y objetiva.
- –
Control de sesgos de incorporación y verificación diagnóstica: el primero es el que ocurre cuando el resultado de la prueba diagnóstica forma parte del criterio de evaluación (p. ej., urocultivos por bolsa positivos son consideradas ITU) y el segundo se comete cuando la prueba de referencia se realiza con mayor o menor probabilidad en función del resultado de la prueba diagnóstica a evaluar.
- –
Análisis correcto: si se aporta información suficiente para que se puedan calcular porcentajes no sesgados de orinas contaminadas, falsos positivos, sensibilidad y especificidad.
Se realizó un análisis agrupado para los porcentajes de contaminados y falsos positivos, asumiendo modelos de efectos aleatorios. Los cálculos y las gráficas se realizaron con la utilidad MetaXL para Excel (EpiGear International Pty Ltd). Para el cálculo de medidas de validez agrupadas (sensibilidad y especificidad) se empleó el programa MetaDiSc (ES) v.1.1.1.6. Se estimaron indicadores de heterogeneidad (I2 y Q de Cochrane) e intervalos de confianza del 95% (IC del 95) para todos los parámetros. Se realizaron contrastes de heterogeneidad (Dersimonian y Laird), de sesgo de publicación (Begg y Egger) y de sensibilidad (con exclusión de estudios individuales). Se realizaron análisis de subgrupos, metarregresiones (área geográfica y muestra representativa), gráficos de Galbraith, gráficos acumulativos y de sensibilidad.
ResultadosDe los 47 artículos examinados a texto completo, se seleccionaron 21 que cumplían los criterios de inclusión7-27. El objetivo de la mayoría de los estudios incluidos se basaba en determinar la validez de la bolsa perineal frente a otras técnicas mediante diferentes estimadores. En 15 de ellos7,12-14,16-18,21,22,24-27 se estimaron las orinas contaminadas y en 129,15-17,19,20,23,25 los falsos positivos. Solo en 5 determinaron la validez respecto un patrón de referencia externo9,11,13,16,17. Un artículo fue excluido por analizar muestras de orina para tira reactiva y no para cultivo28.
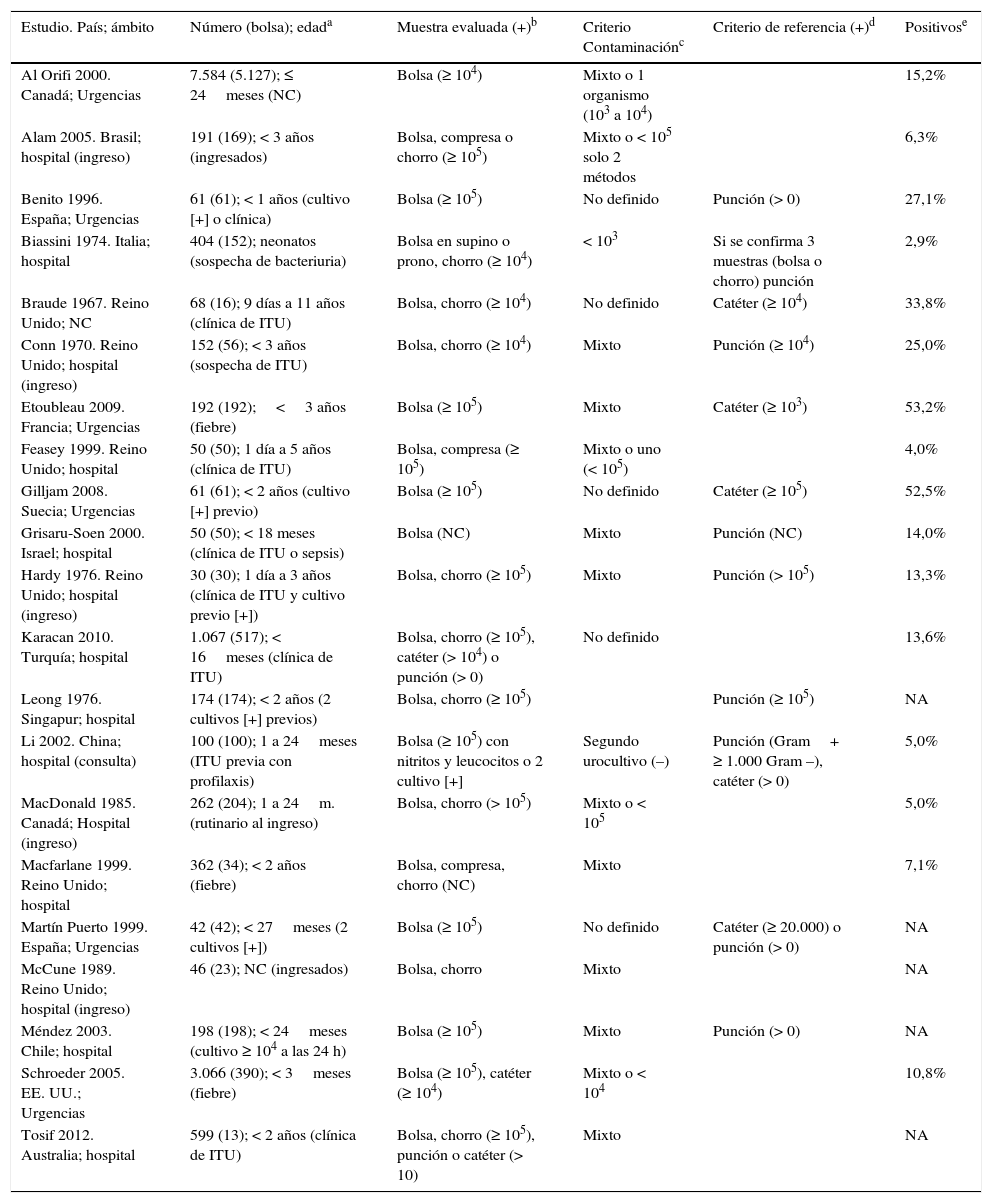
En la tabla 1 se exponen las características simplificadas de los 21 artículos integrados en el metaanálisis. Estos se llevan a cabo en diferentes países, pero sus características y métodos de evaluación resultan muy similares. Los trabajos incluyeron a un total de 14.759 pacientes, 7.659 con muestra de bolsa de orina. Las edades de los niños incluidos en el estudio son parecidas, encontrándose entre un día y 3 años, salvo algún estudio que incluye algún paciente mayor11,14. Los niños incluidos son niños con clínica (la mayoría fiebre sin foco) o sospecha de ITU o pacientes con cultivos previos positivos con técnica de recogida de orina no estéril. Se aportan datos separados por sexos en 5 artículos8,11,12,17,23, con un discreto predominio de mujeres.
Características de los estudios incluidos en el metaanálisis
| Estudio. País; ámbito | Número (bolsa); edada | Muestra evaluada (+)b | Criterio Contaminaciónc | Criterio de referencia (+)d | Positivose |
|---|---|---|---|---|---|
| Al Orifi 2000. Canadá; Urgencias | 7.584 (5.127); ≤ 24meses (NC) | Bolsa (≥ 104) | Mixto o 1 organismo (103 a 104) | 15,2% | |
| Alam 2005. Brasil; hospital (ingreso) | 191 (169); < 3 años (ingresados) | Bolsa, compresa o chorro (≥ 105) | Mixto o < 105 solo 2 métodos | 6,3% | |
| Benito 1996. España; Urgencias | 61 (61); < 1 años (cultivo [+] o clínica) | Bolsa (≥ 105) | No definido | Punción (> 0) | 27,1% |
| Biassini 1974. Italia; hospital | 404 (152); neonatos (sospecha de bacteriuria) | Bolsa en supino o prono, chorro (≥ 104) | < 103 | Si se confirma 3 muestras (bolsa o chorro) punción | 2,9% |
| Braude 1967. Reino Unido; NC | 68 (16); 9 días a 11 años (clínica de ITU) | Bolsa, chorro (≥ 104) | No definido | Catéter (≥ 104) | 33,8% |
| Conn 1970. Reino Unido; hospital (ingreso) | 152 (56); < 3 años (sospecha de ITU) | Bolsa, chorro (≥ 104) | Mixto | Punción (≥ 104) | 25,0% |
| Etoubleau 2009. Francia; Urgencias | 192 (192);<3 años (fiebre) | Bolsa (≥ 105) | Mixto | Catéter (≥ 103) | 53,2% |
| Feasey 1999. Reino Unido; hospital | 50 (50); 1 día a 5 años (clínica de ITU) | Bolsa, compresa (≥ 105) | Mixto o uno (< 105) | 4,0% | |
| Gilljam 2008. Suecia; Urgencias | 61 (61); < 2 años (cultivo [+] previo) | Bolsa (≥ 105) | No definido | Catéter (≥ 105) | 52,5% |
| Grisaru-Soen 2000. Israel; hospital | 50 (50); < 18 meses (clínica de ITU o sepsis) | Bolsa (NC) | Mixto | Punción (NC) | 14,0% |
| Hardy 1976. Reino Unido; hospital (ingreso) | 30 (30); 1 día a 3 años (clínica de ITU y cultivo previo [+]) | Bolsa, chorro (≥ 105) | Mixto | Punción (> 105) | 13,3% |
| Karacan 2010. Turquía; hospital | 1.067 (517); < 16meses (clínica de ITU) | Bolsa, chorro (≥ 105), catéter (> 104) o punción (> 0) | No definido | 13,6% | |
| Leong 1976. Singapur; hospital | 174 (174); < 2 años (2 cultivos [+] previos) | Bolsa, chorro (≥ 105) | Punción (≥ 105) | NA | |
| Li 2002. China; hospital (consulta) | 100 (100); 1 a 24meses (ITU previa con profilaxis) | Bolsa (≥ 105) con nitritos y leucocitos o 2 cultivo [+] | Segundo urocultivo (–) | Punción (Gram+ ≥ 1.000 Gram –), catéter (> 0) | 5,0% |
| MacDonald 1985. Canadá; Hospital (ingreso) | 262 (204); 1 a 24m. (rutinario al ingreso) | Bolsa, chorro (> 105) | Mixto o < 105 | 5,0% | |
| Macfarlane 1999. Reino Unido; hospital | 362 (34); < 2 años (fiebre) | Bolsa, compresa, chorro (NC) | Mixto | 7,1% | |
| Martín Puerto 1999. España; Urgencias | 42 (42); < 27meses (2 cultivos [+]) | Bolsa (≥ 105) | No definido | Catéter (≥ 20.000) o punción (> 0) | NA |
| McCune 1989. Reino Unido; hospital (ingreso) | 46 (23); NC (ingresados) | Bolsa, chorro | Mixto | NA | |
| Méndez 2003. Chile; hospital | 198 (198); < 24meses (cultivo ≥ 104 a las 24 h) | Bolsa (≥ 105) | Mixto | Punción (> 0) | NA |
| Schroeder 2005. EE. UU.; Urgencias | 3.066 (390); < 3meses (fiebre) | Bolsa (≥ 105), catéter (≥ 104) | Mixto o < 104 | 10,8% | |
| Tosif 2012. Australia; hospital | 599 (13); < 2 años (clínica de ITU) | Bolsa, chorro (≥ 105), punción o catéter (> 10) | Mixto | NA |
Catéter: sondaje vesical; chorro: chorro miccional; compresa: compresa estéril; NA: no aplicable; NC: no consta; punción: punción suprapúbica.
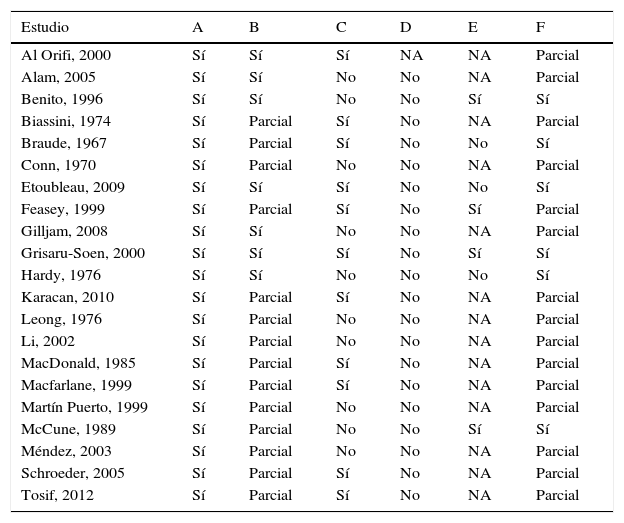
En la tabla 2 se expone la valoración de la calidad de todos los estudios incluidos en el metaanálisis. Los criterios de evaluación empleados para contaminación de la muestra o positividad/negatividad de la misma son apropiados, aunque solo en una tercera parta de los estudios se emplea un patrón de referencia completo para todas las muestras. En la mitad de los estudios la muestra presenta algún tipo de sesgo, fundamentalmente en los que se han evaluado la sensibilidad y la especificidad, ya que en los análisis no se incluyen muestras contaminadas; en otros estudios la muestra incluye una sobrerrepresentación de pacientes con orinas previamente positivas. Ningún estudio detalla procedimientos para garantizar la evaluación independiente o ciega de las pruebas comparadas, aunque la interpretación del cultivo es una prueba relativamente objetiva. La incorporación sesgada de muestras de bolsa con cultivo positivo es habitual en varios trabajos. Finalmente, todos los estudios incluidos ofrecen recuentos que permiten un análisis correcto, aunque solo en una cuarta parte se puede hacer evaluación completa de validez.
Calidad de los estudios incluidos en el metaanálisis
| Estudio | A | B | C | D | E | F |
|---|---|---|---|---|---|---|
| Al Orifi, 2000 | Sí | Sí | Sí | NA | NA | Parcial |
| Alam, 2005 | Sí | Sí | No | No | NA | Parcial |
| Benito, 1996 | Sí | Sí | No | No | Sí | Sí |
| Biassini, 1974 | Sí | Parcial | Sí | No | NA | Parcial |
| Braude, 1967 | Sí | Parcial | Sí | No | No | Sí |
| Conn, 1970 | Sí | Parcial | No | No | NA | Parcial |
| Etoubleau, 2009 | Sí | Sí | Sí | No | No | Sí |
| Feasey, 1999 | Sí | Parcial | Sí | No | Sí | Parcial |
| Gilljam, 2008 | Sí | Sí | No | No | NA | Parcial |
| Grisaru-Soen, 2000 | Sí | Sí | Sí | No | Sí | Sí |
| Hardy, 1976 | Sí | Sí | No | No | No | Sí |
| Karacan, 2010 | Sí | Parcial | Sí | No | NA | Parcial |
| Leong, 1976 | Sí | Parcial | No | No | NA | Parcial |
| Li, 2002 | Sí | Parcial | No | No | NA | Parcial |
| MacDonald, 1985 | Sí | Parcial | Sí | No | NA | Parcial |
| Macfarlane, 1999 | Sí | Parcial | Sí | No | NA | Parcial |
| Martín Puerto, 1999 | Sí | Parcial | No | No | NA | Parcial |
| McCune, 1989 | Sí | Parcial | No | No | Sí | Sí |
| Méndez, 2003 | Sí | Parcial | No | No | NA | Parcial |
| Schroeder, 2005 | Sí | Parcial | Sí | No | NA | Parcial |
| Tosif, 2012 | Sí | Parcial | Sí | No | NA | Parcial |
A: prueba o estrategia bien definida; B: criterio de evaluación válido; C: muestra representativa; D: comparación independiente; E: control de sesgos de incorporación y verificación diagnóstica; F: análisis correcto.
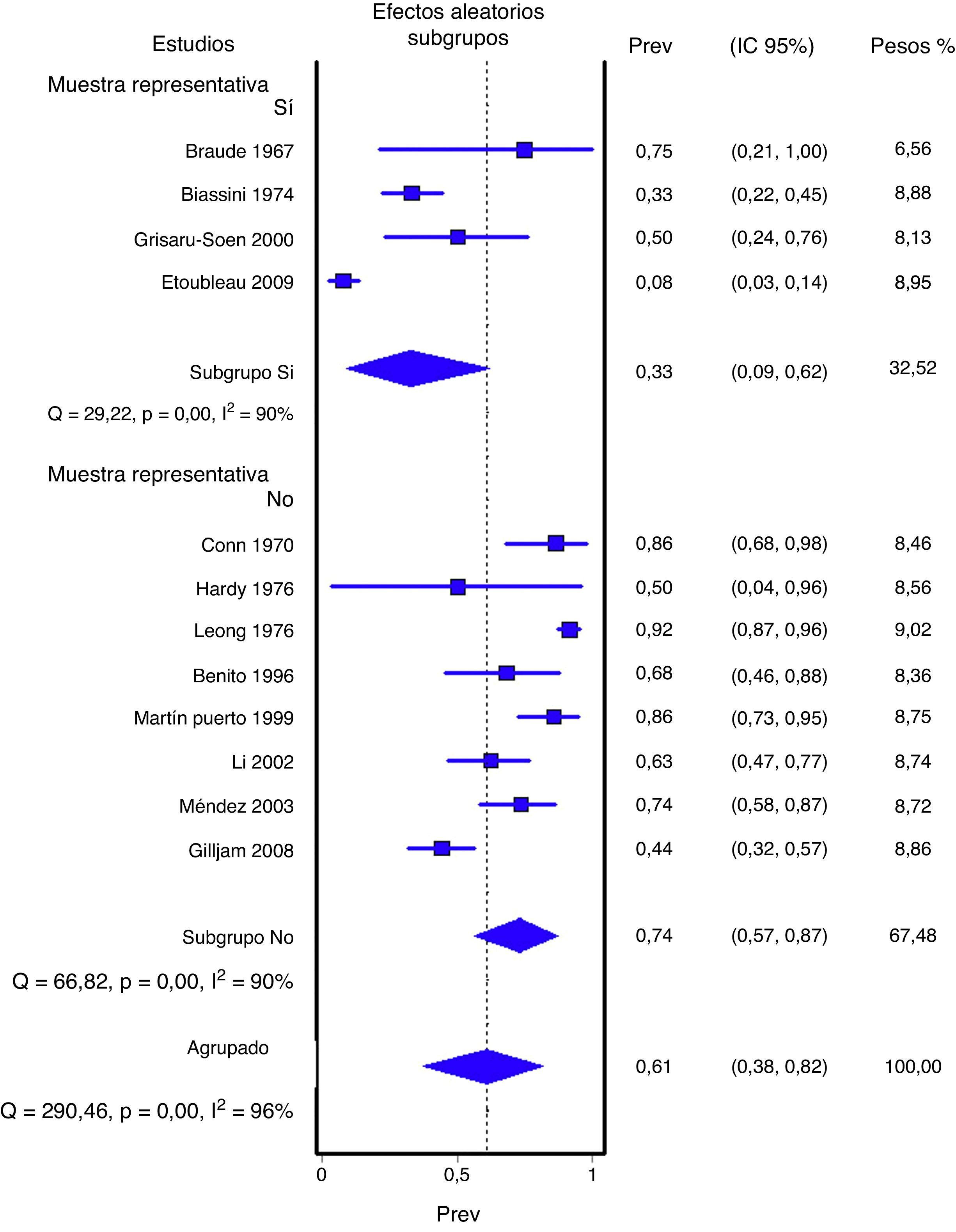
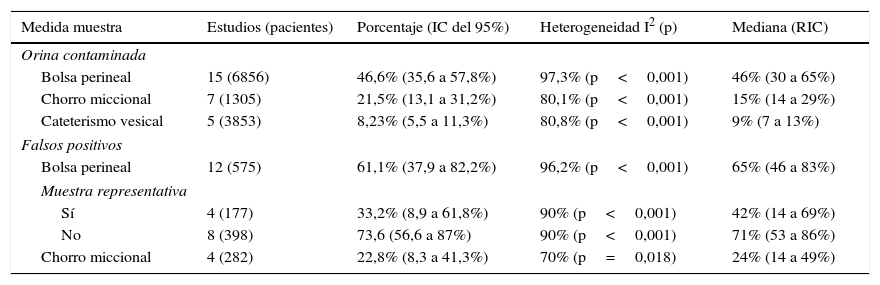
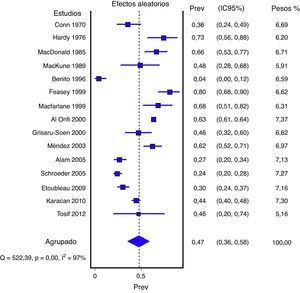
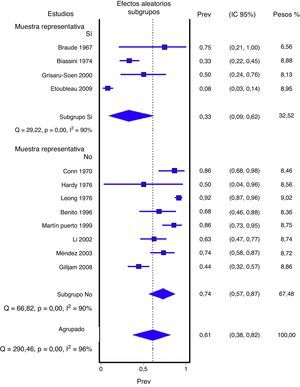
En las figuras 1 y 2 se presenta el metaanálisis de orinas contaminadas y falsos positivos con bolsa perineal. En la tabla 3 se recogen las medidas agrupadas para bolsa perineal y los de otras muestras analizadas en los estudios revisados. Para la orina recogida con bolsa el porcentaje ponderado de orinas contaminadas es del 46,6% y el de falsos positivos del 61,1%. En los análisis de metarregresión se identificó que los estudios con muestras de pacientes representativas tenían un significativo menor porcentaje de falsos positivos; por ello realizamos un metaanálisis por subgrupos. Todas los análisis reflejan una heterogeneidad importante (I2>50%), aunque en ninguno de los análisis realizados se ha identificado ningún estudio cuya exclusión redujera la heterogeneidad. Los contrastes de sesgos de publicación (Begg y Egger) no han mostrado significación estadística.
Resultados agrupados del metaanálisis para contaminación y falsos positivos. Porcentajes ponderados con sus intervalos de confianza del 95% (IC del 95%), heterogeneidad (I2), contraste de Dersimonian y Laird (p), medianas y rangos intercuartílicos (RIC)
| Medida muestra | Estudios (pacientes) | Porcentaje (IC del 95%) | Heterogeneidad I2 (p) | Mediana (RIC) |
|---|---|---|---|---|
| Orina contaminada | ||||
| Bolsa perineal | 15 (6856) | 46,6% (35,6 a 57,8%) | 97,3% (p<0,001) | 46% (30 a 65%) |
| Chorro miccional | 7 (1305) | 21,5% (13,1 a 31,2%) | 80,1% (p<0,001) | 15% (14 a 29%) |
| Cateterismo vesical | 5 (3853) | 8,23% (5,5 a 11,3%) | 80,8% (p<0,001) | 9% (7 a 13%) |
| Falsos positivos | ||||
| Bolsa perineal | 12 (575) | 61,1% (37,9 a 82,2%) | 96,2% (p<0,001) | 65% (46 a 83%) |
| Muestra representativa | ||||
| Sí | 4 (177) | 33,2% (8,9 a 61,8%) | 90% (p<0,001) | 42% (14 a 69%) |
| No | 8 (398) | 73,6 (56,6 a 87%) | 90% (p<0,001) | 71% (53 a 86%) |
| Chorro miccional | 4 (282) | 22,8% (8,3 a 41,3%) | 70% (p=0,018) | 24% (14 a 49%) |
En 2 estudios8,17 se contabilizan por separado los datos de niños y niñas, presentando un mayor riesgo de orina contaminada los niños (38,9% frente a 29,2%; odds ratio [OR] 1,53; IC el 95, 1,36 a 1,72). Lo mismo se hace en 4 estudios para falsos positivos, no encontrando diferencias significativas (OR 0,96; IC del 95, 0,25 a 3,65). Para orinas recogidas con chorro miccional y cateterismo vesical, los riesgos de orina contaminada o falso positivo son claramente menores.
En la figura 3 se presenta el metaanálisis para indicadores de validez del cultivo con bolsa perineal respecto técnica estéril. La sensibilidad y la especificidad ponderada son del 88 y el 82%, respectivamente. Estas estimaciones no presentan heterogeneidad.
DiscusiónA pesar de que la recogida de orina para cultivo mediante bolsa perineal es de uso generalizado, la evidencia disponible indica que es un método poco válido por alto riesgo de orinas contaminadas y de falsos positivos. Debemos reconocer que los estudios encontrados resultan muy heterogéneos, por lo que las cifras encontradas son necesariamente imprecisas. Aunque la heterogeneidad observada podría ser inaceptable para medidas relativas de riesgo, es frecuente encontrar índices I2 por encima del 90% en metaanálisis de estudios de prevalencia29-35. De hecho, en metaanálisis de riesgos las diferencias de prevalencia basal entre estudios, que se ven parcialmente compensadas con las medidas relativas, son uno de los condicionantes principales de heterogeneidad.
Incluso aceptando los límites más favorables de nuestras estimaciones, resultan claramente inaceptables. El hecho de que uno de cada 2 cultivos de orinas recogidas con bolsa perineal resulte contaminado o falsamente positivo compromete la utilidad de la técnica, o al menos debe hacer que nos cuestionemos la validez de sus resultados.
Los altos porcentajes de contaminación y falsos positivos tienen que ver con el procedimiento que se lleva a cabo, en cuanto a la limpieza, la colocación y el recambio de la bolsa perineal, según la meticulosidad de la técnica existen diferentes riesgos de contaminación10. Según nuestros resultados, el riesgo de contaminación de la orina en niños es algo mayor, aunque en ambos casos inaceptablemente altos. Aunque el porcentaje de falsos positivos es menor en los estudios en los que las muestras no incluyen una sobrerrepresentación de pacientes con urocultivos previos positivos, es, en todo caso, un porcentaje muy elevado. Estos estudios no se excluyeron del metaanálisis porque es habitual que los niños con urocultivos (con bolsa) previos positivos sean sometidos a nuevos cultivos. Este hecho tiende a sobrestimar los casos positivos en las muestras, pero no tendría por qué influir en el porcentaje de confirmación (falsos positivos) con técnicas de referencia.
Sorprende observar que el análisis de la validez realizado en los 5 estudios donde se pudieron estimar la sensibilidad y la especificidad, respecto a técnicas de recogida estéril, muestren cifras por encima del 80%. Es evidente que si en los recuentos considerados para el análisis de validez no se tienen en cuenta las orinas contaminadas (que no pueden ser contabilizadas como positivas ni como negativas y que en la práctica clínica son muy frecuentes), cualquier estimación resulta sesgada. No obstante, no podemos descartar que existan entornos de trabajo o grupos de pacientes en los que, mediante una aplicación estricta de las medidas higiénicas, puedan conseguirse estos resultados.
Los resultados de esta revisión reflejan las limitaciones de los estudios incluidos en la misma. La mayoría de ellos son de calidad media, ya que un criterio importante, como la valoración independiente o ciega de la prueba diagnóstica y del criterio de referencia, no consta en ningún estudio. Asimismo, las muestras de pacientes incluidas no son suficientemente representativas por sesgos en la inclusión de muestras previamente positivas o contaminadas. De igual manera, sorprende que la mayoría de los trabajos se hagan en el medio hospitalario, a pesar de que es en los centros de salud donde son atendidos muchos de los lactantes con síntomas de ITU.
Aunque en distintos documentos y guías de práctica clínica ya se recomienda el empleo de otras técnicas para la recogida de orina, cuando el diagnóstico debe ser fiable1,2, la información de esta revisión permite cuantificar el peso y la importancia de esta recomendación. Considerando el alto riesgo de contaminación, si tenemos un paciente de alto riesgo, al que queremos realizar tratamiento antibiótico inmediato, no podemos fiarnos de un cultivo recogido con bolsa perineal. Si el resultado de este cultivo es una orina contaminada no sabríamos si el paciente tiene o no infección. De igual manera, un resultado positivo tendría un alto riesgo de ser falso. Además, el antibiótico administrado interferiría en la validez de una nueva muestra de orina, que recogiéramos para confirmar el diagnóstico. La incertidumbre diagnóstica afectaría no solo al mantenimiento del tratamiento, sino, además, a la indicación o no de otras pruebas diagnósticas y seguimiento. La cascada iatrogénica que desencadena todo diagnóstico erróneo debe ser también considerada.
En pacientes de bajo riesgo, en los que el diagnóstico es poco probable y la demora del tratamiento aceptable, podríamos recoger la orina con bolsa y esperar su resultado. El carácter menos invasivo y la facilidad de esta técnica han hecho que esta sea la estrategia habitual en nuestra práctica asistencial. Pero tenemos que ser conscientes de que solo serán aceptables resultados negativos, porque los positivos serán muy probablemente falsos y habrá que confirmarlos con técnicas de recogida de orina más válidas (cateterismo vesical o punción suprapúbica). Esta recomendación, recogida en documentos de consenso1,2, es de carácter pragmático, aun asumiendo que un esmero cuidado en la ejecución del procedimiento de limpieza, la colocación y el recambio de la bolsa minimizará los defectos de esta técnica de recogida de orina.
Podemos concluir diciendo que la bolsa adhesiva perineal no es un método suficientemente válido para la recogida de orina para cultivo porque casi la mitad de los cultivos resultarán contaminados y 2 de cada 3 positivos será falso. Aun siendo estimaciones imprecisas, por la gran heterogeneidad de los estudios disponibles, deben ser tenidas en cuenta en la elección del método de recogida de orina. Las estimaciones de sensibilidad y especificidad no son aplicables por no considerar el riesgo de contaminación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.