Streptococcus pneumoniae (SP) es un patógeno que causa un elevado consumo de antibióticos. Objetivos: conocer la sensibilidad a antibióticos de uso habitual, los factores epidemiológicos asociados y favorecer el uso racional de antibióticos.
Pacientes y métodosEn verano del 2009 y el invierno del 2010 realizamos un estudio multicéntrico en Atención Primaria (AP). Se recogió una muestra nasofaríngea y se cumplimentó una encuesta epidemiológica en 1.562 niños de 1 y 4 años.
ResultadosEl 31,3% (489/1.562) eran portadores nasales (PN). Se realizó un estudio de sensibilidad en 376 aislados, y se serotipificaron 343. El 61,7% (964/1.562) habían recibido al menos una dosis de vacuna antineumocócica conjugada heptavalente (PCV7). El 12,8% (44/343) correspondía a serotipos vacunales (SV). La resistencia a penicilina (criterio meningitis CMI>0,06mg/l) fue del 28%, siendo del 54% para los SV. Para infecciones no meníngeas, el 100% de los aislados eran sensibles a penicilina parenteral (CMI ≤ 2mg/l). Existe un alto nivel de resistencias para eritromicina (45,8%). Fueron factores favorecedores de resistencia haber tomado antibióticos el mes previo y ser portador de SV tanto para penicilina como para cefotaxima y la edad de 4 años un factor de protección. Los serotipos 14, 35B, 19A, 15A y 19F fueron los menos susceptibles a penicilina.
ConclusionesLa amoxicilina por vía oral para pacientes ambulatorios y la penicilina o ampicilina por vía intravenosa para pacientes ingresados son excelentes opciones para el tratamiento de infecciones neumocócicas no meníngeas, en entornos como el nuestro, con una baja incidencia de aislados con alto nivel de resistencia a penicilina (CMI ≥ 2mg/l).
Streptococcus pneumoniae (SP) is a human pathogen that involves a high use of antibiotics. The objective of the study was to determine the susceptibility to commonly used antibiotics and their associated risk factors, in order to promote rational use of antibiotics.
Patients and methodsIn A multicentre study was conducted in summer 2009 and winter 2010 on children attending paediatric clinics in the Region of Murcia. A nasopharyngeal sample was collected and an epidemiological questionnaire was completed. The study included 1562 children aged 1 and 4 years old.
ResultsAlmost one-third (31.3%, 489/1562) of children were nasal carriers. A sensitivity study was carried out on 376 isolates, of which 343 were serotyped. Almost two-thirds (61.7%, 964/1562) of children had received at least one dose of PCV7 (heptavalent pneumococcal conjugate vaccine), and 12.8% (44/343) of the isolates belonged to PCV7 serotypes. The prevalence rates of penicillin resistance (meningitis infections criteria CMI>0.06mg/L) were 28.1%; however, this percentage was 54% in PCV7 serotypes. None of the isolates had (MIC >2mg/L), so prevalence rates of susceptibility with non-meningitis infections criteria were 100%. There was a high percentage of erythromycin resistance (45.7%). The factors favouring resistance to penicillin and cefotaxime were the consumption of antibiotics in the previous month and the carrying of vaccine serotypes. On the other hand, the age of 4 years old was a protective factor of resistance. The 14, 35B, 19A, 15A, and 19F serotypes were less susceptible to penicillin.
ConclusionsBoth oral amoxicillin given to outpatients and intravenous penicillin or ampicillin to hospitalized patients are excellent options for the treatment of non-meningeal infections, as seen with pneumonia in these kinds of environments, where there is low incidence of isolates highly resistant to penicillin (CMI ≥ 2mg/L).
Streptococcus pneumoniae (SP) es uno de los patógenos que con más frecuencia ocasiona infecciones comunitarias, tanto en la población pediátrica como en adultos. Causa enfermedad invasora grave como sepsis, meningitis y neumonía bacteriémica, además de otros procesos menos graves pero mucho más frecuentes como otitis y sinusitis, por lo que su impacto en salud pública es muy elevado, originando un elevado consumo de antibióticos1. Nuestro objetivo fue conocer, en nuestro ámbito geográfico, la sensibilidad del SP a los antibióticos de uso habitual y su relación con los factores epidemiológicos recogidos en orden a alcanzar una utilización más racional de los antibióticos.
Material y métodosRealizamos un estudio multicéntrico transversal en niños de 1 y 4 años de la Comunidad Autónoma de la Región de Murcia (CARM). La población de la CARM en 2009 era de 18.479 niños de un año y 17.555 de 4 años (Instituto Nacional de Esatadística)2. El estudio se realizó en niños que acudían para revisión en el «Programa del niño sano», de forma discrecional. Se incluyó a niños sanos de 12 meses (10-14 meses) y de 4 años (3,5-4,5 años) vacunados o no con VCN7. Se excluyó a aquellos que presentaban procesos febriles o enfermedades crónicas, fibrosis quística o inmunodeprimidos.
En colaboración con la Asociación de Pediatría Extrahospitalaria y Atención Primaria de la Región de Murcia (APERMAP), participaron en el estudio 60 pediatras de Atención Primaria (AP) de la CARM, en todas las áreas de salud excepto una (que representa únicamente el 10% de la población), y microbiólogos de los hospitales de cada área de salud, donde fueron recogidas las muestras. Se nombró un pediatra como coordinador de cada área hospitalaria participante.
Recogida de datosSe realizó en 2 periodos, verano de 2009 e invierno de 2009-2010. Tras explicación verbal, se recogió el consentimiento informado y se realizó un cuestionario epidemiológico, que incluía los siguientes datos: centro de salud, fecha de recogida, edad, sexo, vacunación antineumocócica, lactancia materna, escolarización/asistencia a guardería, antibióticos en el último mes, padres fumadores y número de hermanos. La información se recogió de forma preferente de la historia clínica y se completó, en los casos necesarios, mediante entrevista a los padres. El proyecto fue aceptado por la Fundación para la Formación e Investigación Sanitarias de la Región de Murcia (FFIS) y becado por el programa «Proyectos Fundación Cajamurcia» con la beca FFIS/CM09/037.
Procesamiento microbiológico de las muestrasLa toma de las muestras, exudado nasofaríngeo, se realizó mediante torunda pernasal flexible (Deltalab medio de AMIES®), por personal de enfermería de las consultas de Pediatría de cada centro. Se remitieron a su hospital de área en medio de transporte, donde se sembraron en placas de con sangre de carnero al 5% y disco de optoquina. Se incubaron en estufa durante 24-48 h en atmósfera de CO2 (5-10%) a una temperatura de 37°C. La identificación del neumococo se efectuó mediante la morfología de la colonia, sensibilidad a la optoquina y la solubilidad en sales biliares. Tras su identificación, las cepas se suspendían en un medio de leche descremada (Skim milk Difco®) y se guardaban congeladas a –80°C para su conservación, siendo remitidas al hospital de referencia, en el que se realizaron los estudios de sensibilidad. Posteriormente, se enviaron para su serotipificación al Laboratorio Nacional de Referencia de Neumococos del Instituto Carlos III de Madrid. La CMI a penicilina y cefotaxima se determinó por el método de E-test (bioMèrieux), en placas de agar sangre. Para el resto de los antibióticos estudiados, la sensibilidad antimicrobiana se determinó por el método de difusión con discos en placas de agar sangre. Tras 2 resiembras de la cepa a estudiar en agar sangre, se preparó un inóculo equivalente a una turbidez de 0,5 de la escala de Mc Farland. Se sumergió una torunda en la suspensión, exprimiendo la torunda contra las paredes del tubo y posteriormente se sembró en sábana en una placa de agar sangre en 3 direcciones. Tras dejar secar unos minutos se colocaron tiras de E-test de penicilina y cefotaxima. En otra placa igual se aplicaron discos de los restantes antibióticos ensayados (eritromicina, clindamicina, vancomicina, linezolid, rifampicina y levofloxacino). Ambas placas se incubaron en atmósfera de 5-10% de CO2 a 37°C durante 24h. Para considerar las cepas sensibles, intermedias o resistentes se siguieron las recomendaciones del Clinical and Laboratory Standards Institute en su revisión de 20133. Como cepa control, se utilizó, SP. ATCC 49619.
Análisis estadísticoSe calculó el tamaño muestral en 318 niños en cada uno de los 4 grupos, suponiendo un 30% de portadores con una precisión del 5% para un nivel de confianza del 95%. Para la comparación de las medias se utilizó la prueba estadística de la t de Student. Para el estudio de asociación entre variables cualitativas se realizó un análisis de tablas de contingencia empleando el estadístico de la chi al cuadrado de Pearson. Para la identificación de factores asociados a la resistencia realizó un análisis multivariante mediante regresión logística incluyendo todas aquellas variables que tenían, o estaban muy cercanas, a la significación estadística en el univariante. Se realizó, además, este mismo análisis estadístico estratificado para los de un año en la variable de escolarización. Todos los resultados se consideraron significativos para un valor α < 0,05.
ResultadosSe incluyó a 1.562 niños; 729 de un año (387 verano, 342 invierno) y 833 de 4 años (445 verano, 388 invierno). Del total de los niños incluidos, el 61,7% (964/1.562) habían recibido al menos una dosis de VCN7 y el 58% (905/1562) habían recibido 2 o más dosis. El porcentaje total de PN fue del 24,6% (205/832) en verano y del 38,9% (284/730) en invierno (p<0,001), y un valor medio para toda la cohorte estudiada del 31,3% (489/1.562).
De los 489 aislamientos, perdimos 122 por diversas circunstancias (rotura de congelador, contaminación, lisis durante el transporte de la muestra, etc.), por lo que se realizó antibiograma en 367. En el traslado al Laboratorio Nacional de Referencia de Neumococos perdimos otros 24, por lo que se serotipificaron 343. Por lo tanto, en nuestro estudio de sensibilidades utilizaremos 2 cifras de referencia, 343 cuando intervienen las cepas serotipificadas, y 367, cuando se hace referencia al estudio de sensibilidad antibiótica.
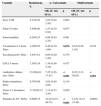
Recuperamos 44 aislados (12,8%) incluidos en la vacuna PCV-7 repartidas entre 4 serotipos, 14 y 23F (16 cada uno), 19F 10 aislados y 6B 2. Otros 83 aislados (24,2%) se distribuían entre los 6 serotipos adicionales de la vacuna PCV-13, destacando los serotipos 6A y 19A con 36 y 31 aislados, respectivamente. Doscientos dieciséis (63%) aislados no estaban incluidos en ninguna de las 2 vacunas.
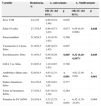
En la tabla 1 representamos el porcentaje de resistencias de penicilina según la vía de administración y la patología a tratar. Entre los 367 aislados, con criterios de infección no meníngea y tratamiento con penicilina v oral se identificaron 103 aislados resistentes (28%), 101 con resistencia intermedia (CMI 0,12-1mg/l) y 2 con alto nivel de resistencia (CMI=2mg/l). Todos fueron sensibles con criterios de infección no meníngea y tratamiento con penicilina parenteral. Los principales serotipos implicados en la resistencia pueden verse en la tabla 2, destacando el 14 con 87,5%, el 35B con el 71,4% el 19A con un 54,8%, 15A el 44% y el 19F un 37,5%. El porcentaje de resistencias de los serotipos incluidos en la PCV-7 fue del 54%, siendo en el resto del 18,4% (p<0,001). En el análisis multivariante (tabla 3) encontramos que el ser portador de SV (p=0,004) y la toma de antibióticos en el mes anterior (p<0,001) para toda la población, y la asistencia a guardería para los de un año (p=0,049) eran factores de riesgo de resistencia a penicilina y tener 4 años (p=0,048) un factor protector en relación a los de un año.
Sensibilidad de S. pneumoniae a penicilina, cefotaxima y eritromicina. Puntos de corte aplicados: CLSI 2013
| Sensible/N.° de aislados | Intermedios/N.° de aislados | Resistentes/N.° de aislados | % no sensibles | |
|---|---|---|---|---|
| Neumococos 367 | ||||
| Penicilina parenteralinfección meningitis (CMI) | ≤ 0,06264 | ≥ 0,12103 | 28 | |
| Penicilina parenteralinfección no meníngea (CMI) | ≤ 2367 | 40 | ≥ 80 | 0 |
| Penicilina oral (penicilinav)(CMI) | ≤ 0,06264 | 0,12-1101 | ≥ 22 | 28 |
| Cefotaxima infección meníngea (CMI) | ≤ 0,5345 | 120 | ≥ 22 | 6 |
| Cefotaxima infección no meníngea (CMI) | ≤ 1365 | 22 | ≥ 40 | 0,5 |
| Eritromicina (CMI) | < 0,25199 | 0 | > 1168 | 45,7 |
CMI mg/l: concentración inhibitoria mínima.
Serotipos más frecuentes y patrones de resistencias en orden descendente de porcentaje de pérdida de sensibilidad a penicilina
| Serotipo | Número de cepas | PENI-NS y (%) | ERITRO-R y (%) |
|---|---|---|---|
| 14 | 16 | 14 (87,5) | 12 (75) |
| 35B | 14 | 10 (71,4) | 1 (7,1) |
| 19A | 31 | 17 (54,8) | 20 (64,5) |
| 15A | 25 | 11 (44) | 21 (84) |
| 19F | 10 | 6 (37,5) | 10 (62,5) |
| 6A | 36 | 9 (25) | 15 (41,6) |
| 23F | 16 | 3 (18,7) | 7 (43,7) |
| 11A | 21 | 0 | 17 (80,9) |
| 6C | 16 | 0 | 7 (43,7) |
| 15B | 16 | 0 | 5 (31,2) |
| 23A | 14 | 0 | 9 (64,3) |
ERITRO-R: eritromicina resistente; PENI-NS: penicilina no sensible.
Análisis univariante y multivariante de las resistencias a penicilina con criterio de CMI>0,06mg/l
| Variable | Resistencia, % | A. univariante | A. Multivariante | ||
|---|---|---|---|---|---|
| OR (IC del 95%) | p | OR (IC del 95%) | p | ||
| Sexo V/M | 24,1/22 | 0,89 (0,54-1,46) | 0,636 | ||
| Edad 1/4 años | 27,7/19,5 | 0,86 (0,73-1,02) | 0,073 | 0,59 (0,34-0,996) | 0,048 |
| Estacionalidad | 21,8/24,5 | 1,16 (0,70-1,92) | 0,566 | ||
| Vacunación ≥ 2 dosis. Sí/no | 21,9/24,3 | 0,88 (0,53-1,45) | 0,607 | ||
| Escolarización. Sí/no | 31,9/18,3 | 0,48 (0,29-0,80) | 0,005 | 0,32 (0,10-0,997)a | 0,049 |
| LM ≥ 3m. Sí/no | 23,9/22,2 | 1,10 (0,67-1,82) | 0,708 | ||
| Antibiótico último mes. Sí/no | 52,6/19,3 | 4,63 (2,31-9,30) | < 0,001 | 4,82 (2,36-9,82) | < 0,001 |
| Padres fumadores. Sí/no | 24,1/22,6 | 1,09 (0,61-1,92 | 0,777 | ||
| Tener ≥2 hermanos. Si/No | 17,5/24,1 | 0,67 (0,32-1,39) | 0,284 | ||
| Portador de SV Si/NO | 54,5/18,4 | 5,32 (2,75-10,32) | < 0,001 | 6,42 (1,79-23,05) | 0,004 |
LM: lactancia materna; M: mujer; SV: serotipo vacunal; V: varón.
Con respecto a la sensibilidad a cefotaxima, de los 367 aislados, 22 (6%) tenían una CMI>0,5mg/l, y de ellos un 63,6% pertenecían a SV (10 al serotipo 14). Encontramos 2 aislados con resistencia de alto nivel a cefotaxima con los puntos de corte de infección meníngea (CMI=2mg/l) correspondientes a los serotipos 14 y 19. No detectamos ningún aislado con CMI > 2mg/l. En el análisis multivariante (tabla 4) encontramos como factores de riesgo de resistencias el ser portador de SV (p<0,001) y el hecho de haber tomado antibióticos en el último mes (p<0,001).
Análisis univariante y multivariante de las resistencias a cefotaxima con criterio CMI>0,5mg/l
| Variable | Resistencia, % | A. Univariante | Multivariante | ||
|---|---|---|---|---|---|
| OR (IC del 95%) | p | OR (IC del 95%) | p | ||
| Sexo V/M | 6,11/6,42 | 1,05 (0,42-2,45) | 0,904 | ||
| Edad 1/4 años | 5,59/6,80 | 1,23 (0,52-2,92) | 0,637 | ||
| Estacionalidad | 6,28/6,25 | 0,99 (0,42-2,33) | 0,991 | ||
| Vacunación ≥ 2 dosis. Sí/no | 4,29/8,92 | 0,46 (0,19-1,09) | 0,076 | 0,54 (0,20-1,45) | 0,222 |
| Escolarizacióna. Sí/no | 5,44/7,81 | 0,68 (0,29-1,59) | 0,374 | ||
| LM ≥ 3 meses | 7,38/5,18 | 1,36 (0,58-3,19) | 0,477 | ||
| Antibiótico último mes. Sí/no | 23,26/4,01 | 7,25 (2,95-17,81) | < 0,001 | 8,02 (3,12-20,62) | < 0,001 |
| Padres fumadores. Sí/no | 9,78/5,09 | 2,02 (0,84-4,84) | 0,114 | ||
| Tener ≥ 2 hermanos. Sí/no | 17,50/24,12 | 1,13 (0,37-3,45) | 0,829 | ||
| Portador de SV. Sí/No | 6,90/6,15 | 16,28 (6,51-40,75) | < 0,001 | 12,54 (4,43-35,49) | 0,0001 |
LM: lactancia materna; M: mujer; SV: serotipo vacunal; V: varón.
La resistencia a eritromicina se situó en el 45,8% (168/367) (tabla 1). Por serogrupos (tabla 2) 15A, 11A, y 14 sobrepasaban el 75%, y 19A, 19F y 23A el 60%. La proporción de aislados resistentes entre los SV fue del 68,5%, mientras que entre los serotipos no vacunales (SNV) fue del 40,8% (p<0,001). De los 264 neumococos sensibles a penicilina, 99 (37,5%) se consideraron resistentes a eritromicina, destacando los serotipos 15A, 11A, 19A, 23A, 6A y 6C. Encontramos diferencias estadísticamente significativas al comparar la resistencia a eritromicina entre aislados sensibles a penicilina y no sensibles (37,5% y 67%, respectivamente), siendo más elevada en los no sensibles (p=0,003).
Se detectó resistencia a clindamicina en 110 cepas (29,9%), destacando los serotipos 19F (10 aislados) y 33F (7 aislados) en los que el 100% eran resistentes y el 15A con el 72% de resistencias (18/25).
En cuanto a la resistencia combinada a varios antibióticos: 69 cepas (18,8%) presentaban resistencia a penicilina y eritromicina y 45 (12,3%) eran multirresistentes (resistencia a 3 o más antibióticos), siendo en ambos casos los serotipos 19A, 15A y 14 los más significativos.
Para el resto de antibióticos estudiados (linezolid, levofloxacino, rifampicina y vancomicina) no encontramos ningún aislado resistente.
DiscusiónRealizamos este estudio 8 años después de la introducción en nuestro país de la PCV7 y ante la inmediata comercialización de nuevas vacunas conjugadas de 10 y 13 serotipos. Queríamos conocer la susceptibilidad de los neumococos circulantes, en la población infantil sana, a los antibióticos de uso habitual, y la influencia de los factores epidemiológicos recogidos, ya que las infecciones respiratorias en las que este microorganismo está implicada (otitis, sinusitis, neumonías) suponen un elevado consumo de antibióticos principalmente a nivel de AP.
El uso inadecuado de antibióticos es un importante problema de salud pública, puesto que se ha asociado a aumento de las resistencias bacterianas1. España se encuentra entre los países europeos con mayor consumo de antibióticos y mayor porcentaje de resistencias1,4.
El mecanismo de resistencia a la penicilina se basa en la alteración de las penicillin-binding proteins (PBP)5. Estas alteraciones producen diversos grados de resistencias, desde niveles muy bajos, cepas sensibles, a niveles intermedios o de alta resistencia5. Para macrólidos se han descrito 2 mecanismos de resistencia. El fenotipo MSLB por modificación enzimática de la diana ribosómica (gen ermB que codifica la producción de metilasas que metilan el 23S ARNr e impiden la unión con la diana). Este mecanismo confiere resistencia cruzada a todos los macrólidos (14, 15 y 16 átomos), a lincosamidas y a estreptograminas. Este fenotipo es el más frecuente en nuestro medio y puede expresarse, a su vez, de forma constitutiva o de forma inducible. Y el fenotipo M que consiste en un sistema de expulsión activa del antibiótico (gen mef[E]). Este mecanismo confiere resistencia a macrólidos de 14 y 15 átomos manteniendo sensibilidad a los de 16 átomos, a lincosaminas y estreptograminas5.
Los patrones de resistencias varían considerablemente entre países y evolucionan con el tiempo1. En el contexto europeo, nuestro país, junto con Francia, ha tenido las tasas más elevadas de resistencias4, observándose un descenso de la resistencia a penicilina en los últimos años. Factores relacionados con estos cambios son el descenso en el uso de antibióticos, la introducción de las nuevas vacunas, además de otros factores menos conocidos, como expansión de clones, etc.1,6-9.
Con respecto a la penicilina, para infección meníngea, en nuestro estudio, encontramos un 28% de las cepas no susceptibles (CMI>0,06mg/l), cifras similares a estudios realizados en España8 e inferiores a otros, tanto en nuestro país como foráneos6,9-11. Al igual que han comunicado otros autores, al aplicar criterios de infección no meníngea y penicilina parenteral (resistencia CMI > 2mg/l), el 100% de los neumococos fueron sensibles10,12,13. Los SV presentan unas tasas mayores de resistencia (54% en nuestro estudio) que los SNV (18%), repitiéndose este hecho en la literatura1,7,9. Existe, por tanto, un descenso importante en las resistencias a penicilina respecto a estudios previos a la comercialización de las vacunas conjugadas realizados en nuestro país (64%14 y 68%15) o en los primeros años de la comercialización de la PCV7, y se relaciona con esta vacuna y con la disminución del consumo de antibióticos9,16.
Como en otros estudios, el ser portador de SV9,10 tener menor edad11, la asistencia a guardería y haber tomado antibióticos el mes antes1,10 se asociaron a resistencia. El serotipo 14 entre los SV, el 19A entre los incluidos en la vacuna trecevalente, el 15A y 35B tienen las tasas más altas de resistencia a penicilina, similar a lo reflejado en otros estudios1,10.
El 94 y el 99,4% eran sensibles a cefotaxima para infecciones meníngeas y no meníngeas, respectivamente, de acuerdo con otras comunicaciones10.
En cuanto a los macrólidos, la resistencia a la eritromicina va unida a la de la penicilina1. Esta asociación también fue observada en nuestro estudio. Encontramos una resistencia muy elevada a la eritromicina, 45,8%, cifra similar a un estudio realizado antes de la comercialización de la PCV714 y superior a otros estudios españoles antes y durante la comercialización de la misma. Esta se relaciona estrechamente con el elevado consumo de macrólidos1,7,9,14. También encontramos asociación de resistencia a macrólidos y SV, de forma similar a lo observado por otros autores9. En la literatura se describe un descenso de resistencias tras la comercialización de la PCV7, por el descenso de los SV y una posterior elevación de las mismas por aparición de SNV como el 19A con elevada tasas de resistencia1,11,13
La resistencia combinada se produjo en 69 cepas (18,8%) sin que haya cambios significativos respecto a trabajos anteriores8.
Para la clindamicina, encontramos un porcentaje de resistencias del 29,9%. En este trabajo no se determinó el fenotipo de resistencia de los macrólidos pero este mejor comportamiento aparente de la clindamicina con respecto a los macrólidos podría depender de la presencia de fenotipos inducibles de MLSB o por la presencia de cepas con un fenotipo M.
Las cifras de multirresistencia (resistencia a 3 o más antibióticos), en Europa, aunque muy variables, se sitúan en torno al 15%1. En nuestro estudio la encontramos en 45 aislados (12,3%), cifra cercana a la media europea.
En infecciones no meníngeas, el cambio en la afinidad de las PBP que confiere a algunos aislados una resistencia relativa, se puede superar con el empleo de concentraciones más altas de penicilina5,16,17. Por lo tanto, en entornos como el nuestro, con baja prevalencia de resistencia de neumococo de alto nivel a penicilina (CMI>2mg/l), la amoxicilina se puede utilizar como tratamiento de primera línea en niños adecuadamente inmunizados con formas leves o moderadas de enfermedad en la que se sospeche etiología neumocócica como la neumonía18. Para aquellos que precisen ingreso hospitalario se puede utilizar penicilina o ampicilina parenterales16,18. Esta estrategia es aplicable para el tratamiento de la otitis media aguda de forma ambulatoria, puesto que dosis de 80-90mg/kg/día permite alcanzar, en el oído medio, concentraciones de amoxicilina dentro de parámetros farmacocinéticos y farmacodinámicos, con tiempos con concentraciones por encima de la CMI que permiten el tratamiento de neumococos con resistencia intermedia (CMI 0,12-1.0mg/l) y de muchos con resistencia de alto nivel (CMI> 2mg/l)19. De igual manera, en sinusitis aguda, altas dosis de amoxicilina pueden alcanzar concentraciones en fluidos nasales adecuadas para superar resistencias atribuibles a la alteración en la PBP20.
El empleo de cefalosporinas de tercera generación es una excelente opción en el tratamiento para infecciones no meníngeas en pacientes no completamente inmunizados, en zonas con alta prevalencia de neumococos con alto nivel de resistencia a penicilina (CMI>2mg/l) y formas graves de enfermedad, incluyendo empiema18.
En infecciones meníngeas, y siempre que se sospeche etiología neumocócica, debe de indicarse el tratamiento con cefotaxima y vancomicina, por su efecto sinérgico, hasta conocer el microorganismo causal y su sensibilidad, dado que un 6% de los aislados tienen resistencia intermedia a cefotaxima y hay 2 aislados con CMI de 2mg/l, y que ambas situaciones se han asociado a fracaso terapéutico con tratamiento solo con cefotaxima o ceftriaxona21.
Los macrólidos deben de ser restringidos en infecciones de vías aéreas, dado el elevado porcentaje de resistencias y solo debe de considerarse su utilización si se sospecha neumonía atípica18 o en casos de alergia tipo i a betalactámicos en procesos no complicados22.
Las principales fortalezas de este trabajo estriban en el momento de su realización, justo antes de la comercialización de las nuevas vacunas, y la cantidad de muestras recogidas a pesar del excesivo número de muestras perdidas. Sin embargo, como suele suceder en este tipo de estudios, no existe aleatorización previa, puesto que la participación es voluntaria, por lo que podría ser una muestra no totalmente representativa. No se recogieron los datos de dosis y duración de la antibioterapia previa, ni se evaluaron las colonizaciones múltiples lo que ha podido modificar los resultados finales.
ConclusionesTeniendo como objetivo final una mejor utilización de antibióticos, nuestros datos permiten apoyar el uso de amoxicilina por vía oral, a dosis elevadas, en la mayoría de las infecciones bacterianas de vías aéreas leves o moderadas como otitis, sinusitis y neumonía adquirida en la comunidad y, en aquellos pacientes que precisen tratamiento parenteral la penicilina y la ampicilina constituyen el tratamiento de elección de las infecciones neumocócicas no meníngeas no complicadas. Tenemos una muy elevada tasa de resistencias a macrólidos, por lo que estos deben de restringirse a situaciones muy específicas. Los serotipos 14, 19A y 15A son los que mayor nivel de resistencias alcanzan. Ser portador de SV, haber tomado antibióticos el mes antes, la edad de un año con respecto a los de 4 y la asistencia a guardería son factores de riesgo de resistencia a penicilina.
FinanciaciónEste proyecto ha sido aceptado por la Fundación para la Formación e Investigación Sanitarias de la Región de Murcia (FFIS) y becado por el programa «Proyectos Fundación Cajamurcia» con la beca FFIS/CM09/037.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
H.U.V. Arrixaca: Ángela Casquet Barceló, Guillermo Nieves González, José M. Calderón Sánchez, Luisa Camps Martínez, Nadia Sayed Sancho, M. Ángeles Chumilla Valderas, Joaquina Villalobos Pérez, M. Matilde Cuenca Gómez, Fuensanta Costa Guirao, Begoña Pelegrin López, Rosario Hurtado del Cerro, José Saura Sánchez Parra, Francisco España, Inmaculada Martínez Artero.
H.U. Morales Meseguer: Antonio Iofrío de Arce, Luisa M. García Sandoval, Jesús Meca Garrido, Enrique Gutiérrez, Beatriz Garnica Martínez, Rosa M. Pérez Tomás, Esperanza Moreno Gomáriz, M. Dolores Hernández-Gil, M. José Vicente Fernández.
H.U. Reina Sofía: Gonzalo Sanz Mateo, Fuensanta Alemán Lorca, Alí Ghandour Houmani, Enrique López Conesa, Silvia Martínez García, Cristina Cañavate González, Mercedes Gutiérrez Pérez, y Antonio Lao García.
H.U. Los Arcos-Mar Menor: Rosa M. Sánchez Andrada, Isabel Cascales Barceló, María Vera Lorente, Maria Teresa José Hernangómez Cuesta, Monserrat Martínez López, Josefina Martínez Garre y Jose Maria Ojeda Escuriet.
H.U. Rafael Méndez: Sebastián Lorente García, Francisco Pérez Navarro, Carmen Nelia Vicente de Jiménez, Manuel García Moreno, Teresa Domínguez Rodríguez, Juan Francisco Soriano Ibarra y Francisco Jaldo Alba.
H.U. Santa Lucía: M. Pilar Espejo García, M. Paz Ortuño del Moral, Lorena Conesa Hernández, M. Dolores Rosique Conesa, Clara Ferrández García, Gloria Heredero García, Javier Peñalver Manrrubia, M Teresa Fábrega Valverde, M Eugenia Serna de Miquel, Eva Rodríguez Martínez, Ana González Pacanowska, Teresa Vidal Vidal.
H.U. Yecla-Altiplano: Juan José Vigueras Abellán, M. Eugenia Fuentes Sebastián, Josefina Romero Ortiz, Lucía González-Moro Azorín, José M. Ibáñez García y Víctor Sánchez Quiñones