Hemos considerado oportuno ampliar información sobre la determinación de anticuerpos antigangliósidos en el síndrome de Guillain-Barré, en relación con el artículo de Pérez-Lledó et al.1, Guillain-Barré syndrome: clinical presentation and prognosis in children under six years-old.
El síndrome de Guillain-Barré (SGB) cursa con parálisis flácida, arrefléxica, ascendente y simétrica, con o sin trastornos sensoriales, que puede llevar a la tetraparesia grave1,2. Se clasifica en 4 subtipos (estudios neurofisiológicos): polirradiculoneuropatía aguda inflamatoria desmielinizante (PAID), neuropatía axonal sensitivo-motora aguda (NASMA), neuropatía axonal motora aguda (NAMA) y síndrome de Miller-Fisher (SMF) (ataxia, oftalmoplejía y arreflexia).
Actualmente es la causa más frecuente de parálisis flácida aguda en Pediatría. Su incidencia es de 0,6-1,9 casos/100.000 niños menores de 15 años. Se da un predominio del sexo masculino (1,25:1). Sin preferencia estacional. La primera descripción fue ofrecida por Osler en 1892. En 1916, Guillain, Barré y Strohl detallaron el cuadro clínico.
Su etiología precisa es desconocida, pero en algunos casos existen mecanismos inmunes implicados (anticuerpos antigangliósidos). Dos tercios de los casos están precedidos de infección aguda (1-3 semanas): Campylobacter jejuni (26-41%), citomegalovirus (CMV) (10-22%), virus de Epstein-Barr (10%), Haemophilus influenzae (2-13%), virus varicela-zóster, Mycoplasma pneumoniae3. Vacunaciones (no asociación causal).
El SGB puede surgir tras vacunación, pero este peligro puede ser sobreestimado. En Estados Unidos, un aumento del riesgo de SGB se asoció a la vacuna de la gripe porcina en 1976, pero la gravedad del riesgo ha sido objeto de controversia. Posteriormente, no se observó un mayor riesgo hasta 1991.
Los individuos que recibieron en 1992–1993 o 1993–1994 vacunas contra la influenza no tuvieron un riesgo significativamente mayor de SGB, pero la combinación de las dos temporadas sugirió que el riesgo de SGB tras la vacunación de gripe resultó ser aproximadamente de un caso de SGB por cada millón de pacientes inoculados. Algunos casos de SGB se han reportado después de la administración de la vacuna antimeningocócica conjugada tetravalente MCV4.
Tras leer estas líneas podemos ver cómo la vacunación puede relacionarse en algunos casos con SGB.
El SGB se puede originar por respuesta autoinmune a antígenos extraños (agentes infecciosos, vacunas) que son mal dirigidos al tejido nervioso causando daño en los gangliósidos (glucoesfingolípidos presentes en el tejido nervioso humano, especialmente en los nodos de Ranvier). Un ejemplo es el gangliósido GM1, que puede estar afectado en el 20 a 50% de los casos, especialmente en aquellos con una infección por Campylobacter jejuni. El resultado final de estos ataques autoinmunes en los nervios periféricos es la pérdida de mielina y, consecuentemente, el bloqueo en la conducción nerviosa. La función axonal permanece intacta y la recuperación puede ser tan rápida como ocurra la remielinización. Si la degeneración axonal es importante, la recuperación se produce con mayor lentitud y existe mayor grado de daño residual. Campylobacter jejuni genera anticuerpos antigangliósidos (GM1 en PAID, GQ1b en SMF y GD1a en NAMA) que lesionan la mielina en PAID y SMF y el axón en NAMA; CMV genera anticuerpos antigangliósidos GM2 en NASMA.
Criterios diagnósticos, Asbury 1990:
- -
Clínica: progresión de la debilidad. Afectación simétrica. Arreflexia. Síntomas y signos sensitivos leves. Afectación de nervios craneales: facial (50%). Disfunción autonómica. Ausencia de fiebre al comienzo. Recuperación tras 2-4 semanas.
- -
LCR: disociación albuminocitológica (proteínas aumentadas tras la primera semana). Diez células/mm o menos (leucocitos mononucleares).
- -
Neurofisiología: confirma y determina el subgrupo. Enlentecimiento de la velocidad de conducción motora. Bloqueo parcial de la conducción. Aumento de las latencias distales.
Describimos brevemente el caso clínico de un niño de 5 años que fue diagnosticado de SGB con patrón electromiográfico desmielinizante y afectación axonal grave.
Nuestro paciente cumplía todos los criterios clínicos, de LCR, y la EMG confirmaba un SGB (desmielinizante y con afectación axonal). La variante axonal motora (sin compromiso sensitivo) suele tener un buen pronóstico. Nuestro paciente, según la escala funcional de gravedad clínica de Hughes, obtenía una puntuación elevada (4, confinado en cama), lo que nos hacía ser pesimistas en cuanto a la total recuperación4.
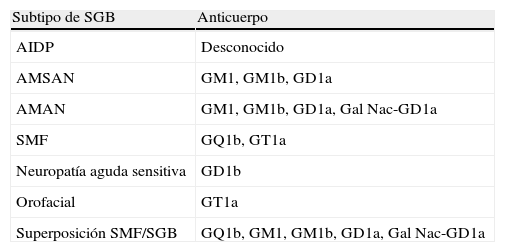
Recientemente, en algunos casos se puede añadir al diagnóstico la determinación de anticuerpos antigangliósidos. Los anticuerpos fueron detectados con mayor frecuencia en la neuropatía axonal motora aguda. Los subtipos de SGB se pueden relacionar con estos anticuerpos y con algunos patógenos5–9, permitiendo así orientar y conocer precozmente la evolución clínica. La variedad de infecciones puede contribuir a la clínica y heterogeneidad inmunológica del SGB. En nuestro caso, la serología mostró IgM e IgG positivos para CMV, comprobando posteriormente el anticuerpo antigangliósido positivo GM2 (asociado a CMV según estudios5,10), relacionado con axonopatía grave y pronóstico desfavorable5,10 (tabla 1).
Subtipo de síndrome de Guillain-Barré y anticuerpo antigangliósido relacionado
| Subtipo de SGB | Anticuerpo |
| AIDP | Desconocido |
| AMSAN | GM1, GM1b, GD1a |
| AMAN | GM1, GM1b, GD1a, Gal Nac-GD1a |
| SMF | GQ1b, GT1a |
| Neuropatía aguda sensitiva | GD1b |
| Orofacial | GT1a |
| Superposición SMF/SGB | GQ1b, GM1, GM1b, GD1a, Gal Nac-GD1a |
Modificada de Hughes RA, Comblath DR. Guillain-Barré syndrome. Lancet. 2005;366:1653-66.
Dada la ausencia de síntomas de infección por CMV, así como de elevación de reactantes de fase aguda, en nuestro caso no se inició tratamiento específico para CMV10.
El tratamiento se debe iniciar lo antes posible con el objetivo de disminuir la duración y gravedad de la enfermedad y acelerar la recuperación. Siempre con hospitalización y monitorización, medidas de soporte, analgesia/sedación, apoyo ventilatorio si precisa, manejo nutricional, control hidroelectrolítico, apoyo psicológico y rehabilitación precoz.
Los tratamientos específicos son: inmunoglobulina intravenosa (2g/kg en 5 días o en 2 días) o plasmaféresis. En nuestro paciente utilizamos inmunoglobulina intravenosa a 1g/kg/día durante 2 días consecutivos sin observar efectos secundarios, pero sí estabilización de la clínica. El tratamiento en 2 días es recomendable por ser más breve e igualmente eficaz.
La recuperación fue lenta pero progresiva, normalizándose a los 6 meses. Los anticuerpos antigangliósidos GM2 (IgM) persistieron positivos durante los primeros 4 meses.
Al Servicio de Neurofisiología del Hospital Clínico de Valencia por su colaboración.