El síndrome hepatopulmonar (SHP) es una causa rara de hipoxemia en pediatría, caracterizada por enfermedad hepática y/o hipertensión portal asociada a dilataciones vasculares intrapulmonares y anomalías en la oxigenación arterial1,2. Esta tríada es tan específica que apoya el diagnóstico del SHP incluso en presencia de enfermedad cardiopulmonar crónica asociada1. El SHP se produce con más frecuencia asociada a la cirrosis, sin que sea imprescindible la existencia de hipertensión portal1–3. Este síndrome está infradiagnosticado porque puede ocasionar síntomas sutiles o permanecer subclínico, y por la ausencia de programas de cribado rutinario en pacientes con hepatopatia1,4,5.
El cálculo del gradiente de oxígeno alvéolo-arterial es el método más sensible en la detección precoz de desoxigenación arterial (PA-PaO2 ≥ 15mmHg)1. La estratificación es realizada por el grado de hipoxemia: ligero (PaO2 ≥ 80mmHg), moderado (60 ≥ PaO2 < 80mmHg), grave (50 ≥ PaO2 < 60mmHg) y muy grave (PaO2 < 50mmHg)1. Para afirmar el diagnóstico de SHP es necesario demostrar la presencia de shunt intrapulmonares1,6.
La American Association for the Study of Liver Diseases recomienda la detección precoz del SHP, dado que la gravedad de la enfermedad pulmonar puede hacer a estos pacientes elegibles para trasplante, independientemente del compromiso hepático7. A pesar de los pacientes con hipoxemia grave tienen mayor mortalidad en el postrasplante inmediato, el grado de hipoxemia no contraindica el trasplante y el SHP es completamente reversible con el trasplante8,9.
Describimos el caso de una adolescente de sexo femenino, de 17 años, con diabetes mellitus tipo i desde los 5 años, única hija de padres no consanguíneos. A los 7 años se constató una elevación discreta de las transaminasas, con estudio etiológico no concluyente (tabla 1).
Investigación de la elevación de las transaminasas
| Alfa-1- antitripsina: normal |
| Ceruloplasmina sérica y cobre urinario en las 24 h: normales |
| Marcadores víricos: hepatitis A, B, C y HIV negativos |
| Ferritina: 204 ng/mL (N: 2-178) |
| Perfil lipídico: normal |
| Estudio inmunológico humoral: IgA e IgM aumentadas; IgG, C3 y C4 normales |
| ANA, antimúsculo liso, anti-LMK1, anti-SLA/LP, anti-LC1: negativos |
| Anticuerpos antitransglutaminasa y antiendomisio: negativos |
| Lactato: normal; amonio: 157μmol/L (N < 40) |
| Cromatografía de los aminoácidos séricos y urinarios: sin alteraciones |
| Cromatografía de los ácidos orgánicos: sin alteraciones |
| Dosificación del ácido orótico: normal; mutación de la ornitina transcarbamilasa OTC: negativa |
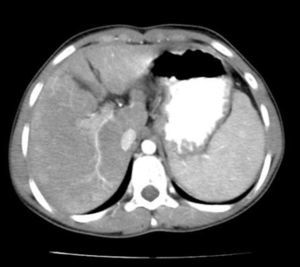
A los 9 años, por persistencia de la elevación de las transaminasas, se realizó una ecografía abdominal que informó hígado de tamaño normal, parénquima heterogéneo, con nódulos hipoecogénicos; el estudio con Doppler mostró venas porta y suprahepáticas permeables, y esplenomegalia de 12,3cm. La TC abdominal presentó parénquima con densidad heterogénea, áreas nodulares mal definidas y la existencia de una atrofia relativa del segmento iv del lóbulo hepático izquierdo (fig. 1). El estudio metabólico no permitió la clarificación etiológica (tabla 1).
A los 12 años de edad fue internada por infección respiratoria por Mycoplasma pneumoniae. Presentaba hipoxemia, hipocratismo digital y esplenomegalia de 5cm por debajo del reborde costal. Presentaba hemoglobina 17,0g/dL, AST 84 U/L, ALT 141 U/L y γ-GT 161 U/L, con funciones de síntesis hepática normales. La gasometría arterial con oxígeno a 2 L/min descubrió PaO2 de 77mmHg con PA-PaO2 > 45mmHg. Tras la resolución de la infección respiratoria, la paciente se mantuvo dependiente de oxígeno.
La endoscopia digestiva demostró varices esofágicas y gastropatía hipertensiva, y había iniciado tratamiento con propranolol. La histología hepática evidenció un parénquima con arquitectura trabecular preservada, discreto infiltrado inflamatorio de predominio mononucleado en los espacios porta, sin actividad necroinflamatoria de interfaz, dilatación de los sinusoides y vasos linfáticos en los espacios porta, lesiones de siderosis hepatocitaria y en células de Kupfer (grado ii/iv).
La TC torácica no evidenció signos de fibrosis o lesiones parenquimatosas. El ecocardiograma transtorácico con Doppler excluyó la presencia de shunt intracardíaco e hipertensión pulmonar.
Las enfermedades con posible implicación hepática y pulmonar fueron excluidas.
El ecocardiograma con contraste salino agitado reveló la presencia de shunt pulmonar extracardíaco compatible con SHP. La gammagrafía con albúmina marcada con tecnecio99 reveló actividad renal y cerebral compatible con SHP.
Seis meses después de la infección respiratoria, la paciente presentaba disnea para pequeños esfuerzos, necesitando oxígeno a 6 L/min, PaO2 en aire ambiente de 49,3mmHg (PA-PaO2 > 50mmHg), lo que define SHP muy grave. Diez meses después de la constatación de la hipoxemia fue sometida a trasplante hepático. En el pretrasplante presentaba plaquetas de 70.000/μL, tiempo de protrombina 13,6s y esplenomegalia de 13,8cm sin ascitis.
El estudio anatomopatológico del hígado explantado indicaba hiperplasia nodular regenerativa.
A pesar de la existencia de criterios bien definidos para SHP1,4, su desconocimiento puede llevar a retrasos en el diagnóstico. El SHP debe ser tratado con oxígeno por cánula nasal en los pacientes con hipoxemia grave1,6 pero el único tratamiento definitivo es el trasplante hepático1,6,9,10. En el periodo de espera puede producirse una disminución de la PaO2, aumentando así los riesgos y el tiempo necesario para la reversión de la hipoxemia postrasplante8,10. Pacientes con PaO2 < 60mmHg tienen mayor mortalidad en espera de trasplante, por ello son priorizados frente a otros pacientes con hepatópatas crónicos7,9.
La corrección de la hipoxemia tiene lugar, de media, cerca de 6 meses tras el trasplante hepático3,10; que en este caso ha sido alrededor de un año. Periodos tan prolongados para la recuperación sugieren la hipótesis de remodelación de los vasos pulmonares5.