Introducción
El síndrome de shock tóxico (SST) es una entidad clínica infrecuente en pediatría producida por una reacción a superantígenos descrita por primera vez en Colorado en el año 1978 por Todd et al1. Posteriormente en los años 1980 se produjo un pico de incidencia de este cuadro en Estados Unidos (1.407 casos recogidos por los Centers for Disease Control and Prevention [CDC] en un total de 20 meses)2 que se relacionó con el uso en chicas durante el período menstrual de tampones vaginales absorbentes contaminados por Staphylococcus aureus3. Durante las últimas 2 décadas se han descrito en la literatura médica múltiples series de casos no relacionados con tampones sino con una gran variedad de situaciones clínicas: adenitis, neumonías, heridas quirúrgicas, abscesos, sinusitis, sobreinfección de heridas cutáneas, etc.4-13.
Hoy sabemos que el SST no es una entidad exclusivamente producida por S. aureus, sino que puede ser producida por otros Staphylococcus, Streptococcus pyogenes u otros gérmenes9,10,14-19. Aunque la gran mayoría de los casos continúan siendo secundarios a S. aureus.
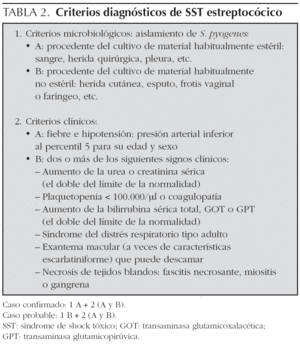
En la actualidad, el SST se define como una enfermedad aguda y grave, secundaria a una infección por gérmenes principalmente del grupo Staphylococcus (productores de toxinas: principalmente TSST-1) o Streptococcus (productores de toxinas eritrógenas A, B y C) que cursa con fiebre, hipotensión, fallo multiorgánico y posterior descamación. Este cuadro clínico se desarrollaría de forma secundaria a la activación de la cascada inflamatoria tras la liberación de citocinas proinflamatorias por linfocitos T activados por toxinas bacterianas que actuarían como superantígenos20. El diagnóstico de SST se fundamenta en el cumplimento de unos criterios clínico-microbiológicos propuestos por los CDC21,22.
Junto con estas formas más floridas existen cuadros incompletos o menos floridos que no cumplen los criterios propuestos y que en ocasiones podrían pasar inadvertidas o confundirse con otras entidades. Por ello suponemos que las estadísticas relativas a la incidencia de esta entidad infravaloran su importancia.
Materiales y métodos
Estudio retrospectivo de los casos de SST ingresados en la unidad de cuidados intensivos del Hospital Pediátrico Sant Joan de Déu de Barcelona en los últimos 15 años (1990-2005). Se incluyeron aquellos casos admitidos en nuestra unidad que cumplían los criterios clínico-microbiológicos propuestos por el CDC para el diagnóstico de SST. Estos criterios difieren discretamente en función de la etiología sospechada del cuadro como podemos ver en las tablas 1 y 2. Un total de 9 casos cumplieron los criterios de selección.
En todos los casos se recogieron datos de filiación, antecedentes personales, sintomatología previa al ingreso, y exploración física al ingreso. Así mismo se registraron los valores de las analíticas de sangre realizadas, así como los resultados de los estudios microbiológicos. Durante el ingreso se recogieron datos sobre la evolución clínica del paciente, en especial la aparición de complicaciones y secuelas, y los tratamientos empleados. Se determinó el tiempo de hospitalización en la unidad.
Los datos obtenidos fueron introducidos y posteriormente analizados mediante el programa estadístico SPSS 11.0. Se realizó un análisis descriptivo de las diferentes variables recogidas. Se valoró la diferencia en el número complicaciones y secuelas entre los casos de etiología estreptocócica y estafilocócica mediante un t-test. Se consideraron resultados estadísticamente significativos una p < 0,05.
Resultados
En total se revisaron 9 casos. Cinco de ellos de sexo femenino (55 %). Dos de los pacientes se encontraban ingresados por un traumatismo craneoencefálico (TCE) grave cuando iniciaron el cuadro. La distribución a lo largo de los meses del año fue uniforme. La edad media fue de 7,1 ± 6,8 años (rango 11 meses-17 años).
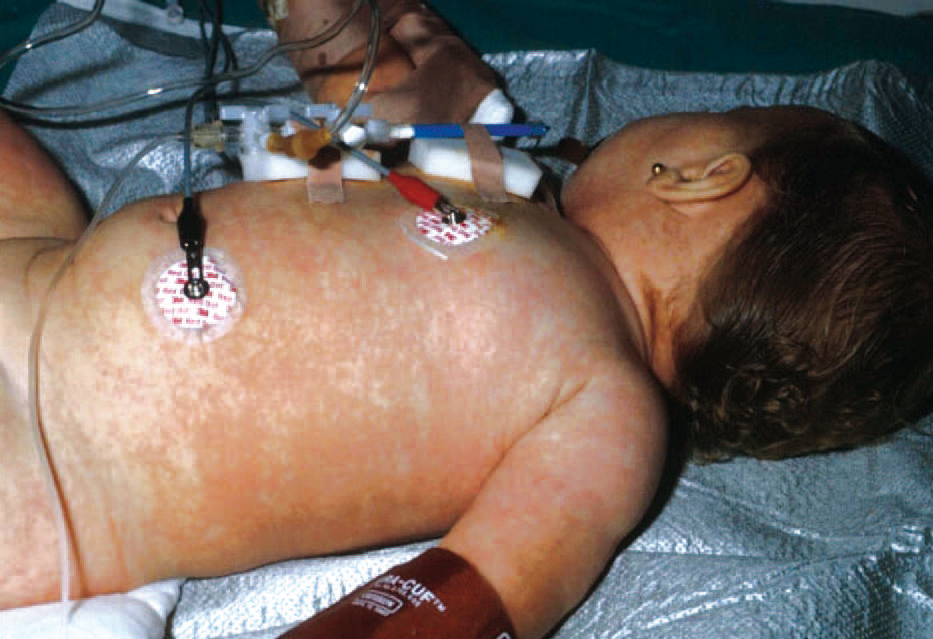
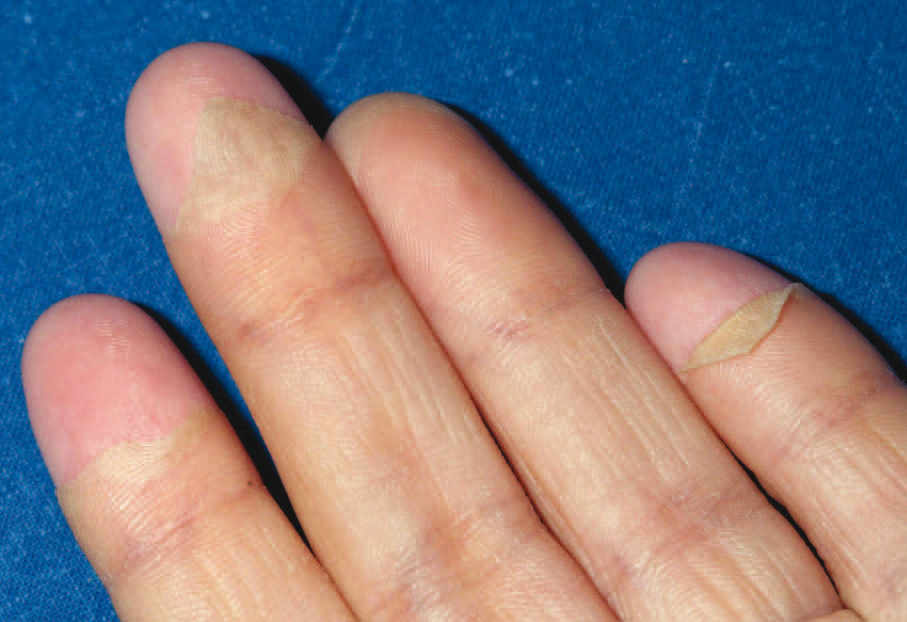
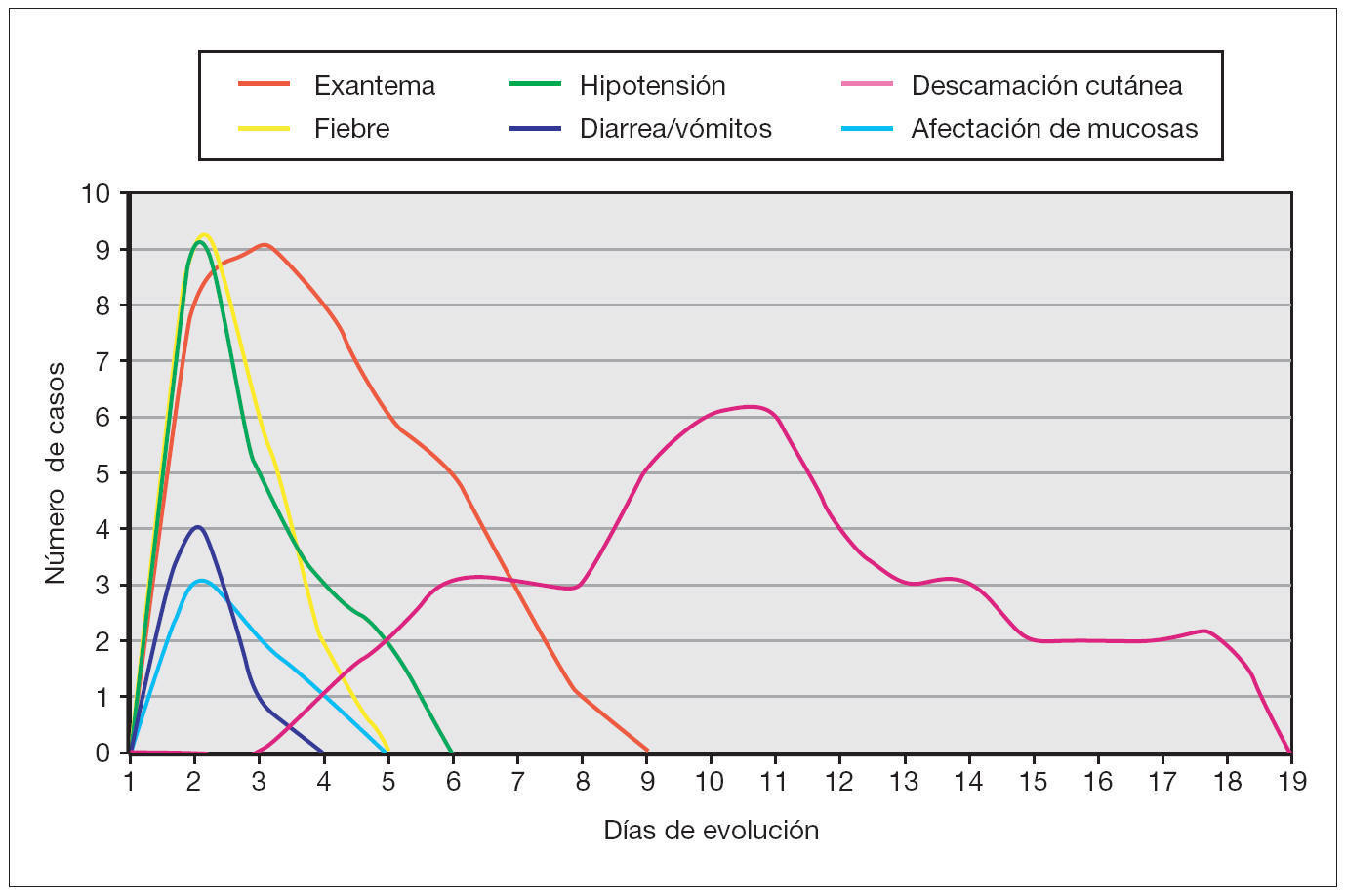
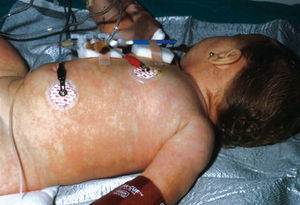
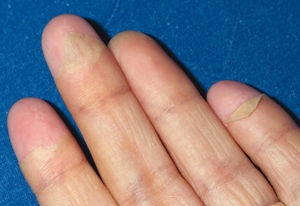
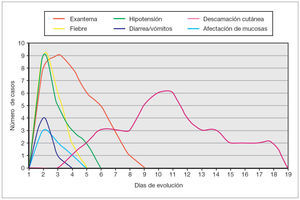
Todos los casos presentados cumplían los criterios diagnósticos propuestos por el CDC. Los hallazgos clínicos presentes en todos los pacientes fueron: exantema, hipotensión arterial (definida como presión arterial inferior al percentil 5 para su edad y sexo), fiebre (> 39 °C) y descamación cutánea. Las características del exantema se correspondió a un eritema generalizado en 5 casos (55 %), exantema escarlatiniforme en dos (22 %), exantema rubeiliforme y eritema malar en uno (11 %), respectivamente (fig. 1). Este exantema persistió durante una media de 4,5 días (desviación estándar [DE] 2,3 días). Con posterioridad todos los pacientes presentaron descamación. El tiempo medio necesario para la aparición de la descamación fue de 8,5 días (DE 3,7 días; rango de 4-15 días) (fig. 2).
Figura 1. Exantema maculoso.
Figura 2. Descamación en "guante de calcetín".
Como reflejo del fallo multiorgánico existente en esta entidad, se detectó en todos ellos coagulopatía, en 8 casos (89 %) afectación hepática, en ocho disminución del nivel de conciencia, en siete (78 %) afectación muscular, en seis (66 %) insuficiencia renal, en cinco (55 %) plaquetopenia, en cuatro (45 %) síntomas gastrointestinales, en cuatro hipocalcemia, en tres (33 %) afectación de mucosas, en tres edema en extremidades inferiores, en dos (22 %) síndrome de distrés respiratorio agudo y en dos episodios comiciales tónico-clónicos. Otros hallazgos secundarios al fallo multiorgánico fueron: insuficiencia suprarrenal, anasarca, lesiones necróticas en falanges distales y derrame pleural, todos ellos presentados en un caso (11 %), respectivamente. Un paciente presentó un episodio de paro cardiorrespiratorio durante el ingreso que fue revertido mediante maniobras de reanimación cardiopulmonar avanzada. La cronología de aparición de los principales síntomas/signos se encuentra esquematizada en la figura 3.
Figura 3. Cronología de aparición de los signos/síntomas.
En las analíticas practicadas al ingreso destacó la existencia de una marcada desviación a la izquierda en todos los casos (porcentaje medio de neutrófilos 83 %, 43 % neutrófilos bandas), a pesar de que tan sólo en el 45 % de los casos existió leucocitosis y en ningún caso leucopenia. La cifra media de leucocitos fue de 16.000 (DE 10.700; rango 6.300-35.000). En todos los casos existió elevación de la proteína C reactiva; proteína C reactiva media de 203 mg/l (DE 78,2; rango 90-290).
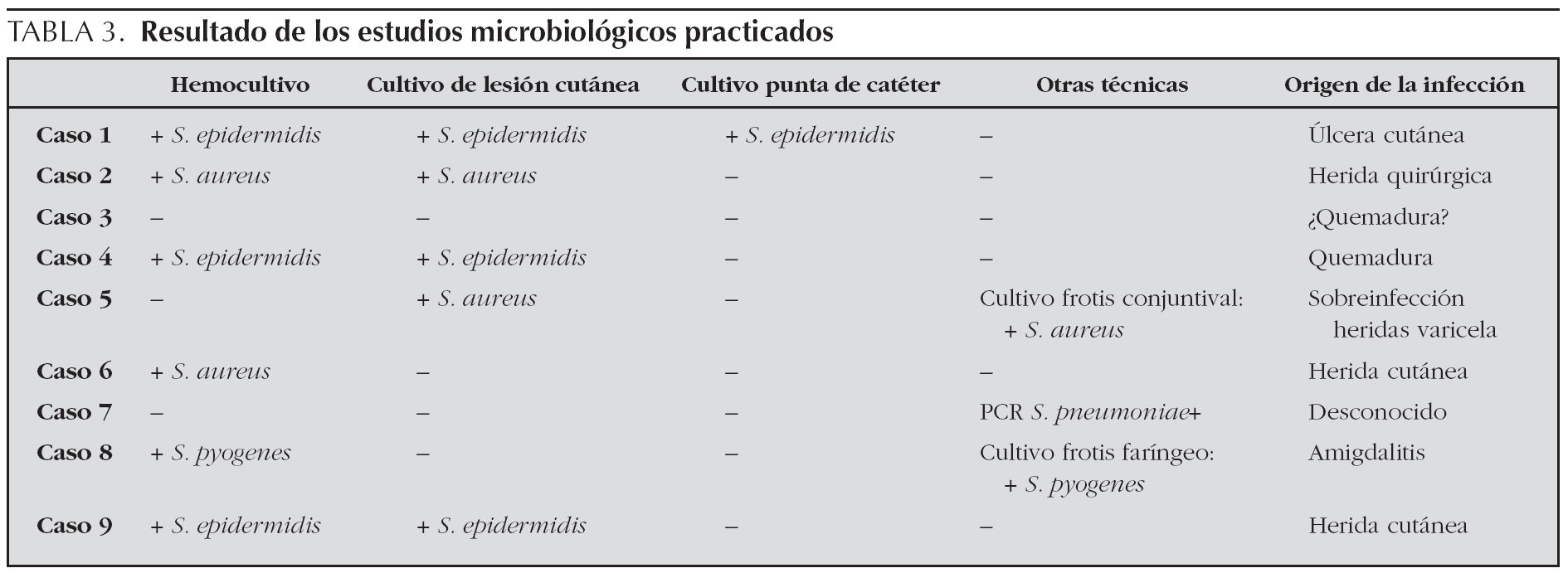
En cuanto a la posible etiología, en los cultivos realizados se aislaron en 6 casos Staphylococcus (tres S. epidermidis, tres S. aureus) y en un caso Streptococcus pyogenes, tan sólo en 2 casos no se consiguió aislar microorganismo. En uno de los 2 pacientes en los que los cultivos fueron negativos se obtuvo una reacción en cadena de la polimerasa en sangre positiva para Streptococcus pneumoniae. El origen de los cultivos se esquematiza en la tabla 3. De los cultivos positivos seis fueron hemocultivos (66 %), cinco cultivos de heridas cutáneas (55 %), uno cultivo de frotis conjuntival, uno cultivo punta de catéter central y uno frotis faríngeo.
El origen de la infección se evidenció en 7 casos: seis de origen cutáneo (uno por sobreinfección de quemaduras, uno por infección de herida quirúrgica tras cirugía correctora de displasia de caderas, uno por impetiginización de heridas varicelosas y tres por infección de herida cutánea) y un caso de origen amigdalar. No se detectó ninguna forma asociada al uso de tampones. Los resultados de los cultivos practicados se exponen en la tabla 3.
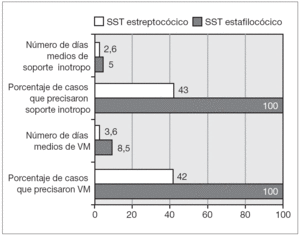
Todos los pacientes recibieron medidas de soporte vital y antibioterapia. Dentro del primer punto los aportes líquidos medios administrados durante las primeras 48 h para compensar la hipovolemia relativa por la fuga capilar y la caída de las resistencias periféricas fueron del 140 % de las necesidades basales diarias (balance hídrico medio diario + 680 ml). Un total de 3 casos necesitaron transfusión de hemoderivados. Precisaron ventilación mecánica 5 casos (55 %) (aunque debemos tener en cuenta que 2 pacientes ya se encontraban previamente bajo soporte ventilatorio por un traumatismo craneal grave). Despreciando estos 2 casos por el posible sesgo que produciría, en los 3 casos restantes (33 %) el soporte ventilatorio se mantuvo durante un período medio de 6,3 días. Precisaron soporte vasoactivo 5 pacientes durante una media de 3,6 días.
En cuanto a la antibioterapia, en el caso producido por S. pneumoniae y S. pyogenes recibieron una combinación de meropenem + teicoplanina y penicilina + clindamicina, respectivamente. El resto de casos fueron tratados con asociaciones de cloxacilina o vancomicina + gentamicina. Recibieron corticoterapia 6 casos y en uno se administró gammaglobulina intravenosa con la intención disminuir la intensidad de la cascada inflamatoria. En el caso secundario a infección de herida quirúrgica se retiró el material de osteosíntesis en cuanto se estabilizó al paciente.
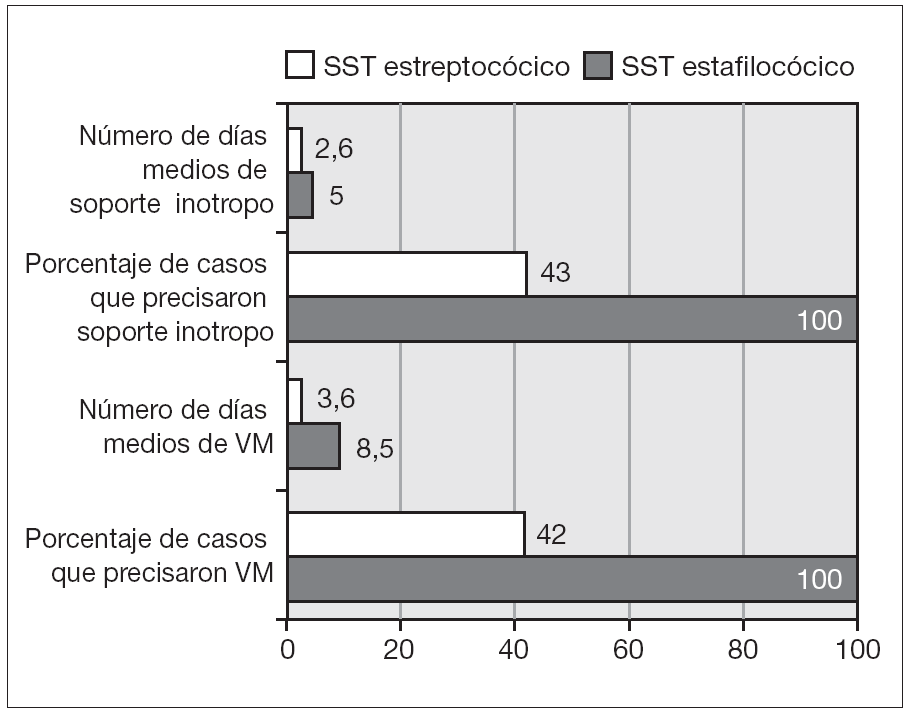
Los 2 casos secundarios a Streptococcus presentaron en líneas globales mayor gravedad aunque, debido al escaso contingente, los resultados no son estadísticamente significativos. Esta mayor gravedad se reflejó en la mayor necesidad de soporte ventilatorio y vasoactivo y en la existencia de un mayor número de complicaciones (como se refleja en la fig. 4). Los 2 casos secundarios a Streptococcus presentaron insuficiencia renal severa que precisó diálisis y el caso secundario a S. pneumonie presentó un episodio de paro cardiorrespiratorio.
Figura 4. Diferencias según la etiología. VM: ventilación mecánica.
Los pacientes requirieron una estancia media en la unidad de cuidados intensivos pediátricos (UCIP) de 8,2 días (DE 4,5 días). La estancia media hospitalaria fue de 19 días (DE 7,5 días).
Todos los casos evolucionaron correctamente del cuadro infeccioso, sin existir secuelas de gravedad a largo plazo. Tan sólo en el caso secundario a S. pyogenes se detectaron en el seguimiento signos de insuficiencia renal leve e insuficiencia mitral leve. Este último signo detectado mediante ecocardiografía parece corresponder a un proceso de fiebre reumática de presentación atípica tras el proceso infeccioso.
Discusión
El SST es una entidad aguda y grave poco frecuente en pediatría (alrededor de 0,5/100.000 habitantes) producida por una reacción a superantígenos asociada inicialmente al uso de tampones colonizados por S. aureus productores de la toxina TSST-13. A pesar de que la etiología predominante continúa siendo S. aureus, durante los últimos 10 años se ha asociado a diferentes gérmenes (principalmente S. epidermidis y S. pyogenes)9,14-19 y a diferentes situaciones clínicas (adenitis, neumonías, infección de heridas quirúrgicas, abscesos, sinusitis, sobreinfección de heridas cutáneas, faringitis, infección de quemaduras, etc.)4-13. Algunas de estas situaciones clínicas quedan reflejadas en nuestra serie. De nuestros resultados cabe remarcar la existencia de 2 pacientes (22 % de la muestra) en los que el SST se presentó como la complicación de una pequeña lesión cutánea tras ser ingresados por un traumatismo craneal grave. A tenor de estos datos, esta complicación, ampliamente descrita en la bibliografía con respecto a pacientes ingresados por quemaduras7,8 debería valorarse en todo paciente ingresado por TCE que inicia un cuadro febril con empeoramiento hemodinámico.
Tras un descenso progresivo en los últimos 25 años de las formas relacionadas con tampones, probablemente relacionado con los cambios en la composición de los mismos, en la actualidad son predominantes las formas no asociadas al uso de tampones2,23. Este hecho se ve reflejado en nuestra serie, donde no se detectó ninguna forma relacionada con esta etiología.
De nuestra casuística debemos destacar el episodio secundario a S. pneumoniae. Dado que se trata de un microorganismo extraordinariamente implicado en esta entidad (tan sólo tenemos constancia de un caso previo) que ocasiona un cuadro de gran gravedad24.
La etiopatogenia de esta entidad radica en la capacidad de ciertos microorganismos de producir toxinas que, aun actuando a distancia, desencadenan una reacción hiperinmune20. Estas toxinas actúan como hiperantígenos capaces de estimular masivamente a linfocitos T y a macrófagos que, mediante la liberación de citocinas (factor de necrosis tumoral α, interleucina 1β, interleucina 2 e interferón)25, activan una cascada inflamatoria que desemboca en una serie de manifestaciones cardiovasculares como pueden ser la pérdida del tono vascular y el aumento de la permeabilidad capilar. Esta hipotensión conduce a una inadecuada nutrición y oxigenación de los tejidos y, consecuentemente, a un fallo multiorgánico.
Como se observa en nuestra serie, clínicamente se caracteriza de forma constante por fiebre, eritrodermia generalizada con posterior descamación, hipotensión arterial y fallo multiorgánico1. Dado que no existe ninguna prueba de laboratorio de uso habitual que permita confirmar el diagnóstico de SST26, éste se basa en el cumplimiento de unos criterios clínicos propuestos por el CDC21,22. El diagnóstico diferencial se debe establecer con todas aquellas entidades que cursan con fiebre, exantema, hipotensión y fallo multiorgánico27,28. Clásicamente el tratamiento se fundamentaba en dos pilares: por una parte el tratamiento frente a la infección, y por otra el tratamiento del shock y del fallo multiorgánico29. En primer lugar debe procederse a la estabilización del paciente mediante medidas de soporte vital. Frecuentemente es necesario el empleo de fármacos vasoactivos y incluso de soporte ventilatorio. Es importante el uso de antibióticos intravenosos en dosis elevadas mediante antimicrobianos con acción antibetalactamasa (cloxacilinas o dicloxacilinas). Cabe remarcar que, al tratarse de un cuadro mediado por toxinas, los antibióticos pueden no ser decisivos en la evolución; sin embargo, se ha relacionado la existencia de recurrencias con el uso de una antibioterapia inadecuada30. En los casos de SST secundarios a S. pyogenes es preferible la asociación de penicilina y clindamicina. Una vez estabilizado al paciente se procederá a la retirada del material contaminado o del drenaje del foco productor de toxinas.
En base al mejor conocimiento del mecanismo etiopatogénico de la entidad, en los últimos años se ha postulado, dentro del tratamiento del SST, el uso de corticoides y gammaglobulinas intravenosas para disminuir la intensidad de la cascada inflamatoria10,31-33. El uso de gammaglobulinas se justificaría en la elevada concentración de anticuerpos anti-TSST y anti-ET-A en la gammaglobulina hipereinmune comercial. Estas medidas parecen estar justificadas, principalmente en los casos de mayor gravedad, por las evidencias actuales de que podría disminuir la intensidad del fallo multiorgánico y la mortalidad33-35. Nuestros resultados, por el escaso contingente de la muestra, no permite extraer conclusiones firmes.
En nuestra serie no se observó ningún episodio de recurrencia. Hecho que sí se ha observado en otras series30,36 asociándose ésta a un déficit en la síntesis de anticuerpos contra las toxinas implicadas y a la persistencia del microorganismo productor de la toxina.
Cabe destacar la buena evolución clínica presentada por los 9 casos expuestos. Probablemente el mejor conocimiento de esta entidad en los últimos años ha permitido un diagnóstico precoz y un mejor manejo terapéutico que ha conducido a un descenso de la mortalidad y de la tasa de complicaciones con respecto a otras revisiones previas37. Especialmente por lo que respecta a los casos de SST secundarios a Streptococcus, donde las cifras de mortalidad se cifraban entre el 30-50 % de los casos.
Como comentarios finales cabe remarcar que, a pesar de su baja incidencia en pediatría, es necesario incluir el SST en el diagnóstico diferencial de aquellos casos que cursan con fiebre, exantema y shock, ya que un diagnóstico precoz ha demostrado mejorar el pronóstico. S. pneumoniae debe incluirse dentro de los microorganismos causantes de SST. El tratamiento se fundamenta en medidas de soporte vital y antibioterapia mediante antimicrobianos con acción antibetalactamasa.
Correspondencia: Dr. J.A. Costa Orvay.
Hospital Sant Joan de Déu.
P.º Sant Joan de Déu, 2. 08950 Esplugues de Llobregat. Barcelona. España.
Correo electrónico: curune@yahoo.es
Recibido en septiembre de 2006.
Aceptado para su publicación en marzo de 2007.