Introducción
La planificación y correcto control del embarazo de la mujer con epilepsia suele acompañarse de una gestación normal y nacimiento de niños sanos en un 90-95 % de los casos 1. No deben olvidarse, sin embargo, los riesgos potenciales de la enfermedad y del tratamiento.
Se calcula que 1 de cada 250 recién nacidos están expuestos in utero a fármacos antiepilépticos. El riesgo absoluto de malformaciones mayores es del 7 al 10 %, lo que supone una incidencia 2-3 veces superior respecto a la población general 2-4. Entre los factores implicados se incluyen el tamaño molecular del fármaco anticonvulsivante, la fracción libre, su liposolubilidad, las altas concentraciones en plasma fetal, los niveles bajos de folatos maternos, la politerapia, sus metabolitos activos y el efecto de las convulsiones maternas sobre el feto. Durante el embarazo el riesgo de crisis aumenta un 10-20 %, especialmente entre la 12 y 20 semanas, con mayor probabilidad de sufrirlas aquellas mujeres que ya presentaban crisis frecuentes antes de la gestación 5. Estudios recientes han demostrado que durante el embarazo los niveles de fármacos antiepilépticos son subterapéuticos como consecuencia de los cambios farmacocinéticos que se producen durante la gestación y el no cumplimiento del tratamiento por temor a los efectos sobre el feto 6,7. Son conocidas ciertas anomalías congénitas asociadas a antiepilépticos clásicos como el retraso de crecimiento intrauterino, alteraciones craneofaciales, anomalías digitales, defectos del tubo neural, cardiopatías, etc., tanto en tratamientos combinados como en monoterapia 8,9. Para prevenir ciertos efectos teratogénicos se recomienda una dosis diaria de 4 mg de ácido fólico en la gestante, ajuste detallado de la dosis del fármaco y favorecer la monoterapia. El cambio posconcepcional de fármaco no reduce significativamente el riesgo de malformación y puede comprometer el control de las convulsiones 10,11.
En los últimos años se han comercializado nuevos fármacos antiepilépticos, también denominados de nueva generación, debido a la necesidad de disponer de fármacos eficaces frente a epilepsias resistentes, mejorar la tolerancia, la vida media de eliminación, disminuir interacciones y mejorar el cumplimiento terapéutico. El efecto teratogénico de estos nuevos fármacos no es conocido. Aunque no se ha demostrado que su riesgo sea inferior al de los de primera generación, no hay ensayos clínicos comparativos entre ellos. Es probable que sean menos teratogénicos y no se han identificado malformaciones organoespecíficas, y las halladas son de difícil interpretación 12.
Observación clínica
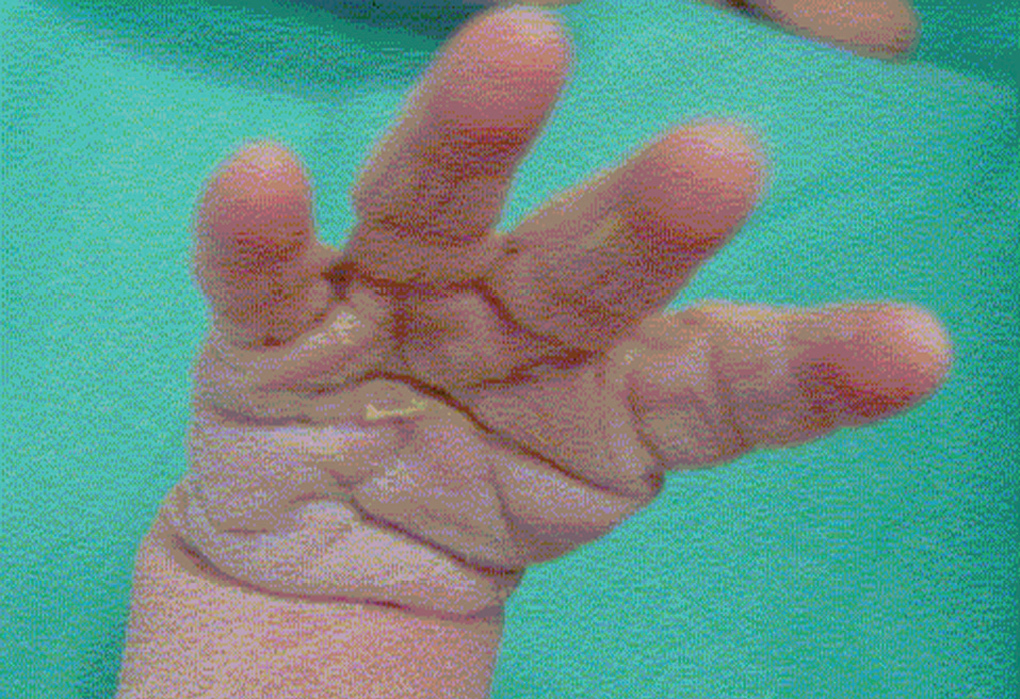
Recién nacido hijo de una mujer de 33 años con antecedente de epilepsia desde los 6 años que fue tratada hasta los 18 con métodos naturistas. A partir de entonces se trató, en etapas sucesivas, con carbamazepina, ácido valproico y topiramato (TPM) asociado a clonazepam. Antecedentes familiares de polidactilia en mano en abuelo materno, al que se le extirpó un dedo supernumerario, entre el primer y segundo dedo, en su infancia. La madre nota mejoría de las convulsiones con el tratamiento combinado y cuando decide tener descendencia suspende el tratamiento con clonazepam y continúa con 300 mg diarios de TPM. Durante el embarazo se realizó tratamiento con ácido fólico y polivitamínicos. La analítica realizada durante el embarazo, incluidas serologías, fue normal, inmune para la rubéola, detección de estreptococo betahemolítico del grupo B en frotis vaginal y rectal negativa. En la semana 11 presentó una convulsión como las habituales consistente en crisis nocturna de hipertonía mandibular, brazos y manos, de unos 20 s de duración. Recuerda haber sufrido en toda la gestación un total de cuatro episodios de similares características distribuidas en todos los trimestres. En la semana 41 se realiza cesárea electiva por presentación podálica con amniorrexis intraoperatoria, de la que se obtienen aguas claras. Recién nacido de sexo femenino de 3.335 g, talla 50,5 cm, perímetro craneal de 35,5 cm. Test de Apgar al minuto de 9 y a los 5 min de 10. En la exploración física destaca agenesia del pulgar de mano derecha, el pulgar izquierdo es hipoplásico y en aducción (figs. 1 y 2) sindactilia casi completa de segundo y tercer dedos de los pies, hiploplasia del músculo orbicular derecho de la boca y displasia de cadera izquierda, siendo normal el resto de exploración.
Figura 1.
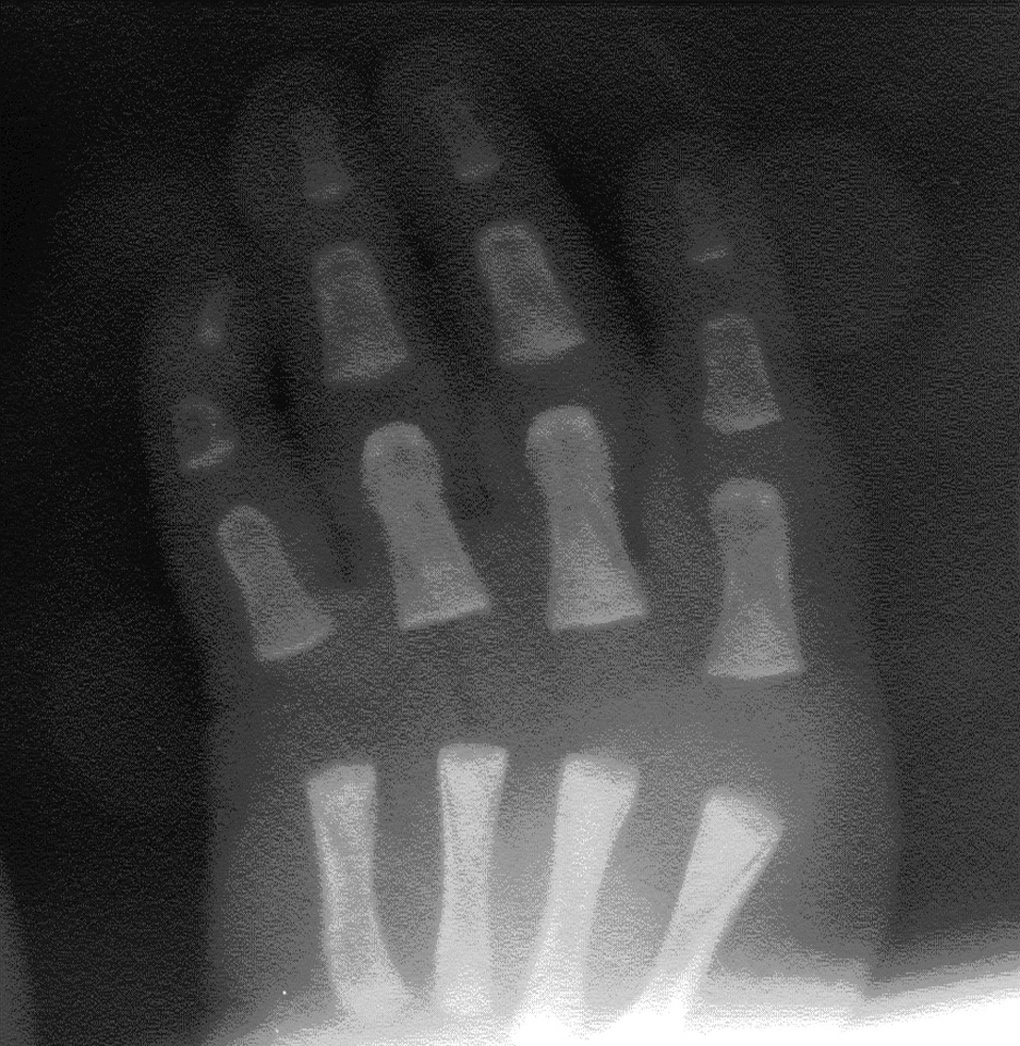
Figura 2.
La serie ósea mostró agenesia de falanges del primer dedo y primer metacarpiano de mano derecha, mano izquierda normal, ausencia de falanges distales de los dedos tercero y quinto del pie derecho, y del cuarto y quinto del izquierdo; el cúbito y radio de ambos brazos eran normales, tórax y clavículas normales. Ecografía abdominal, ecocardiografía Doppler color normal y ecografía cerebral normales. Hemograma y cariotipo normal. Otoemisiones acústicas bilaterales presentes. Recibió lactancia artificial. En controles posteriores presenta mejoría de la hipoplasia del músculo orbicular de la boca y de la displasia de cadera.
Discusión
El TPM es un monosacárido con un grupo sulfamato que inicialmente se sintetizó para el tratamiento de la diabetes por su actividad hipoglucemiante. Fue aprobado por la Food and Drug Administration (FDA) en Estados Unidos en 1996 para el tratamiento de crisis convulsivas parciales en adultos junto con otros fármacos 13. En España, se autorizó en 1998. Actúa en los canales de calcio y sodio dependientes de voltaje, canales de potasio, receptores de glutamato y anhidrasa carbónica. Modula la acción del receptor GABA-A aumentando el flujo de ion cloruro al interior de la célula neuronal. Sus aplicaciones terapéuticas son, en adultos y niños, crisis convulsivas parciales, síndrome de Lennox-Gastaux, epilepsia generalizada primaria resistente y coma antimigrañoso. Se han descrito efectos adversos neuropsiquiátricos dependientes de la dosis, y también litiasis renal en pacientes predispuestos. En ensayos clínicos se han descrito miopía y trastornos de visión inespecíficos, aumento de la presión intraocular y pérdida de peso 14.
Existen pocos datos acerca de los riesgos de exposición fetal a nuevos antiepilépticos. Con excepción de TPM y vigabatrina, el resto no parecen ser teratogénicos en animales, a dosis variables. No se debe olvidar, sin embargo, que los efectos en animales no siempre son extrapolables en seres humanos debido a la implicación de diversos factores, entre ellos los genéticos 15. Se han descrito efectos teratogénicos en animales de experimentación con el TPM. En monos se demostró reducción del peso fetal y retraso en la maduración ósea. En ratones se observaron malformaciones en extremidades y dedos a dosis muy elevadas 14. En seres humanos se demostró que el TPM pasa libremente la placenta con valores en sangre materna y fetal equiparables. Un estudio demostró que, a las 3 semanas del parto, la relación entre leche y plasma materno fue de 0,86 de promedio lo que supone un 3-23 % de la dosis diaria de la madre; este autor, además, no halló malformaciones en los recién nacidos 16. En un caso aislado se ha descrito retraso en el crecimiento intrauterino, hipoplasia nasal e hipoplasia ungueal del quinto dedo 17. Cissoko et al 18 comunicaron 12 gestantes tratadas con diferentes fármacos de nueva generación entre ellos el TPM, y sólo un feto presentó malformación: aplasia de músculo orbicular de la boca al igual que nuestro caso, pero la madre fue tratada además con lamotrigina y ácido valproico. En ninguna gestante en tratamiento con TPM en monoterapìa se halló malformación. Perucca et al 19 no hallaron ninguna malformación en 10 gestantes tratadas sólo con TPM, pero sí en casos con politerapia. En el caso que se presenta no se ha podido hallar una relación de las anomalías óseas con ninguna causa específica, y la ingesta materna de TPM se establece como posible agente causal, aunque llama la atención el antecedente familiar de polidactilia. Dada la escasez de información en la bibliografía revisada, se hace evidente que son necesarios estudios prospectivos para obtener mayor información de los efectos de los clásicos y nuevos antiepilépticos durante la gestación. El EURAP es un registro prospectivo internacional que intenta evaluar y determinar el riesgo de malformaciones causadas por el uso de antiepilépticos. Se implementó en Europa en 1999 y en la actualidad registra resultados de países de casi todos los continentes, entre ellos España 20.