Introducción
El estudio del Diabetes Control and Complication Trial (DCCT) 1 demostró, en 1993, que es necesario mantener un buen control metabólico para evitar o retrasar la aparición de las complicaciones microvasculares de la diabetes mellitus tipo 1. Estas complicaciones comienzan a desarrollarse ya en la edad pediátrica 2-4, lo que hace imprescindible mantener un control metabólico adecuado desde esta edad. También se demostró en el DCCT que los pacientes tratados con bombas de infusión subcutánea continua de insulina (BICI) obtenían mejor control glucémico que los tratados con regímenes de múltiples dosis de insulina (MDI). La BICI es la forma más fisiológica de administrar insulina, ya que permite mejor adaptación a las necesidades cambiantes de la misma a lo largo del día 5.
En los últimos años, diversos estudios han evidenciado que el tratamiento con BICI es una buena alternativa terapéutica en pacientes en la edad pediátrica y que es muy bien aceptado por niños y adolescentes 6-10. Aunque el DCCT 1 mostró que con este tipo de terapia el riesgo de hipoglucemias graves era mayor, estudios posteriores han puesto de manifiesto que no sólo el número de hipoglucemias no aumenta con la terapia con BICI, sino que se trata de una buena alternativa terapéutica para aquellos pacientes con hipoglucemias graves frecuentes 9. Otras complicaciones de los dispositivos de infusión continua de insulina como el aumento de la incidencia de cetoacidosis 11 o la excesiva ganancia de peso 6,8, que se describieron en los primeros estudios, no se encuentran en otros más recientes cuando aumenta la experiencia con este tipo de terapia 9,12,13.
Los avances técnicos tanto en las bombas como en los catéteres, entre otros aspectos su tamaño más reducido, más fáciles de usar, más seguras, con memoria electrónica y con control remoto, han permitido ampliar su uso en la edad pediátrica.
El tratamiento con BICI permite obtener un buen control metabólico, una vida más flexible 10 e incluso se pueden realizar ajustes más frecuentes de la dosis de insulina para adaptarse a las demandas metabólicas cambiantes, características en este grupo de edad. Las principales indicaciones del tratamiento con BICI en la edad pediátrica son la existencia de episodios frecuentes de hipoglucemias graves o inadvertidas, importantes excursiones glucémicas, episodios recurrentes de cetoacidosis, presencia de fenómeno del alba o tener un estilo de vida muy irregular 14-16.
El propósito de este estudio es determinar la eficacia y la seguridad del tratamiento con BICI sobre el control glucémico en un grupo de niños y adolescentes con diabetes mellitus tipo 1 seguidos durante un período superior a un año.
Pacientes y métodos
Se analizan los datos de 29 niños y adolescentes diagnosticados de diabetes mellitus tipo 1 y seguidos en nuestra Unidad de Diabetes Pediátrica. Se obtuvo consentimiento informado por parte de los pacientes para poder comunicar sus datos.
Los criterios de inclusión fueron tener una edad comprendida entre 3 y 19 años, más de un año de evolución de diabetes mellitus y haber sido tratados durante al menos un año con BICI. Todos ellos estaban tratados previamente con regímenes de múltiples dosis de insulina (análogo o insulina rápida, e insulina de acción intermedia [NPH] en varias dosis) y se monitorizaba la glucemia capilar un mínimo de seis veces al día.
Un total de 17 de los 29 pacientes tratados con BICI en nuestra unidad cumplían los criterios de inclusión. La edad media al comienzo de la BICI fue de 14,02 ± 3,70 años. La duración media de la diabetes era de 5,81 ± 3,31 años. Las indicaciones para el comienzo de la nueva terapia fueron: diabetes inestable con importantes excursiones glucémicas en 15 casos, hipoglucemias graves frecuentes en otro caso y para intentar mejorar la calidad de vida en una paciente que padecía también una artritis crónica grave. Todos los pacientes recibían previamente tratamiento intensivo con múltiples dosis de insulina (media de 5,17 dosis diarias de insulina). El resto de los datos se muestran en la tabla 1.
La implantación del tratamiento con BICI se realizó en todos los pacientes de forma ambulatoria en el Hospital de Día Pediátrico. Las familias y los pacientes recibieron durante 3 días educación diabetológica específica y entrenamiento en este tipo de tratamiento. Se les facilitó un libro realizado en nuestra unidad en el que están recogidos todos los aspectos de este tipo de terapia. Después de la instauración de la BICI todos los pacientes fueron controlados a los 3 días, a la semana, al mes y posteriormente en las revisiones habituales de los pacientes diabéticos de nuestra unidad cada 2 meses. Todos ellos disponían de contacto telefónico con la Unidad de Diabetes durante las 24 h del día.
Se utilizó dispositivo de infusión continua de insulina Minimed 508 (Minimed, Medtronic, Sylmar, CA). Los pacientes iniciaron el tratamiento con insulina lispro (Humalog®). En todos los casos fue bien tolerada excepto en una paciente que por cristalización de la insulina precisó el cambio a insulina aspártica (Novorapid®).
Para calcular la dosis inicial de insulina se utilizaron las necesidades de insulina de los días previos. En los niños impúberes no se redujo inicialmente la dosis de insulina y se programó el 50 % como basal y el otro 50 % como bolos preprandiales. En los adolescentes se redujo la dosis el 20 %, y se comenzó administrando el 60 % como basal y el 40 % restante como bolos 16,17. Los ajustes posteriores se hicieron para los bolos preprandiales según la glucemia a las 2 h de la ingesta, y para ajustar la dosis basal midiendo la glucemia a partir de 3 h postingesta, a lo largo de la noche y en ayunas. Los objetivos glucémicos eran los siguientes: postingesta de 100 a 140 mg/dl, en ayunas y a partir de las 3 h postingesta de 80 a 120 mg/dl y durante la noche de 80 a 120 mg/dl en niños mayores de 6 años y de 100 a 140 mg/dl en los menores de 6 años. Se les enseñó a calcular el índice insulina/hidratos de carbono para el ajuste de los bolos preingesta de las distintas tomas y el índice de sensibilidad para el ajuste de los bolos correctores ante una hiperglucemia. Se les enseñó a evaluar el remanente de insulina activa del bolo anterior antes de poner un nuevo bolo. Se les recomendó el cambio del catéter cada 2-3 días y ante las siguientes circunstancias: glucemia capilar mayor de 300 mg/dl y presencia de cuerpos cetónicos en sangre, glucemia mayor de 300 mg/dl que no ha respondido tras una administración de insulina a través de la bomba de insulina, y ante cualquier signo de infección de la zona de inserción del catéter.
Los datos analizados en este estudio son: índice de masa corporal (IMC), episodios de hipoglucemia grave, episodios de cetoacidosis, hemoglobina glicosilada (HbA1c), problemas mecánicos con la BICI, problemas con los catéteres y zonas de inserción, así como, dosis de insulina y grado de satisfacción. La HbA1c se determina con método HPLC (cromatografía líquida de alta resolución) (Menarini, estandarizada para el DCCT). El valor normal es de 5,31 ± 0,31 %.
Se realiza una exploración física en cada revisión, en la que se recoge el peso y la talla y se calcula el IMC. Para calcular la desviación estándar del IMC se utilizan las gráficas de Hernández (Gráficas de Hernández, 1988). El grado de satisfacción se mide por pregunta directa en cada individuo incidiendo en si ha mejorado su calidad de vida y la percepción de su control glucémico. Se analizan los datos a los 2, 6 y 12 meses del comienzo del tratamiento con BICI.
Se define hipoglucemia grave como aquel episodio de hipoglucemia clínica y/o bioquímica, que precisa la asistencia de una segunda persona para poder remontarla. Se compara el número de hipoglucemias graves durante los 6 meses previos al inicio de BICI con las hipoglucemias graves a los 6 y a los 12 meses tras iniciar el nuevo tratamiento.
Se define cetoacidosis diabética como aquel episodio consistente en hiperglucemia superior a 250 mg/dl y cetoacidosis (cuerpos cetónicos > 1 mmol/l y pH < 7,3) que requiere ingreso hospitalario.
En un intento de identificar aquellos pacientes que se van a beneficiar más del tratamiento con BICI, hemos dividido a los pacientes en respondedores y no respondedores. Se define respondedores a aquellos pacientes que mantienen una HbA1c ≤ 7,3 % al año del tratamiento o disminuyen la HbA1c inicial más del 1 %. No existen diferencias entre ambos grupos en cuanto a edad, estadio puberal, HbA1c, dosis de insulina previa o IMC. La única diferencia significativa es el tiempo de evolución de la diabetes (tabla 1).
Análisis estadístico
El análisis estadístico se realizó con el paquete estadístico SPSS (Evanston, IL) versión 11.0 para Windows. Se utiliza test ANOVA (análisis de la varianza) para muestras no paramétricas. Los pacientes actuaron como sus propios controles para evitar los factores de confusión. Las diferencias fueron consideradas estadísticamente significativas si p < 0,05. Se realiza un subanálisis en los pacientes respondedores y no respondedores, puberales y prepuberales.
Resultados
Niveles de HbA1c
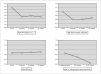
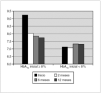
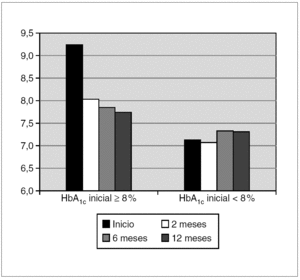
Se objetiva una disminución de la HbA1c. La disminución de la HbA1c se produce ya en el primer control a los 2 meses tras el comienzo del tratamiento, para estabilizarse después durante todo el primer año del mismo. La media de descenso de la HbA1c en el grupo global es de 0,6 % y es mayor el descenso en el grupo con HbA1c inicial > 8 %, que es del 1,5 %. El 35 % de los pacientes mantienen una HbA1c al año por debajo del 7 % y sólo el 17 % están por encima del 8 % (figs. 1 y 2).
Figura 1. Evolución de HbA1c (%), dosis de insulina (U/kg/día), índice de masa corporal (IMC) e hipoglucemias graves (episodios por paciente en 6 meses) durante el primer año tras el tratamiento con bombas de infusión subcutánea continua de insulina (BICI) en 17 pacientes. Las diferencias no son estadísticamente significativas.
Figura 2. Evolución de la HbA1c durante el primer año de tratamiento con BICI en dos grupos de pacientes divididos por el valor de la HbA1c inicial, ≥ 8 y < 8 %.
Incidencia de hipoglucemias graves
La incidencia de hipoglucemias graves disminuye de forma progresiva a los 6 y a los 12 meses del tratamiento. En el período de los 6 meses tras el inicio de la terapia con BICI, hay un total de cinco episodios de hipoglucemia grave; todos ellos fueron en el mismo paciente. Se trata de un paciente de 10 años con obesidad grave, diabetes de muy difícil control y resistencia a la insulina, tratado previamente con insulina y metformina que se mantuvo al iniciar el tratamiento con BICI, y que en las semanas iniciales tuvo cuatro episodios graves de hipoglucemia a pesar de la reducción progresiva de la dosis de insulina. Se le retiró el tratamiento con metformina y desde entonces no ha vuelto a tener ningún episodio de hipoglucemia grave.
Sólo hubo un episodio de hipoglucemia grave en el resto del grupo en el período de tratamiento de 6 a 12 meses (fig. 1).
Incidencia de cetoacidosis
Hubo un total de tres episodios de cetoacidosis, todos ellos en el mismo paciente.
Dosis de insulina
La dosis de insulina disminuye inicialmente, en el período de 0 a 2 meses, para estabilizarse después. Este descenso de la dosis de insulina no se observó en los 4 pacientes prepuberales. Los pacientes utilizan el 48 % como insulina basal y el resto como 3-4 bolos diarios. Al principio todos los pacientes utilizan sólo los bolos normales; posteriormente comienzan a utilizar los otros tipos de bolos disponibles, fundamentalmente el bolo dual. Se observa una disminución de la dosis de insulina tanto en el grupo de pacientes respondedores como en el de los no respondedores.
Ganancia de peso
En nuestro grupo de pacientes el IMC permanece estable con la nueva terapia. No se observaron cambios en el IMC ni en los prepuberales ni puberales ni en ninguno de los subgrupos.
Grado de satisfacción
Todos los pacientes refirieron una mejoría en su calidad de vida fundamentalmente gracias a la flexibilidad horaria que les concedía la BICI.
Discusión
Nuestra experiencia está en concordancia con los resultados de estudios previos en este grupo de edad. Se evidencia que el tratamiento con BICI es una buena alternativa terapéutica en la diabetes tipo 1 en niños y adolescentes, ya que permite mejorar el control metabólico sin aumentar la incidencia de complicaciones agudas.
La disminución de la HbA1c ha sido evidenciada en distintas series. Así, Boland et al 18 en 1999, en un grupo de 24 adolescentes, evidenciaron una disminución de la HbA1c en el 0,9 % al año de tratamiento junto con una disminución en la dosis de insulina y en el número de hipoglucemias graves. Sin embargo, en este grupo de pacientes encontraron un aumento del IMC. Maniatis et al 6 un año después, objetivan también una disminución en la HbA1c, en este caso de sólo del 0,2 %, con un aumento de peso en sus 56 pacientes. Estudios a más largo plazo, como el estudio de Plotnick et al 19 en el año 2003, señala que la hemoglobina disminuye al principio pero que acaba estabilizándose y vuelve a las cifras iniciales.
La mayoría de los sujetos estudiados han sido adolescentes, para los que al principio fue indicado el tratamiento con BICI. Posteriormente, esta indicación se ha trasladado a pacientes preescolares. Dos estudios recientes, han demostrado también la eficacia de este tipo de terapia en niños pequeños. Weinzimer et al 20 encuentra una disminución de la HbA1c del 0,4 % en 65 preescolares con un descenso del número de hipoglucemias graves en el 50 %, y DiMeglio et al 21 señala una disminución de HbA1c de 8,3 a 7,5 % en un grupo de 20 niños menores de 5 años.
No obstante, también hay estudios que no han demostrado esta mejoría 17,22 u otros en los que la mejoría inicial se sigue de una etapa de estabilización y finalmente de un empeoramiento. La mejoría inicial suele ser global 23, pero hay que señalar que todos estos pacientes son reeducados al inicio del tratamiento y reciben una motivación que podría justificar por sí sola la mejoría de la hemoglobina. Esto ha sido descrito en el estudio de Weintrob et al 24. Se trata de un estudio aleatorio cruzado que compara BICI y MDI. Dos meses antes del inicio del tratamiento con BICI los pacientes reciben un reciclaje en educación diabetológica, con lo cual la hemoglobina disminuye de forma significativa en ambos grupos. Sin embargo, tras el inicio de la terapia con BICI la HbA1c permanece estable.
En nuestra experiencia observamos una mejoría más significativa en el control metabólico en aquellos pacientes con peor control previo. Así, los 7 pacientes con HbA1c > 8 % al inicio del tratamiento con BICI mejoran su control metabólico. Curiosamente de los 5 pacientes que tenían hemoglobinas menores de 7 % al principio, tres empeoran su control metabólico; en este caso se trató de 3 adolescentes que ante la libertad que les proporcionaba la BICI relajaron su colaboración. De los 4 pacientes prepuberales, tres mejoraron el control y uno se mantuvo estable. En nuestra experiencia la colaboración por parte de los pacientes de menor edad es en general muy buena.
Son pocas las complicaciones que hemos encontrado con la nueva terapia. Las hipoglucemias graves, que son las limitaciones fundamentales para mantener un buen control metabólico, han disminuido su incidencia de forma progresiva. El único paciente que comenzó el tratamiento con BICI por tener hipoglucemias graves previas, pasó de tener cinco episodios graves los 6 meses previos a un sólo episodio en el año posterior. Se han objetivado un total de tres episodios de cetoacidosis, todos ellos en el mismo paciente. Se trata de un paciente prepuberal con antecedentes previos de varios episodios de cetoacidosis, cuya familia tiene mucho miedo a las hipoglucemias. Esto le lleva a una infrainsulinización progresiva que ante cualquier factor desencadenante como infección o estrés puede acabar en cetoacidosis.
No hubo infecciones locales, ni problemas de hipersensibilidad, y los pocos problemas mecánicos que surgieron pudieron ser resueltos por los pacientes en su domicilio.
A pesar de que en la literatura médica se ha relacionado casi siempre la terapia intensiva (MDI o BICI) con aumento del IMC 1,6, en nuestro grupo no hemos podido constatarlo y el IMC ha permanecido estable. No hemos observado cambios en el peso ni en el grupo de pacientes que responde ni en aquellos que no lo hacen. Existen dos probables teorías para explicarlo, la primera es que todos nuestros pacientes estaban previamente tratados con terapias de múltiples dosis de insulina con una media de 5 inyecciones diarias, ya de por sí un tratamiento intensivo. La segunda razón es la disminución del número de hipoglucemias leves que permiten a los pacientes no tomar tanta sobrecarga calórica en forma de raciones de hidratos de absorción rápida para corregir las hipoglucemias.
Como en estudios previos 18,23,25, objetivamos una disminución de la dosis de insulina. Este descenso ocurre a expensas del grupo de pacientes púberes o pospúberes, ya que en los pacientes prepuberales las necesidades de insulina se mantienen estables, resultado similar al obtenido por otros grupos en estudios precedentes 9,17. Si dividimos a los pacientes en respondedores y no respondedores, curiosamente es en el grupo de los no respondedores en el que hay una disminución mayor de la dosis de insulina (20 % frente al 10 %). Una posible explicación sería que los pacientes no respondedores omitan alguna de sus dosis de insulina por mal cumplimiento, hecho también señalado previamente en la literatura médica 26.
Entre las limitaciones del estudio nos gustaría señalar dos: el reducido número de pacientes, lo que no nos permite encontrar resultados estadísticamente significativos, y el hecho de que el estudio no tenga dos brazos aleatorios con otro grupo de pacientes no tratados con bomba de insulina y así poder comparar directamente ambos grupos. Sin embargo, sí encontramos los resultados clínicamente relevantes y semejantes a los reflejados con anterioridad en la literatura médica en estudios con mayor número de sujetos.
Como conclusión, podemos afirmar que el tratamiento con dispositivos de infusión continua de insulina es una alternativa eficaz y segura en la edad pediátrica ya que permite mejorar el control metabólico con disminución de las necesidades de insulina sin aumentar el riesgo de hipoglucemia grave ni aumentar el peso. No obstante, y teniendo en cuenta el aumento del gasto económico que supone y las nuevas alternativas terapéuticas que han surgido con los análogos de insulina de acción prolongada, es importante, tratar de identificar qué pacientes se van a beneficiar realmente de este tipo de terapia.
Correspondencia: Dra. R. Barrio Castellanos.
Servicio de Pediatría. Hospital Ramón y Cajal.
Ctra. Colmenar, km 9,100. 28034 Madrid. España.
Correo electrónico: rbarrio.hrc@salud.madrid.org
Recibido en febrero de 2005.
Aceptado para su publicación en septiembre de 2005.