Analizar la experiencia de tratamiento con OAF en pacientes ingresados por crisis asmática (CA) en una planta de hospitalización pediátrica (PHP), así como analizar la diferencia de la evolución según sean tratados de entrada con flujos de 15lpm o inferiores a 15lpm.
MétodosEstudio retrospectivo y analítico en niños (4 a 15 años) ingresados por CA en la PHP de un hospital terciario entre 2012 y 2016. Se compararon 2 grupos de pacientes: los tratados con OAF y los tratados con oxigenoterapia convencional; se construyó un modelo de regresión logística para identificar variables predictivas de necesidad de OAF. Se comparó la evolución de los pacientes en función del flujo de inicio de la OAF (15lpm vs<15lpm).
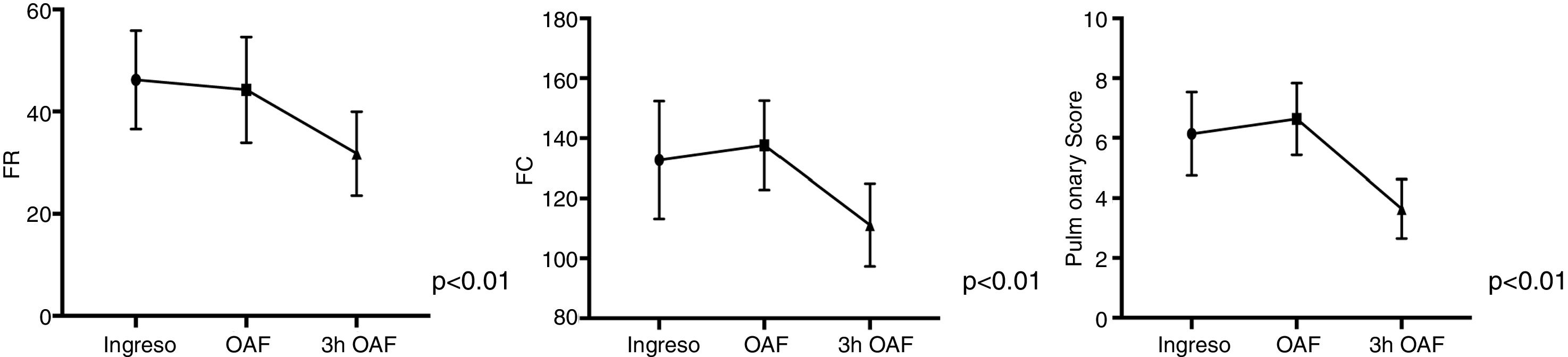
ResultadosSe incluyeron 536 pacientes con CA, de los que 40 (7,5%) precisaron OAF. La mediana de edad fue de 5 (4-6) años. La OAF en los pacientes con CA produjo una reducción en la frecuencia cardiaca, frecuencia respiratoria y Pulmonary Score en las primeras 3-6horas de tratamiento. En el análisis multivariante los pacientes con una mayor puntuación en el PS y un mayor número de ingresos previos precisaron con más frecuencia OAF. Los pacientes tratados con un flujo de inicio de 15lpm ingresaron menos frecuentemente en UCIP que aquellos con flujo inicial inferior a 15lpm (13% vs. 47%, p=0,05).
ConclusiónLa OAF como tratamiento de las CA en las PHP parece ser una terapia de gran utilidad. El Pulmonary Score y el número de ingresos previos permite identificar un grupo de riesgo de precisar OAF.
To assess the experience with oxygen therapy with a high flow nasal cannula (HFNC) in hospital on patients with asthmatic exacerbation (AE) in a paediatric ward, and to assess the clinical outcome according with the initial oxygen flow (15lpm or <15lpm).
MethodsThis was a retrospective study of children aged 4 to 15 years with AE admitted to a paediatric ward in a tertiary level hospital between 2012 and 2016. Two groups of patients were compared; Group 1: patients treated with HFNC, and Group 2: patients treated with conventional oxygen therapy. A logistic regression model was constructed in order to identify predictive variables of HFNC. The clinical outcome of the patients was also compared according to the initial flow of HFNC (15lpm VS <15lpm).
ResultsThe study included a total of 536 patients with AE, 40 (7.5%) of whom required HFNC. The median age was 5 (4-6) years. Heart rate (HR), respiratory rate (RR) and Pulmonary Score (PS) significantly decreased at 3-6hours after starting HFNC in Group 1. In the multivariate analysis, patients with high Pulmonary Score values and greater number of previous admissions required HFNC more frequently. Patients treated with an initial flow of 15lpm were admitted less frequently to the PICU than those with an initial flow less than 15lpm (13% vs 47%, p=.05).
ConclusionHFNC seems to be a useful therapy for asthma exacerbation in paediatric wards. Severity of Pulmonary Score and the number of previous admissions could enable a risk group that needs HFNC to be identified.
El asma es la enfermedad inflamatoria obstructiva crónica de la vía aérea más frecuente en niños, afecta a más de 300 millones de personas en el mundo y produce múltiples ingresos hospitalarios, precisando hospitalización hasta el 15% de los episodios en edad pediátrica1,2, y en ocasiones ingreso en la unidad de cuidados intensivos pediátricos (UCIP), con el coste económico que conlleva3. Durante la crisis asmática (CA) la mayor parte de los pacientes mejoran con el tratamiento estándar, con aporte de oxígeno, utilización de β2 agonistas y tratamiento con corticoides. El 80% de la mortalidad ocurre en pacientes con mal control de la enfermedad4.
La oxigenoterapia de alto flujo (OAF) se ha demostrado como un tratamiento seguro y eficaz de la bronquiolitis y asma en niños5,6. La OAF se considera una alternativa respecto la CPAP en pacientes con asma y con enfermedades que produzcan fallo respiratorio7. El tratamiento con OAF reduce el espacio muerto, mejorando el aclaramiento de CO2, y produce cierta presión positiva al final de la espiración, lo que se ha demostrado también en pacientes con asma en UCIP8,9. Aun así, hay pocos estudios que avalen la eficacia y utilidad de la OAF en la CA6,10, y ninguno que demuestre su utilidad y seguridad en las plantas de hospitalización pediátrica (PHP).
Aunque el procedimiento para su administración se encuentra relativamente estandarizado, existen algunos aspectos en discusión, como pueden ser el flujo inicial idóneo de oxígeno, o el momento de administración ideal, lo que se demuestra en la diversidad de protocolos de trabajo en los estudios publicados. No existen guías internacionales ni trabajos que indiquen el flujo óptimo de inicio y el flujo máximo que debemos utilizar durante el tratamiento con OAF en CA en PHP. Algunos autores lo estiman por el peso, oscilando flujos de 1-3l/kg/min, mientras que otros autores lo estiman por la gravedad que presenta el paciente hasta un máximo de 3l/kg/min. La FiO2 se suele iniciar al 100%, permitiendo disminuirla de acuerdo con la saturación transcutánea de oxígeno en las primeras horas para conseguir saturaciones superiores a 91-93%11.
Por lo tanto, nuestro objetivo principal es analizar la experiencia de tratamiento con OAF en pacientes ingresados por CA en una PHP, así como analizar la diferencia de la evolución según sean tratados de entrada con flujos de 15lpm o flujos inferiores a 15lpm.
Pacientes y métodoSe realizó un estudio con diseño observacional y analítico de una cohorte retrospectiva en niños de 4 a 15 años ingresados por CA moderada/grave en las plantas de hospitalización. El ámbito de estudio es un hospital terciario con 38 camas de hospitalización de pediatría general y 1.750 ingresos anuales. Las crisis asmáticas representaron la tercera causa más frecuente de ingreso en nuestro centro durante el período del estudio.
Se consideró CA a aquel episodio caracterizado por tos, dificultad respiratoria y sibilancias, que cursó con hiperreactividad bronquial y una obstrucción variable del flujo aéreo, total o parcialmente reversible, ya sea por la acción farmacológica o de forma espontánea12. El tratamiento habitual se realizó de acuerdo con el Consenso sobre el tratamiento del asma en Pediatría, avalado por la Asociación Española de Pediatría de Atención Primaria, la Sociedad Española de Urgencias de Pediatría, la Sociedad Española de Neumología Pediátrica, la Sociedad Española de Inmunología Clínica y Alergia Pediátrica y la Sociedad Española de Pediatría Extrahospitalaria y de Atención Primaria (SEPEAP)13.
El muestreo fue consecutivo, durante el periodo comprendido entre enero de 2012 a diciembre de 2016. Se incluyeron todos los pacientes de 4 a 15 años ingresados con CA en la planta de hospitalización de pediatría (PHP). Se excluyeron pacientes fuera de esos rangos de edad, los que ingresaron directamente en la UCIP, o aquellos con enfermedades de base, malformaciones faciales o traqueostomía que no hubieran podido ser tratados con OAF. La variable dependiente principal del estudio es la variable binaria, que indica si fueron o no tratados con OAF durante su estancia en la PHP. Se utilizó un sistema de OAF, modelo Fisher & Paykel (MR850 humidification system). Los criterios para iniciar el tratamiento con OAF en PHP fueron: progresión de la dificultad respiratoria, valorado por el incremento del Pulmonary Score (PS) a moderado/grave14, o disminución de la saturación de oxígeno (SatO2) <91% a pesar de oxigenoterapia complementaria. Se inició OAF según los criterios previos, y el médico responsable en ese momento definió el flujo de inicio según la situación clínica del paciente.
Se utilizó un flujo de inicio variable de 10-15lpm. En aquellos pacientes en los que se inició el tratamiento con flujos menores de 15lpm y no mejoraron clínicamente, se incrementó progresivamente hasta un máximo de 15lpm. Se utilizó una FiO2 necesaria para conseguir una saturación ≥91%, con cánulas nasales ajustadas al peso y edad del paciente. Sobre la cohorte de pacientes que recibieron OAF se realizó un análisis secundario. Se dividió en 2 grupos: los pacientes que fueron tratados con flujo de inicio de 15lpm y los pacientes que fueron tratados inicialmente con menor flujo. La variable dependiente de este análisis secundario es la necesidad de ingreso en la UCIP por fallo del tratamiento con OAF, debido a su empeoramiento clínico, precisando vigilancia más estrecha o mayor asistencia respiratoria. El criterio para ingreso en la UCIP, que quedó a juicio del médico responsable, se estableció en función de la progresión de la dificultad respiratoria (valorado de nuevo con incremento de PS a moderado/grave o una disminución de la SatO2<91%) a pesar de optimizar la terapia del OAF.
Se recogieron datos clínico-epidemiológicos como la edad, el sexo, el peso, los antecedentes personales, el score de gravedad (Pulmonary Score), la frecuencia respiratoria (FR) y la frecuencia cardiaca (FC), tanto al ingreso en la planta de hospitalización como al inicio de OAF, y en las siguientes 3-6horas de tratamiento. Se registraron además los tratamientos concomitantes, las pruebas complementarias que fueron realizadas, así como la necesidad de ingreso en UCIP o de reingreso posterior. Se valoraron las complicaciones derivadas del OAF (escaras, epistaxis, neumotórax, etc.), así como la tolerancia al tratamiento con OAF al paciente o la necesidad de sedación.
El análisis estadístico se realizó mediante el programa estadístico SPSS versión 21.0. (SPSS Inc., Chicago, IL). Las variables cuantitativas se expresaron como media y desviación estándar o mediana y rango intercuartílico según la distribución normal o no de la muestra. Las variables cualitativas se expresaron como porcentajes. Para comparar las variables cualitativas se utilizaron los test de Chi cuadrado y Fisher y para las variables cuantitativas la U de Mann Whitney y el test de Kruskal Wallis. El grado de correlación entre variables cuantitativas se analizó con la prueba de Spearman.
Para valorar los factores que podrían condicionar el empeoramiento y, por lo tanto, la necesidad de OAF en las crisis asmáticas se construyeron 2 modelos probabilísticos de regresión logística; en el primer modelo se incluyeron como covariables solamente aquellas con una p<0,20 en el análisis bivariante, como la edad, el PS, número de consultas en urgencias en los últimos 3 meses, número de ingresos previos y tabaquismo pasivo. En el segundo modelo se incluyeron como covariables la edad, el PS y el número de ingresos previos. Los resultados se expresaron en ambos modelos como OR e IC 95%. Como criterios de selección y comparación entre los modelos de regresión logística se utilizaron los índices de Akaike (AIC) y el Bayesian information criteria (BIC). El modelo elegido fue aquel con menor valor de AIC y BIC, lo que indicaba mejor ajuste del modelo (modelo 1).
Asimismo, para valorar los factores que condicionan el ingreso en UCIP se construyó un modelo de regresión logística. En este modelo 2 la necesidad de ingreso en UCIP es la variable dependiente, y se introdujeron como covariables la edad, el PS y el flujo de OAF (15lpm o<15 lpm) que en el análisis bivariante obtuvieron p<0,20.
La bondad del ajuste de los modelos se evaluó con la R2 de Nagelkerke y el test de Hosmer-Lemeshow. Se descartó colinealidad en todos los modelos. Se consideró estadísticamente significativa una p<0,05. El estudio fue aprobado por el Comité ético de investigación clínica (código: 136/17).
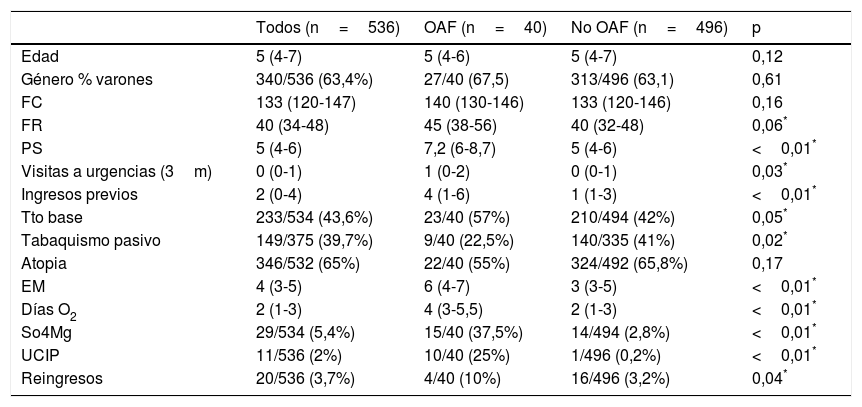
ResultadosEn el periodo de estudio (2012-2016) se incluyeron 536 pacientes diagnosticados de CA, de los que precisaron OAF 40 (7,5%). El 63% de la cohorte eran varones, la mediana de edad fue de 5 (4-6) años y la estancia media de 4 (3-5) días. Ambos grupos fueron similares y comparables en cuanto a edad, sexo, características demográficas y porcentaje de atopia en el momento del ingreso. Los pacientes que presentaban mayor FR y mayor puntación en el PS al inicio del tratamiento (PS 7,5 [6-8,7] en el grupo OAF y PS 5 [4-6] en el grupo de oxigenoterapia convencional, p<0,01) precisaron con más frecuencia OAF. Además, en el grupo de tratamiento con OAF los pacientes presentaron mayor número de visitas a urgencias en los 3 meses previos (1 [0-2] vs 0 [0-1], p=0,03), mayor tabaquismo pasivo, mayor número de ingresos previos (4 [1-6] vs 1 [1-3], p<0,01) y mayor porcentaje de pacientes con tratamiento de base (tabla 1).
Características basales y evolución clínica del grupo tratado con OAF y del grupo control
| Todos (n=536) | OAF (n=40) | No OAF (n=496) | p | |
|---|---|---|---|---|
| Edad | 5 (4-7) | 5 (4-6) | 5 (4-7) | 0,12 |
| Género % varones | 340/536 (63,4%) | 27/40 (67,5) | 313/496 (63,1) | 0,61 |
| FC | 133 (120-147) | 140 (130-146) | 133 (120-146) | 0,16 |
| FR | 40 (34-48) | 45 (38-56) | 40 (32-48) | 0,06* |
| PS | 5 (4-6) | 7,2 (6-8,7) | 5 (4-6) | <0,01* |
| Visitas a urgencias (3m) | 0 (0-1) | 1 (0-2) | 0 (0-1) | 0,03* |
| Ingresos previos | 2 (0-4) | 4 (1-6) | 1 (1-3) | <0,01* |
| Tto base | 233/534 (43,6%) | 23/40 (57%) | 210/494 (42%) | 0,05* |
| Tabaquismo pasivo | 149/375 (39,7%) | 9/40 (22,5%) | 140/335 (41%) | 0,02* |
| Atopia | 346/532 (65%) | 22/40 (55%) | 324/492 (65,8%) | 0,17 |
| EM | 4 (3-5) | 6 (4-7) | 3 (3-5) | <0,01* |
| Días O2 | 2 (1-3) | 4 (3-5,5) | 2 (1-3) | <0,01* |
| So4Mg | 29/534 (5,4%) | 15/40 (37,5%) | 14/494 (2,8%) | <0,01* |
| UCIP | 11/536 (2%) | 10/40 (25%) | 1/496 (0,2%) | <0,01* |
| Reingresos | 20/536 (3,7%) | 4/40 (10%) | 16/496 (3,2%) | 0,04* |
EM: estancia media; FC: frecuencia cardiaca; FR: frecuencia respiratoria; OAF: oxigenoterapia de alto flujo; PS: Pulmonary Score; UCIP: unidad de cuidados intensivos pediátricos.
* Significación estadística.
La OAF en los pacientes con CA produjo una reducción en la FC, FR y PS en las primeras 3-6horas de tratamiento de forma significativa (fig. 1). Los pacientes tratados con OAF, al tratarse de pacientes más graves, presentaron mayor estancia media (6 días [4-7] vs 3 días [3-5], p<0,01), mayor número de días de tratamiento con oxígeno y con corticoides y precisaron más frecuentemente tratamiento con sulfato de magnesio intravenoso; presentaron también mayor número de reingresos posteriores (4/40 [10%] vs 16/496 [3,2%], p=0,04) que los pacientes con CA que no precisaron OAF. Precisaron ingreso en UCIP 8 de los 40 pacientes tratados con OAF (20%) y uno de 496 (0,2%) en el grupo tratado con oxigenoterapia convencional (p<0,01) (tabla 1).
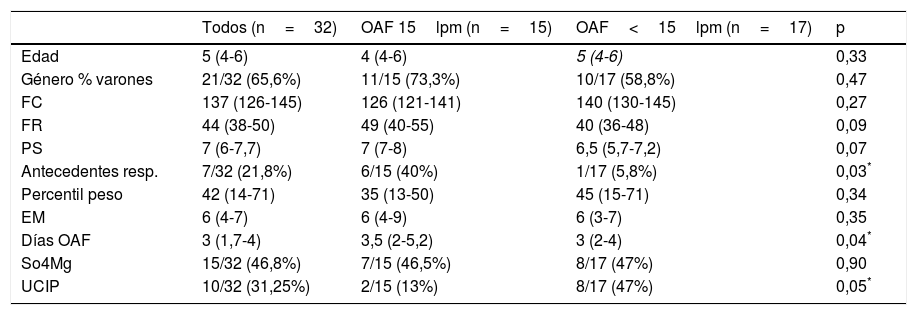
Se compararon las características basales y la evolución de los pacientes tratados con OAF, según el flujo de inicio fuera de 15lpm o menor, y se observó que, aunque los pacientes tratados a 15lpm presentaban mayor frecuencia respiratoria, mayor PS y más antecedentes de crisis asmáticas, precisaron menor porcentaje de ingreso en UCIP de forma significativa (tabla 2).
Características basales y evolución de los pacientes con CA según el flujo de oxígeno al inicio del tratamiento
| Todos (n=32) | OAF 15lpm (n=15) | OAF<15lpm (n=17) | p | |
|---|---|---|---|---|
| Edad | 5 (4-6) | 4 (4-6) | 5 (4-6) | 0,33 |
| Género % varones | 21/32 (65,6%) | 11/15 (73,3%) | 10/17 (58,8%) | 0,47 |
| FC | 137 (126-145) | 126 (121-141) | 140 (130-145) | 0,27 |
| FR | 44 (38-50) | 49 (40-55) | 40 (36-48) | 0,09 |
| PS | 7 (6-7,7) | 7 (7-8) | 6,5 (5,7-7,2) | 0,07 |
| Antecedentes resp. | 7/32 (21,8%) | 6/15 (40%) | 1/17 (5,8%) | 0,03* |
| Percentil peso | 42 (14-71) | 35 (13-50) | 45 (15-71) | 0,34 |
| EM | 6 (4-7) | 6 (4-9) | 6 (3-7) | 0,35 |
| Días OAF | 3 (1,7-4) | 3,5 (2-5,2) | 3 (2-4) | 0,04* |
| So4Mg | 15/32 (46,8%) | 7/15 (46,5%) | 8/17 (47%) | 0,90 |
| UCIP | 10/32 (31,25%) | 2/15 (13%) | 8/17 (47%) | 0,05* |
EM: estancia media; FC: frecuencia cardiaca; FR: frecuencia respiratoria; OAF: oxigenoterapia de alto flujo; PS: Pulmonary Score; UCIP: unidad de cuidados intensivos pediátricos.
* Significación estadística.
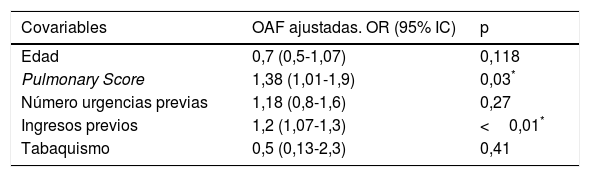
En el modelo 1 la variable dependiente fue la necesidad de OAF en la cohorte y las covariables incluidas en la preselección fueron aquellas con una p<0,2 en el análisis bivariante (edad, PS, ingresos previos, número de visitas a urgencias en los 3 meses anteriores y tabaquismo pasivo). En el modelo 1 encontramos que el PS (odds ratio [OR]=1,38 (IC del 95%: 1,01-1,9), p=0,03) y el número de ingresos previos (OR=1,2 (IC del 95%:1,07-1,3), p<0,01) son las 2 covariables que explican la necesidad de OAF en nuestra cohorte. Los valores de R2 de Nagelkerke y de AIC y BIC se recogen en la tabla 3.
Covariables predictoras de OAF en el análisis de regresión logística
| Covariables | OAF ajustadas. OR (95% IC) | p |
|---|---|---|
| Edad | 0,7 (0,5-1,07) | 0,118 |
| Pulmonary Score | 1,38 (1,01-1,9) | 0,03* |
| Número urgencias previas | 1,18 (0,8-1,6) | 0,27 |
| Ingresos previos | 1,2 (1,07-1,3) | <0,01* |
| Tabaquismo | 0,5 (0,13-2,3) | 0,41 |
Modelo 1: R2 Nagelkerke 0,3, AIC: 114,231, BIC: 136,5-2LL:102,2.
La edad, el score de gravedad y el número de urgencias y de ingresos previos fueron analizados como variables continuas, mientras que el tabaquismo pasivo lo fue como variable categórica. Los asteriscos indican aquellos parámetros que resultaron significativos en el análisis ajustado.
IC: intervalo de confianza; OAF: oxigenoterapia de alto flujo; OR: odds ratio.
* Significación estadística.
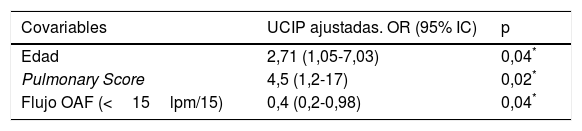
En el modelo 2 se consideró como variable dependiente el ingreso en UCIP. En el análisis bivariante se objetivó que en los pacientes que precisaron ingreso en UCIP el PS era significativamente más alto al ingreso que en el grupo que no preciso UCIP (9 [7-9] vs 5 [4-6], p<0,01), e igualmente en la tabla 2 se muestra cómo los pacientes que inician la terapia con OAF con flujos inferiores (<15lpm) ingresan significativamente más en UCIP que aquellos que iniciaron la terapia a flujos mayores (15lpm) (8/17 [47%] vs 2/15 [13%], p=0,05) (tabla 2). Por ello ambas variables, junto con la edad, fueron introducidas en el modelo de regresión logística. En este modelo 2 encontramos que el PS (OR=4,5 [IC del 95%: 1,2-1,7], p=0,02) y el flujo de OAF<15lpm al inicio de la terapia (OR=0,4 [IC del 95%: 0,2-0,98], p=0,04) son las covariables que explican la necesidad de ingreso en UCIP en nuestra cohorte (tabla 4). Los valores de R2 de Nagelkerke y de AIC y BIC de este modelo se recogen en la tabla 4.
Covariables predictoras de UCIP en el análisis de regresión logística
| Covariables | UCIP ajustadas. OR (95% IC) | p |
|---|---|---|
| Edad | 2,71 (1,05-7,03) | 0,04* |
| Pulmonary Score | 4,5 (1,2-17) | 0,02* |
| Flujo OAF (<15lpm/15) | 0,4 (0,2-0,98) | 0,04* |
Modelo 2: R2 Nagelkerke 0,65, AIC: 22, BIC: 27,3-2LL:14.
La edad y el score de gravedad fueron analizados como variables continuas, mientras que el flujo de OAF es una variable categórica. Los asteriscos indican aquellos parámetros que resultaron significativos en el análisis ajustado.
IC: intervalo de confianza; OAF: oxigenoterapia de alto flujo; OR: odds ratio; UCIP: unidad de cuidados intensivos pediátricos.
La terapia fue bien tolerada. Los pacientes no precisaron sedación en ningún caso. No se observaron complicaciones relacionadas con el tratamiento de OAF como neumotórax o escaras nasales, salvo en algún caso aislado sensación de irritación nasal.
DiscusiónEste trabajo supone el primer estudio que describe la experiencia con OAF en el tratamiento de la crisis asmática moderada/grave en las PHP. Un 7,5% de los pacientes ingresados por crisis asmática en PHP presentaron empeoramiento respiratorio y necesitaron ser tratados con esta modalidad de asistencia respiratoria. La OAF produjo una disminución en la frecuencia respiratoria, frecuencia cardiaca y el PS en las primeras horas de tratamiento, con la consiguiente mejoría del paciente. Solamente precisaron ingreso en UCIP el 20% de los pacientes tratados con OAF, con el impacto clínico que eso supone.
En nuestra cohorte el valor del PS al ingreso, así como el número de ingresos previos, fueron los principales factores de riesgo de presentar un empeoramiento clínico y, de este modo, de precisar OAF. Así, hemos definido un subgrupo de pacientes de riesgo de gravedad en las crisis asmáticas que van a precisar más frecuentemente OAF, lo que tiene importantes implicaciones, ya que este subgrupo de pacientes serían susceptibles de recibir una vigilancia más estrecha en las primeras horas del ingreso, así como de inicio precoz del tratamiento con OAF8. De forma muy similar, algunos autores han intentado definir criterios de empeoramiento clínico y de ingreso en UCIP en la crisis asmática: la historia de 3 o más visitas a urgencias en el año previo, la elevación de la IgE, o una saturación menor de 91% en la presentación o durante la duración de la crisis asmática15. Otros estudios realizados en UCIP intentan definir la población que podría tener un mayor beneficio de OAF, y de este modo, indican que sería muy útil establecer un algoritmo o unos criterios clínicos, como pueden ser la presencia de sibilancias, el trabajo respiratorio, la entrada de aire, la saturación de oxígeno, en los que se puede anticipar la gravedad de la CA y, por lo tanto, la necesidad de OAF16.
El desarrollo y la utilización de la OAF en los últimos años ha demostrado que mejora la dificultad respiratoria y la saturación de oxígeno, debido a la mejoría el aclaramiento mucociliar, el lavado del espacio muerto nasofaríngeo y la mejora del aporte de oxígeno al pulmón, produciendo cierta presión en la vía aérea17, destacando la confortabilidad de esta terapia ventilatoria, mediante la escala CONFORT en las UCIP18. Es importante tener en cuenta que el uso de la OAF requiere una gran experiencia en enfermedad respiratoria en niños, así como adecuada monitorización y alta proporción de personal de enfermería17.
En nuestro estudio se demuestra una disminución significativa de la FR, FC y PS en las primeras 3horas del inicio del tratamiento con OAF, de forma similar a lo publicado por otros autores en pacientes con crisis asmáticas tratadas con esta modalidad terapéutica. Esta mejora en los parámetros respiratorios se observa en los primeros 60-90minutos6, continuando en las siguientes 8-12horas4, siendo estos datos ya demostrados en pacientes con bronquiolitis y asma5.
En comparación con la CPAP, que puede producir menor comodidad y en algunos casos puede precisar sedación19,20, la OAF tiene mejor tolerancia, mayor confortabilidad, produce menos ruido y no produce deformaciones nasales8,17,21,22. En nuestra cohorte no hemos encontrado efectos secundarios, ni problemas de tolerancia o confortabilidad relacionados con el uso de esta modalidad de administración de O2. Algunos estudios multicéntricos, aleatorizados en adultos demuestran que la OAF tiene menor mortalidad a los 90 días que la VNI o la terapia estándar de oxígeno23. Otros estudios han demostrado tasas bajas de intubación en pacientes con hipoxemia que reciben tratamiento con OAF (aunque estos estudios utilizan flujos más altos)24. La OAF también se ha asociado con un incremento del grado de bienestar, reducción de la severidad de la disnea y disminución de la frecuencia respiratoria, mejorando la supervivencia23,25. En contraste, en un estudio retrospectivo realizado en 42 niños con CA en UCIP en el que comparaban OAF con VNI, observaron que aunque es una terapia potencialmente útil en las UCIP, sí que en el 40% de pacientes muy graves puede retrasar el tratamiento con VNI, que no mostró ningún fallo en el tratamiento. En el modelo de regresión logística multivariante observaron que en pacientes con menos de 146lpm y de 55rpm es probable que no falle la OAF, lo que implica ser siempre precavidos a la hora de utilizar la OAF y no retrasar, si no hay mejoría, otras modalidades de soporte26.
En algunos estudios observacionales previos se ha descrito una disminución significativa en el ingreso en UCIP en lactantes con bronquiolitis grave tras la introducción de OAF en las plantas de hospitalización. Así, González et al. 5 describen en 2013 una disminución del 62% del riesgo relativo de ingreso en UCIP en los lactantes con bronquiolitis tratados con OAF. De la misma manera Mayfield et al.27 en 2014 publican que los pacientes que son tratados con OAF por bronquiolitis en las plantas de hospitalización tienen 4 veces menos posibilidades de ingresar en UCIP que aquellos tratados con oxigenoterapia convencional (OR: 4,086; IC 95%: 1,0-8,2; p=0,043).
Al analizar el flujo de inicio del tratamiento con OAF hemos observado que los pacientes con mayor PS al ingreso, y aquellos en los que se inició OAF con un flujo menor de 15lpm existe un mayor riesgo de ingreso en UCIP que los tratados con un flujo de 15lpm, presentado, por lo tanto, un menor porcentaje de fracaso terapéutico, lo que nos hace pensar que quizás comenzar esta terapia con flujos más elevados desde el momento de la indicación podría evitar más ingresos en UCIP, si bien deberían elaborarse más estudios prospectivos aleatorizados para confirmar esta hipótesis.
Este estudio presenta una serie de limitaciones, como son su carácter retrospectivo, observacional y unicéntrico, lo que quizás limita su validez externa. Además, el flujo de inicio de la terapia de OAF queda a criterio del médico de hospitalización. El número de pacientes incluidos es pequeño, por lo que creemos que deberían realizarse estudios prospectivos aleatorizados y multicéntricos para confirmar estos resultados. Asimismo, sería necesario definir el momento ideal para iniciar la terapia con OAF, la detección precoz de pacientes de riesgo, el procedimiento de ventilación ideal y la duración del tratamiento. Del mismo modo, sería de gran utilidad validar esta terapia en el transporte de los pacientes inter e intrahospitalarios17.
En conclusión, la oxigenoterapia de alto flujo como tratamiento de las crisis asmáticas puede ser una terapia útil en las plantas de pediatría. Los pacientes con scores de gravedad más elevados y con mayor número de ingresos previos constituyen un subgrupo de pacientes de riesgo que se podrían beneficiar de esta modalidad de asistencia respiratoria, por lo que sugerimos una monitorización más estrecha desde el primer momento del ingreso en planta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al personal de enfermería y a los pacientes y sus familias.