La leucemia representa el 30% de la patología oncológica en la infancia. El 97% son agudas y de estas un 77% linfoblásticas (LAL) y un 20% mieloblásticas. El 3% restante son mieloides crónicas. La LAL predomina en niños menores de 15 años y tiene un pico de máxima incidencia entre los 2 y los 4 años. En estos pacientes pueden aparecer distintas afecciones cerebrales secundarias a isquemia, hemorragia, infección o infiltración del SNC. Las trombosis venosas producen el 30% de los episodios agudos cerebrales. El riesgo estimado de trombosis en niños en tratamiento por LAL es del 5%1.
Los fármacos que aumentan el riesgo trombótico son los corticoides y sobre todo la L-asparaginasa.
Caso 1. Niña de 5 años, diagnosticada de LLA-B común, en remisión completa, en tratamiento quimioterápico según protocolo SHOP-2005 de alto riesgo en fase de intensificación; comienza con cefalea progresiva y vómitos 10 días después de la administración de L-asparaginasa. Se realiza una angio-TAC, objetivándose trombosis de seno venoso longitudinal y transverso, iniciándose anticoagulación con heparina de bajo peso molecular (HBPM).
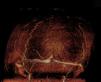
Caso 2. Niña de 12 años, diagnosticada de LLA-T, tratada según protocolo nacional SHOP-2005, de alto riesgo; estando en tratamiento de mantenimiento presentó una recidiva, iniciándose Protocolo de Recidivas LAL-SHOP-2008. Una semana después de iniciar la inducción comienza con cefalea progresiva, vómitos, inatención y bradipsiquia, realizándose una resonancia magnética (RM) cerebral, donde se objetiva trombosis del seno longitudinal superior (fig. 1). Se inicia HBPM, que se suspende al mes y medio en el contexto de shock séptico.
Caso 3. Niño de 8 años, diagnosticado de LLA pre-B común. Desde los 5 años presentaba crisis parciales simples en tratamiento con Depakine® y hemiparesia mínima derecha residual, secundaria a lesión atrófica subcortical izquierda de etiología presumiblemente isquémica perinatal. Durante la fase de inducción, a los 2 días de la administración del ciclo, presenta crisis tonicoclónicas generalizadas distintas de sus crisis previas, por lo que se realiza una RM, objetivándose trombosis de seno longitudinal y transverso, y un infarto hemorrágico cortical. Se instauró HBPM durante 6 meses.
En los 3 pacientes se objetivó posteriormente mediante neuroimagen recanalización de los senos, permaneciendo asintomáticos y sin presentar recidivas. Se realizaron estudios de trombofilia, siendo normales en los 3.
La L-asparaginasa es un agente quimioterapéutico obtenido de distintas cepas de Escherichia coli y Erwinia chrysnathemil2. Se incluye en el protocolo de tratamiento de LAL en la fase de inducción en el grupo de riesgo estándar y en las fases de inducción, intensificación y mantenimiento en los pacientes de alto riesgo3. Un 1-2% de los pacientes tratados con L-asparaginasa desarrollan patología hemorrágica o isquémica en el SNC. La mayoría de los episodios ocurren durante la fase de inducción, ya que existe relación entre el desarrollo de complicaciones vasculares neurológicas y la dosis administrada. El periodo de desarrollo de lesiones cerebrovasculares se sitúa entre los días 4 y 49 tras la administración.
Las manifestaciones clínicas de TVC son variables e inespecíficas, e incluyen cefalea, vómitos, alteración de conciencia, déficits focales y convulsiones1. Para su diagnóstico precoz, es importante tener un alto índice de sospecha y realizar una prueba de imagen cerebral urgente ante la presencia de estos síntomas.
La TAC computarizada muestra signos directos o indirectos de TVC en el 70-80%.
Las técnicas de elección para el diagnóstico, ante la sospecha, son la RM cerebral y las técnicas de venografía por RM o TAC-venografía. La angiografía convencional, gold estándar para el diagnóstico, en la actualidad se reserva para los casos en los que no se llegue a un diagnóstico de certeza mediante los estudios previos4.
Además de los estudios de neuroimagen, hay que realizar otros estudios para aclarar la etiología, sobre todo de hipercoagulabilidad, con implicaciones en la duración del tratamiento y posterior profilaxis.
Con respecto al tratamiento, hay que abordar 3 vertientes: tratamiento sintomático, tratamiento etiológico y terapia antitrombótica. El tratamiento antitrombótico es uno de los puntos más controvertidos. No existe ningún ensayo aleatorizado sobre el tratamiento con fármacos antitrombóticos en la edad pediátrica, por lo que las recomendaciones se basan en estudios observacionales, extrapolación de estudios en adultos y consejo de expertos5. Los objetivos del tratamiento antitrombótico son la prevención de la propagación del trombo, la recanalización del seno o vena ocluida y la prevención de nuevos episodios. A pesar de la ausencia de ensayos clínicos pediátricos, se recomienda la anticoagulación entre 3-6 meses, ya que parece disminuir la mortalidad, el riesgo de secuelas y de recidiva5,6.
La presencia de una TVC contraindica seguir con la administración de L-asparaginasa.