Sr. Editor:
La incidencia global de tromboembolismo en el período neonatal es de 5 por 100.000 nacimientos. La trombosis venosa renal (TVR) es, con diferencia, la manifestación tromboembólica más frecuente en esta edad, representando más del 40 % de todas las trombosis venosas1.
Existen factores predisponentes (genéticos y adquiridos) del estado protrombótico. La trombofilia hereditaria se ha asociado a diferentes anomalías genéticas. La mayoría de los niños portadores de la mutación G20210A en el gen de la protrombina no desarrollan trombosis2.
El tratamiento de la TVR neonatal es controvertido y la respuesta a las terapias anticoagulante y fibrinolítica es diferente a la observada en niños mayores.
Presentamos una niña de 2 días de vida con una TVR derecha, portadora heterozigota de la mutación G20210A en el gen de la protrombina y su evolución tras tratamiento con heparina de bajo peso molecular (HBPM).
Niña nacida a término sin incidencias perinatales salvo fiebre materna intraparto (la madre recibió ampicilina intravenosa). Peso al nacimiento 3.775 g, test de Apgar al minuto, 9 y a los 5 min, 10. Presentaba ligera hipotonía e irritabilidad al estímulo.
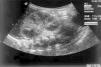
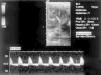
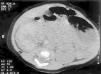
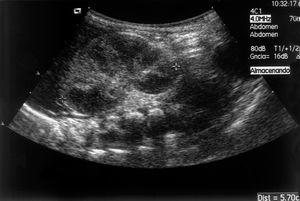
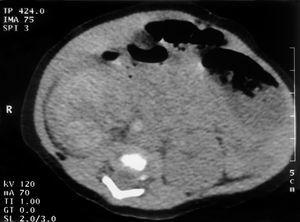
En la analítica destacaba hemoglobina 20,4 g/dl; hematocrito, 63 %; neutrófilos inmaduros/neutrófilos totales, 0,7; creatinina, 96 μmol/l,; AST 159 U/l; creatinfosfocinasa, 3.505 U/l; proteína C reactiva, 25,4 mg/dl. Recibió ampicilina y gentamicina. A las pocas horas presentó hipertensión arterial que necesitó tratamiento farmacológico, con buena respuesta. A las 48 h de vida se detectó una masa en flanco derecho y hematuria isomórfica. La ecografía abdominal mostró un riñón derecho patológico (fig. 1) y el Doppler del riñón derecho era indicativo de TVR (fig. 2). La gammagrafía renal evidenció ausencia de riñón derecho. La tomografía computarizada (TC) abdominal mostró calcificación en la cava infrarrenal (fig. 3). El dímero D fue 4.756 μg/l. La tabla 1 muestra el resultado del estudio biológico de trombosis. Analíticas sucesivas constataron trombopenia (80 x 109/l), incremento de la creatinina (116 μmol/l) y proteinuria (95 mg/h/m2) con normalización posterior. Diuresis conservada. La actividad renina plasmática: 21,5 μg/h/l. No precisó cateterismo umbilical.
Figura 1. Ecografía: corte longitudinal riñón derecho con un aumento global de tamaño, medulares aumentadas de tamaño, disminuidas de ecogenicidad y seno renal disminuido de tamaño.
Figura 2. Estudio eco-Doppler de arteria renal derecha con inversión del flujo diastólico.
Figura 3.TC abdominal: calcificación de la vena cava inferior infrarrenal compatible con trombosis.
A los 17 días de vida se tuvo conocimiento de la mutación del gen de la protrombina G20210A (tabla 1) y se inició HBPM: bemiparina, 115 U/kg/día por vía subcutánea durante 2 meses y luego 50 U/kg/día, 10 meses más. No constaban antecedentes familiares de tromboembolismo. El estudio genético familiar demostró la mutación PTG20210A en el padre, abuelo paterno y una tía paterna.
En la actualidad (a los 30 meses de edad) la niña no presenta hematuria, proteinuria ni hipertensión arterial (retirado tratamiento). La función renal es normal.
La ecografía abdominal muestra atrofia renal derecha e hipertrofia compensadora del riñón izquierdo. El Doppler del riñón izquierdo es normal.
La mutación de la protrombina G20210A3 tiene una prevalencia en la población adulta española sana del 6,5 %4 y en pacientes con tromboembolismo alcanza el 17,2 %, siendo el factor genético más prevalente4, aunque el riesgo de trombosis en los portadores es moderado, existiendo homozigotos adultos asintomáticos5. Existen pocos datos sobre la relación entre esta mutación y eventos trombóticos en el período perinatal. Sin embargo, su prevalencia parece bastante inferior a la del adulto1,6.
El manejo de la trombosis neonatal es controvertido y debería individualizarse. Sin embargo, el presente caso plantea la necesidad de un tratamiento anticoagulante sin dilación, sobre todo cuando existe compromiso de un órgano. Los anticoagulantes y fibrinolíticos apenas se han valorado en estudios clínicos de recién nacidos y generalmente la dosis y duración de tratamiento se extrapola a partir de datos en adultos7. La HBPM ofrece ventajas en comparación con la heparina estándar: administración subcutánea, biodisponibilidad próxima al 100 %, farmacocinética más predecible, así como menor frecuencia de complicaciones2 y eficacia similar. Nuestra paciente recibió HBPM probablemente en dosis subterapéutica, según investigaciones realizadas con otras HBPM en neonatos8. A pesar de ello, la evolución posterior fue favorable en la medida en que la HBPM probablemente frenó la afectación del riñón contralateral. Sin embargo, la evolución del riñón afectado hacia la atrofia permite sugerir la indicación de un tratamiento anticoagulante más precoz con independencia del resultado del estudio biológico de trombofilia.
La respuesta de las trombosis neonatales a la fibrinólisis es menor que en adultos puesto que los recién nacidos tienen concentraciones inferiores de plasminógeno. Se ha utilizado el activador tisular del plasminógeno con éxito9 aunque en la población pediátrica existe un mayor riesgo de hemorragia (especialmente hemorragia intracraneal) de alrededor del 1,5 % y puede alcanzar hasta el 13 % en niños pretérmino10.
A pesar de la falta de consenso en la literatura médica con respecto al tratamiento de la trombosis venosa neonatal consideramos indicado el inicio precoz de tratamiento anticoagulante.