El tumor miofibroblástico inflamatorio es una enfermedad poco frecuente en la edad pediátrica, en general benigna, aunque con posible evolución a malignidad.
Se presentan 3 pacientes con tumor miofibroblástico en edad pediátrica, en diferentes localizaciones: pulmonar, gástrica e intestinal.
Las características clínicas dependen del lugar en el que esté ubicado el tumor. Generalmente, hay fiebre prolongada en todos, sin gran afectación del estado general. En el primer caso, la hematemesis era su primer síntoma, mientras que en el segundo la anemia y la fiebre obligaron a la realización de una imagen abdominal. En el tercer caso fueron la fiebre, la tos y los síntomas respiratorios los que alertaban acerca de una posible tumoración pulmonar. En este caso se obtuvo un cultivo positivo para una micobacteria atípica: Mycobacterium avium.
Todos los casos cursan con aumento de proteína C reactiva, velocidad de sedimentación globular, anemia, trombocitosis y aumento de gammaglobulinas.
La evolución es favorable; la cirugía es curativa siempre y cuando la resección sea total; el diagnóstico es anatomopatológico.
Los autores quieren destacar la precocidad en el diagnóstico de uno de los pacientes (3 meses), dato no hallado en la literatura médica.
There cases of paediatric inflammatory myofibroblastic tumours in different locations are presented. This a rare benign disease, that can develop into malignant forms.
Clinical features are associated with the location. Fever was the main symptom in all our cases. The symptoms that indicated the location of the tumour were, haematemesis in the first case, and respiratory disease in the third. ,In the third case our patient was diagnosed with tuberculosis due to mycobacterium avium. All cases had increased CRP, ESR, thrombocytosis and high levels of gamma globulins
Surgery is curative if total resection is possible, and the diagnosis is made by histopathology.
We would like to emphasise the early development in the second case as this was a 3 months-old infant.
El tumor miofibroblástico, también conocido como seudotumor inflamatorio, es una lesión benigna poco frecuente en la edad pediátrica, aunque cada vez son más las publicaciones que aparecen en la literatura médica.
La primera descripción fue hecha por Brumm en 19391 en un tumor localizado en los pulmones. Desde entonces, su nombre ha generado cierta controversia; en la actualidad, se ha aceptado la denominación de tumor miofibroblástico inflamatorio (TMI).
Las características clínicas, localización, evolución y pronóstico de esta tumoración son muy variables. El diagnóstico es anatomopatológico y la cirugía es el tratamiento de elección, y llega a ser en la mayoría de los casos curativa cuando la resección es total.
Se presentan 3 casos de TMI de diferente localización, con características clínicas diferentes, analíticas similares y evolución favorable.
Caso 1Paciente varón de 6 años de edad que ingresa en este servicio por fiebre moderada, astenia, anorexia y pérdida de peso (1kg), así como por deposiciones oscuras de una semana de evolución.
En el momento de la exploración, cabe destacar un buen estado general, con palidez cutaneomucosa. El paciente está febril.
En los exámenes complementarios se detecta anemia con hemoglobina (Hb) de 7,5g/dl; volumen corpuscular medio (VCM) de 75fl; leucocitosis de 11,8×109/l con desviación izquierda; trombocitosis de 651×109/l; velocidad de sedimentación globular (VSG) superior a 138mm/h; proteína C reactiva (PCR) superior a 12mg/dl y una sideremia de 10μg/dl.
Ante la sospecha de una hemorragia digestiva se indica una gastroscopia, donde se observa una tumoración en la cara posterior del estómago. Se completa el estudio mediante una tomografía computarizada (TC) abdominal que muestra una masa en el estómago, con densidad de las partes blandas y que respeta planos vecinos. Ante este hallazgo, se decide realizar como primera opción terapéutica una gastrectomía parcial con reconstrucción tipo Billroth I.
Macroscópicamente, la pieza extirpada corresponde a una lesión de aspecto polipoideo de unos 6cm de diámetro, coloración pardoviolácea, recubierta de mucosa normal y con cierta ulceración en su superficie, que se extiende desde la capa mucosa hasta la serosa (fig. 1).
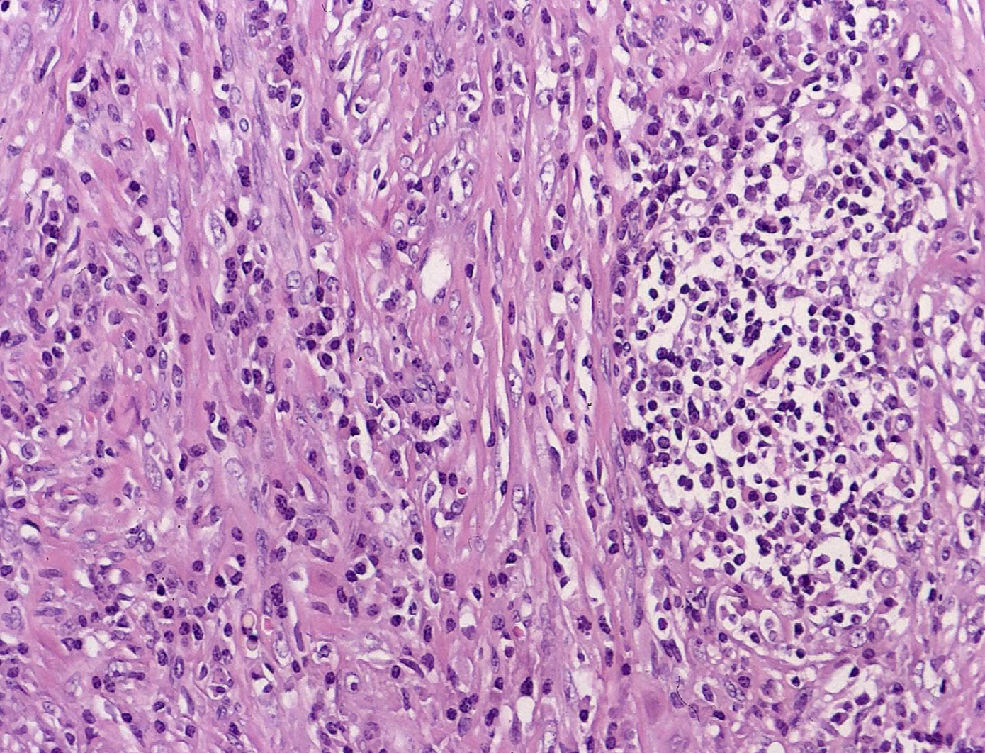
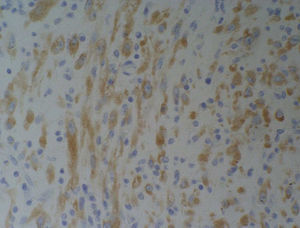
El examen microscópico informa de un crecimiento fusocelular con estroma colagenizada, células fusiformes miofibroblásticas sin atipias citológicas ni mitosis, y componente inflamatorio con linfocitos y células plasmáticas (fig. 2).
Las células son positivas para vimentina y actina, y negativas para linfocitos CD34 y proteína S-100, con lo que el diagnóstico es de TMI.
A los 10 años de evolución, el paciente continúa asintomático con normalización absoluta de los exámenes complementarios.
Caso 2Lactante de 2 meses de edad enviada desde otro centro hospitalario para estudio de un proceso febril de 2 semanas de evolución. Había seguido tratamiento antibiótico por infección de orina por Enterobacter cloacae. La ecografia abdominal y la gammagrafía con tecnecio y galio realizadas son normales. A pesar de este tratamiento, persiste la fiebre y se evidencian una anemia moderada y progresiva y un aumento de los reactantes de fase aguda, aunque mantiene un buen estado general.
En el momento de su ingreso, en la exploración física únicamente destaca la palidez de la piel y las mucosas.
Los exámenes complementarios detectan una Hb de 7,2g/dl; con VCM de 84,4fl; leucocitosis de 18×109/l con fórmula normal; trombocitosis de 1.102×109/l; VSG de 116mm/h; PCR de 17,5mg/dl; enolasa de 14,4mg/dl y alfafetoproteína de 116,2ng/ml; el resto de las determinaciones son normales.
Se realiza una nueva ecografía abdominal en la que se aprecia una masa de 4×4cm de características vasculares, localizada en el peritoneo, independiente del riñón y del hígado. Se completa el estudio con una TC y una resonancia magnética que confirman las características anteriormente descritas y su localización en la zona intestinal. Se decide intervenir quirúrgicamente para resecar la masa en su totalidad.
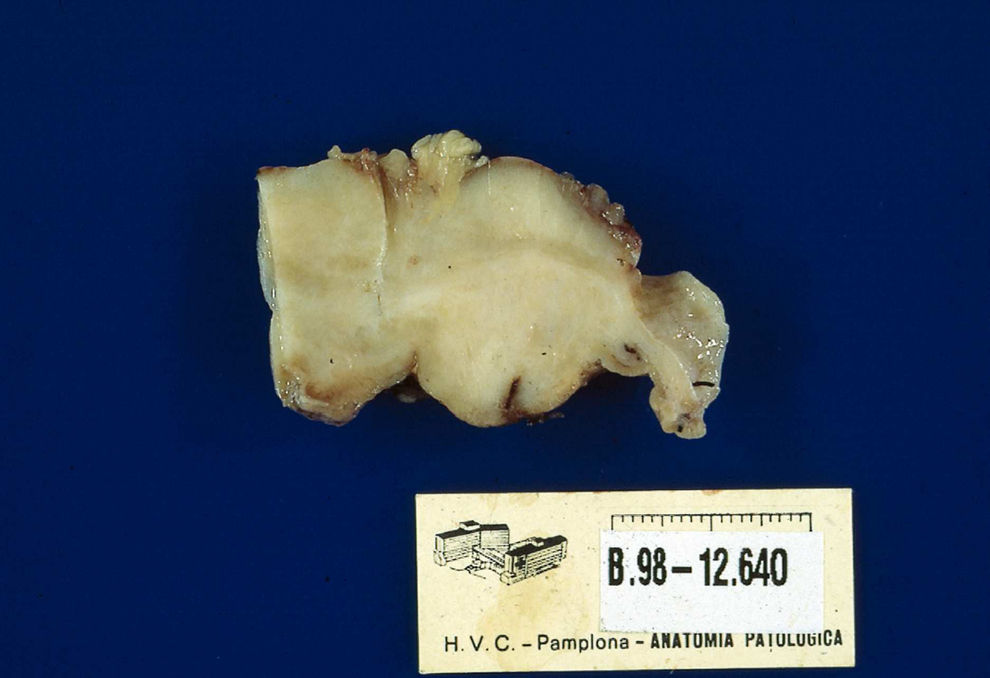
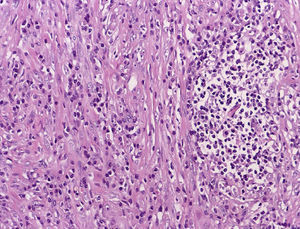
Macroscópicamente, se trata de una tumoración localizada en el íleon, que mide 5,5×5×6cm, de consistencia blanda, que presenta una superficie lisa y brillante, que engloba el asa intestinal (fig. 3).
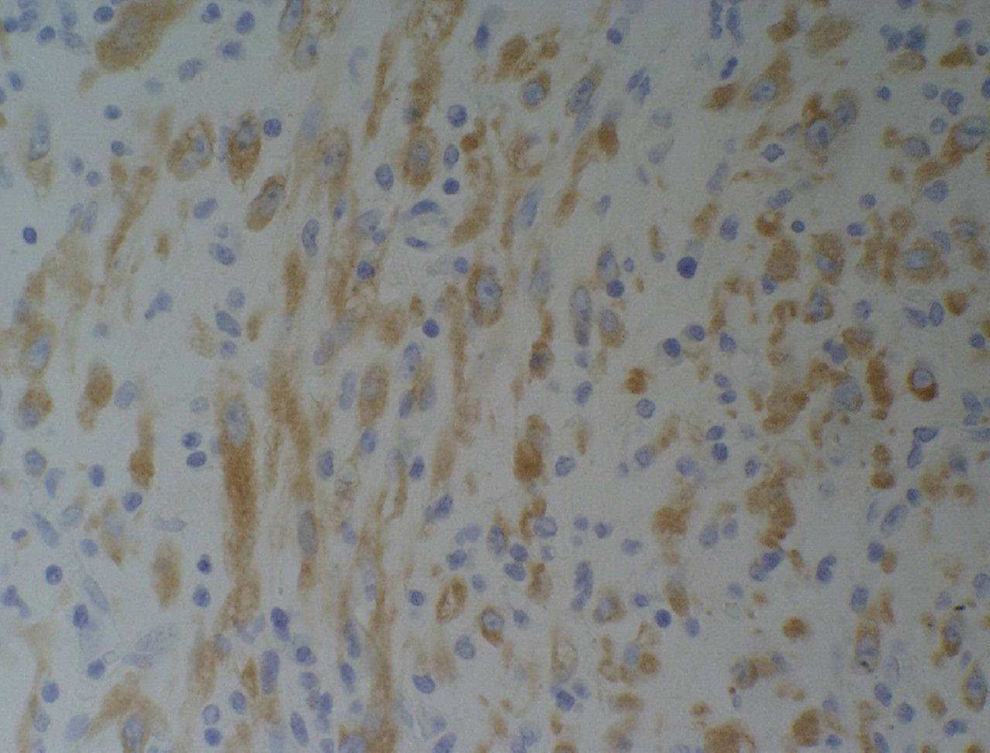
Microscópicamente, se informa como una tumoración fusocelular originada en la serosa intestinal, constituida por haces fibrosos con una celularidad muy polimorfa, donde alternan los elementos inflamatorios y las células miofiobroblásticas con inmunofenotipo ALK (anaplastic lymphoma kinase), desmina, actina, vimentina y proteína S-100 positivas; el diagnóstico anatomopatológico definitivo es el de TMI (fig. 4).
La evolución es muy favorable, con analítica normal 3 meses después de la cirugía.
Caso 3Paciente de 8 años y 10 meses que acude al Servicio de Urgencias por presentar dolor torácico de horas de evolución. El dolor es continuo, se acompaña de dificultad respiratoria. Aparece también en reposo y no empeora con los movimientos respiratorios. No presenta tos ni expectoración. Presenta algunos vómitos.
Está en tratamiento desde hace un mes y medio con isoniacida, rifampicina y piracinamida por sospecha fundada de tuberculosis (TBC) con Mantoux de 10mm y TC indicativa de TBC pulmonar.
A la exploración física presenta regular estado general, temperatura de 36,4°C, frecuencia cardíaca de 127 y saturación de oxígeno 88–92%.
Auscultación pulmonar: hipoventilación en el hemotórax izquierdo con quejido respiratorio continuo.
Auscultación cardíaca: rítmico y sin soplos.
El resto es normal. Se realiza una radiografía de tórax en la que se aprecia velamiento del hemitórax izquierdo con desplazamiento mediastínico y neumotórax. Analíticamente destaca una anemia microcítica con elevación de los reactantes de fase aguda: leucocitos de 10,9×109/l con un 74,8% de polimorfonucleares (PMN); plaquetas de 482×109/l; VSG de 111mm/h y PCR de 8,74mg/dl. Presenta, asimismo, hipergammaglobulinemia con inmunoglobulina G de 1.830mg/dl.
Ingresa en planta con tratamiento antibiótico (cefotaxima) y al día siguiente se le realiza una fibrobroncoscopia en la que se visualiza en la carina una tumoración que ocluye la entrada al bronquio principal izquierdo, indicativa de un posible granuloma tuberculoso. Se realiza un lavado broncoalveolar, se envían muestras para Anatomía Patológica y Microbiología. Se obtiene cultivo positivo para Mycobacterium avium, por lo que se modifica el tratamiento; la pauta es isoniacida, rifampicina y claritromicina. Un mes y medio después se le realiza una TC pulmonar en la que se observa un colapso total del pulmón izquierdo y una masa paratraqueal que capta contraste y comprime el bronquio principal izquierdo. Posteriormente, se le realiza una broncoscopia rígida, con toma de varias biopsias y exéresis de la tumoración bronquial. La anatomía patológica de las muestras establece el diagnóstico de tumor miofibroblástico, con marcadores inmunohistoquímicos no indicativos de malignidad. Dos meses después se lo interviene quirúrgicamente del tumor; el postoperatorio inmediato es favorable. En el informe anatomopatológico definitivo destacan fragmentos de un tumor con un crecimiento fasciculado en las zonas mixoides, con abundantes vasos, constituido por células de aspecto fibroblástico, epitelioide e histiocítico, con alguna mitosis típica. Entremezcladas hay abundantes células inflamatorias: plasmáticas, linfocitos y PMN.
No se identifican granulomas, células de Langerhans, necrosis ni bacilos de Ziehl.
En la inmunohistoquímica (IHQ) destacan: vimentina: +++; desmina, AMS, CK AE1-AE3, ALK, proteína S-100 y virus del herpes tipo 8: negativos; P-53: débilmente + en el 5% de las células. Todo esto compatible con un tumor miofibroblástico.
La evolución de la paciente es tórpida y presenta recidiva del tumor. Actualmente sigue tratamiento con isoniacida, rifampicina y piracinamida; está pendiente una nueva resección.
DiscusiónEl TMI es una lesión benigna, poco frecuente y de predominio en la edad pediátrica. Su localización anatómica es muy variable, puesto que el miofibroblasto es la célula originaria; si bien se describe predominantemente en los pulmones y en niños y adultos jóvenes, no se ha encontrado en la literatura médica revisada TMI en menores de 3 meses de edad2–7. Anteriormente se han presentado 2 casos de localización digestiva (otra de las localizaciones referidas frecuentemente en la literatura médica) y otro de localización pulmonar, probablemente secundario a una infección por M. avium.
Su patogenia no está aclarada, aunque son muchos los autores que defienden una naturaleza reactiva8–10, una respuesta exagerada a algún tipo de estímulo. Muchos son los agentes infecciosos que se han asociado a esta entidad, entre ellos, los más frecuentes son los siguientes: M. avium intracellulare, Corynebacterium equi, Bacillus sphaerius, Coxiella burnetii, virus de Epstein-Barr y hongos1. Esta teoría se encuentra avalada por las características inflamatorias del tumor, la hipergammaglobulinemia y la elevación de VSG que se presenta de forma constante, y la presencia de reactantes de fase aguda, así como por el antecedente de infección que aparece en muchos de los casos descritos. Recientemente se ha implicado al virus del herpes tipo 8 como posible causante. El papel de un agente infeccioso parece quedar restringido a los primeros estadios, iniciándose así una cascada de reacciones en las células y la estroma inflamatoria, a través de las cuales el tumor llega a ser autónomo.11.
De los 3 casos expuestos, en uno de ellos el antecedente infeccioso está claro puesto que la paciente presentaba infección por M. avium con cultivo y PCR positivos. Similar patogenia podría tener el segundo caso, puesto que hubo antecedente de infección del tracto urinario con urocultivo positivo para E. cloacae; no queda clara la relación entre ambos procesos. En el otro caso, no es posible determinar un antecedente infeccioso previo, aunque tampoco podría descartarse.
Las características analíticas son comunes para todos los casos. En la mayor parte de ellos se encontró anemia, VSG elevada y aumento de los reactantes de fase aguda (PCR, trombocitosis), así como leucocitosis e hipergammaglobulinemia. Sin embargo, el comportamiento de estos tumores es muy variable, desde pacientes asintomáticos o con fiebre de origen desconocido, hasta cuadros clínicos similares a una neoplasia que dan lugar a fenómenos obstructivos o compresivos de los órganos vecinos y síntomas constitucionales generales (como fiebre, cansancio, sudoración y pérdida de peso), en relación con la localización anatómica7. El estudio complementario es, en muchas ocasiones, lo que hace detectar casualmente estos tumores: pueden denominarse verdaderos «incidentalomas»3. En estos casos, se observó cómo la fiebre y las alteraciones analíticas fueron características constantes; pero mientras que en el primero las deposiciones oscuras orientaron hacia un posible origen hemorrágico intestinal, en el segundo caso fue la fiebre prolongada la que hizo precisa la realización de pruebas de imagen; la masa fue un hallazgo casual.
Los hallazgos radiológicos orientan hacia un proceso benigno. La ecografía y la TC suelen mostrar masas hipodensas encapsuladas, que no son características, por lo que el diagnóstico definitivo requiere de la confirmación anatomopatológica, por lo que es necesaria una cirugía o biopsia7,12–15.
Macroscópicamente, como ocurre en estos casos, se observa una masa bien circunscrita, encapsulada, firme, con bordes no infiltrantes y cambios focales mixoides8.
Microscópicamente se describen 3 patrones histológicos: uno que muestra cambios mixoides, vasculares y áreas inflamatorias; un segundo con células fusiformes, compactas, con células inflamatorias entremezcladas (infiltrado de células plasmáticas y eosinófilos), y un tercero con un predominio de matriz colágena densa4,7,12,13,16.
La IHQ revela que la población de células inflamatorias es policlonal, lo que expresa benignidad, ya que la mayoría de las neoplasias malignas son monoclonales. Las células son positivas para vimentina, actina, músculo liso y desmina; y con CK, antígeno de membrana epitelial y proteína S−100 negativos2,7,17. En un 50% de los casos las células son positivas para ALK, también descrita en algunos procesos proliferativos malignos18–20. Ultraestructuralmente, se demuestra la existencia de un componente miofibroblástico con abundante retículo endoplásmico rugoso, filamentos citoplásmicos y cuerpos densos2,7. El diagnóstico diferencial en cualquier localización debe realizarse con neoplasias primitivas o metastásicas2. Si la localización es en la zona respiratoria, se debe diferenciar de otros procesos inflamatorios, como granulomatosis de Wegener, TBC pulmonar, linfomas y fibrohistiocitomas. Cuando se localiza en el hígado, hay que pensar en abscesos hepáticos, linfomas, TBC; y, si la localización es en los tejidos blandos principalmente, hay que hacer el diagnóstico diferencial con otros tumores mesenquimales21.
En general, el tumor miofibroblástico tiene un comportamiento benigno y la cirugía es curativa en la mayoría de los casos cuando la resección es completa. Se han descrito, de igual forma, otros tratamientos, como corticoides, antiinflamatorios (ciclooxigenasa-2) radioterapia e, incluso, colchicina; si bien es cierto que siempre se prefiere la cirugía radical. Los controles periódicos posteriores son necesarios, ya que se han dado casos de recidiva, sobre todo en los que la resección de márgenes no ha sido completa.
De forma muy infrecuente, el tumor miofibroblástico puede degenerar hacia la malignidad; en estos casos, los miofibroblastos presentan atipias y cursan con un comportamiento clínico agresivo con recidivas o metástasis, en las que la quimioterapia y la radioterapia han demostrado ser efectivas22–24.
Como conclusión, los autores de este artículo quieren destacar las características inflamatorias de este tumor, tanto in situ como en cuanto a lo analítico; las diferentes localizaciones anatómicas en su presentación; la excelente evolución tras la cirugía y el que se los debe tener en cuenta en el diagnóstico diferencial de otras enfermedades tumorales y de la fiebre de origen desconocido en la edad pediátrica.
Asimismo, quieren destacar la edad del segundo paciente (2 meses), puesto que no se ha encontrado ningún caso publicado con esa edad en la literatura médica revisada.
Por último, hay que hacer especial mención a las características analíticas comunes a los 3 casos que, acompañados de fiebre y buen estado general, deben hacer sospechar esta enfermedad si se han descartado otras posibles causas. En ocasiones, el diagnóstico no es fácil e, incluso, son necesarias varias pruebas de imagen, pero es importante pensar en él para poder diagnosticarlo, puesto que el pronóstico es favorable y el tratamiento, curativo.