Evaluar el valor diagnóstico de la interleuquina-6 (IL-6) para predecir el riesgo de sepsis neonatal, a fin de diseñar un algoritmo para decidir el inicio de tratamiento antibiótico.
MétodosSe determinaron la IL-6 y la proteína C reactiva (PCR) en 42 recién nacidos (RN) con sospecha clínica de infección. Los RN se clasificaron como infección confirmada, infección probable o ausencia de infección, sobre la base de los resultados de los cultivos, las radiografías de tórax y la afectación de 4 o más áreas clínicas en una escala de 8. Las muestras para IL-6 se recogieron en la evaluación inicial y se congelaron hasta su determinación al final del estudio. El análisis de IL-6 se realizó de forma ciega mediante un test rápido. Se determinaron las curvas de características operador receptor para PCR e IL-6 frente a infección (confirmada o probable).
ResultadosOnce (26,2%) entre 42 casos incluidos en el estudio se clasificaron como infección confirmada o infección probable. El área bajo la curva para IL-6 fue de 0,9, con un valor de corte de 53pg/ml, sensibilidad del 90,91%, especificidad del 80%, valor predictivo positivo del 62,5% y valor predictivo negativo del 96%. El nivel de IL-6>96pg/ml o la combinación de IL-6>53+ PCR>13,3mg/l fueron los marcadores que mejor predijeron la infección (especificidad y VPP del 100%).
ConclusionesLa determinación de IL-6 podría permitir demorar o suspender precozmente el tratamiento antibiótico en los recién nacidos con IL-6<54pg/ml. En los casos con IL-6>96pg/ml o IL-6>53+PCR>13,3 mg/l, el tratamiento antibiótico debería iniciarse de inmediato, dada la alta probabilidad de infección. La aplicación de un algoritmo basado en la determinación de IL-6 y PCR, en la evaluación inicial de los RN con sospecha clínica de infección, podría reducir el consumo innecesario de antibióticos.
To evaluate the diagnostic value of interleukin-6 (IL-6) to predict the likelihood of neonatal sepsis in order to design an algorithm to decide antibiotic therapy.
MethodsIL-6 and C-reactive protein (CRP) were determined in 42 newborns with clinical suspicion of infection. Newborns were classified as a confirmed, probable or no infection, based on the results of cultures, chest X-rays and the involvement of four or more clinical areas on a scale of eight. Samples for IL-6 were collected in the initial assessment and frozen until its determination at the end of the study. Blinded IL-6 measurements were performed using a rapid test. Receiver operator characteristics curves (ROC) for CRP and IL-6 versus infection (confirmed or probable) were determined.
ResultsAmong the 42 cases included in the study 11 (26.2%) were classified as confirmed or probable infection. The area under curve (AUC) for IL-6 was 0.9, with a cut-off value of 53pg/ml: sensitivity 90.91%, specificity 80%, positive predictive value (PPV) 62.5% and negative (NPV) 96% The level of IL-6>96pg/ml and/or the combination of IL-6>53+CRP>13.3mg/l, were the markers that best predicted infection: specificity 100% and PPV: 100%.
ConclusionsAssessment of IL-6 could allow withholding or early discontinuation of antibiotics in newborns with IL-6<54pg/ml. In cases with IL-6>96pg/ml and/or IL-6>53+ CRP>13.3, antibiotics should be started promptly, given the high likelihood of infection. Implementation of an algorithm based on the determination of IL-6 and CRP, in the initial assessment of the newborn with clinical suspicion of infection, could reduce unnecessary antibiotic therapy.
El diagnóstico de sospecha de la sepsis neonatal se fundamenta en una serie de factores de riesgo y de parámetros clínicos y analíticos inespecíficos, por lo que en muchas ocasiones resulta difícil valorar cuándo es conveniente iniciar tratamiento antibiótico. Por otro lado, el diagnóstico de confirmación depende de los resultados de los hemocultivos, que en el período neonatal presentan menor rentabilidad debido a que el volumen de extracción es muchas veces insuficiente para detectar bacteriemias que en muchos casos son intermitentes. Por eso es importante disponer de algún marcador bioquímico que nos permita predecir la probabilidad de infección, así como apoyar el diagnóstico clínico de sepsis1. La interleuquina-6 (IL-6) es uno de de los mediadores de la inflamación que se liberan más precozmente en el curso de un cuadro séptico y es crucial en el inicio de la respuesta inmunitaria, así como en la activación de linfocitos T y proliferación y diferenciación de linfocitos B2. Además, la IL-6 es un potente pirógeno que induce la liberación de proteínas de fase aguda, como la proteína C reactiva (PCR). La IL-6 alcanza su pico máximo a las 2h de inicio del estímulo bacteriano, por lo que sus niveles pueden encontrarse elevados antes del inicio de los síntomas y antes de que se eleven los marcadores utilizados de rutina, como la PCR3,4. La elevación de los niveles de IL-6 en sangre materna y en cordón umbilical en partos pretérmino se ha relacionado también con mayor morbimortalidad en el período neonatal, tanto sepsis precoz como otras enfermedades no infecciosas5,6. La IL-6 y otras citoquinas, como IL-8, IL-1 y TNF-α han demostrado ser útiles no sólo en el diagnóstico, sino en la evaluación de la eficiencia terapéutica7. Además, la combinación de IL-8 con PCR ha demostrado ser útil para reducir de forma segura la indicación de tratamientos antibióticos innecesarios en recién nacidos (RN) con riesgo o sospecha de infección8,9. Otros marcadores, como la procalcitonina (PCT), se han evaluado en el diagnóstico de la infección neonatal con resultados variables, probablemente en relación con la elevación progresiva de los niveles de PCT entre las 12 y 48h de vida en el RN, incluso en ausencia de infección, lo que restaría utilidad en el diagnóstico de la sepsis neonatal precoz10–12.
En este estudio se ha pretendido analizar la utilidad de la determinación de IL-6 para predecir la sepsis neonatal en el RN con sospecha clínica de infección, mediante una nueva técnica rápida de cromatografía en papel. Este nuevo método se ha comparado recientemente con el método de referencia (ELISA), con resultados satisfactorios13, y existe alguna publicación que avala su uso en neonatos14. Secundariamente y en función de los resultados, se planteó elaborar un algoritmo de decisión para el inicio de tratamiento antibiótico en el RN con sospecha clínica de infección.
Material y métodoSe incluyeron los neonatos nacidos entre octubre de 2007 y enero de 2008 que presentaron sospecha clínica de infección. En ningún caso se realizó extracción de sangre exclusivamente para incluirse en el estudio, sino que se aprovechó suero residual de aquellos casos a los que se solicitó analítica con PCR. En la primera evaluación tras la sospecha clínica, se solicitó bioquímica urgente con “perfil de sepsis neonatal” que incluía PCR e IL-6. En el laboratorio se separó una pequeña cantidad de suero (100μl) y se congeló hasta su determinación al final del estudio. Además del perfil bioquímico, en todos los casos se realizó hemograma con fórmula manual, hemocultivo y gasometría. En la mayoría de los casos de sospecha de sepsis precoz (<72h) se recogieron cultivos de superficie (faríngeo, conjuntival, umbilical y ótico). Se recogieron cultivos de orina, líquido cefalorraquídeo (LCR) u otros en los casos que procedía sobre la base de la sospecha clínica. Las muestras para IL-6 se mantuvieron congeladas hasta su determinación al final del estudio. Este estudio lo autorizó el Comité de Ética y Asistencia Sanitaria del hospital y se solicitó consentimiento informado a los padres de los pacientes incluidos en el estudio.
Al alta del paciente, se recogió una serie de datos perinatales y clínicos en orden a clasificar a los pacientes en 3 grupos: A) infección confirmada: cualquiera de los 2 supuestos: 1) cultivo positivo significativo en sangre, LCR u orina, 2) radiografía de tórax con patrón de bronconeumonía y al menos tres criterios de infección probable; B) infección probable: alguna alteración en al menos 4 de las siguientes áreas clínicas: 1) respiratoria: distrés, apnea, taquipnea o hipoxemia; 2) cardiológica: taquicardia o bradicardia; 3) hemodinámica: mal color, hipoperfusión periférica o hipotensión.; 4) neurológica: irritabilidad, letargia, hipotonía, hipoactividad o convulsiones; 5) digestiva: mala alimentación, intolerancia o distensión abdominal; 6) regulación térmica: fiebre >38 °C, hipotermia (<36 °C); 7) metabólica: acidosis metabólica o hiperglucemia, y 8) hematológica: leucocitosis >30.000/μl o leucopenia<9.000/μl en menos de 72h, leucocitosis >20.000/μl o leucopenia <5.000/μl en más de 72h, neutropenia de <1.000/μl, índice de neutrófilos inmaduros>0,2 en <72h o >0,12 en >72h, y C) ausencia de infección: no cumple criterios de infección confirmada ni probable.
La clasificación del RN sobre la base de los criterios de infección se realizó al alta y de forma ciega a los resultados de IL-6.
La determinación de IL-6 se realizó a posteriori en el laboratorio de urgencias y de forma ciega a los datos clínicos de los pacientes. La medición se realizó mediante tecnología de cromatografía en papel con química seca (Milenia® Quickline IL-6-MQL6 1) de Vitro®. El análisis cuantitativo se realizó con PicoScan® de Milenia Biotec®, con rango de cuantificación de 50–10.000pg/ml. Los resultados se obtuvieron en un tiempo aproximado de 20 min.
Se obtuvieron las curvas de características operador receptor (COR) de IL-6 y PCR mediante el programa MedCalc, y se determinaron los puntos de corte para PCR e IL-6, así como la sensibilidad, la especificidad, los cocientes de probabilidad de prueba positiva-negativa y valores predictivos, con los correspondientes intervalos de confianza. Para el análisis de IL-6 en combinación con PCR se utilizó la calculadora Excel para pruebas diagnósticas de la red CASPe (URL: http://www.redcaspe.org). Se utilizó SPSS para estadística descriptiva. Se analizaron los resultados agrupando los casos de infección confirmada y probable.
ResultadosCuarenta y dos RN cumplieron criterios de inclusión en el estudio. De ellos, 4 consultaron en el servicio de urgencias. El rango de edad gestacional fue de 27 a 42 semanas con una media de 35,3 semanas y un peso medio de 2.500g. La edad de sospecha clínica estuvo entre 2h y 30 días de vida, con una mediana de 22h. En 30 casos (71%) se sospechó sepsis precoz (<72h), y en 12 casos (29%) se sospechó sepsis tardía.
Once RN de los 42 incluidos en el estudio (26,2%) (probabilidad preprueba) cumplieron criterios de infección probable o confirmada: 6 casos de infección confirmada y 5 casos de infección probable (6 casos fueron sepsis precoz y 5 fueron sepsis tardía). De los 6 casos de infección confirmada, 3 fueron sepsis precoz con bronconeumonía, y los 3 restantes fueron sepsis tardía (4–8 días) con urocultivo positivo, aunque los 3 debutaron con un cuadro séptico, uno de ellos con bacteriemia y 2 con meningitis.
Veinte RN (47,6%) recibieron antibióticos, incluyendo los 11 casos con criterios de infección y los 9 que se clasificaron al alta como no infectados.
Entre los 11 RN clasificados como infección confirmada o probable, el nivel de IL-6 fue detectable (<50pg/ml) en 10 casos e indetectable (<50pg/ml) en uno. Cinco tuvieron niveles de IL-6 superiores a 100pg/ml, 3 de ellos superiores a 10.000pg/ml. Entre los 31 casos clasificados como no infectados, el nivel de IL-6 fue indetectable (<50pg/ml) en 24 casos y detectable (>50pg/ml) en 7, en ningún caso superior a 100pg/ml (tabla 1). La diferencia fue estadísticamente significativa con el test no paramétrico U de Mann-Whitney, con un valor de p = 0,0001. Los niveles de PCR también estuvieron significativamente elevados en los 11 RN infectados (20,6mg/l, error estándar [ES] 7,5) respecto a los no infectados (5,1mg/l, ES 1,6) (U de Mann-Whitney: p = 0,047).
La curva COR para IL-6 tuvo un área bajo la curva (AUC) de 0,9 (fig. 1). En el punto de corte 53pg/ml la sensibilidad fue del 90,91% y la especificidad fue del 80%, con un valor predictivo positivo (VPP) del 62,5% y un valor predictivo negativo (VPN) del 96%. A partir de 96pg/ml, el test tuvo especificidad y VPP del 100% (tabla 2).
Curvas de características operador receptor de interleuquina-6 (áreas bajo la curva [AUC] de 0,9 [intervalo de confianza {IC} del 95%: 0,765–0,971], p = 0,0001), y proteína C reactiva (AUC de 0,7 [IC del 95%: 0,542–0,833], p = 0,03). La diferencia no es estadísticamente significativa (p = 0,054).
Interleuquina 6 (pg/ml), proteína C reactiva (mg/l) y combinación de ambas frente a infección: valores de sensibilidad, especificidad, cocientes de probabilidad de prueba positiva/negativa (LR) y valores predictivos (positivos y negativos) para diferentes puntos de corte
| Criterio | Probabilidad pretest | Sensibilidad (IC del 95%) | Especificidad (IC del 95%) | LR pos | LR neg | VPP (IC del 95%) | VPN (IC del 95%) |
| IL-6>53 | 26,2 | 90,91 (58,7–98,5) | 80,65 (62,5–92,59) | 4,7 | 0,11 | 62,5% (38,6–81,5) | 96% (81,1–99,3) |
| IL-6>96 | 26,2 | 45,5 (16,9–76,5) | 100 (89–100) | – | 0,55 | 100 (56,6–100) | 83,8 (68,9–92,3) |
| PCR >13,3 | 26,2 | 45,45 (16,9–76,5) | 93,55 (78,55–99) | 7,05 | 0,58 | 71,4 (35,9–91,8) | 82,9% (67,3–91,9) |
| PCR >36,8 | 26,2 | 27,27 (6,3–60,9) | 100 (88,7–100) | – | 0,73 | 100 (43,8–100) | 79,5 (64,5–89,2) |
| IL-6>53+PCR >13,3 | 26,2 | 45,5 (21,3–72) | 100 (89–100) | – | 0,55 | 100 (56,6–100) | 83,8 (68,9–92,3) |
| IL-6>53+PCR >13,3 o IL-6>96 | 26,2 | 54,5 (28–78,7) | 100 (89–100) | – | 0,45 | 100 (61–100) | 86,1 (71,3–93,9) |
IC: intervalo de confianza; IL-6: interleuquina-6; PCR: proteína C reactiva; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La curva COR para PCR tuvo un AUC de 0,702 (fig. 1). En el punto de corte 13,3mg/l, la sensibilidad fue del 45,45% y la especificidad fue del 93,55%, con un VPP del 71,4% y un VPN del 82,9%. A partir de 36,8mg/l, el test tuvo especificidad y VPP del 100% (tabla 2).
La diferencia entre las curvas COR de PCR e IL-6 no llegó a ser estadísticamente significativa (p = 0,054) dado que se solaparon los intervalos de confianza de las AUC (fig. 1).
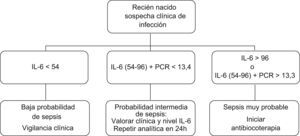
La IL-6 >96pg/ml o la combinación de IL-6 positiva (>53pg/ml) y PCR positiva (>13,3mg/l) presentaron especificidad y VPP del 100% frente a la infección (tabla 2).
DiscusiónEl presente estudio presenta limitaciones, en razón del número de casos incluidos y la dificultad para establecer un método de referencia para el diagnóstico clínico de sepsis neonatal. La baja rentabilidad del hemocultivo en el RN ya es conocida y nos obliga en la mayoría de los casos a utilizar criterios clínicos para el diagnóstico de sepsis neonatal. Al no existir ninguna escala validada para el diagnóstico clínico de de sepsis clínica neonatal, se decidió adaptar un baremo basado en datos clínicos y analíticos, de características similares a otros que han utlizado otros autores7,15. Aunque somos conscientes del margen de error, éste en ningún caso estuvo condicionado por los resultados de IL-6, dado que la determinación de IL-6 se realizó de forma ciega a la clasificación de los pacientes, que se había hecho previamente. Por otro lado, el número de casos ha incidido en la menor precisión de los intervalos de confianza y en la ausencia de diferencias significativas entre IL-6 y PCR (p = 0,054), a pesar de que es probable que existan.
En función de nuestros resultados, la IL-6 resultó ser un marcador preciso de sepsis en el estudio inicial del RN con sospecha clínica de infección, como se pudo apreciar en la curva COR (AUC de 0,9; p = 0,0001), sensiblemente mejor que PCR, a pesar de que la diferencia no fue estadísticamente significativa.
Tomando como punto de corte IL-6 >53pg/ml, prácticamente en límite de detectabilidad (indetectable <50), la IL-6 resultó ser un test muy sensible, ya que fue positivo en 10 de los 11 niños clasificados como infectados. Este punto de corte está muy próximo al recientemente publicado mediante obtención del rango de valores normales de IL-6 en RN no infectados16. Sólo uno de los pacientes clasificado como infectado tuvo IL-6 negativa. Este paciente había sido diagnosticado de bronconeumonía, aunque al revisar la historia no pudo descartarse que se tratara de un síndrome de aspiración meconial, en cuyo caso la sensibilidad de IL-6 habría sido del 100%. En cualquier caso, podemos considerar que la IL-6 podría ser un marcador muy sensible y con un alto VPN en el diagnóstico precoz de la sepsis neonatal, lo que nos permitiría en la práctica clínica demorar la decisión de iniciar tratamiento antibiótico en RN de bajo riesgo, en los que la IL-6 resulta indetectable (<50pg/ml) y que no presentan un cuadro clínico de sepsis evidente. Al establecer como punto de corte valores de IL-6 superiores a 96pg/ml, el test resultó menos sensible pero altamente específico y con un alto VPP, por lo que, en estos casos, se debería iniciar tratamiento antibiótico empírico de forma inmediata.
La PCR (punto de corte >13,3mg/l) resultó ser poco sensible en la evaluación inicial del RN con sospecha de infección, por lo que resultaría poco útil para discriminar a aquellos pacientes a los que se les podría evitar el tratamiento antibiótico. Aunque tomando como punto de corte una PCR >36,8mg/l el test podría ser altamente específico, su baja sensibilidad le restaría utilidad clínica.
Sin embargo, la combinación de IL-6 positiva (>53pg/ml) y PCR positiva (>13.3mg/l) fue similar en cuanto a especificidad y VPP, a la IL-6 >96pg/ml, por lo que en estos casos también debería iniciarse tratamiento antibiótico precoz.
La combinación de cualquiera de ambos test positivos: IL-6 >96pg/ml o IL-6 >53+PCR >13,3, podría ser la mejor opción para definir la probabilidad de sepsis como alta.
En los pacientes con valores de IL-6 entre 54 y 96pg/ml y PCR no superior a 13,3m/l, la decisión de iniciar tratamiento antibiótico debería realizarse sobre la base de criterios clínicos y del nivel de IL-6 (cuanto más próximo a 96pg/ml, mayor probabilidad de sepsis), y valorar la oportunidad de repetir los marcadores en función de la evolución clínica.
Sobre la base de la interpretación de estos resultados hemos diseñado un algoritmo de decisión para el diagnóstico precoz de sepsis neonatal y la indicación de iniciar tratamiento antibiótico (fig. 2). Evidentemente este algoritmo debería ser meramente orientativo, ya que por encima de él debería estar en todos los casos el criterio clínico del pediatra que atiende al RN.
En nuestro estudio, 9 de los 20 RN que recibieron tratamiento antibiótico se clasificaron al alta como no infectados. En función de nuestros resultados podemos afirmar que la determinación de IL-6 mediante tecnología de cromatografía en papel, en el momento inicial de la sospecha clínica de infección, es un método fácil, rápido (resultados en 20min) y altamente sensible, que podría evitar en algunos casos el inicio de tratamientos antibióticos innecesarios. En otros, podría permitir la suspensión precoz de los antibióticos en los casos de evolución clínica favorable, como han sugerido algunos autores17. La combinación con PCR podría mejorar la especificidad, en los casos de IL-6 moderadamente elevada (50–100 pg/ml). Esta combinación podría ser especialmente útil cuando el paciente lleva más tiempo de evolución y es más probable que la IL-6 esté ya en fase de descenso y la PCR en ascenso.
Como conclusión, la aplicación de un algoritmo basado en la determinación rápida de IL-6 y PCR, en la evaluación inicial del RN con sospecha clínica de infección, podría reducir el número de RN a los que se administra un tratamiento antibiótico innecesario, y reducir a su vez los posibles efectos adversos y el número de estancias neonatales. Sería recomendable realizar un estudio más amplio para confirmar estos resultados.






![Curvas de características operador receptor de interleuquina-6 (áreas bajo la curva [AUC] de 0,9 [intervalo de confianza {IC} del 95%: 0,765–0,971], p = 0,0001), y proteína C reactiva (AUC de 0,7 [IC del 95%: 0,542–0,833], p = 0,03). La diferencia no es estadísticamente significativa (p = 0,054). Curvas de características operador receptor de interleuquina-6 (áreas bajo la curva [AUC] de 0,9 [intervalo de confianza {IC} del 95%: 0,765–0,971], p = 0,0001), y proteína C reactiva (AUC de 0,7 [IC del 95%: 0,542–0,833], p = 0,03). La diferencia no es estadísticamente significativa (p = 0,054).](https://static.elsevier.es/multimedia/16954033/0000007100000006/v1_201304301839/S1695403309004664/v1_201304301839/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w95erwEulN6Tmh1xJpRhO+VE=)