Introducción
El virus del papiloma humano (VPH) constituye la infección de transmisión sexual más frecuente del mundo, de tal manera que virtualmente todo individuo sexualmente activo estará expuesto en algún momento de su vida a este virus 1. Hoy sabemos que la infección persistente por algunos tipos de VPH (de alto riesgo oncogénico) constituye un factor causal indispensable, aunque no suficiente, para el desarrollo del cáncer de cérvix, y se ha relacionado también con otras formas de cáncer anogenital, de vía aérea y digestivo 2-5. Además la infección por otros tipos de VPH denominados de bajo riesgo oncogénico, condiciona una importante morbilidad al producir verrugas y lesiones anogenitales de bajo grado 1,6,7.
Aunque estas patologías son mayoritariamente ginecológicas o se presentan de manera habitual fuera de la edad pediátrica en el caso del cáncer de cérvix, en la cuarta-quinta década de la vida, la adquisición del precursor necesario para su desarrollo, el VPH se puede producir ya con el inicio de las relaciones sexuales en la adolescencia 8-12. Por otro lado, la inminente disponibilidad de vacunas profilácticas eficaces frente a la infección por VPH, así como el hecho de que la eficacia de estas vacunas estaría condicionada en gran medida por su aplicación antes de que el sujeto entre en contacto con el VPH (es decir, antes del comienzo de su actividad sexual, en la época prepuberal) 13-15, sitúan al pediatra ante un nuevo reto: la prevención desde la infancia de toda la patología relacionada con el VPH, y paradigmáticamente, el cáncer de cérvix.
En este artículo revisamos los aspectos esenciales de la infección por VPH, su relación con el cáncer cérvix y otras formas de enfermedad, los avances recientes en sus vacunas preventivas y el papel del pediatra en este contexto.
Características y tipos de virus del papiloma humano
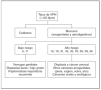
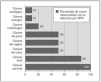
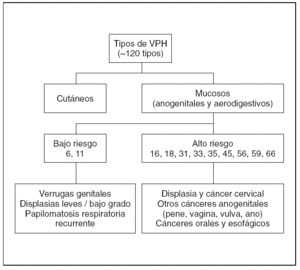
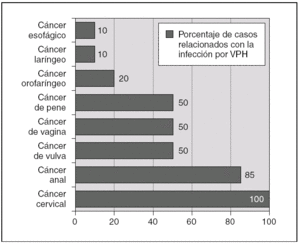
Los VPH son virus ADN de doble cadena sin envoltura y simetría icosaédrica con cápside de 72 capsómeros y de la familia Papovaviridae, que infectan preferencialmente las células epiteliales, donde crecen lentamente y se autorreproducen en el interior del núcleo 1,4,16. Habitualmente los VPH se dividen en cutáneos y mucosos 1. Los VPH cutáneos (tipos 1, 2 y 4) son los causantes de las verrugas comunes y plantares 1. Entre los más de 120 tipos de papilomavirus identificados molecularmente, alrededor de 40 pueden infectar la mucosa genital mediante transmisión sexual, y entre 13 y 18 son considerados altamente carcinogénicos, oncogénicos o de alto riesgo (fig. 1) 1,4,16. La mayoría de estos VPH de alto riesgo están además relacionados filogenéticamente con sólo 2 tipos: el VPH 16 (tipos 31, 33, 35, 52, 58) o el VPH 18 (tipos 39, 45, 59, 68) 1,4,16. Estudios epidemiológicos sobre la prevalencia de los diferentes tipos de VPH en el cáncer de cérvix muestran, sin embargo, que la mayoría de los cánceres cervicales (60 a 72 %) están relacionados con sólo dos tipos: el VPH 16 y el 18 14-17. Los VPH oncogénicos están también implicados en el desarrollo de otros tipos menos frecuentes de cáncer, como el de canal anal, vulva, pene u orofaringe (fig. 2) 1,3,4,18,19. Por otro lado, la infección con virus considerados de bajo riesgo oncogénico, fundamentalmente los tipos 6 y 11, puede causar verrugas anogenitales (condilomas acuminados) y neoplasias intraepiteliales de bajo grado de vagina, vulva, cérvix, pene y ano 1,6,7.
Figura 1. Clasificación de los principales tipos de virus del papiloma humano.
Figura 2. Infección por virus del papiloma humano (VPH) y cáncer. Porcentaje de casos relacionados con la infección por VPH. (Datos extraídos de las referencias 1, 3, 4, 18 y 19.)
Manifestaciones clínicas, transmisión y prevalencia de la infección por VPH mucosos
La manifestación clínica más común y conocida de los VPH mucosos son las verrugas genitales (condilomas acuminados), ocasionada en el 90 % de los casos por los VPH 6 y 11 1,7. Esta patología aunque no es maligna, condiciona una importante morbilidad, implicaciones psicosociales y un coste sanitario significativo 7,20,21.
La infección por VPH mucosos no constituye una patología pediátrica frecuente, y su mecanismo de transmisión puede ser sexual, horizontal o vertical 7,20,21. El período medio de incubación en infecciones por VPH es desconocido en niños 7. Se han descrito verrugas genitales infantiles como signo de abuso sexual, si bien la presencia exclusiva de verrugas genitales no es diagnóstica, y el valor predictivo positivo de este hallazgo aumentaría con la edad 7,20,21. La transmisión vertical de algunos tipos de VPH de la madre al niño, puede originar la colonización e infección del tracto respiratorio del niño dando lugar a la papilomatosis respiratoria recurrente, un cuadro grave y de difícil tratamiento 7,20,21. Los papilomas laríngeos constituyen los tumores de laringe más frecuentes en la infancia 7,20,21. Se ha postulado también la posibilidad de transmisión de VPH a través de fomites, pero es una posibilidad remota y no probada 7,20,21.
La infección por VPH en el adulto es fundamentalmente una enfermedad de transmisión sexual, con un período de incubación que dura de semanas a meses 1. Hay una serie de hechos importantes a considerar en su mecanismo de transmisión: a) es necesaria la existencia de un contacto sexual, sin que necesariamente exista penetración vaginal; b) el hombre actúa como portador, y c) la persona fuente de contagio padece por lo general una infección subclínica 1,8-12.
El condón no previene totalmente la infección por VPH, ya que el virus puede estar en el perineo, en el escroto o en la región perianal 22-24. No obstante, y aún cuando la protección no es total, los condones suponen una protección significativa, y disminuyen la incidencia de neoplasias intraepiteliales cervicales (CIN) 2/3, de verrugas genitales y de cáncer de cérvix invasivo 22-24. Este hecho tiene gran importancia en el diálogo del pediatra con los adolescentes, dado que una transmisión inadecuada de esta información puede dar lugar a un mensaje erróneo sobre la protección frente a ésta y otras enfermedades de transmisión sexual 22-24.
Las infecciones del cérvix ocasionadas por VPH son muy comunes, especialmente entre mujeres jóvenes 1,8-12. Desde el momento en que se inician las relaciones sexuales, transcurre una mediana de sólo 3 meses hasta la adquisición de la infección por VPH 12, y más de la mitad de las adolescentes, tendrán más de un tipo de VPH 11. Se refieren en la literatura especializada tasas de prevalencia que oscilan entre un 25 y un 65 % en mujeres adolescentes sexualmente activas y que pueden alcanzar hasta el 82 % en los primeros 2 años desde el inicio de la actividad sexual 1,8-12. En general las manifestaciones cervicales son subclínicas, y se diagnostican mediante colposcopia, frotis cervical o biopsia 1,8-12.
Factores de riesgo y protección de la infección por VPH
Los dos principales factores determinantes de la infección por el VPH son la edad y la actividad sexual 1,8-12,25-27. Las mujeres jóvenes son las que mayor riesgo tienen, que se incrementa con el número de compañeros sexuales (recientes y globales), y a su vez con la promiscuidad de su compañero 8-12,25-27. Aquellos individuos que inician su actividad sexual más precozmente, adquieren la infección por VPH con mayor frecuencia 25,26. No obstante, es importante el hecho de que no es exclusivamente una razón de comportamiento el que los adolescentes adquieran la infección por VPH: el VPH tiene especial avidez por las células cilíndricas, por lo que los cambios metaplásicos que acontecen de forma natural en el cérvix de las adolescentes, constituye un terreno muy fértil para la adquisición del VPH 1. Posteriormente la incidencia de la infección por VPH disminuirá con la edad, debido también a cambios en la respuesta inmunitaria, para tener un nuevo repunte en los años perimenopáusicos y posmenopáusicos 28.
Existen otros cofactores potencialmente favorecedores de la infección por VPH tales como la dieta, el tabaco, la paridad, otros agentes infecciosos (herpes simple o Chlamydia), las alteraciones en el estado inmunológico (virus de la inmunodeficiencia humana [VIH] u otras enfermedades y situaciones de inmunosupresión), y los anticonceptivos hormonales 1,29.
Se han descrito elementos protectores frente a la infección persistente por VPH relacionados con el consumo de frutas y vegetales, así como con los niveles circulantes, o en forma de aportes dietéticos o medicamentosos, de vitaminas C y E, carotenos, licopeno, luteína, zeaxantina y criptoxantina 30. Igualmente, se han identificado perfiles de bajo y alto riesgo en función del patrón de polimorfismos presentes en el sistema de antígenos leucocitarios humanos (sistema HLA) 31.
Respuesta inmunitaria frente a VPH
Los VPH cuentan con múltiples mecanismos para evitar la respuesta de nuestro sistema inmunitario 32-34. Los VPH infectan y se multiplican en los queratinocitos, células distantes de los centros inmunes y con una vida media muy corta, lo que hace innecesaria la destrucción de la célula por parte del virus, evitando así la activación de la respuesta inflamatoria e inmunitaria 32-34. Además, los VPH disminuyen los niveles de interferón, disminuyendo la expresión de los genes responsables de su producción 32-34. No obstante, nuestro sistema inmunitario será capaz de superar la mayoría de las infecciones por VPH mediante una potente respuesta inmunitaria celular localizada, que logra la regresión de la lesión y la generación de anticuerpos séricos neutralizantes dirigidos contra los epítopos de la proteína L1 expresados en la superficie externa de la partícula viral intacta 32-34. El nivel de anticuerpos que generan incluso durante el pico máximo es bajo, probablemente por la ausencia de viremia (por el ciclo intraepitelial del virus) y la producción de las partículas virales en la superficie de la células epiteliales (que están lejos de macrófagos y células presentadoras de antígenos); no obstante, la seropositividad protege frente a una nueva infección por ese mismo virus, incluso con unos títulos bajos 32-34.
Infección por VPH y cáncer de cérvix
El cáncer de cérvix constituye la forma de neoplasia relacionada con una infección más frecuente del mundo y es el cáncer más frecuente en el sexo femenino después del cáncer de mama: mata 250.000 mujeres al año en el mundo, alrededor de 750 al año en España 13-15. La instauración de programas de detección precoz y controles seriados, han permitido un control relativo de la enfermedad, que hace que menos del 20 % de los 500.000 nuevos casos de cáncer de cérvix que se producen cada año, acontezcan en los países más desarrollados y que poseen estos programas de detección 13-15.
Existe un cuerpo de evidencia convincente que demuestra que el VPH actúa como agente etiológico en el cáncer de cérvix: se ha encontrado ARN mensajero y proteínas de VPH de alto riesgo en la mayoría de las lesiones displásicas y cánceres cervicales, y ADN en el 99,7 % de los tejidos cancerígenos cervicales 2-5. De hecho, el VPH cumple todos los criterios marcados por la Agencia Internacional para la Investigación en Cáncer (IARC) para ser considerado un agente carcinogénico 2-5. Además puede originar cáncer del canal anal, vulva, pene y orofaringe 2-5. Por tanto, reafirmamos que para que se produzca un cáncer de cérvix, es necesaria aunque no suficiente una infección previa por VPH 2-5. No obstante, a pesar de la frecuencia de estas infecciones, en la mayoría de los casos la infección por VPH es eliminada eficazmente por el organismo, ocasionando alteraciones citológicas o histológicas cervicales menores y transitorias, habitualmente subclínicas 2-5. Por lo general, el virus se elimina en el plazo de 1 o 2 años, sin embargo la persistencia de cualquiera de los aproximadamente 13 a 18 genotipos de VPH carcinogénicos, causará en la mayoría de los casos una lesión precancerígena cervical cuyo diagnóstico no se establece hasta varios años después de la infección causante, o un cáncer invasivo que se diagnosticará al menos 20 años después de la infección 2-5. Sólo si esta infección persiste y progresa, puede originar lesiones precancerosas, que en determinados individuos evolucionarán hasta la situación de cáncer invasivo 2-5. El intervalo entre la adquisición de la infección por VPH y la progresión hacia malignidad durará al menos 10 años, por lo que el cáncer de cérvix es poco habitual en mujeres por debajo de los 25 años, y su incidencia aumenta progresivamente hasta un pico entre los 40 y los 50 años de edad 35.
Los programas de detección y control hacen prevenible el cáncer de cérvix, mediante el diagnóstico y el tratamiento de lesiones cervicales precursoras que podrían evolucionar hacia cáncer invasivo 13-15. El gran éxito de las estrategias de prevención de cáncer de cérvix en países industrializados se objetiva por ejemplo en Estados Unidos, donde la incidencia de cáncer de cérvix ha disminuido un 75 % en los últimos 40 años 13. Sin embargo, la instauración y el mantenimiento de programas de detección efectivos es difícil y a veces inviable, en los países en desarrollo 13-15. Por otro lado, estos programas no previenen la infección por VPH, ni el desarrollo de lesiones cervicales de alto grado de malignidad (CIN 2 y 3) ni lesiones de bajo grado de malignidad (CIN 1) persistentes que también requieren tratamiento, ni la aparición de otras formas de cáncer no cervical o de verrugas genitales relacionadas con el VPH 13-15. El desarrollo de vacunas cuya formulación incluya los tipos de VPH más comúnmente implicados en estas patologías podría reducir significativamente la mortalidad, la morbilidad y los costes relacionados con la infección por VPH.
Inmunización frente a VPH
En los últimos años se ha avanzado de manera importante en el desarrollo de vacunas frente a VPH y han sido publicados los resultados de diversos estudios fase II mostrando excelentes resultados de inmunogenicidad y seguridad en la prevención de la infección por VPH utilizando vacunas frente al VPH basadas en la utilización de partículas similares al virus (PSV) 13-15,36-39. Las PSV se obtienen mediante la síntesis y autoensamblamiento in vitro de las proteínas principales de la cápside del virus VPH (L1); son idénticas morfológicamente a los viriones de VPH, pero al no contener ADN viral no pueden transmitir el virus ni ocasionar la enfermedad, pero sí inducen la generación de anticuerpos neutralizantes y confieren protección contra la adquisición del VPH 40-43.
Los estudios iniciales con vacunas monovalentes mostraron la seroconversión de prácticamente todos los vacunados, con títulos de anticuerpos mucho más altos que los obtenidos mediante la infección natural, y capaces de neutralizar in vitro PSV 40-43. Además, entre un 5 y un 52 % de las mujeres vacunadas, dependiendo del tipo de VPH incluido en la vacuna, presentaban anticuerpos en las secreciones cervicovaginales 42, y los valores de células T activadas específicas frente a VPH eran muy superiores a los detectados en la infección natural 43, lo que sugiere que la vacuna podría inducir respuestas inmunitarias adaptativas superiores incluso a las de la infección natural.
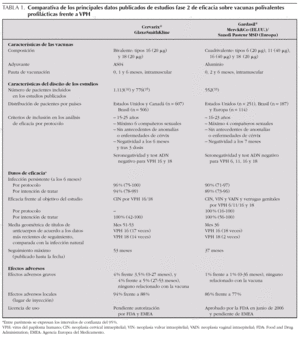
En el momento actual 2 vacunas polivalentes frente a VPH están siendo objeto de estudios fase III y estarán pronto disponibles en nuestro medio: la vacuna bivalente (Cervarix®, GlaxoSmithKline) y la vacuna tetravalente (Gardasil®, Sanofi Pasteur MSD) (tabla 1). Ambas vacunas son seguras, bien toleradas, y protegen con una eficacia del 100 % frente a la infección persistente por los VPH 16 y 18, un paso biológico intermedio clave en la carcinogénesis cervical 36-39. Su eficacia frente a la neoplasia cervical intraepitelial grado 2 o superior producida por los VPH 16 y 18, precursores del cáncer cervical, es también del 100 % en función de los datos ya difundidos y a la espera de la publicación los resultados definitivos de los estudios fase III en marcha; en el caso de la cuadrivalente, el grado de eficacia es igualmente elevado en la protección frente a las verrugas genitales por VPH 6 y 11 36-39,44-50. Sabemos además que la vacuna es eficaz al menos durante 4,5 años y 3 años, respectivamente, para la vacuna bivalente 39 y la cuadrivalente 37,45. Desde junio de 2006, la vacuna cuadrivalente ha sido licenciada por la Food and Drug Administration (FDA) 47 y recomendada desde ese mismo mes por el Advisory Committee on Immunization Practice (ACIP) del Center for Disease Control and Prevention (CDC) de Estados Unidos 48.
En función de la historia natural de la infección por VPH y la neoplasia cervical, parece lógico pensar que el momento idóneo para alterar la historia natural del proceso y por tanto para instaurar la vacunación frente VPH debería ser antes del contacto con el virus, y por tanto, antes del inicio de la actividad sexual, probablemente entre los 9 y los 12 años de edad. 13-15 Los modelos matemáticos reafirman la importancia de que la vacunación se realice a esta edad 13-15,51 y el ACIP del CDC americano recomienda que la primovacunación con la vacuna cuadrivalente se realice idóneamente a los 11-12 años de edad 48, pero respetando, a discreción del médico, el rango aprobado por la FDA desde los 9 a los 26 años 47.
Alrededor del 30 % de los cánceres cervicales mundiales están asociados con otros tipos de VPH oncogénicos distintos del 16 y el 18, tales como el VPH 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 66 1,4,14-17. A pesar de la similitud filogenética entre varios de estos tipos en la proteína L1, las infecciones genitales por VPH se caracterizan por respuestas tipo específicas, y sólo los VPH 6 y 11, 31 y 33, y 18 y 45 parecen compartir un epítopo neutralizante 33. En este sentido se ha referido en la literatura médica que en el caso de la vacuna bivalente podría existir protección cruzada con los tipos 31 y 45, con una eficacia del 55 % (intervalo de confianza del 95 % [IC 95 %]: 12-78) y el 94 % (IC 95 %: 63-100), respectivamente 39,49. Con la vacuna cuadrivalente, se han referido incrementos en los títulos de anticuerpos frente a los tipos 31, 45, 52 y 58, pero no se han publicado todavía datos de eficacia 45,50. En cualquier caso, los mecanismos de esta protección cruzada no están claros 33.
Si consideramos que los VPH 16 y 18 suponen aproximadamente la causa del 70 % de los cánceres del cérvix, y que los VPH 6 y 11 son responsables de prácticamente todos los casos de papilomatosis respiratoria recurrente y de casi el 90 % de las verrugas anogenitales, la implantación de estas vacunas tendrá un impacto muy significativo en estas patologías 13-15. Así, asumiendo una eficacia tipo-específica de al menos el 90 %, y al margen de las dosis de refuerzo que pudiesen ser eventualmente necesarias, los casos de displasia cervical de grado moderado o alto y carcinomas in situ entre las mujeres vacunadas serían entre un tercio y la mitad de los encontrados en las mujeres no vacunadas 13-15. El impacto de la vacunación en displasias de menor grado o subclínicas es difícilmente evaluable y probablemente más modesto 13-15.
Cuestiones por resolver sobre la vacunación frente a VPH
Las vacunas frente al VPH han demostrado su eficacia frente a la prevención de la infección persistente por los tipos de virus papiloma incluidos en dichas vacunas, y los informes preliminares de los estudios fase III de ambas vacunas también señalan una elevada eficacia también en la prevención de las lesiones precancerígenas cervicales, así como en la prevención de las verrugas genitales en el caso de la vacuna cuadrivalente. Quedan, sin embargo, importantes interrogantes por dilucidar, para muchos de los cuales ya están en marcha estudios potencialmente aclaradores:
1.La duración a largo plazo de la protección, y la necesidad de una o varias dosis de refuerzo tras la primovacunación, así como sus consecuencias en la relación coste-beneficio de la vacunación preventiva.
2.El efecto que la vacunación frente a una enfermedad de transmisión sexual en edades tan tempranas de la vida pueda tener sobre los conceptos y los hábitos sexuales de los más jóvenes.
3.La posibilidad de reemplazamiento de los tipos de VPH incluidos en las vacunas por otros tipos virales no incluidos.
4.La eficacia y el papel de la vacuna administrada en el sexo masculino, y la importancia y la rentabilidad de su eventual vacunación 52.
5.Cómo afectaría a corto y a medio plazo la introducción de la vacuna profiláctica frente a VPH a los programas de detección de cáncer ya implantados e institucionalizados.
6.Determinar la estrategia de vacunación en aquellos adultos jóvenes que previamente hayan tenido un posible o probable contacto con el virus, o incluso un contacto confirmado.
7.Establecer la titulación de anticuerpos protectores.
8.Confirmar la existencia de protección cruzada frente a otros serotipos no incluidos en la vacuna, y evaluar la importancia de la misma en el impacto vacunal.
9.Evaluar la eficacia de la vacuna en la prevención de otros cánceres y formas de enfermedad relacionadas con la infección por VPH distintos del cáncer de cérvix.
10.Conocer cómo afectará a los sujetos vacunados la exposición posterior al virus salvaje frente al que está vacunado, así como a otros tipos no incluidos.
11.Corroborar el perfil de elevada seguridad que hasta la fecha han mostrado estas vacunas, una vez aplicadas a gran escala.
12.Establecer la inmunogenicidad y seguridad de la vacuna en poblaciones inmunodeprimidas (sida, trasplantados) o con otras afecciones endémicas (hepatitis B, malaria).
13.Evaluar el papel de la vacunación en los países más desfavorecidos donde acontece el 80 % de los cánceres cervicales, y adecuar los costes de la vacuna para lograr una implantación eficaz en este entorno.
Retos para el pediatra
Las vacunas frente al VPH estarán pronto disponibles para su uso clínico. Los pediatras desempeñarán un papel clave en la difusión y aceptación de la vacuna, así como en su prescripción y consecución de elevadas coberturas vacunales en la población preadolescente y adolescente. El hecho de que esta vacuna prevenga una enfermedad que empieza en la edad adulta y que además está relacionada con la transmisión sexual, exigirá un diálogo específico con los niños o sus padres o tutores sobre el tema 53-61. El grado de conocimiento por parte del pediatra de la infección por VPH y de su elevada prevalencia entre adolescentes y adultos jóvenes, su relación con el cáncer cervical y otras formas de cáncer anogenital, de vía aérea y digestivo, así como con las verrugas genitales, y el papel de la vacunación en la prevención de estas patologías, influenciarán indudablemente la actitud del propio pediatra frente a esta vacuna y exige un necesario esfuerzo de actualización y formación continuada en la materia 53-61.
Son muchos los factores extrínsecos a la vacuna que condicionarán su éxito, y entre ellos destaca la importancia del momento de vacunación 13-15,53-61. Los pediatras tendrán una responsabilidad esencial en la implantación y difusión de esta vacuna, por su acceso a los pacientes en la edad prepuberal y en la adolescencia precoz con más probabilidad y eficacia que desde cualquier otra disciplina médica, aspecto esencial si consideramos la necesidad de 3 visitas en un período de 6 meses para la realización de la pauta correcta de vacunación 53. De hecho, la existencia de un programa de salud del niño sano correctamente incorporado y de elevado cumplimiento en nuestro país, pone a nuestra disposición el sustrato idóneo para la captación del paciente en la edad adecuada para su inmunización. De este modo, el control de salud a los 12 años que en su momento fue utilizado para realizar el catch-up con la vacunación frente a hepatitis B, eventualmente podría ser utilizado para la inmunización frente a VPH.
Estudios preliminares sobre la problemática de la implantación de la vacuna, señalan que la reticencia o rechazo de la vacunación por parte de los padres y los propios adolescentes será la principal barrera para su introducción 53-61. Aunque este aspecto todavía no se ha evaluado específicamente en nuestro país, la tradición y el respaldo que suponen la opinión y la recomendación del pediatra sobre la inmunización frente a una enfermedad, y más en nuestro entorno, puede tener una influencia muy importante en la decisión y el posicionamiento de los padres o adolescentes frente a la vacuna 53-61.
Conclusiones
La identificación de la relación del VPH con el cáncer de cérvix y otras formas de cáncer epitelial, los enormes costes económicos y sociales relacionados con la enfermedad, el conocimiento de los factores de riesgo epidemiológicos para la infección y la historia natural de la enfermedad y la próxima disponibilidad de vacunas preventivas eficaces proporcionan una oportunidad única en la historia para ejecutar una estrategia de prevención primaria del cáncer de cérvix, sus precursores y otras patologías relacionadas ocasionadas por los VPH como las verrugas genitales o la papilomatosis laríngea recurrente.
La vacuna frente al VPH abre una nueva línea de prevención durante la edad pediátrica de patologías de presentación habitual y característica en la edad adulta, pero que pueden iniciarse ya durante la infancia. Constituye una necesidad de primer orden realizar la formación específica de los profesionales de la pediatría en este terreno.
Aunque todavía existen diversas cuestiones por esclarecer respecto a la vacuna frente al VPH, su disponibilidad es inminente, y una vez más el pediatra desempeñará un papel determinante y esencial, no siempre reconocido, en su aceptación y difusión, en su correcta administración y grado de cobertura alcanzada, e incluso en la sensibilización de las autoridades sanitarias implicadas en las decisiones de salud global. Sin duda un nuevo reto que los pediatras abordaremos con profesionalidad y eficacia, buscando como siempre, lo mejor para la salud presente y futura de nuestros niños.
Correspondencia: Dr. E. Bernaola Iturbe.
Aralar, 4 bajo. 31002 Pamplona. España.
Correo electrónico: bernaola@teleline.es
Recibido en julio de 2006. Aceptado para su publicación en julio de 2006.