Introducción
El tratamiento de la leucemia linfoblástica aguda infantil (LLA) constituye uno de los mayores éxitos en la historia de la medicina 1. Los índices de supervivencia han mejorado en los últimos 15 años de manera progresiva, hasta alcanzar en el momento actual cotas superiores al 80 %. Uno de los factores más determinantes en alcanzar estos resultados ha sido la identificación de factores pronóstico y establecer protocolos terapéuticos según grupos de riesgo 2.
Sin embargo, la identificación de los pacientes que van a recaer según los grupos de riesgo, resulta un criterio insuficiente en el momento actual 3.
Aún todavía acontecen numerosas recaídas en pacientes sin factores pronósticos conocidos de riesgo y clasificados en grupos de bajo o intermedio riesgo de tratamiento.
Dado que la supervivencia de los pacientes que recaen oscila entre el 14 y el 40 %, resulta indispensable reconocer las futuras recaídas antes de que acontezcan y diseñar protocolos de tratamiento dirigidos a evitar que ésta ocurra 4,5.
Desde 1981, el grupo corporativo de estudio de la leucemia linfoblástica aguda Berlín-Frankfurt-Münster (LLA-BFM) ha propuesto diversos regímenes de tratamiento de acuerdo a factores pronósticos clínicos. A pesar del incremento en la supervivencia en las sucesivas versiones del protocolo BFM, las recaídas ocurren todavía en los grupos sin alto riesgo 6-16.
En esta publicación analizamos los factores pronósticos convencionales de recaída en nuestra serie y los comparamos con los grupos de riesgo BFM como predictores de recaída en pacientes con LLA, en los momentos previos a la introducción de la enfermedad mínima residual (EMR) como factor pronóstico.
Pacientes y método
Pacientes
Entre 1984 y 2004, un total de 232 niños con LLA fueron tratados según el protocolo BFM en nuestra unidad. Los pacientes fueron tratados consecutivamente según las sucesivas versiones del protocolo BFM (BFM83, BFM86, BFM90, BFM95) 6.
Factores pronóstico en los pacientes al diagnóstico
Las variables analizadas fueron: edad (< 2, 2-6, 7-12 y > 12 años), sexo, número de leucocitos al diagnóstico (> 80.000/μl "hiperleucocitosis" o < 80.000/μl), inmunofenotipo de los blastos (B o T), grupo de riesgo BFM (estándar, intermedio, alto), número de plaquetas al diagnóstico (> 100.000 o < 100.000/μl), niveles de hemoglobina al diagnóstico (> 8 o < 8 g/dl), infiltración del sistema nervioso central (SNC) al diagnóstico, número de células blásticas en sangre periférica el día 8 de tratamiento (> 1.000 o < 1.000/μl), presencia de blastos en médula ósea el día 33 de tratamiento (> 5 o < 5 %), alteraciones citogenéticas patológicas t(9,22) o t(4;11), y transcritos patológicos BCR/ABL o MLL/AF4.
El motivo de la elección de 80.000 leucocitos/μl fue un criterio estadístico; se trata del percentil medio entre los valores clásicos de hiperleucocitosis 50.000 leucocitos/μl percentil 80 en nuestra serie y 100.000 leucocitos/μl percentil 87 en nuestra serie.
Factores pronóstico en los pacientes que recaen
Las variables analizadas fueron, además de las características de los pacientes al diagnóstico, las características de la recaída: tiempo desde la finalización del tratamiento a la recaída (precoz antes del año o tardío después de un año), lugar de la recaída (médula ósea, testículo o SNC), trasplante de progenitores hematopoyéticos.
Análisis estadístico
La supervivencia libre de eventos (SLE), recaída, es la principal variable del estudio y se calculó con el método de Kaplan-Meier, con el intervalo de confianza del 95 % (IC 95 %). Los factores pronósticos descritos anteriormente fueron analizados en su asociación con la SLE. Se realizó un estudio univariante de las diferentes variables mediante el método proporcional de Cox, cociente de riesgos instantáneos. Las variables con significación estadística (p < 0,05) se incluyeron posteriormente en un análisis multivariante.
La sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) de las variables del modelo multivariante y de los grupos de riesgo BFM para identificar la recaída fueron calculados.
La supervivencia global (SG), muerte, es la principal variable de estudio en los pacientes en recaída, y fue calculada con el método de Kaplan-Meier, con el IC 95 %. La comparación entre los grupos fue dada mediante el log-rank test. El análisis fue exclusivamente univariante en los pacientes en recaída, por el pequeño número de pacientes. El test chi cuadrado (χ 2) de Pearson fue realizado para buscar la relación estadística entre las variables.
Los cálculos estadísticos fueron realizados utilizando el paquete estadístico SPSS 12.0 para Windows (Statistical Statistical Package for the Social Sciences).
Resultados
Características de los pacientes
Entre enero de 1984 y diciembre de 2004, un total de 232 niños fueron diagnosticados de LLA y tratados según el protocolo BFM. Las características de los pacientes se muestran en la tabla 1.
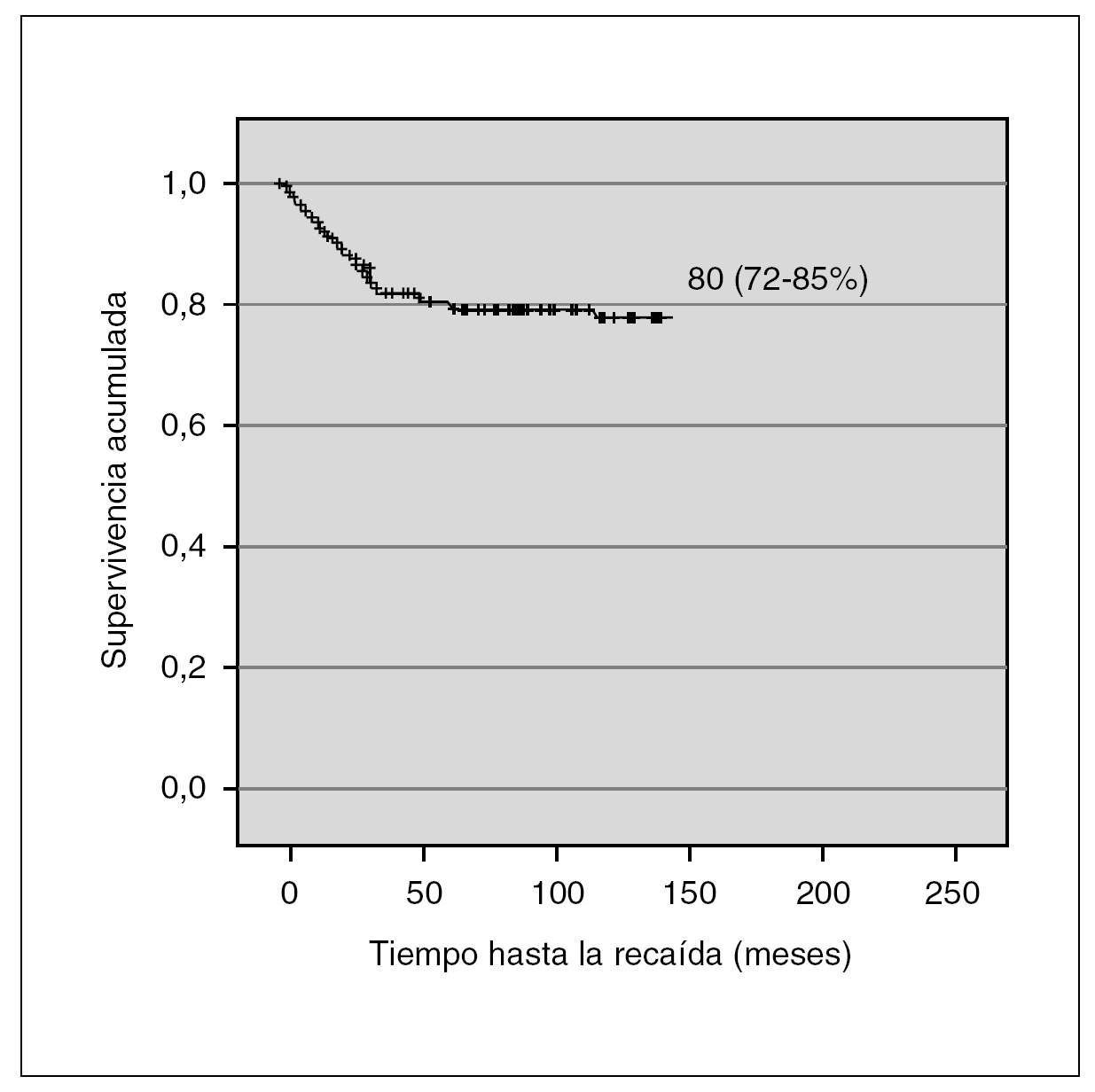
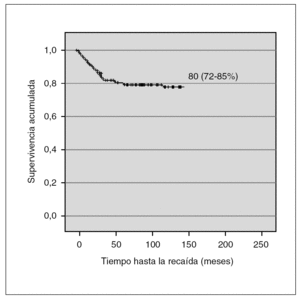
Las características de los pacientes fue homogénea en las sucesivas versiones del protocolo BFM. La SLE de los pacientes de nuestra serie fue de 79,2 % (IC 95 %: 73-85) (fig. 1).
Figura 1. Supervivencia libre de eventos.
Evolución de los pacientes diagnosticados de LLA según sus factores pronóstico
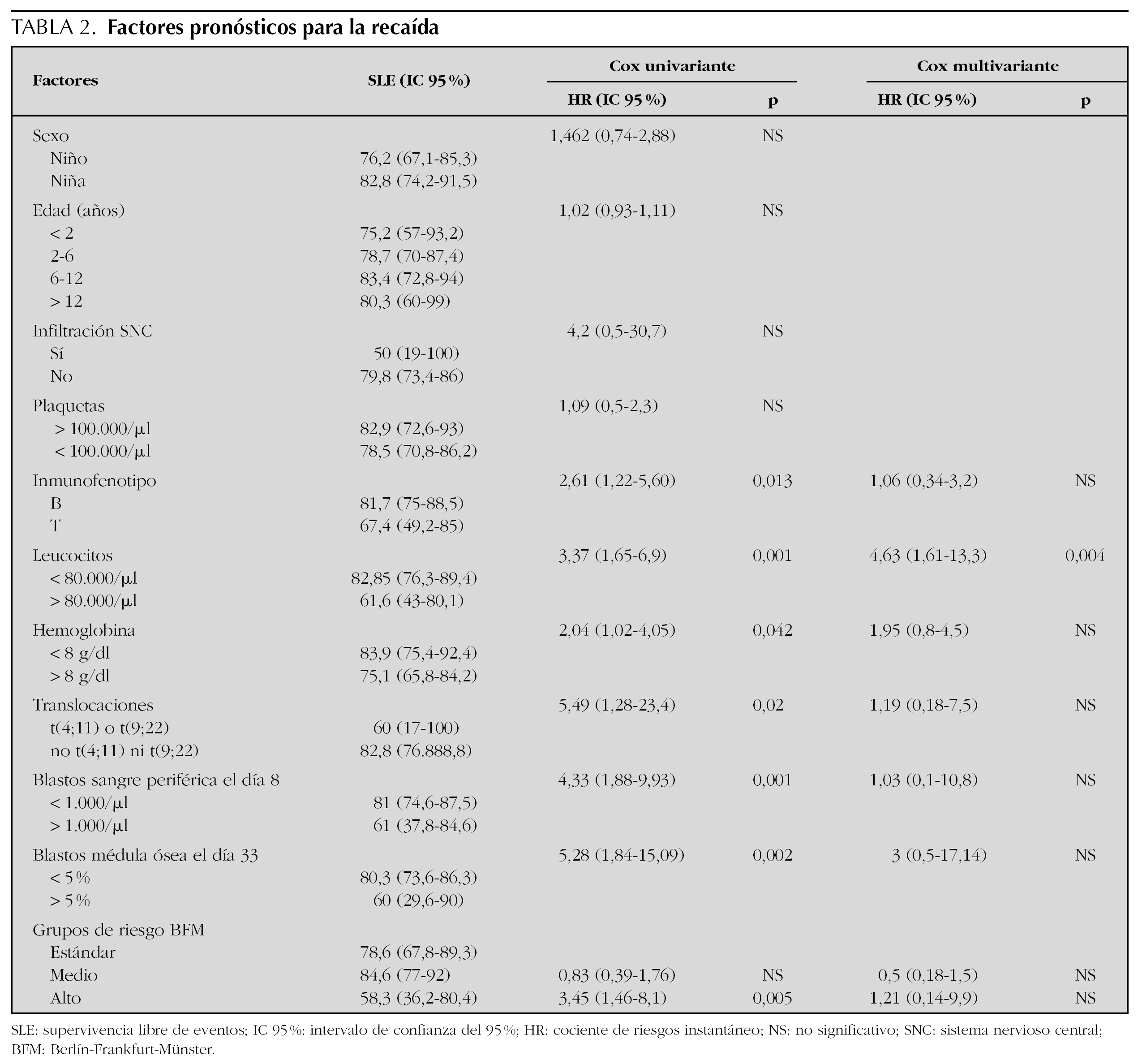
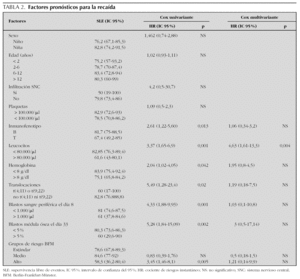
Las variables pronóstico analizadas se muestran en la tabla 2.
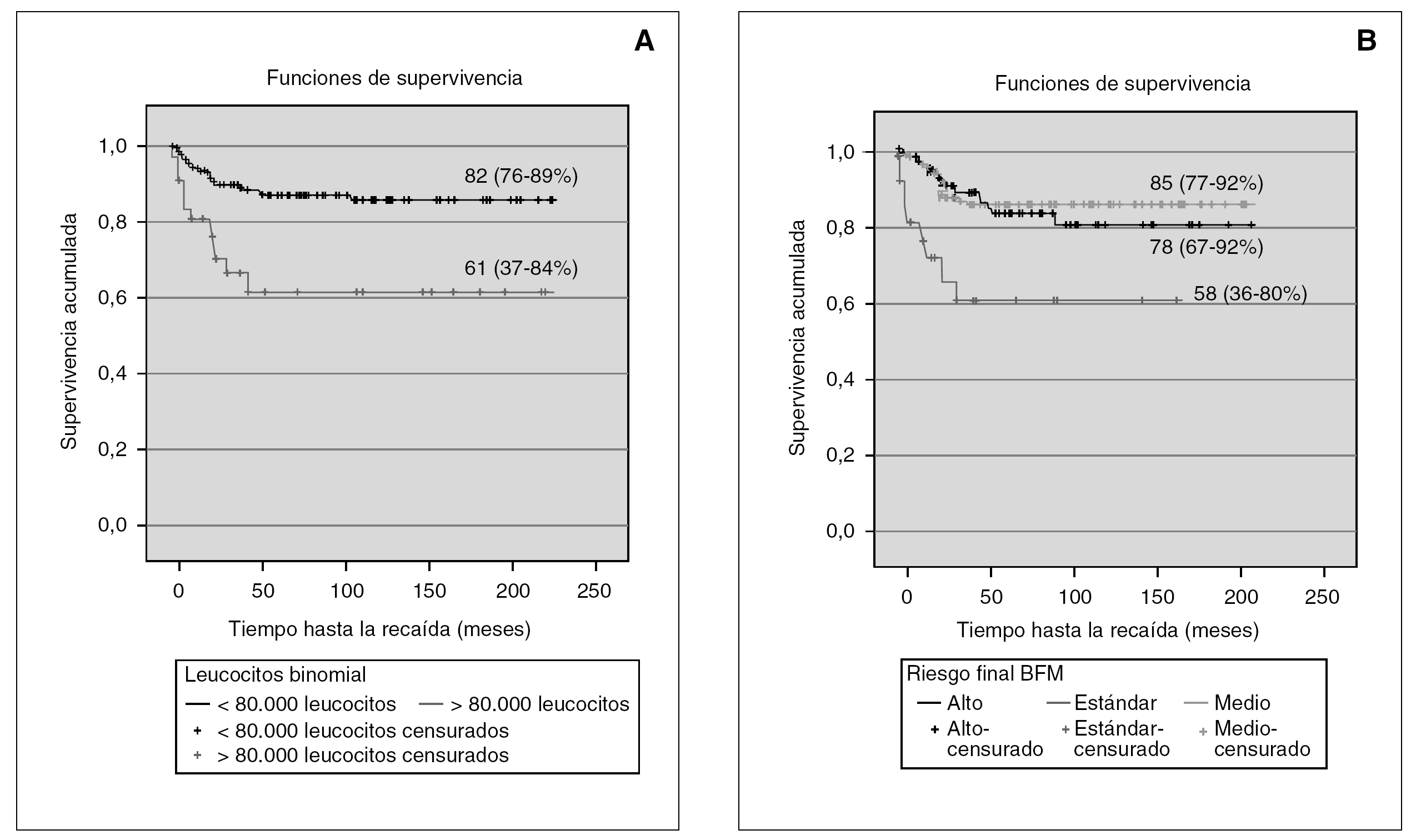
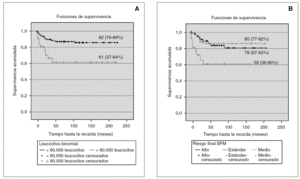
El análisis univariante muestra que el número de leucocitos al diagnóstico, inmunofenotipo, hemoglobina al diagnóstico, blastos en sangre periférica el día 8, blastos en médula ósea el día 33, translocaciones patológicas y grupos de riesgo BFM, tienen significación pronóstica (fig. 2).
Figura 2. Supervivencia libre de eventos en las variables número de leucocitos (A)y grupo de riesgo BFM (B).
El análisis multivariante muestra que el número de leucocitos al diagnóstico (> 80.000 o < 80.000/μl) tiene significación pronóstica y cómo la hiperleucocitosis incrementa la probabilidad de recaída 4,63 (IC 95 %: 1,61-13,3) (tabla 2).
Identificación de recaídas según el modelo multivariante y grupos de riesgo BFM
La sensibilidad y VPP para el número de leucocitos al diagnóstico y grupos de riesgo BFM fue de 33 y 30,7 frente a 25 y 28,1, respectivamente.
La especificidad y VPN para el número de leucocitos al diagnóstico y grupos de riesgo BFM fue de 86,2 y 87,5 frente a 89,17 y 86,5, respectivamente (tabla 3).
Un total de 24 pacientes (12,5 %) con una cifra de leucocitos inferior a 80.000/μl y hasta 27 pacientes (13,5 %) clasificados como riesgo estándar o intermedio, recayeron.
Características de los pacientes que recaen
La tabla 4 muestra las características de los pacientes con LLA que recaen.
La SG en este grupo fue de 10,72 % (IC 95 %: 6-27,3).
Factores pronóstico de los pacientes que recaen
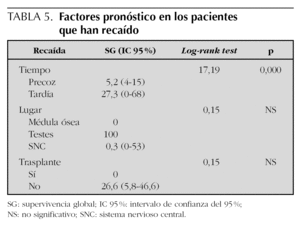
Las variables analizadas mediante estudio univariante se muestran en la tabla 5.
La recaída precoz fue la variable con una mayor significación estadística pronóstica en la supervivencia (log-rank test = 17,19; p = 0,000).
El número de leucocitos al diagnóstico y los grupos de riesgo BFM se asocian significativamente con la recaída en todos los pacientes (x 2 = 7,85, p = 0,0053; χ 2 = 6,6, p = 0,03, respectivamente).
Las variables número de leucocitos al diagnóstico, cifra de hemoglobina y número de blastos en sangre periférica el día 8 de tratamiento presentan asociación estadísticamente significativa con la recaída precoz (tabla 6).
Discusión
La intención de este artículo es doble. Por un lado analizar nuestra experiencia en el tratamiento de la LLA en los últimos 20 años y por otro lado establecer un modelo que trate de identificar la recaída basándose en los factores de riesgo convencionales y/o grupos de riesgo propuestos por el grupo corporativo alemán BFM. De esta manera podremos conocer y comparar el impacto futuro de la enfermedad mínima residual como factor pronóstico en la evolución de la LLA 17-19.
En nuestra serie la SLE fue de 79,4 % (IC 95 %: 72,7-85,4), comparable con las publicadas por el grupo BFM 7,8. El análisis univariante de los factores pronóstico en nuestros pacientes incluye todas las variables de los grupos de riesgo BFM. No encontramos diferencias en las variables edad, sexo, infiltración del SNC y número de plaquetas. En cambio, encontramos diferencias estadísticamente significativas mediante análisis univariante en el inmunofenotipo, número de leucocitos y hemoglobina al diagnóstico, blastos en sangre periférica el día 8, blastos en médula ósea el día 33 y translocaciones patológicas. Sin embargo, sólo el número de leucocitos superior a 80.000/μl, hiperleucocitosis, se comporta como la variable independiente predictora más poderosa en el análisis multivariante. Estos resultados coinciden con lo publicado por Schrappe et al 6,8, quienes proponen la edad inferior a un año, t(9;22) y la hiperleucocitosis como las variables predictoras más importantes para predecir la recaída. En nuestra serie los niños menores de un año y la translocación t(9;22) corresponden a un grupo de pacientes muy pequeño por lo que podría explicar la ausencia de significación estadística.
Respecto a la variable hiperleucocitosis, en nuestra serie incrementa la probabilidad de recaída en un 4,63 (1,61-13,3). En nuestra experiencia, recayeron 6 de 25 pacientes con hiperleucocitosis clasificados según el grupo BFM como riesgo estándar/intermedio. Por lo tanto la hiperleucocitosis debería ser una variable predictora que clasificara a los pacientes como de alto riesgo, independientemente de otros factores.
Sin embargo, la hiperleucocitosis y los grupos de riesgo BFM no poseen la suficiente sensibilidad ni valor predictivo positivo para identificar los pacientes que van a recaer. En el momento actual la óptima clasificación en grupos de riesgo para el tratamiento de la LLA resulta desconocida 20-23. Luego, nuevas estrategias de clasificación deben desarrollarse para soslayar este problema. En este sentido el desarrollo de la detección de la EMR mediante citometría de flujo o reacción en reacción en cadena de la polimerasa a tiempo real, resulta una prometedora estrategia 17-19.
El pronóstico de los pacientes en recaída de LLA ha mejorado en los últimos años según la experiencia del grupo BFM hasta alcanzar 47 ± 3. En nuestra serie la supervivencia global es baja (10,72 %; IC 95 %: 6-27,3). Los factores mayormente relacionados con la mala evolución en los pacientes en recaída los constituyen la recaída precoz, la presencia de más de 1.000 blastos/μl en sangre periférica el día 8 y la presencia de más del 5 % de blastos en médula ósea el día 33 de tratamiento, en el análisis univariante. Además es interesante la relación estadística encontrada entre los pacientes con recaída precoz con hiperleucocitosis, concentraciones de hemoglobina mayores de 8 g/dl y la presencia de más de 1.000 blastos/μl en sangre periférica el día 8 de tratamiento. Aunque estas consideraciones están realizadas en un pequeño número de muestra, estos hallazgos sugieren la probable relación entre recaída precoz y alta carga blástica al diagnóstico 23.
A pesar de que no era objetivo primario del estudio, comprobamos cómo el trasplante de progenitores hematopoyéticos no mejora la supervivencia de los pacientes en recaída. Sin embargo, numerosos autores defienden el trasplante de progenitores hematopoyéticos HLA (locus del antígeno de histocompatibilidad) idéntico como la opción terapéutica ideal en niños con LLA de alto riesgo y recaída 4,24,25. Probablemente el escaso número de pacientes y la heterogeneidad de los procedimientos influyan en esta discrepancia.
A modo de conclusión referimos que actualmente no hay ningún factor pronóstico convencional con la suficiente sensibilidad y VPP para predecir las recaídas. Es necesario investigar nuevos factores de riesgo, validarlos y establecer tratamientos adaptados al riesgo en nuestra búsqueda de la curación total de la LLA infantil.
Correspondencia: Dr. A. Pérez Martínez.
Laboratorio de Oncología y Trasplante Hematopoyético. Hospital Niño Jesús.
Avda. Menéndez Pelayo, 65. 28009 Madrid. España.
Correo electrónico: aperezm.hnjs@salud.madrid.org
Recibido en diciembre de 2005.
Aceptado para su publicación en mayo de 2006.