La ventilación mecánica invasiva (VMI) en pacientes con fibrosis quística (FQ) y enfermedad pulmonar avanzada es una contraindicación relativa para el trasplante pulmonar (TP) en adultos, sin que se disponga de suficientes datos pediátricos.
Pacientes y métodosEstudio retrospectivo de 8 años en pacientes con FQ a los que se les realizó TP (n = 21), analizando sus resultados según recibiesen (n = 8) o no (n = 13) VMI preTP. Se compararon datos demográficos, quirúrgicos, postoperatorios, de función pulmonar y de supervivencia (inmediata y al año) entre ambos grupos. Se estimó el papel de la VMI preTP como factor de riesgo postoperatorio (odds ratio) y se realizó el análisis de Kaplan-Meier de supervivencia en ambos grupos.
ResultadosNo hubo diferencias significativas en edad, sexo y parámetros nutricionales entre ambos grupos. El tiempo medio de VMI preTP fue de 7,12 días (de 4 a 12 días). El número medio de rechazos, el tiempo de VMI posTP y la estancia en unidad de cuidados intensivos pediátricos fueron significativamente superiores en pacientes con VMI preTP. Ésta fue un factor de riesgo para la necesidad de circulación extracorpórea, traqueotomía, rechazo del injerto y fallo orgánico postoperatorio asociado. No hubo diferencias significativas en la función del injerto y la supervivencia inmediata y al año tras el TP, pero el análisis de supervivencia a más largo plazo sí difirió significativamente entre ambos grupos.
ConclusionesA partir de la experiencia de los autores de este artículo, los pacientes con FQ que requieren VMI preTP presentan una cirugía y un postoperatorio más complejos. La VMI no influiría en la supervivencia inmediata y al año, pero sí en la supervivencia a más largo plazo.
Invasive mechanical ventilation (IMV) in patients with advanced cystic fibrosis (CF) is a relative contraindication for lung transplant (LT) in adults, although there is currently no data on children.
Patients and methodsAn 8-year retrospective study on 21 children with CF who underwent LT was performed, analysing their results as they were receiving (n=8) or not (n=13) IMV pretransplant. Demographic and surgical data, postoperative course, lung function and survival (immediate and 1-year) were compared between both groups. The role of the IMV pretransplant as a postoperative risk factor was estimated (odds ratio) and Kaplan Meier survival study was performed in both groups.
ResultsNo differences in patient age, sex and nutritional parameters were observed between both groups. Those on IMV who received LT required more frequent and longer bypass, more need for tracheotomy, a higher number of rejection episodes per patient and multiorgan failure, longer PICU stay and longer time on IMV than those who were not on IMV when LT was received. Nevertheless, no differences could be found regarding graft function and immediate and 1-year survivals (62.5% vs. 92.3% with and without IMV respectively). On the other hand, long-term survival was significantly lower than in patients on IMV.
ConclusionsIn our experience, children with CF on IMV who receive LT have more complicated surgery and immediate postoperative course. Though immediate and 1-year results and survivals may be encouraging, medium and long-term ones are significantly lower.
En la fibrosis quística (FQ) las anomalías en el transporte iónico de la membrana celular ocasionan un aumento de la viscosidad de las secreciones mucosas. Las infecciones respiratorias repetidas y las obstrucciones en la vía aérea consiguientes dan lugar a un daño pulmonar progresivo que se inicia en los primeros meses de la vida1,2. Más del 90% de los pacientes fallece por causa respiratoria cuando se alcanza el estadio final de la enfermedad pulmonar1.
La detección precoz de la enfermedad y el tratamiento antibiótico, de aclaramiento de secreciones y nutricional, han conseguido que la supervivencia media haya pasado de 16 años en 1970 a 32 años en 19983. Para los niños nacidos en la década de 1990 la supervivencia media esperada supera los 40 años3. Sin embargo, en algunos pacientes se desarrolla una afectación respiratoria grave en épocas precoces de la vida. En estos casos, la ventilación mecánica invasiva (VMI) se ha considerado clásicamente una técnica con malos resultados4,5 y una contraindicación, al menos relativa, para el trasplante pulmonar (TP)6,7, único tratamiento capaz de prolongar y mejorar la vida de estos pacientes.
Para valorar la influencia de la ventilación mecánica pretrasplante en niños con FQ en España, se ha realizado un estudio retrospectivo durante 8 años, en el que se compara la evolución y los resultados del TP en pacientes con FQ en función de que los pacientes recibieran o no VMI previa.
Pacientes y métodosSe revisaron los historiales médicos de todos los pacientes pediátricos con FQ (edades comprendidas entre un mes y 16 años) que recibieron TP (de los pacientes retrasplantados sólo se incluyó el primer TP) durante el período comprendido entre enero de 1999 y diciembre de 2006. En ellos se recogieron datos demográficos, quirúrgicos (subtipo de trasplante [bipulmonar secuencial, unipulmonar y lobulares]; tiempo y necesidad de circulación extracorpórea [CEC], y tiempos de isquemia para los injertos), necesidad de traqueotomía, tiempo de ventilación mecánica, tiempo de ingreso en la unidad de cuidados intensivos pediátricos (UCIP), complicaciones en el postoperatorio (número de rechazos por paciente, disfunción primaria del injerto y fallos orgánicos asociados), resultados (supervivencia inmediata, al año del TP y durante su seguimiento y espirometría a los 6 meses) y complicaciones tardías (bronquiolitis obliterante y necesidad de retrasplante).
Los pacientes se agruparon según precisaran o no VMI antes del TP. Además, se registraron los pacientes con FQ y VMI que no llegaron a trasplantarse.
El tratamiento escalonado de la insuficiencia respiratoria descompensada preTP en todos los pacientes incluyó lo siguiente3: fisioterapia respiratoria y rehabilitación musculoesquelética; intensificación del tratamiento antibiótico, inicialmente de forma empírica y continuado según aislamientos microbiológicos; nutrición enteral precoz, con fórmulas monoméricas o poliméricas con suplemento de enzimas pancreáticas; corticoides en pacientes con hipercapnia grave o si presentaban aspergilosis broncopulmonar alérgica (ABPA) (metilprednisolona [1 a 2mg/kg/día durante 4 a 7 días, con descenso rápido hasta 5 a 10mg/día]) y lavados bronquiales endoscópicos a través del tubo endotraqueal en pacientes intubados con hipercapnia refractaria.
Se administró oxigenoterapia mediante cánula nasal, mascarilla o mascarilla y reservorio para mantener una saturación igual o superior al 90% o disminuir el trabajo respiratorio; cuando no fue suficiente, había una hipercapnia progresiva o síntomas de agotamiento respiratorio, se empleó como primera opción ventilación mecánica no invasiva en 2 niveles de presión por medio de mascarilla facial.
En pacientes con insuficiencia respiratoria grave descompensada, en los que la ventilación no invasiva fracasó (sin mejoría o empeoramiento de la oxigenación, de la ventilación o del trabajo respiratorio), se utilizó VMI mediante respiradores Evita (Dräger)® en modalidad SIMV (synchronized intermittent mandatory ventilation ‘ventilación mandataria intermitente sincronizada’) con Autoflow® para minimizar el pico inspiratorio de presión, con tiempos espiratorios prolongados y los mínimos niveles de PEEP (positive end-expirative pressure ‘presión positiva telespiratoria’) necesarios para minimizar el cierre de la vía aérea y disminuir el atrapamiento aéreo, ajustados en función de la autoPEEP, del cálculo de la fracción de espacio muerto y del análisis de las curvas de presión y de volumen.
La ventilación de alta frecuencia, con respiradores tipo Sensor Medics® (A o B), se empleó ocasionalmente para reducir el daño pulmonar yatrógeno y la hipercapnia grave (superior a 100mmHg o inferior pero con pH arterial inferior a 7,20), refractaria a los cambios en ventilación convencional, incluida la relajación muscular y la ventilación volumétrica controlada. En pacientes con insuficiencia cardíaca derecha (cor pulmonale) se utilizó óxido nítrico inhalado y, en caso de sepsis asociada, se utilizó soporte inotrópico con dopamina, noradrenalina o adrenalina.
Los criterios de inclusión en lista de espera de TP fueron6,7,8: enfermedad pulmonar en fase final con esperanza de vida inferior a 2 años o rápido deterioro con incremento de la frecuencia de hospitalización, volumen espiratorio máximo en el primer segundo (FEV1) inferior al 30%, función cardíaca normal o recuperable y ambiente familiar y estado psicológico normales. Durante el período de estudio se contó con la posibilidad de inclusión en código de máxima urgencia, condicionado al empleo de VMI. Se consideraron contraindicaciones para el TP la presencia de sepsis extrapulmonar, el fallo multiorgánico o la grave inestabilidad hemodinámica. Se utilizó CEC durante el procedimiento cuando el pinzamiento arterial pulmonar no se toleró.
Durante el postoperatorio inmediato los pacientes se alojaron en habitaciones con presión positiva, con medidas de aislamiento respiratorio y de contacto. Durante la VMI los objetivos fueron alcanzar una fracción inspiratoria de oxígeno inferior al 60%, mantener una PEEP de 4 a 8cm de agua para prevenir el edema pulmonar9,10 e intentar la extubación precoz, con la mínima sedación posible, la analgesia epidural, el uso de modalidades sincronizadas de ventilación con presión de soporte y el uso de ventilación no invasiva tras la extubación en los pacientes que lo requirieron. En todos los casos la extubación se precedió de fibrobroncoscopia para comprobar las suturas y obtener cultivos. En caso de fracasos repetidos de la extubación, se realizó traqueotomía para facilitar el destete del respirador.
Los pacientes se monitorizaron con catéter de Swan-Ganz y se intentó mantener una presión venosa central de uno a 2mmHg y una presión capilar pulmonar de 6mmHg. Además, se emplearon coloides como expansores de elección y dopamina, dobutamina y adrenalina como apoyo inotrópico; en caso de hipertensión pulmonar, se utilizaron milrinona y óxido nítrico. Se intentó conseguir un aporte calórico superior al basal para su edad y su peso con nutrición parenteral o enteral.
El tratamiento antibiótico se ajustó a los aislamientos preTP en donante y receptor y se modificó según cultivos posteriores. Además, se introdujo progresivamente profilaxis con ganciclovir, cotrimoxazol y anfotericina B desoxicolato en aerosol (5mg/12h).
La inmunosupresión se realizó con corticoides, azatioprina (o micofenolato) y ciclosporina (o tacrolimus). Ante la sospecha de rechazo, se indicó fibrobroncoscopia con toma de biopsias transbronquiales. Cuando no fue posible, se confirmó el diagnóstico ex juvantibus y se valoró la respuesta a bolos de metilprednisolona (de 10 a 15mg/kg/día o 500mg/día por vía intravenosa, durante 3 días).
Análisis estadístico: los datos se analizaron mediante test no paramétricos (el test de la U de Mann-Whitney para comparar variables cuantitativas entre los distintos grupos y el test exacto de Fisher para las variables cualitativas y las proporciones). Se estimó la odds ratio para la VMI pretrasplante como factor de riesgo y finalmente se realizó un análisis de supervivencia de Kaplan-Meier. Los resultados se expresan como mediana y rango y en algún caso como media y error estándar de la media. El grado de significación aceptado fue p<0,05.
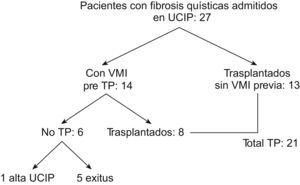
ResultadosDurante el período de estudio, 21 pacientes pediátricos con FQ recibieron TP. De ellos, 8 estaban previamente ingresados en la UCIP con VMI debido a descompensación de su insuficiencia respiratoria: 7 pacientes con VMI convencional y una paciente con ventilación de alta frecuencia. El tiempo medio de espera desde que se inició la VMI hasta el TP fue de 7,12 días (rango: 4 a 12 días). Además, otros 6 pacientes con FQ y VMI no llegaron a recibir un TP, 5 de ellos fallecieron tras una media de 10,7 días de ventilación mecánica (figura 1) (estos pacientes no se incluyen en el estudio).
Figura 1. Distribución de los pacientes con fibrosis quística ingresados en la unidad de cuidados intensivos pediátricos durante el período de estudio. Se excluyó del estudio a los 6 pacientes que finalmente no se trasplantaron. TP: trasplante pulmonar. UCIP: unidad de cuidados intensivos pediátricos. VMI: ventilación mecánica invasiva.
La descompensación respiratoria se debió en la mayoría de los casos a una infección pulmonar (78,5%); en 2 casos se trató de un neumotórax y en otro se trató de una hemoptisis masiva, si bien estos pacientes presentaban clínica infecciosa asociada. Los aislamientos bacteriológicos se realizaron en hemocultivos, esputos, aspirados bronquiales y lavados broncoalveolares. La mayoría presentaron cultivos mixtos. En el 50% de los casos se aislaron los mismos microorganismos detectados en los cultivos previos a la descompensación, aunque con aumento de la resistencia previa a los antibióticos, mientras que en el otro 50% aparecieron nuevos gérmenes. Los más frecuentemente aislados fueron bacilos gramnegativos (Pseudomonas, Stenotrophomona maltophilia y Alcaligenes xylosoxidans), cocos grampositivos (sobre todo Staphylococcus aureus resistente a meticilina) y hongos (Aspergillus y Candida). Tres pacientes presentaban ABPA.
Trece pacientes recibieron TP electivo sin VMI previa e ingresaron en la UCIP directamente desde el quirófano. No hubo diferencias significativas en cuanto a sus características de edad, sexo y parámetros nutricionales previos al TP al compararlas con las de los que estaban en VMI previa (tabla 1).
Tabla 1. Características de los pacientes con fibrosis quística que recibieron trasplante pulmonar, en función de la existencia de ventilación mecánica invasiva previa *
| Características | VMI previa | Sin VMI | p |
| N.o de pacientes | 8 | 13 | |
| Edad (años) | 11,70 (4,8–15,7) | 12,06 (5,9–15,8) | NS |
| Sexo (varones/mujeres) | 5/3 | 4/9 | NS |
| Wpa (%) | 76,4 (50,4–103,2) | 76 (61,3–102,4) | NS |
| Wtb (%) | 92 (78,7–97,7) | 91,1 (86,3–96,2) | NS |
NS: no significativo; P: percentil; VMI: ventilación mecánica invasiva.
* Los resultados se expresan como mediana y rango.
a WP: índice de Waterlow para el peso o porcentaje de peso para la talla P 50 (peso real/peso para la talla en P 50×100). Normal superior al 90%. Desnutrición: leve (del 90 al 80%), moderada (del 80 al 70%) y grave (<70%).
b WT: índice de Waterlow para el peso o porcentaje de talla para la edad (talla real/talla P 50 para la edad×100). Normal superior al 95%. Desnutrición: leve (del 95 al 90%), moderada (del 90 al 85%) y grave (<85%).
Todos los pacientes sin VMI previa recibieron trasplante bipulmonar secuencial. En cambio, en el grupo con VMI, 2 pacientes recibieron TP bilobulares de donantes adultos y un paciente con atelectasia crónica izquierda recibió trasplante unipulmonar derecho. Hubo una incidencia significativamente superior del uso de CEC en el grupo con VMI y de la duración de ésta. Por el contrario, no hubo diferencias significativas en cuanto a los tiempos de isquemia de los injertos entre ambos grupos (tabla 2). Tres pacientes con VMI preTP fallecieron en quirófano y sólo uno en el otro grupo.
Tabla 2. Datos quirúrgicos del trasplante pulmonar de los pacientes en función de la necesidad de ventilación mecánica invasiva pretrasplante *
| Con VMI pretrasplante | Sin VMI pretrasplante | p | |
| Necesidad de by–pass, n (%) | 6 (75) | 3 (23,07) | 0,017 |
| Tiempo medio by–pass (h) | 4,7 (2,9–9,16) | 4 (2–6,1) | 0,005 |
| Tiempo de isquemia del primer pulmón (min) | 330 (270–435) | 330 (240–450) | NS |
| Tiempo de isquemia del segundo pulmón (min) | 480 (360–585) | 438 (255–570) | NS |
NS: no significativo; VMI: ventilación mecánica invasiva.
* Los datos se expresan como mediana y rango.
Los tiempos medios hasta la extubación y el alta de la UCIP fueron significativamente superiores en el grupo con VMI previa (19 frente a 3 y 38 frente a 18 días, respectivamente). Los pacientes de este grupo requirieron con más frecuencia traqueotomía para el destete del respirador y presentaron mayor número de episodios de rechazo por paciente y de fallos orgánicos asociados en el postoperatorio inmediato, todo esto con diferencias significativas (tabla 3).
Tabla 3. Datos del postoperatorio inmediato del trasplante pulmonar y de la evolución a medio plazo *
| Características | Con VMI pretrasplante | Sin VMI pretrasplante | p |
| Necesidad de traqueotomía a | 4 (80) | 3 (23) | 0,047 |
| Rechazos en UCIP (episodios/paciente) | 1,4 ± 0,4 | 0,6 ± 014 | 0,049 |
| Pacientes con fallo asociado a órganos b | 6 | 2 | 0,041 |
| Tiempo de extubación a (días) | 19 (8–45) | 3 (1–95) | 0,011 |
| Tiempo en la UCIP a (días) | 38 (17–66) | 18 (3–110) | 0,027 |
| Supervivencia en la UCIP, % | 62,5 | 92,3 | NS |
| FEV1c a los 6 meses tras el TP, % | 72,6 (50–84) | 77 (44–102) | NS |
| Bronquiolitis obliterante | 2 | 4 | NS |
| Retrasplante | 2 | 1 | NS |
| Supervivencia al año, % | 50 | 92,3 | NS |
FEV1: volumen espiratorio máximo en el primer segundo; NS: no significativo; TP: trasplante pulmonar; UCIP: unidad de cuidados intensivos pediátricos; VMI: ventilación mecánica invasiva.
* Los datos se expresan como mediana y rango, salvo para el número de rechazos por paciente que se expresa como media ± error estándar de la media.
a Se excluyó a 3 pacientes del grupo con VMI previa y a un paciente del grupo sin VMI que fallecieron durante la cirugía.
b Tres pacientes del grupo con VMI pretrasplante y un paciente del grupo de control presentaron fallo multiorgánico.
c Se expresa como porcentaje sobre el valor previsto para el sexo y la talla.
La función del injerto tras el postoperatorio inmediato, valorada por el FEV1 a los 6 meses del TP, no mostró diferencias significativas entre ambos grupos. Hasta el momento actual 2 pacientes del grupo con VMI previa (40% de los supervivientes) y 4 pacientes del grupo sin VMI previa (33% de los supervivientes) han desarrollado bronquiolitis obliterante. En total se realizaron 3 retrasplantes: 2 en el grupo con VMI previa (por neumonitis descamativa y bronquiolitis obliterante), ambos con mal resultado, y uno en el grupo sin VMI previa, aunque volvió a desarrollarse en él bronquiolitis obliterante en el segundo injerto y finalmente falleció.
Aunque la supervivencia inmediata fue menor en el grupo con VMI previa (el 62,5 frente al 92,3%), sólo un paciente de este grupo falleció durante el primer año tras el TP, en el que se desarrolló una neumonitis descamativa que obligó a realizar un retrasplante con mal resultado. En cualquier caso, las diferencias en el porcentaje de supervivencia inmediata al trasplante y al año de éste (el 50 frente al 92,3%) no fueron estadísticamente significativas (tabla 3).
El análisis de la VMI como factor de riesgo en el TP se recoge en la tabla 4. La VMI incidió significativamente en la necesidad de CEC durante la cirugía y de traqueotomía tras el TP así como en la incidencia de fallo orgánico asociado en el postoperatorio inmediato; por el contrario, no fue factor de riesgo significativo para la mortalidad inmediata o tardía (a un año) ni para el desarrollo de bronquiolitis obliterante o la necesidad de retrasplante posterior.
Tabla 4. Análisis de la ventilación mecánica invasiva previa como factor de riesgo postrasplante pulmonar
| Factores | Odds ratio | Intervalo de confianza del 95% | p |
| Necesidad de by–pass | 3,7 | 1,3 a 10,5 | 0,017 |
| Necesidad de traqueotomía | 3,5 | 1,2 a 10,3 | 0,047 |
| Fallo asociado a órganos tras TP | 2,6 | 1,3 a 5,2 | 0,018 |
| Mortalidad inmediata | 4,9 | 0,6 a 39,2 | 0,25 |
| Mortalidad al año | 1,62 | 0,7 a 3,9 | 0,39 |
| Bronquiolitis obliterante | 0,6 | 0,09 a 4,1 | 1 |
| Retrasplante | 4,8 | 0,5 a 41,7 | 0,19 |
TP: trasplante pulmonar.
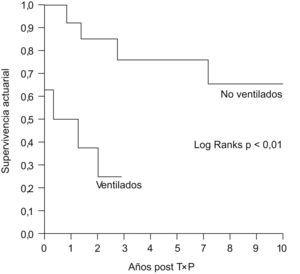
Estos datos contrastan con los del análisis de supervivencia, en el que se demostraron diferencias significativas entre ambos grupos con un aumento acusado de la mortalidad a partir del año del TP en el grupo de pacientes que recibieron VMI previa (figura 2).
Figura 2. Curvas de Kaplan-Meier de supervivencia de pacientes trasplantados con y sin ventilación mecánica invasiva previa.
DiscusiónLos primeros casos de pacientes con FQ que requirieron VMI y evolucionaron favorablemente correspondieron a pacientes pediátricos11; sin embargo, hay pocas revisiones sobre esto. Berlinski et al12 publicaron una serie en la que encuentran que la edad es el único factor relacionado con la mortalidad: para menores de 5 años, ésta es del 22% y para mayores de esa edad es del 75%. Esta diferencia se debe, con seguridad, a que el daño respiratorio aumenta con el tiempo. En esta serie, que sólo incluye pacientes mayores de 5 años, la mortalidad global, incluidos los pacientes con FQ que recibieron VMI y no se trasplantaron dentro del mismo período, es del 57,2%, influenciada por el TP como tratamiento. En el mismo estudio se identifica la malnutrición como un factor de riesgo de presentar fallo respiratorio con necesidad de VMI. En esta serie, los datos nutricionales representativos de todos los pacientes (media y mediana) muestran valores de desnutrición moderada y sin diferencias significativas entre los grupos comparados.
El resurgir de la ventilación no invasiva13,14,15 ha supuesto un avance importante para estos pacientes, lo que evita la VMI en muchos casos. Además, se ha relacionado el empleo de ventilación mecánica no invasiva durante meses antes del TP con mayor supervivencia posterior al mejorar el estado nutricional e impedir el cansancio de los músculos respiratorios15,16. Cuando es preciso recurrir a la VMI, el tratamiento respiratorio es difícil. Los pacientes descompensados por causas reversibles de insuficiencia respiratoria (neumotórax y hemoptisis) tienen mayores posibilidades para el destete del respirador13; lo mismo sucede con los pacientes afectados por ABPA que suelen responder al tratamiento con corticoides. En el resto, al combinarse fallo obstructivo y restrictivo, es frecuente que la SIMV con presión de soporte fracase y se tenga que recurrir a modalidades de ventilación controladas por volumen, lo que obliga a sedación profunda, muchas veces con relajación muscular.
Los pacientes con hipercapnia refractaria son de muy difícil tratamiento; el uso de corticoides se sigue a veces de mejorías espectaculares4 por su efecto antiinflamatorio sobre la mucosa respiratoria, también la ventilación de alta frecuencia oscilatoria puede aumentar el lavado de dióxido de carbono, pero dificulta el aclaramiento de secreciones y, finalmente, la limpieza bronquial mediante fibrobroncoscopio consigue mejorías importantes, aunque transitorias, de la ventilación.
Los malos resultados han llevado a cuestionar el ingreso en la UCIP de pacientes con FQ y fallo respiratorio por enfermedad avanzada3. En esta serie, como en otras4,11, se comprueba que la posibilidad de destete del respirador es limitada y que la mortalidad de los niños con FQ y VMI es elevada.
También el TP se considera contraindicado, al menos de forma relativa6,7, ya que la VMI previa empeoraría el resultado del TP al dificultar la eliminación de secreciones, favorecer las infecciones e inducir atrofia de los músculos respiratorios, lo que prolonga el tiempo de VMI tras el TP. Sin embargo, una serie de hechos pone en duda esta consideración: a) la mayor experiencia y la mejoría en los resultados del TP en general, con numerosos casos publicados de buena evolución en pacientes con VMI previa, y b) la mejoría en la calidad de vida y de supervivencia de los pacientes con FQ. Además, la mayor reserva funcional del niño respecto al adulto y el menor tiempo de daño respiratorio por la enfermedad hacen aún más relativa la contraindicación del TP en pacientes pediátricos con FQ y VMI.
Así, Bartz et al17, en su serie de pacientes adultos jóvenes con FQ, sólo encuentran diferencias significativas en el tiempo hasta la extubación tras el TP cuando comparan los pacientes trasplantados con y sin VMI previa.
Durante el período de estudio estos pacientes contaron con la posibilidad de inclusión en código urgente una vez conectados al respirador. El empleo de una estrategia adicional (trasplante lobular) amplió de forma importante el abanico de donantes, lo que permitió que se utilizaran injertos procedentes de adultos. En esta serie se realizó en 2 casos con buenos resultados inmediatos. Sobre esta base, se aceptaron pacientes con FQ y VMI enviados de otros centros, que plantearon el TP como la única opción de supervivencia y siempre que no hubiese contraindicación para éste.
Como era previsible, los pacientes con FQ trasplantados con VMI previa presentaron dificultades adicionales al resto: más porcentaje de CEC y mayor duración de ésta, mayor necesidad de traqueotomía, de incidencia de rechazos por paciente y de fallo orgánico asociado, así como mayor duración de la VMI postoperatoria y de estancia en la UCIP. Estos resultados coinciden con los de Elizur et al18, que en una serie pediátrica similar a la presentada también encuentran más complicaciones postoperatorias inmediatas en los pacientes trasplantados con VMI previa (mayor incidencia de disfunción primaria del injerto y mayor tiempo en VMI hasta al alta de la UCIP y hasta el alta hospitalaria).
Aunque sin diferencias significativas, en esta serie la supervivencia inmediata fue menor en los pacientes con VMI, pero en aquellos que sobrevivieron al postoperatorio inmediato, la mortalidad al año, la calidad de vida y la incidencia de bronquiolitis obliterante fue similar a la de los pacientes trasplantados sin VMI previa. Esto coincide con otras experiencias similares17,19, aunque no con la serie pediátrica referida18, que registra peor supervivencia al año del TP en los pacientes con VMI previa.
No obstante, no se han publicado resultados a más largo plazo. Por eso se consideró de gran interés ampliar el período de seguimiento mediante un análisis de supervivencia que incluyese todo el período de estudio. Se pudo comprobar cómo las diferencias entre ambas series crecieron hasta hacerse significativas. Es difícil explicar este hecho, dado el escaso número de pacientes y la ausencia de experiencias similares; asimismo, es posible que el daño pulmonar producido por un postoperatorio más complicado fuese causante de una menor supervivencia del injerto y del paciente a largo plazo.
En conclusión, a partir de la experiencia de los autores de este artículo, la supervivencia de los niños con FQ que reciben VMI es escasa, pero el TP es capaz de mejorarla. Aunque la cirugía y el postoperatorio de los niños con FQ y VMI que reciben TP son más complejos, los resultados inmediatos no difieren significativamente de los de niños con TP y sin VMI previa.
La supervivencia al año de pacientes con una alta probabilidad de morir si no reciben un TP podría inducir a no considerar la VMI previa como una contraindicación, pero los resultados a largo plazo ponen en duda este planteamiento.
No obstante, el escaso número de pacientes y el hecho de tratarse de un estudio retrospectivo obligan a interpretar con cautela estos resultados.