El Comité Asesor de Vacunas (CAV) de la Asociación Española de Pediatría (AEP), con base en la evidencia disponible, informa y comenta las novedades que sobre vacunas se han producido en el año 2008 y aconseja las modificaciones del Calendario Vacunal para el año 2009. Se insiste en recomendar la administración de la segunda dosis de recuerdo de vacuna de varicela al inicio de la escolarización (3-4 años) según las especificaciones de la ficha técnica de una de las vacunas. Se sigue reiterando la importancia de universalizar la vacunación antineumocócica conjugada heptavalente, en consonancia con las incuestionables pruebas científicas existentes, la recomendación de la Organización Mundial de la Salud, la postura adoptada en la mayoría de los países europeos de nuestro entorno y la decisión que tomó en 2006 la Comunidad Autónoma de Madrid en España. Se aportan nuevas razones científicas que corroboran la recomendación, realizada en 2008 por este Comité, de implementar la vacuna frente al rotavirus y el virus papiloma humano; se insiste respecto a esta última en la vacunación prioritaria desde los 11 años hasta los 16 años y se amplía, en consonancia con las fichas técnicas de los preparados vacunales disponibles, hasta los 26 años. En estas recomendaciones vacunales, se insiste en dos vacunas, gripe y hepatitis A, que deben aplicarse a los niños en riesgo. Este Comité considera que las vacunas frenta a la gripe y la hepatitis A deben ser implementadas cuando los pediatras lo consideren oportuno, más allá de los grupos de riesgo, como primer paso para una futura recomendación universal. Por último, este año se incluye un anexo sobre las recomendaciones y estrategias vacunales a seguir en el caso de niños no vacunados o inmunizados de forma incompleta.
Based on the available evidence, we, the Vaccine Advisory Committee (CAV) of the Spanish Association of Pediatrics (Asociación Española de Pediatría, AEP), provide information about and comments on vaccine-related innovation during 2008. Modifications to the Vaccine Schedule for 2009 are also discussed. The importance of the recommendation of administration of a varicella booster at start of school (3–4 years of age) is highlighted according to the technical specifications of one of the vaccines. The importance of making the heptavalent pneumococcal conjugate vaccine universally available is reiterated in accordance with the unquestionable results of scientific tests, WHO recommendations, the posture adopted by the majority of neighboring European countries, and the decision taken in 2006 by the autonomous community of Madrid (Spain). New scientific reasons are provided, corroborating the recommendation made by this committee in 2008, for the implementation by Spanish pediatricians of the vaccine against rotavirus and human papilloma virus. With regard to the latter, vaccination should be from 11 to 16 years of age, and then extended, in accordance with the technical specifications of the available vaccine preparations, to 26 years of age. As part of the recommendations, we insist that children in risk groups should be given flu vaccine and hepatitis A vaccine. The committee considers that these two vaccines must also be given, when pediatricians consider it appropriate, to children other than those in risk groups. This recommendation can be regarded as the first step towards a future recommendation of universal vaccination. Finally, this year we include an appendix with recommendations and vaccination strategies to be followed in children who have not previously received vaccines or who have not been completely immunized.
El Comité Asesor de Vacunas (CAV) de la Asociación Española de Pediatría (AEP), actualiza anualmente el calendario vacunal recomendado1–8. Estas indicaciones van dirigidas a los pediatras y a todo el personal sanitario involucrado en las inmunizaciones infantiles, las familias de los niños y los responsables de salud pública encargados de valorar la inclusión de nuevas vacunas en los calendarios vacunales oficiales. Para la elaboración de este documento, válido para el año 2009, se han seguido los criterios de inclusión de vacunas en el Calendario Infantil de la Asociación Española de Pediatría que se publicaron en 2008 en esta misma revista9.
Consideraciones más relevantes sobre el Calendario de Vacunaciones para el año 2009No existen variaciones en las recomendaciones para las vacunas de: poliomielitis (VPI), Haemophilus influenzae b (Hib), hepatitis B (HB), difteria, tétanos y tos ferina de niños (DTPa).
Vacuna de la difteria, tétanos y tos ferina de adultosLa persistencia de casos de tos ferina en lactantes10 por el contagio de un adulto afecto de la enfermedad hace, que se insista en la recomendación de la vacuna dTpa de adulto con baja carga antigénica, en lugar de la dT, entre los 13 y 16 años y que los adultos reciban dosis de recuerdo cada 10 años, especialmente los que por su trabajo tienen relación con recién nacidos y lactantes (p. ej., personal sanitario y de guardería)11. Esta vacuna sigue sin poder utilizarse como primovacunación, la ficha técnica la autoriza únicamente como dosis de recuerdo.
Vacunas combinadas (hexavalentes)El CAV insiste, un año más, en que se generalice en todas las comunidades autónomas la implementación de estos preparados vacunales y así se pueda evitar tres pinchazos en las comunidades que vacunen de hepatitis B a los 2, a los 4 y a los 6 meses, y dos pinchazos a las que vacunen con hepatitis B al nacimiento y a los 2 y a los 6 meses. Cada vez son más las comunidades autónomas que, a pesar de seguir vacunando contra la hepatitis B al nacimiento a todos sus recién nacidos, implementan vacunas hexavalentes. La dosis de recuerdo a los 15-18 meses se deberá hacer con vacuna pentavalente, independientemente de la pauta vacunal con hepatitis B en el primer año de vida.
Vacuna frente a meningococo CEn función de la experiencia obtenida y los datos de vigilancia epidemiológica de la enfermedad meningocócica en España12, el CAV sigue recomendando vacunar en el primer año de vida con dos dosis de cualquiera de las vacunas conjugadas existentes en el mercado, preferentemente a los 2 y a los 4 meses, y una dosis de recuerdo entre los 12 y los 18 meses13,14.
Vacuna frenta al sarampión, la rubéola y la parotiditisSe sigue manteniendo la misma pauta de vacunación de dos dosis. La primera entre los 12 y los 15 meses y la dosis de recuerdo antes de la escolarización obligatoria (3-4 años). La aparición de brotes de las tres enfermedades en los últimos años, incluso con algún caso de rubéola congénita, hace que el objetivo de la OMS en Europa de eliminar el sarampión y la rubéola, en especial la forma de rubéola congénita, y reducir la parotiditis epidémica a menos de 1 caso cada 100.000 para 2010 sea una meta cada vez más difícil de alcanzar. Es necesario extremar las precauciones y asegurar la vacunación con triple viral a toda la población infantil, así como detectar a individuos no vacunados para proceder a su inmunización15–17.
Vacuna frenta a la varicelaEn la actualidad, sólo tres comunidades autónomas (Madrid, Navarra)18,19, además de Ceuta y Melilla, tienen incluida la vacunación frenta a la varicela en el segundo año de vida. El resto de las comunidades autónomas administra la vacuna entre los 10 y los 14 años de edad a los sujetos susceptibles. Con los datos actuales, esta estrategia precisaría alrededor de 30 años para cubrir el hueco actual de inmunidad en adolescentes y adultos, por lo que resulta insuficiente20. En 2008 el CAV consideró oportuno continuar con la vacunación de todos los niños entre los 12 y los 15 meses de edad e introducir una dosis de recuerdo a los 3-4 años de edad con el fin de mejorar la efectividad vacunal8. Durante el último año han sido publicados varios estudios epidemiológicos que en algunos casos indican unas tasas altas de hospitalización, especialmente en los niños menores de 2 años de edad21. Por otra parte, algunas comunidades autónomas han realizado estudios poblacionales de seroprevalencia que indican que la inmensa mayoría de las infecciones se adquieren entre la edad de 2 años y la adolescencia y han establecido tasas reales de la enfermedad basándose en algunos casos en sistemas de vigilancia centinelas22,23. En 2007, en toda España se declararon 153.099 casos al Sistema de Enfermedades de Declaración Obligatoria (EDO), con una tasa de 346 casos/100.000 habitantes, lo que significa un ligero descenso con respecto al año anterior (448/100.000 habitantes en 2006). Al analizar los datos, resultan más que llamativas las diferencias que existen entre algunas comunidades autónomas respecto a las tasas de varicela declaradas al sistema (EDO), algunas con tasas casi 150 veces por debajo de la media nacional24. Estos datos muestran una escasa vigilancia epidemiológica de la enfermedad en algunas áreas, lo que impide conocer la magnitud real del problema. Es deseable que haya un esfuerzo para conseguir una uniformidad dentro de la vigilancia que permita conocer las tasas reales en cada momento y territorio.
El CAV recomienda la administración de la vacuna dentro del calendario habitual, con una primera dosis entre los 12 y los 15 meses y una segunda entre los 3 y los 4 años de edad. Recientemente la Agencia Española del Medicamento ha introducido en la ficha técnica de Varivax® la indicación de administrar una segunda dosis de vacuna para niños entre 12 meses y 12 años. De cualquier forma, los niños entre 12 meses y 12 años deben recibir dos dosis de vacuna frente a la varicela separadas entre sí por al menos 3 meses, salvo en los casos en que haya evidencia de inmunidad a la enfermedad (dos dosis administradas de vacuna, evidencia de haber padecido la varicela o historia de herpes zoster) o que presenten contraindicaciones para recibir la vacuna. En cambio, las personas con edad de 13 años o más pueden recibir las dos dosis separadas al menos 28 días. Por lo tanto, los niños que previamente recibieron una dosis de la vacuna deberán recibir una dosis adicional.
La futura introducción de vacunas tetravalentes (sarampión, rubéola, parotiditis, varicela) ya disponibles en otros países facilitará la implementación de estas pautas. Por otra parte, se insiste en la recomendación de vacunar a los adolescentes y los adultos que no hayan tenido la enfermedad mejorando los sistemas de vigilancia tanto de varicela como de herpes zoster, con el fin de conocer el verdadero impacto de esta forma de manifestarse la infección por virus VZ y poder evaluar en un futuro si la vacunación infantil de varicela modifica la incidencia de esta enfermedad.
Los dos preparados comerciales disponibles tienen diferentes indicaciones en España: Varivax® está autorizada según su ficha técnica para niños sanos a partir de los 12 meses de edad y Varilrix® para mayores de 12 años y en situaciones especiales para menores de 12 años sanos y en el entorno de inmunodeficientes.
Vacuna antineumocócica conjugada heptavalenteEl CAV se ratifica en la recomendación de seguir inmunizando con esta vacuna e insiste en la necesidad de introducirla en los calendarios vacunales de las diferentes comunidades autónomas, como lo hizo la Comunidad de Madrid en 200618. La vacunación antineumocócica universal con la vacuna conjugada es una realidad en la mayoría de los países de Europa occidental. La vacuna ha demostrado elevadas eficacia, efectividad y seguridad25. Además, es evidente que induce inmunidad de grupo al disminuir los portadores nasofaríngeos, así como un descenso de neumococos resistentes y del consumo de antibióticos.
La Organización Mundial de la Salud (OMS)26, valorando la alta incidencia de la enfermedad neumocócica en el mundo, que afecta fundamentalmente a niños pequeños, ya estableció que es prioritario incluir esta vacuna en los programas nacionales de vacunación. Se tiene constancia de que hay un discreto reemplazo de cepas vacunales por cepas no vacunales, especialmente a cargo del serotipo 19 A, debido a causas multifactoriales27, entre las que la vacunación parece ser uno de los que menos importancia puede tener.
En cualquier caso hay que tener en cuenta que el impacto de la vacunación en países con una alta cobertura es mucho mayor que la tasa de reemplazo, por lo que el beneficio de la inmunización universal es evidente.
Por otro lado, se espera que en el curso de los próximos 2 años estén disponibles vacunas conjugadas contra neumococo que incluyen más serotipos, en la seguridad de que contribuirán a una más amplia cobertura de la enfermedad neumocócica en la población a la que se apliquen.
Para 2009, el CAV continúa recomendando la misma pauta de vacunación en número de dosis e intervalo que en ediciones previas del calendario. Hay que seguir llamando la atención sobre los riesgos potenciales de las inmunizaciones incompletas o tardías, e insistir en la importancia de cumplir el calendario desde los primeros meses de vida administrando todas las dosis indicadas en la ficha técnica, independientemente del contacto mayor o menor, precoz o tardío con otros niños. En el momento actual, aunque hay indicios de que pautas «alternativas» de vacunación, con un menor número de dosis, podrían ser igualmente efectivas contra la enfermedad neumocócica invasora, la evidencia es todavía insuficiente para cambiar la recomendación vigente. Se desconoce qué impacto tiene la inmunización con menor número de dosis en las formas no invasoras de la enfermedad neumocócica y en especial en la inmunidad colectiva28.
Vacuna frenta a rotavirusEn 2008, el CAV estableció la recomendación de introducir de manera universal la vacuna frenta a rotavirus8. Durante el último año han sido publicados varios trabajos realizados en nuestro país que demuestran la importancia de la enfermedad producida por rotavirus29, así como el importante gasto que origina30. Algunos estudios recientes han encontrado tasas de hospitalización causada por rotavirus mayores que en trabajos publicados con anterioridad31,32. En la actualidad se dispone de dos vacunas de administración oral comercializadas, que se han demostrado seguras y eficaces contra rotavirus:
- –
Rotarix® (Laboratorios GlaxoSmithKline), cuya pauta de administración consiste en 2 dosis orales separadas un mínimo de 4 semanas, de tal manera que la primera dosis se administre a partir de las 6 semanas de vida y la pauta se complete antes de la semana 24.
- –
Rotateq® (Laboratorios Sanofi Pasteur MSD), cuya pauta de administración consiste en 3 dosis orales, separadas 4 semanas, de tal modo que la primera dosis se administre después de las 6 semanas de vida y se termine la vacunación antes de la semana 26.
Para ambas vacunas, la pauta debe iniciarse antes de que se cumplan las 12 semanas de edad33,34. La vacunación debe completarse siempre con la misma marca comercial con que se inicia, ya que no hay datos de la eficacia y la seguridad de la combinación de los dos preparados comerciales.
Recientemente, con base en ensayos clínicos anteriores, ha sido evaluada la eficacia de la vacuna pentavalente en lactantes con antecedente de prematuridad, y se ha encontrado datos similares de eficacia y seguridad respecto a sujetos a término35,36. Por otra parte, los datos de un ensayo clínico realizado sobre prematuros con la vacuna monovalente también demuestran eficacia y seguridad similares a las encontradas en lactantes a término37.
Son numerosos los países en todo el mundo que han incluido la vacunación frente a rotavirus en sus respectivos calendarios vacunales. Por otro lado, organizaciones científicas europeas, como la Sociedad Europea de Enfermedades Infecciosas Pediátrica (ESPID) y la Sociedad de Gastroenterología, Hepatología y Nutrición Pediátrica (EPSGHAN), han emitido un comunicado conjunto sobre las recomendaciones basadas en la evidencia para la vacuna frente a rotavirus38.
Recientemente, en Estados Unidos se han publicado algunos datos que podrían indicar una alta efectividad de la vacunación aplicada de manera universal, pues en la temporada 2006–2007 se ha observado una disminución superior al 50% con respecto a temporadas anteriores, probablemente gracias a la influencia de la vacunación, aunque este extremo debe seguir analizándose39.
Por lo tanto, el CAV sigue recomendando la administración universal de la vacuna frente a rotavirus, aunque entiende que la reciente incorporación de nuevas vacunas en el calendario financiado y la perspectiva de futuras incorporaciones necesarias como la vacunación frente a neumococo y varicela hace que la financiación pública resulte difícil por el momento.
Vacuna frenta al virus del papiloma humanoLa infección por Papilomavirus humano (VPH) es la enfermedad de transmisión sexual más frecuente en el mundo. Esta infección constituye una causa necesaria para el desarrollo del cáncer de cérvix (los tipos 16 y 18 explican más del 70% de los casos); se ha relacionado también con otras formas de cáncer anogenital, de vía aérea y aparato digestivo, y es además el origen de las verrugas anogenitales (producidas en más del 90% de los casos por los tipos 6 y 11). Los aspectos esenciales de esta infección, su relación con el cáncer de cuello uterino y otras formas de enfermedad, las características de las vacunas profilácticas disponibles y el papel del pediatra en este contexto han sido objeto de diversas revisiones y actualizaciones recientes por este Comité y otros, que se detallan en la bibliografía40–42.
Están disponibles en España dos vacunas seguras y eficaces contra el VPH:
- –
Gardasil®, vacuna profiláctica recombinante de partículas de tipo viral (VPL) comercializada por Laboratorio Sanofi Pasteur MSD. Está aprobada para su uso por la FDA estadounidense (junio de 2006) y la EMEA (septiembre de 2006). Es una vacuna tetravalente que contiene los tipos 6, 11, 16 y 18, con aluminio como adyuvante. Tiene indicación por ficha técnica en la prevención de las lesiones displásicas cervicales de alto grado (CIN 2/3), del cáncer cervical, de la lesiones displásicas vulvares de alto grado (VIN 2/3), de las lesiones displásicas vaginales de alto grado (VaIN 2/3) y de las verrugas genitales externas (condilomas acuminados) producidos por estos serotipos. Su eficacia está demostrada en mujeres adultas de 16 a 26 años de edad y su inmunogenicidad, en niños y niñas de 9 a 15 años. La pauta recomendada es de 3 dosis intramusculares a los 0, 2 y 6 meses43.
- –
Cervarix®, vacuna profiláctica recombinante de partículas de tipo viral (VPL) comercializada por Laboratorio GSK. Está aprobada para su uso por la EMEA (septiembre de 2007). Es una vacuna bivalente que contiene los tipos 16 y 18 del VPH, con ASO4 como adyuvante. Tiene indicación por ficha técnica en la prevención de las neoplasias intraepiteliales cervicales de alto grado (CIN 2/3) y del cáncer cervical producidos por estos serotipos. Su eficacia está demostrada en mujeres de 15 a 25 años y su inmunogenicidad, en niñas y mujeres de 10 a 25 años. La pauta recomendada es de 3 dosis intramusculares a los 0, 1 y 6 meses44.
En función de la historia natural de la infección por VPH y la neoplasia cervical, el momento idóneo para realizar la primovacunación debería ser antes del contacto con el virus y, por lo tanto, antes del inicio de la actividad sexual. Si bien en nuestro entorno se cifraba que únicamente entre un 8 y un 18% de la población iniciaba las relaciones sexuales antes de los 16 años, los estudios más recientes objetivan un cambio importante en el comportamiento sexual de nuestros jóvenes: el inicio de la sexarquia/coitarquia se está adelantando de forma significativa, y la edad de inicio es más precoz y la promiscuidad es mayor cuanto menor es la edad del entrevistado45. Además, la inmunogenicidad de la vacuna es significativamente mayor —aproximadamente el doble— cuando se administra a las mujeres y los varones antes de los 15 años que cuando se aplica en edades posteriores. A esto hay que añadir que la población es mucho más asequible en este intervalo de edades que en edades superiores. Por ello, el CAV incluyó esta vacuna ya en el calendario de 2008, en función de los datos disponibles en la literatura y en consonancia con las recomendaciones de los principales organismos, entidades y grupos de expertos nacionales e internacionales relacionados, dentro del consenso de las Sociedades Científicas Españolas recientemente actualizado46,47. El CAV recomienda que sean vacunadas todas las niñas desde los 11 años y al menos hasta los 16 años en primera instancia, continuando en los años posteriores con la vacunación sistemática a los 11-12 años. Por otro lado, se reafirma en la importancia de extender el catch-up inicial en adolescentes y mujeres hasta los 25/26 años de edad, suscribiendo el documento de consenso nacional y las evidencias nacionales disponibles que lo justifican47–53. La infección por VPH es de distribución universal y el riesgo de contraer la enfermedad persiste toda la vida. Es importante recordar a las mujeres que hubiesen podido tener contacto sexual antes de la vacunación que pueden no haber estado expuestas al VPH, y menos aún a todos los tipos de VPH de los que la vacuna protege48,49. No es necesario realizar determinación de VPH previa a la vacunación, ni siquiera en los casos con antecedentes de exposición sexual49,50. El papel de la vacunación del varón todavía no está claro; la vacuna es segura e inmunógena en varones hasta 15-18 años de edad, pero todavía no se ha demostrado su eficacia contra la afección que el VPH ocasiona en el varón (verrugas genitales, oncopatía perineal, etc.) o su transmisión48. Desde una perspectiva de salud pública, la vacunación del varón podría ser importante en caso de tasas bajas de vacunación en mujeres48.
Todos los modelos de coste-eficacia publicados hasta la fecha ratifican que la vacunación anti-VPH es eficiente47. Disponemos de modelos aplicados a nuestro país que también lo confirman, con un coste por año de vida salvado que es inferior al PIB per cápita, lo que según la OMS se traduce como una intervención preventiva muy eficiente49–52.
El CAV se congratula de que el consejo interterritorial haya aprobado a finales de 2007 la inclusión de la vacuna anti-VPH en el calendario vacunal financiado, siguiendo la estela de la gran mayoría de los países de nuestro entorno53.
El éxito en la implementación de la vacunación anti-VPH requiere un abordaje necesariamente multidisciplinario. Existen barreras profesionales (falta de información-formación, perspectiva lejana del problema, etc.) y poblacionales (carga económica, confusión «mediática», desinformación, etc.) que están dificultando la implantación amplia de esta vacuna. Sin duda una educación sanitaria adecuada será clave en la superación de estas barreras. El pediatra está teniendo un papel determinante en la aceptación y la difusión, la información y la formación adecuada y la administración y el grado de cobertura alcanzado por la vacuna anti-VPH.
Vacuna antigripalLa gripe produce una elevada morbilidad anual en la población pediátrica, y los niños son el grupo de edad con mayores tasas de incidencia54–59.
Por el momento el CAV no aconseja la vacunación antigripal sistemática a los niños sanos como ocurre en Estados Unidos, donde las recomendaciones para 2008–2009 incluyen a todos los niños sanos de 6 meses a 18 años de edad54–60. Esta ampliación de la edad de recomendación de la vacunación frente a la gripe la han hecho los Centers for Disease Control and Prevention (CDC) y el Advisory Committe on Immunization Practices (ACIP) por primera vez en febrero de 2008, y aconsejan iniciarla en la campaña 2008–2009 y, de ser posible, no más tarde de la estación de gripe de los años 2009 y 2010. Esta recomendación ha sido hecha tanto para la protección de los niños como para la protección de los adultos mayores y los de riesgo, ya que las tasas de vacunación en estas poblaciones siguen siendo muy bajas y su principal fuente de contagio es los niños.
En Europa ya hay un primer país (Finlandia) que recomienda la vacunación del niño sano (6 a 23 meses de edad) y en el futuro se espera que otros países sigan su ejemplo.
En España, antes de esta recomendación de la vacunación antigripal del niño sería conveniente realizar estudios epidemiológicos de calidad que ayuden a valorar el impacto real de la gripe en el niño, el papel de éstos como fuente de contagio para adultos en riesgo, la tasa de vacunación del adulto mayor y de los niños y adultos en riesgo y, por lo tanto, la posible eficiencia de la vacunación sistemática en nuestro entorno. El CAV recomienda que se realicen estudios en este sentido, que permitan conocer las tasas de incidencia y hospitalización debidas a esta epidemia anual. No obstante, en función de las evidencias existentes, el CAV considera que cualquier niño mayor de 6 meses se puede vacunar cuando los padres lo soliciten, aunque con prioridad de acceso a la vacuna para los niños en riesgo.
Por otro lado, el CAV insiste en el cumplimiento de la vacunación frente a la gripe de niños en riesgo y el personal sanitario en contacto con ellos, ya que el porcentaje de cobertura en estos colectivos en nuestro país sigue siendo muy bajo, probablemente debido a la poca sensibilización que el pediatra tiene respecto al importante papel de esta vacuna en la prevención de la gripe y sus complicaciones, mucho más frecuentes en estos pacientes60,61.
Las recomendaciones anuales referentes a la vacuna antigripal se detallan en la página web de la AEP (www.aeped.es; www.vacunasaep.org) y se resumen a continuación:
- 1.
Niños con enfermedades crónicas:
- –
Neumopatías crónicas, incluido el asma.
- –
Enfermedades cardiovasculares graves.
- –
Neuropatías crónicas, diabetes y otras metabolopatías.
- –
Enfermedades neuromusculares que condicionan afección respiratoria por sí o por una dificultad de movilización de secreciones respiratorias.
- –
Enfermedades o prácticas que condicionan inmunodeficiencia.
- –
Niños que reciben tratamiento continuo con ácido acetilsalicílico.
- –
- 2.
Niños sanos mayores de 6 meses que puedan constituir un riesgo para los adultos enfermos que conviven con ellos y no deban o no puedan ser vacunados.
- 3.
Adultos que pueden constituir un riesgo para los niños que conviven con ellos:
- –
Embarazadas que vayan a dar a luz en los meses de la epidemia anual (noviembre a marzo).
- –
Familiares y convivientes con niños de cualquier edad, que estén encuadrados en las indicaciones recogidas en 1.
- –
Personal sanitario que ejerza su trabajo con niños en hospitales, centros de salud o consultorios privados.
- –
Trabajadores de instituciones que acojan a niños discapacitados físicos o psíquicos.
- –
Trabajadores de guarderías.
- –
Ante el bajo grado de cumplimiento de las pautas de 2 dosis para los niños de 6 meses a 8 años de edad, debe insistirse en el cumplimiento de esta recomendación. Asimismo, cuando en la primera vacunación antigripal de un niño de esa edad se haya administrado una sola dosis, deberán administrarse 2 dosis en la siguiente estación.
En el caso de los padres de niños no pertenecientes a los grupos de riesgo citados anteriormente, y que quieran reducir el riesgo de que sus hijos padezcan una infección gripal o que transmitan la infección, deben ser informados sobre las ventajas de la vacunación.
El CAV quiere promover la sensibilización entre los pediatras, médicos generales y padres sobre esta vacuna, cuya evolución lógica deberá ser su universalización a todos los niños en el futuro.
Vacuna frente a la hepatitis ALa efectividad de la vacuna frente a la hepatitis A (HA) ha sido demostrada en varios estudios que analizan las coberturas vacunales y los datos provenientes de la vigilancia epidemiológica en Estados Unidos62. En ese país, tras las recomendaciones del ACIP en 1997 de vacunar a las poblaciones en riesgo, pudo observarse un descenso del 97% en los casos de HA en la poblaciones nativas indias y de Alaska con coberturas de un 50–80%63. Por otra parte, el descenso de las tasas de infección en adultos indica el papel de la vacunación en la reducción de la transmisión a otros grupos de edad gracias a la disminución de la circulación64. Estos resultados de efectividad vacunal han sido similares en países como Israel65 y también en España, en Cataluña. Recientemente se han publicado nuevos estudios que demuestran que es una medida coste-efectiva66,67.
La mejora de las condiciones higienicosanitarias de nuestro país en las últimas décadas ha tenido como consecuencia la disminución muy importante de los casos de HA. No obstante, en los últimos años, en España se detectan esporádicamente brotes epidémicos de HA. La tasa en el último año ha descendido de 3,76 a 2,27 (de 1.494 a 1.002 casos), aunque ha aumentado levemente en las comunidades con menos casos68. Los estudios serológicos nacionales actuales indican que más del 65% de la población menor de 40 años no tienen inmunidad al VHA69. Este aumento de población susceptible a la infección podría hacer que en los próximos años aumenten los brotes epidémicos, especialmente en los casos de poblaciones marginales y con deficientes condiciones higienicosanitarias70. En función de los datos actualmente disponibles, debería seguir extremándose la vigilancia epidemiológica de la HA realizando una rápida actuación en los casos de brotes epidémicos70. La efectividad vacunal ha sido demostrada en nuestro país a partir de los estudios realizados en Cataluña71–73. Por lo tanto, debería llevarse a cabo la vacunación sistemática de los niños entre los 12 y los 24 meses de edad en las zonas con brotes epidémicos frecuentes, con altas tasas de enfermedad o en poblaciones marginales con riesgo de transmisión de la infección. Igualmente, podría considerarse la vacunación de niños mayores de esa edad en tales poblaciones. La pauta vacunal consiste en dos dosis separadas 6-12 meses. Finalmente, en los próximos años, y en función de los datos epidemiológicos, debería considerarse y estudiar la inclusión de la vacuna frente a la HA en el calendario vacunal financiado, teniendo en cuenta que la estrategia de la vacunación universal en la edad infantil ha demostrado su rentabilidad. Esta situación se verá facilitada en un futuro próximo, al haber aparecido experiencias que demuestran la posibilidad de administrar la vacuna frente a la HA concomitantemente a las vacunas hexavalentes a los 6 meses de edad74.
En conclusión, el CAV recomienda para 2009 incrementar la vacunación en niños con factores de riesgo personales y ambientales y niños viajeros a países endémicos, y extremar las actuaciones preventivas en situación de brotes (fig. 1).
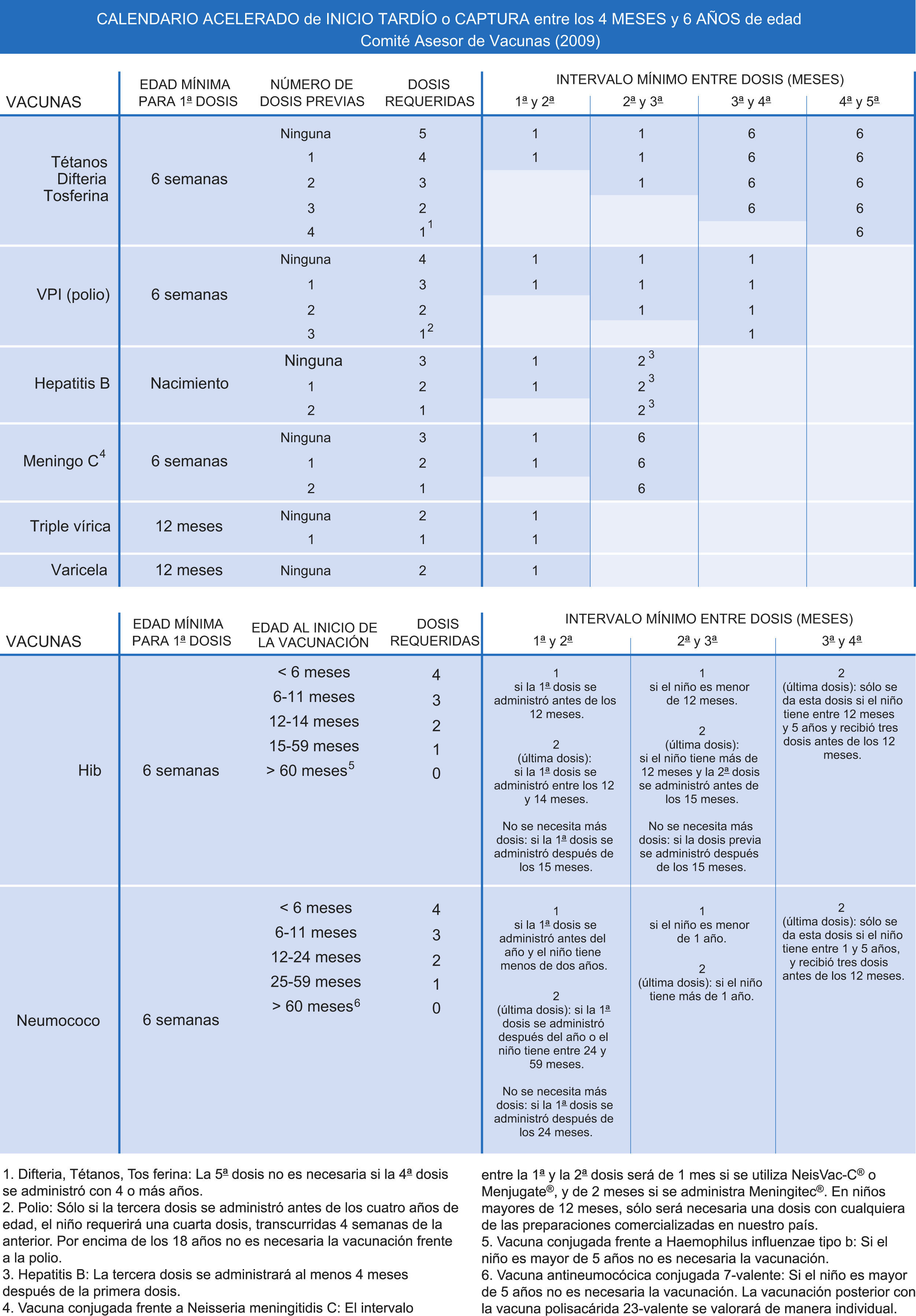
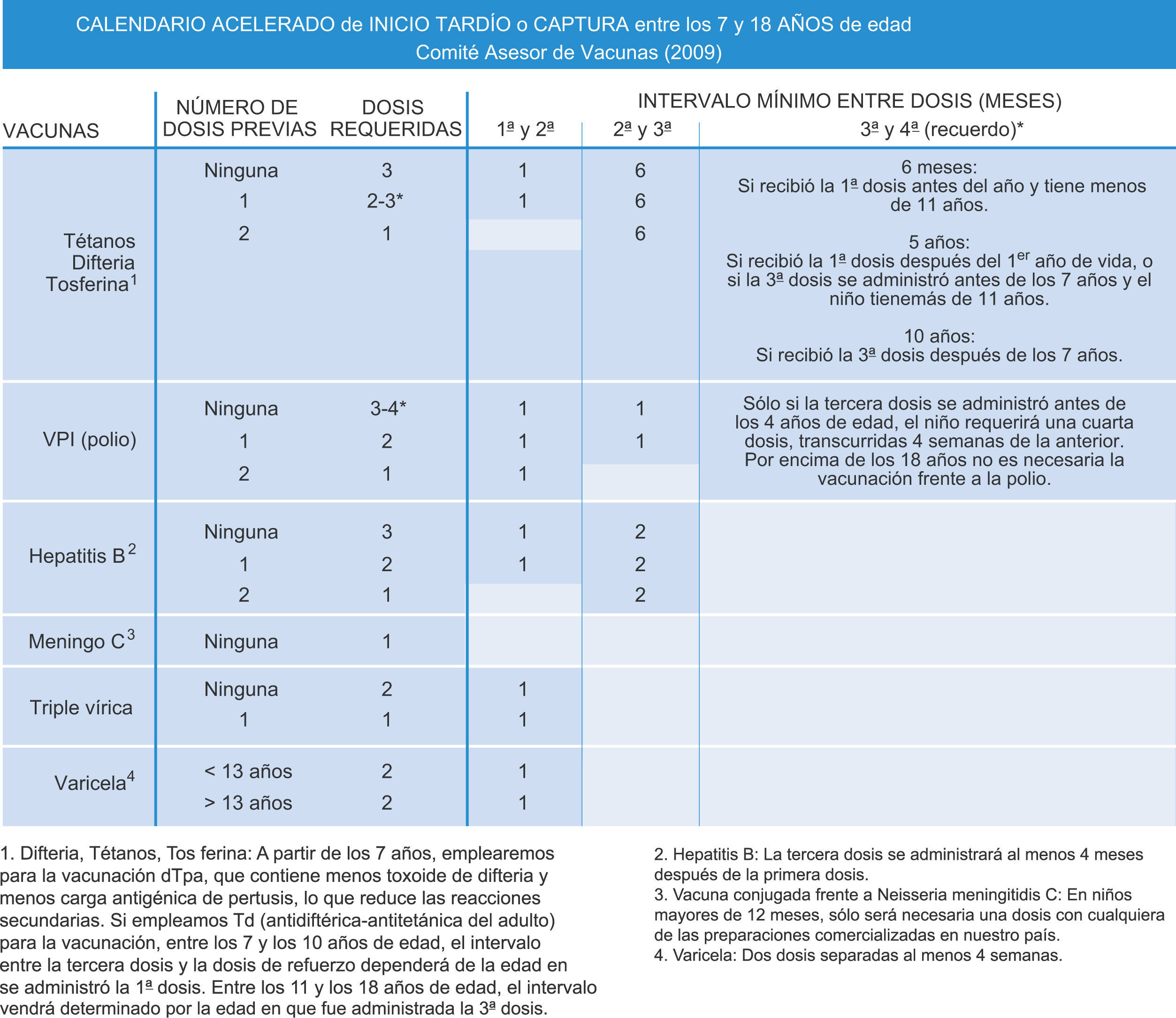
Calendario vacunal acelerado para niños y adolescentes que hayan comenzado tarde la vacunación o esté incompletaLa finalidad del calendario acelerado es proporcionar la inmunización completa, la protección óptima en el menor tiempo posible, al niño con inmunización retrasada o interrumpida75–78.
Las pautas de vacunación acelerada que se adjuntan a este documento pretender ser un instrumento de ayuda al pediatra en su práctica diaria. Es necesario recordar que hay que establecer un calendario individualizado para cada paciente con vacunación retrasada o incompleta, teniendo en cuenta tanto sus antecedentes de vacunación como su edad o condición de riesgo. Respecto a las dosis previas, sólo se considerarán válidas si están avaladas por documentación escrita. Si las dosis previas han sido administradas respetando la edad mínima para la primera dosis y los intervalos de administración, se las considerará dosis válidas y no será necesario revacunar ni reiniciar la pauta vacunal desde el principio. En estos casos se continuará con la pauta hasta completar el número total de dosis requeridas.
Los intervalos mínimos de administración entre dosis de una misma vacuna deberán ser considerados y respetados con el fin de recuperar dosis perdidas utilizando el mínimo intervalo de tiempo pero asegurando una adecuada efectividad vacunal. También es necesario tener en cuenta todas las normas generales de administración vacunal, como los intervalos de administración entre diferentes preparados vacunales, intercambiabilidad entre vacunas de diferentes fabricantes, y lugar y vía de administración. Una vez se haya alcanzado un estado de inmunización en la que el paciente, por su edad, pueda ser incorporado a la vacunación sistemática del calendario oficial, es preferible no utilizar los intervalos mínimos para continuar la vacunación, y a partir de entonces se observarán los intervalos habituales recomendados.
Los anexos 1 y 2 muestran los intervalos mínimos y el número de dosis necesarias de las vacunas recomendadas por el CAV para niños entre 4 meses y 6 años y niños y adolescentes entre los 7 y los 18 años de edad (figs. 2 y 3).