La infección por VIH era el principal factor de riesgo para presentar neumonía por Pneumocystis jirovecii (NPJ). En la actualidad, las características clínico-epidemiológicas de la NPJ en niños han cambiado, existiendo pocos estudios en este sentido.
MétodosRealizamos un estudio observacional retrospectivo en pacientes pediátricos diagnosticados de NPJ durante 17 años en un hospital de tercer nivel en España.
ResultadosSe recogió a 23 pacientes, de los que 11/23 (47,8%) presentaban enfermedad hematológica, 5/23 (21,7%) inmunodeficiencia primaria y 4/23 (17,4%) infección por VIH. Recibían profilaxis con trimetoprima-sulfametoxazol (TMP-SMX) 11/23 pacientes (47,8%). Todos recibieron tratamiento con TMP-SMX y 18/23 (78,3%), glucocorticoides sistémicos. Fallecieron 6/23 pacientes (26,1%), de los que 1/6 (16,7%) presentaba infección por VIH. En los pacientes no VIH con mayor leucocitosis, mayor retención de CO2 y mayor frecuencia cardíaca al inicio, se evidenció mayor mortalidad, diferencias no objetivadas en pacientes con VIH. No se encontraron diferencias en mortalidad en relación con el factor predisponente, empleo de TMP-SMX ni tratamiento con glucocorticoides.
ConclusionesEn la actualidad, los pacientes pediátricos con neoplasias hematológicas constituyen el principal grupo de riesgo de desarrollar NPJ en este grupo etario. No hemos encontrado diferencias de mortalidad entre pacientes con o sin infección por VIH como factor predisponente. Entre los pacientes no VIH la mortalidad fue mayor en aquellos que presentaron mayor leucocitosis, mayor retención de CO2 y mayor frecuencia cardíaca al inicio. No se objetivó mejor pronóstico en pacientes que recibían profilaxis con TMP-SMX previamente al desarrollo de la NPJ ni en los que recibieron glucocorticoides sistémicos como parte del tratamiento.
HIV infection was the main risk of suffering Pneumocystis jirovecii pneumonia (PJP). The clinical-epidemiological characteristics of PJP have currently changed, with there being few studies on this.
MethodsA retrospective observational study was carried out on paediatric patients diagnosed with PJP over a 17 year period in a third level hospital in Spain.
ResultsA total of 23 patients were included, of whom 7/23 (47.8%) suffered a haematological disease, 5/23 (21.7%) a primary immunodeficiency, and 4/23 (17.4%) an HIV infection. Prophylaxis with trimethoprim-sulfamethoxazole (TMP-SMX) was received by 11/23 (47.8%) patients. All were treated with TMP-SMX and 18/23 (78.3%) with systemic glucocorticoids. There were 6(26.1%) deaths, of which one of them (16.7%) suffered an HIV infection. A higher mortality was seen in the non-HIV patients with greater leucocytosis, greater CO2 retention, and a higher heart rate at onset, differences not observed in HIV patients. No differences were found in mortality in relation to the predisposing factor, use of pTMP-SMX, or treatment with glucocorticoids.
ConclusionsPaediatric patients with haematological cancers are currently the main risk group of developing PJP in this age group. No differences were found in mortality between patients with or without HIV infection as predisposing factor. The mortality among non-HIV patients was higher in those that had greater leucocytosis, greater CO2 retention, and increased heart rate at onset. A better prognosis was not seen in patients that received prophylaxis with TMP-SMX prior to the development of the PJP, or in those that received glucocorticoids as part of the treatment.
Pneumocystis jirovecii (P. jirovecii), anteriormente denominado Pneumocystis carinii y considerado un protozoo, fue clasificado posteriormente como hongo gracias a técnicas de secuenciación genética1. Se trata de un microorganismo ubicuo, capaz de producir enfermedad exclusivamente en humanos. Su transmisión se produce por vía respiratoria, persona-persona, dependiendo su capacidad de producir enfermedad del estado inmunitario del huésped.
Diferentes estudios han constatado la elevada prevalencia de anticuerpos frente a Pneumocystis en población pediátrica de países desarrollados, con cifras de hasta el 80% en menores de 4 años, demostrando con ello que la primoinfección por P. jirovecii es frecuente en la infancia2,3 y que generalmente cursa de manera asintomática.
Pacientes inmunocomprometidos, especialmente aquellos que presentan alteraciones cualitativas o cuantitativas de los linfocitos T CD4, no son capaces de eliminar el microorganismo, presentando mayor susceptibilidad para desarrollar neumonía por P. jirovecii (NPJ)4,5. El descenso en la cifra de linfocitos T CD4 es, precisamente, el principal factor de riesgo para desarrollar dicho cuadro4,6. En consonancia con ello, clásicamente, los pacientes con infección por VIH constituían el principal grupo de riesgo para presentar NPJ, presentando cuadros clínicos más graves y con peor pronóstico en comparación con el subgrupo de pacientes no VIH4. El desarrollo de terapias antirretrovirales más efectivas y la profilaxis antimicrobiana con trimetoprima-sulfametoxazol (TMP-SMX) han cambiado la epidemiología de la enfermedad4.
El diagnóstico de la NPJ en niños suele basarse en criterios clínicos, dado que no existen hallazgos analíticos ni radiológicos específicos de dicho cuadro, siendo necesario para la confirmación microbiológica obtener una muestra mediante lavado broncoalveolar (LBA), técnica invasiva que no siempre puede realizarse en situaciones de inestabilidad respiratoria. Como alternativa al LBA, en niños mayores colaboradores y con buen estado general, puede valorarse su obtención mediante esputo inducido. En pacientes inestables, a los que no puede realizárseles el LBA, puede emplearse aspirado nasofaríngeo, lavado oral o broncoaspirado (BAS), aunque la sensibilidad diagnóstica en estas muestras es baja. Con independencia del tipo de muestra extraída, la técnica gold standard para el diagnóstico de la NPJ es la inmunofluorescencia directa (IFD)7,8, con especificidad alta y sensibilidad variable según el tipo de muestra respiratoria empleada. Las técnicas de reacción en cadena de la polimerasa (PCR), tanto cualitativa como cuantitativa, aumentan la sensibilidad respecto a la IFD, aunque no permiten descartar colonización9.
La precocidad en el inicio del tratamiento antimicrobiano y el empleo de corticoterapia sistémica en casos seleccionados han demostrado mejorar el pronóstico de la NPJ10,11.
La profilaxis con TMP-SMX en pacientes de riesgo parece la medida más efectiva para su prevención, aunque no elimina totalmente la probabilidad de desarrollar la enfermedad12.
Diseñamos nuestro estudio con el objetivo de describir las características clínicas, epidemiológicas y pronósticas de la NJP en niños atendidos en un hospital de tercer nivel en nuestro país.
Material y métodosSe realizó un estudio observacional descriptivo retrospectivo de pacientes menores de 18 años diagnosticados de NPJ entre enero del 2000 y marzo del 2017 en un hospital pediátrico de tercer nivel en Málaga (España), mediante la recogida de datos a través de las historias clínicas.
Definimos NPJ como todo aquel cuadro clínicamente compatible, con prueba de imagen sugerente de la enfermedad y confirmación microbiológica con aislamiento de P. jirovecii en LBA o BAS (mediante PCR o IFD positivas).
Se realizó un análisis descriptivo de las principales variables. Se establecieron 2grupos de comparación, pacientes con infección por VIH y pacientes no VIH. Para el contraste de hipótesis se utilizaron la prueba de la chi al cuadrado para variables cualitativas dicotómicas y la prueba t de Student para variables cuantitativas, previa comprobación de normalidad mediante la prueba de Kolmogorov-Smirnov.
El estudio fue aprobado por el comité ético de investigación clínica de nuestro centro, no se empleó consentimiento informado por tratarse de un estudio retrospectivo en el que no se exponen explícitamente datos de cada paciente individual.
ResultadosSe recogieron un total de 23 episodios, en 23 pacientes. De ellos 15/23 (65%) eran varones, con una mediana de edad de 3,10 años (RIC 0,51-7,20 años) durante el episodio. Presentaban alguna enfermedad hematológica 11/23 (47,8%) pacientes, de las que 9/11 (82%) eran leucemias linfoblásticas agudas (LLA). Presentaban inmunodeficiencia primaria (IDP) 5/23 (21,7%), de las que 4/5 (80%) eran inmunodeficiencias combinadas graves y 1/5 (20%) era una agammaglobulinemia ligada al X (ALX). Únicamente 4/23 (17,4%) pacientes presentaban infección por VIH. El resto de los casos, 3/23 (13,1%), habían recibido glucocorticoides sistémicos (GC) a dosis altas (2mg/kg/día) por su enfermedad de base, incluyendo un paciente con síndrome de Guillain-Barré, una enfermedad mixta del tejido conectivo (EMTC) y un síndrome hemofagocítico; los 2últimos, además, recibían otros tratamientos inmunosupresores (tabla 1).
Características epidemiológicas (N = 23)
| Sexo (varón), n (%) | 15 (65) | |||
| Edad (años), mediana (RIC) | 3,10 (0,51-7,20) | |||
| Enfermedad de base, n (%) | Enf. hematológica | 11 (47,8) | LLA | 9 (82) |
| SMD | 1(9) | |||
| Síndrome de Evans | 1 (9) | |||
| IDP | 5 (21,7) | Déficit HLA-II | 4 (80) | |
| ALX | 1 (20) | |||
| VIH 4 (17,4) | ||||
| Tratamiento GC dosis altas | 3 (13) | Enf. mixta del tejido conectivo | 1 (4,3) | |
| Síndrome Guillain-Barré | 1 (4,3) | |||
| Síndrome hemofagocítico | 1 (4,3) | |||
ALX: agammaglobulinemia ligada al X; GC: glucocorticoides; HLA: de sus siglas en inglés, antígenos leucocitarios humanos; IDP: inmunodeficiencia primaria; LLA: leucemia linfoblástica aguda; RIC: rango intercuartílico; SMD: síndrome mielodisplásico; VIH: virus de la inmunodeficiencia humana.
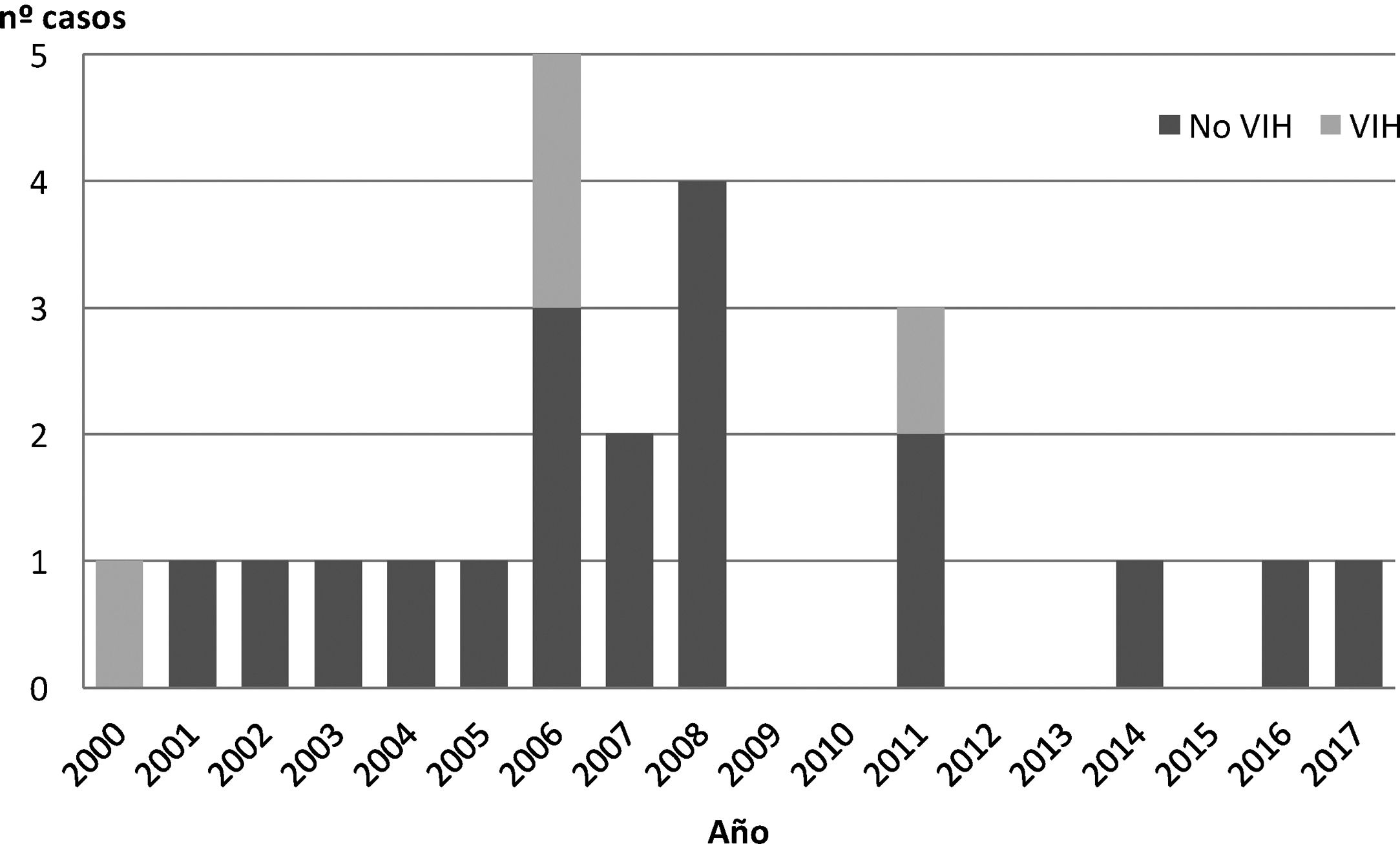
No se detectó ningún caso de NPJ en el subgrupo de pacientes VIH en los últimos 6 años de estudio (fig. 1).
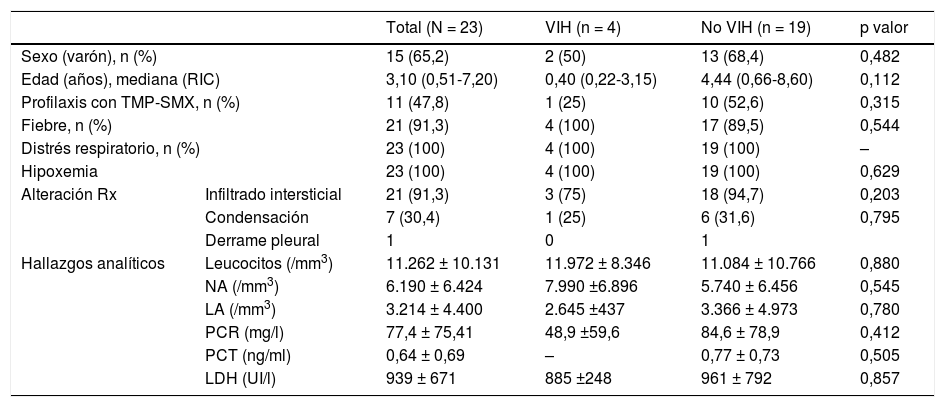
Ambos subgrupos (pacientes VIH y no VIH) eran comparables respecto a sus características epidemiológicas (tabla 2).
Características epidemiológicas y presentación clínico-radiológica
| Total (N = 23) | VIH (n = 4) | No VIH (n = 19) | p valor | ||
|---|---|---|---|---|---|
| Sexo (varón), n (%) | 15 (65,2) | 2 (50) | 13 (68,4) | 0,482 | |
| Edad (años), mediana (RIC) | 3,10 (0,51-7,20) | 0,40 (0,22-3,15) | 4,44 (0,66-8,60) | 0,112 | |
| Profilaxis con TMP-SMX, n (%) | 11 (47,8) | 1 (25) | 10 (52,6) | 0,315 | |
| Fiebre, n (%) | 21 (91,3) | 4 (100) | 17 (89,5) | 0,544 | |
| Distrés respiratorio, n (%) | 23 (100) | 4 (100) | 19 (100) | – | |
| Hipoxemia | 23 (100) | 4 (100) | 19 (100) | 0,629 | |
| Alteración Rx | Infiltrado intersticial | 21 (91,3) | 3 (75) | 18 (94,7) | 0,203 |
| Condensación | 7 (30,4) | 1 (25) | 6 (31,6) | 0,795 | |
| Derrame pleural | 1 | 0 | 1 | ||
| Hallazgos analíticos | Leucocitos (/mm3) | 11.262 ± 10.131 | 11.972 ± 8.346 | 11.084 ± 10.766 | 0,880 |
| NA (/mm3) | 6.190 ± 6.424 | 7.990 ±6.896 | 5.740 ± 6.456 | 0,545 | |
| LA (/mm3) | 3.214 ± 4.400 | 2.645 ±437 | 3.366 ± 4.973 | 0,780 | |
| PCR (mg/l) | 77,4 ± 75,41 | 48,9 ±59,6 | 84,6 ± 78,9 | 0,412 | |
| PCT (ng/ml) | 0,64 ± 0,69 | – | 0,77 ± 0,73 | 0,505 | |
| LDH (UI/l) | 939 ± 671 | 885 ±248 | 961 ± 792 | 0,857 | |
LA: linfocitos absolutos; LDH: lactato deshidrogenasa; NA: neutrófilos absolutos; PCR: proteína C reactiva; PCT: procalcitonina; RIC: rango intercuartílico; Rx: radiografía; TMP-SMX: trimetoprim-sulfametoxazol; VIH: virus de la inmunodeficiencia humana.
Los datos representados en la tabla corresponden a las características epidemiológicas de la muestra (sexo, edad, profilaxis previa con TMP-SMX), la forma de presentación de la enfermedad (fiebre, distrés respiratorio, hipoxemia) y la presentación radiológica y analítica de la enfermedad.
Los parámetros numéricos de los hallazgos analíticos (leucocitos, NA, LA, PCR, PCT, LDH), están representados en forma de media+/– DE.
Recibían profilaxis con TMP-SMX antes de desarrollar la NPJ 11/23 (47,8%) pacientes. En el subgrupo de pacientes no VIH, 10/19 (52,6%) recibían TMP-SMX profiláctico, de los que 9/10 (90,0%) presentaban LLA y 1/10 (10%) presentaba una IDP, mientras que 9/19 (47,4%) no recibían profilaxis previamente, en la mayoría de los casos (6/9; 66,7%) por ser la NPJ la forma de inicio de su enfermedad de base (4/9 IDP, 1/9 neoplasia hematológica y 1/9 síndrome hemofagocítico). Los otros 3pacientes restantes del subgrupo no VIH sin profilaxis con TMP-SMX recibían GC a dosis altas. De los pacientes con infección por VIH solo uno de los 4recibía profilaxis previamente; en los otros 3 pacientes la NPJ fue la forma de inicio de la infección por VIH.
Los signos clínicos más frecuentes al inicio fueron la dificultad respiratoria y la hipoxemia, presente en todos los pacientes. El hallazgo radiológico más frecuente fue el infiltrado intersticial bilateral (21/23; 91,3%). Los hallazgos analíticos y de las pruebas de imagen se resumen en la tabla 2.
Respecto al diagnóstico, en 22/23 (95,6%) pacientes se realizó LBA, con aislamiento positivo en 22/22 (100%). De ellas 15/22 (68,2%) muestras fueron positivas por IFD, 11/22 (50%) por PCR y 4/22 (18,2%) obtuvieron positividad en ambas técnicas. En el paciente con EMTC el diagnóstico se estableció por positividad de PCR en BAS.
Todos los pacientes recibieron tratamiento con TMP-SMX por vía intravenosa a 20mg/kg/día, con una media de un día de retraso en el inicio del tratamiento desde el comienzo de la clínica. Recibieron tratamiento con corticoides por la gravedad del cuadro 15/23 (78,3%) pacientes, con una dosis media de 2mg/kg/día y una media de 2,65 días de retraso desde el inicio de los síntomas.
Precisaron ingreso en la Unidad de Cuidados Inensivos 19/23 (82,6%) pacientes, con necesidad de ventilación mecánica en 15/19 (78,9%). Se empleó ventilación mecánica no invasiva en 4/15 (26,6%) pacientes, con una duración media de 4,5 días, 2de los cuales precisaron posteriormente intubación y soporte respiratorio con ventilación mecánica convencional. Se utilizó ventilación mecánica convencional en 13/15 (86,7%), con una duración media de 7 días, siendo preciso el inicio de ventilación oscilatoria de alta frecuencia en 8/13 (53,3%) pacientes por problemas de oxigenación, con una duración media de 3 días.
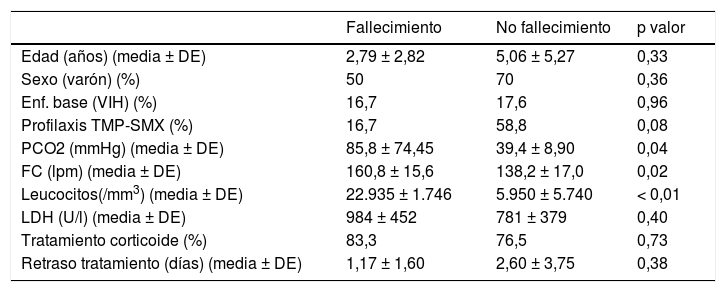
Fallecieron 6/23 pacientes (26,1%), de los que 5/6 (83,3%) eran pacientes no VIH, no siendo significativa la mayor mortalidad evidenciada en los pacientes no VIH respecto a los VIH. Los pacientes no VIH que fallecieron presentaron mayor leucocitosis, mayor retención de CO2 y mayor frecuencia cardíaca al inicio respecto a los pacientes no VIH que sobrevivieron (p < 0,05). La mortalidad en el subgrupo de pacientes no VIH fue menor en aquellos recibían profilaxis, con diferencias cercanas a la significación estadística (p = 0,08). No se encontraron diferencias en mortalidad respecto al uso o no de corticoides ni en aquellos con mayor retraso en el inicio del tratamiento. No se encontraron diferencias en la mortalidad en pacientes VIH en relación con parámetros analíticos, tratamiento con corticoides ni empleo previo de profilaxis con TMP-SMX (tabla 3).
Factores pronósticos de mortalidad
| Fallecimiento | No fallecimiento | p valor | |
|---|---|---|---|
| Edad (años) (media ± DE) | 2,79 ± 2,82 | 5,06 ± 5,27 | 0,33 |
| Sexo (varón) (%) | 50 | 70 | 0,36 |
| Enf. base (VIH) (%) | 16,7 | 17,6 | 0,96 |
| Profilaxis TMP-SMX (%) | 16,7 | 58,8 | 0,08 |
| PCO2 (mmHg) (media ± DE) | 85,8 ± 74,45 | 39,4 ± 8,90 | 0,04 |
| FC (lpm) (media ± DE) | 160,8 ± 15,6 | 138,2 ± 17,0 | 0,02 |
| Leucocitos(/mm3) (media ± DE) | 22.935 ± 1.746 | 5.950 ± 5.740 | < 0,01 |
| LDH (U/l) (media ± DE) | 984 ± 452 | 781 ± 379 | 0,40 |
| Tratamiento corticoide (%) | 83,3 | 76,5 | 0,73 |
| Retraso tratamiento (días) (media ± DE) | 1,17 ± 1,60 | 2,60 ± 3,75 | 0,38 |
DE: desviación estándar; FC: frecuencia cardíaca; LDH: lactato deshidrogenasa; PCO2: presión parcial CO2; TMP-SMX: trimetoprim-sulfametoxazol.
De forma similar a lo reportado en la literatura, nuestro estudio demuestra que, en la actualidad, los pacientes con neoplasias hematológicas constituyen el subgrupo de pacientes de mayor riesgo para desarrollar NPJ13. A bastante distancia, los pacientes con IDP constituyen el segundo grupo de riesgo, especialmente aquellos afectados de inmunodeficiencias combinadas graves, por afectación de la serie linfoide. En las inmunodeficiencias humorales, como es el caso de la ALX, pueden verse casos de NPJ durante el primer año de vida, probablemente con relación a la afectación de la maduración de los linfocitos T mediada por anticuerpos14. El descenso en la tasa de transmisión vertical del VIH y el mejor control de la infección en el recién nacido de madre VIH han conseguido que, actualmente en los países desarrollados, dicha infección haya dejado de ser el principal factor de riesgo para presentar NPJ. En nuestra serie no se han descrito casos de NPJ en pacientes VIH en los últimos 7 años.
A pesar de que las indicaciones de profilaxis frente a P. jirovecii están bien establecidas en pacientes con VIH y en pacientes oncológicos, no existen guías ni recomendaciones en este sentido en el resto de grupos de riesgo4,8,10-12,15,16. Este hecho, unido a que en muchos casos la NPJ constituye la forma de inicio de la enfermedad de base, explica que algo más de la mitad de nuestra serie no recibiese profilaxis con TMP-SMX previamente. De los 12 pacientes que no recibían profilaxis, el 75% no tenía diagnóstico previo de enfermedad predisponente, siendo la NPJ el inicio de su enfermedad de base. Los otros 3 pacientes sin profilaxis recibían GC a dosis altas (síndrome de Guillain-Barré, EMTC y síndrome hemofagocítico), no habiendo iniciado profilaxis por ausencia de recomendaciones específicas al respecto en el momento de desarrollar la enfermedad. Tal y como demuestra nuestra serie, el empleo de profilaxis antimicrobiana no elimina totalmente el riesgo de NPJ, aunque las causas son aún desconocidas.
Clásicamente, se ha descrito una evolución más rápida, con mayor distrés respiratorio y mayor hipoxemia de la NPJ en pacientes no VIH respecto a los pacientes VIH4,8,17, aunque en nuestra serie no hemos podido encontrar dichas diferencias, probablemente por el escaso tamaño muestral en el subgrupo VIH, que hace poco valorable la comparación entre ambos grupos.
Respecto al diagnóstico, todos los pacientes de nuestra serie se diagnosticaron mediante LBA, a excepción de un paciente con EMTC en el que no pudo realizarse dicha técnica por inestabilidad respiratoria, estableciéndose el diagnóstico en este caso por positividad de PCR a P. jirovecii en BAS. La mayoría de los pacientes de nuestra serie se diagnosticaron por IFD positiva, que constituye el gold standard para el diagnóstico, con una sensibilidad del 62,5%, similar a lo reportado en pacientes con VIH11. En 7/23 (30,4%) el diagnóstico se estableció por PCR cualitativa, de los que 6/7 (85,6%) eran pacientes no VIH, subgrupo de pacientes en los que se ha descrito una menor sensibilidad de la IFD por tener menor carga microbiana en las diferentes muestras respiratorias18. Además, 4/7 (57%) pacientes diagnosticados por PCR recibían profilaxis con TMP-SMX, situación que también reduce la carga microbiana y con ello la sensibilidad de la IFD.
Todos los pacientes de nuestra serie recibieron tratamiento intravenoso con TMP-SMX a 20mg/kg/día, tratamiento de primera elección en NPJ recomendado en las guías8,10,11, iniciado de forma precoz. Las recomendaciones actuales incluyen el tratamiento con prednisona oral o metilprednisolona por vía intravenosa en pacientes VIH afectados de NPJ moderada-grave, pacientes que asocien hipoxemia o aquellos que recibiesen previamente corticoides sistémicos por otro motivo, recomendándose su inicio preferiblemente en las primeras 72 h desde la instauración del tratamiento antimicrobiano8,11. A pesar de que algunos estudios han demostrado un descenso en la mortalidad con el uso de corticoides en estas indicaciones (motivo por el que se ha extrapolado la recomendación a pacientes no VIH con estos mismos criterios), en nuestra serie no hemos podido demostrar que el uso de corticoides sistémicos se asocie a un descenso en la mortalidad, probablemente por el escaso tamaño muestral global y del subgrupo de pacientes VIH, que impide realizar una comparación valorable con el subgrupo no VIH. Aunque todos los pacientes de nuestro estudio presentaban hipoxemia, y según la recomendación actual deberían haber recibido corticoides, estamos ante un estudio retrospectivo en el que la indicación de dicho tratamiento se realizó según las recomendaciones del momento histórico en el que se produjeron. En estos pacientes, la gravedad del cuadro pudo haber determinado la indicación de iniciar el tratamiento adyuvante con GC, pudiendo estar nuestros resultados sesgados por este motivo.
La mortalidad en nuestra muestra fue globalmente inferior a lo reportado en otros estudios a expensas de una mortalidad inferior al 40-50% esperable en el subgrupo de pacientes no VIH19. La mortalidad en pacientes VIH fue similar a lo reportado en la literatura8,11. El porcentaje de fallecimientos en nuestra muestra fue similar en ambos grupos, contrariamente al peor pronóstico de los pacientes no VIH previamente reportado en la literatura4,15,17. El escaso tamaño muestral y las diferencias existentes entre ambos subgrupos pueden ser las responsables de estos hallazgos. Probablemente por el mismo motivo no hemos podido encontrar diferencias en mortalidad respecto al empleo previo de profilaxis con TMP-SMX de forma global, aunque al realizar el análisis por subgrupos los pacientes no VIH que la recibían presentaron menor mortalidad respecto a aquellos que no recibían dicha profilaxis. Estas diferencias no se encontraron en pacientes VIH, pues únicamente un paciente de este grupo recibía profilaxis, presentando este paciente un desenlace favorable. En contraposición con lo publicado en la literatura4,7,16, no encontramos en nuestra muestra diferencias en mortalidad en relación con otros parámetros analíticos ni con el empleo de corticoides, ni en el análisis global de la muestra ni el análisis por subgrupos.
Los resultados de este estudio deben tomarse con cautela, dado que se trata de un estudio transversal que no permite establecer relaciones de causalidad. Otras limitaciones de nuestro estudio son su diseño retrospectivo, el pequeño tamaño muestral y las diferencias de tamaño de ambos subgrupos, situaciones que dificultan la capacidad para encontrar significación estadística y para realizar comparaciones valorables entre subgrupos, respectivamente.
En conclusión, nuestro estudio revela que la NPJ en pediatría se presenta, en el momento actual, principalmente a pacientes inmunosuprimidos no afectados de infección por VIH, a pesar incluso del empleo de profilaxis antimicrobiana. La mortalidad continúa siendo elevada, aunque inferior a lo previamente reportado, por lo que es fundamental mantener un elevado nivel de sospecha, pues el inicio precoz del tratamiento es un importante factor pronóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentaciones previas en congresos: IX Congreso de la Sociedad Española de Infectología Pediátrica, Sevilla, 2018; 66.° Congreso de la Asociación Española de Pediatría, Zaragoza, 2018.