La disfagia orofaríngea (DOF) puede resultar infradiagnosticada en determinados grupos de población pediátrica. Atender las necesidades de estos pacientes puede derivar en una sobrecarga de sus cuidadores.
ObjetivosDescribir las características epidemiológicas y clínicas de los pacientes evaluados tras la creación de una consulta monográfica de DOF (C-DOF), estudiar cambios a nivel nutricional, así como la repercusión en la calidad de vida relacionada con la salud (CVRS) de los cuidadores.
Material y métodosEstudio observacional descriptivo de los pacientes evaluados en una C-DOF desde su puesta en marcha. Para evaluar la CVRS, se diseña una encuesta ad hoc adaptada del Swallowing Quality of Life Questionnaire de población adulta.
ResultadosSe evaluaron 103 pacientes (85,4% con patología neurológica de base). Se realizó estudio videofluoroscópico a 51 pacientes (49,5%), reportando alteraciones combinadas de fases oral y faríngea un 64,7%. Existió una correlación directamente proporcional entre la gravedad de la DOF y la presencia de aspiraciones, así como con la afectación motora del paciente. En cuanto a la evaluación antropométrica, se observó mejoría en z-score de peso (+0,14 DE), de talla (+0,17 DE) y de IMC (+0,16 DE). El 46,2% de los cuidadores refirieron que la DOF interfiere negativamente en las actividades básicas de la vida diaria. El incremento en calidad de vida, tras la evaluación en la C-DOF, de forma global resultó estadísticamente significativo.
ConclusionesLa C-DOF proporciona una atención especializada, repercute positivamente en el estado nutricional de los pacientes, así como en los cambios percibidos en la CVRS, con probable impacto en los cuidadores.
Oropharyngeal dysphagia (DOF) without proper evaluation can be underdiagnosed in certain groups of the pediatric population. Meeting the needs of these patients can lead to an overload of their caregivers.
ObjectivesTo describe the epidemiological and clinical characteristics of the patients evaluated after starting a monographic DOF clinic (C-DOF) and study whether there are changes at the nutritional level, as well as the burden and impact that caregivers find on quality of life related to health (HRQOL).
Material and methodsDescriptive observational study of patients evaluated in a C-DOF from its start-up. To evaluate HRQOL, an ad hoc survey adapted from the Swallowing Quality of Life Questionnaire of the adult population was designed.
Results103 patients were evaluated, 85.4% presenting some neurological disease. A videofluoroscopic study was performed in 51 patients (49.5%), reporting combined alterations in both the oral and pharyngeal phases in 64.7% of them. There was a directly proportional correlation between the severity of the DOF and the presence of aspirations, as well as with the patient's motor impairment. Regarding the anthropometric evaluation, there was a trend toward improvement in weight z-score (+0.14 SD), height (+0.17 SD) and BMI (+0.16 SD). Out of 46.2% of the caregivers reported that the DOF problem interfered negatively in the basic activities of daily life. The increase in HRQOL, after the evaluation in the monographic DOF clinic, was statistically significant overall.
ConclusionsThe monographic DOF clinic provided specialized care, impacting positively at the nutritional status of patients, as well as perceived changes in HRQOL, with a probable impact on caregivers.
La disfagia orofaríngea (DOF) constituye un síntoma prevalente en determinados grupos de población pediátrica1, sobre todo en pacientes neurológicos. Se estima que la incidencia de la DOF en pediatría es del 1%2 y los trastornos de alimentación en un 25-45%, si bien la incidencia de DOF de forma global está aumentando3, siendo mucho mayor en poblaciones de riesgo como la parálisis cerebral, que constituye la afección neurológica más frecuente asociada a disfagia, o en los trastornos de neurodesarrollo4. Sin embargo, en muchas ocasiones resulta infradiagnosticada, pudiendo afectar de forma importante a la salud y el futuro desarrollo del niño.
En pediatría resulta difícil estandarizar métodos de cribado de disfagia objetivos no observador-dependientes. Las escalas de severidad de la disfagia son instrumentos que pretenden facilitar la valoración de los pacientes resultando útiles tanto para individualizar el abordaje como para evaluar la eficacia del tratamiento rehabilitador. Dentro de las más utilizadas se encuentran las escalas Dysphagia Outcome and Severity Scale (DOSS)5, Food Intake Level Scale (FIS)6 y Functional Oral Intake Scale (FOIS)7, todas diseñadas para población adulta. La escala FOIS facilita una visión funcional global de la severidad de la disfagia sirviendo, además, para identificar cambios en la alimentación oral en el tiempo (escalada en 7 niveles). Aunque ha sido utilizada en pacientes pediátricos8, versiones adaptadas a población infantil han sido desarrolladas recientemente9,10, que la simplifica a 5 niveles. En parálisis cerebral la escala Eating and Drinking Ability Classification System (EDACS)11 se desarrolló para facilitar la descripción de las habilidades en alimentación, según las alteraciones que presenten en seguridad y eficacia.
Los objetivos del presente estudio fueron evaluar el estado nutricional y las características clínicas de los pacientes afectos de disfagia atendidos en una consulta monográfica de DOF infantil y su evolución posterior, así como estimar el impacto en la calidad de vida relacionada con la salud de sus cuidadores.
Material y métodoEstudio descriptivo observacional de niños evaluados en la consulta monográfica de disfagia infantil en el periodo comprendido entre marzo de 2019 y marzo de 2020.
Se analizaron las siguientes variables: edad, enfermedad de base, procedencia de derivación a la consulta de disfagia y motivos de la misma, evaluación nutricional con antropometría, clasificación de la afectación motora mediante la escala Gross Motor Function Classification System (GMFCS)12, funcionalidad de la ingesta oral según la escala FOIS (se utilizaron versiones adaptadas para niños hasta los 7 años de edad)9,10, realización de videofluoroscopia (VFS) para el diagnóstico y en caso de evaluarse presencia o no de signos de disfagia (alteraciones en fase oral y/o faríngea), presencia de aspiraciones y/o penetraciones, tipo de aspiración (silente o con tos), valoración de la gravedad de la disfagia según la escala EDACS11, rehabilitación logopédica específica en centro externo, indicaciones de dispositivos externos de alimentación y evolución antropométrica durante el seguimiento.
Para el estudio antropométrico se utilizaron los estándares de la Organización Mundial de la Salud en menores de 5 años13 y los estudios españoles de crecimiento14 en el resto, siguiendo de esta manera las recomendaciones de la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) de 2017 de emplear los estándares poblacionales de referencia15. En aquellos pacientes que no pudieron tallarse en bipedestación de forma adecuada se utilizó estimación de la misma mediante la fórmula de Stevenson16 a partir de la longitud de la tibia (LT): talla=LT×3,26+30,8cm.
Se realizó VFS con fluoroscopio digital de marca Siemens modelo Luminus Fusion. Se utilizó la técnica de fluoroscopia pulsada obteniendo imágenes en movimiento en tiempo real con frecuencia de 15 pulsos por segundo (pps).
El tiempo de escopia fue controlado por un radiólogo. Se utilizaron colimadores para minimizar la radiación dispersa y el control automático de dosis de exposición. Se colocó la mesa en posición vertical y se posicionó a los pacientes sentados en silla adaptada (a 90°) o con silla de retención infantil y sistema de anclaje de tres puntos en caso necesario, con el tubo de rayos X en proyección lateral y el foco centrado en la orofaringe del paciente. Todo el procedimiento se realizó con monitorización bajo pulsioximetría continua. Se administró contraste hidrosoluble Visipaque®, en distintos volúmenes y texturas (néctar, líquido y pudin) previamente preparadas por el equipo médico. En caso de objetivar aspiración de contraste a vía aérea, no se realizó progresión de exploración con texturas más líquidas ni mayores volúmenes.
Se diseñó una encuesta ad hoc, adaptada del Swallowing Quality of Life Questionnaire de población adulta (SWAL-QoL)17,18, enviada por vía telemática a los cuidadores principales de aquellos pacientes que al menos hubieran completado 3 meses de seguimiento, tras obtener su consentimiento. La encuesta se dividió en dos partes, la primera referente a la situación previa a la evaluación en la consulta monográfica y la segunda tras ser valorado y recibir recomendaciones específicas. El SWAL-QoL evalúa la autopercepción de calidad de vida (QoL) de los pacientes con disfagia, se ha desarrollado y validado en varios idiomas, entre ellos el español18, y se ha utilizado para valorar el impacto de DOF en pacientes geriátricos, afectos de cáncer de cabeza y cuello19,20, enfermedad de Parkinson21,22, accidente cerebrovascular23 y población adulta con parálisis cerebral24. Sin embargo, en pediatría no existe todavía una herramienta específica y validada para valorar la QoL de los pacientes con DOF.
La encuesta sobre actividades básicas de la vida diaria (ABVD) (anexo) se estructuró en 20 ítems, con 5 posibles respuestas cada uno, con sistema de puntuación tipo Likert, respecto a la frecuencia de lo cuestionado (de 1 a 5, desde situación más desfavorable a más favorable), midiendo de esta forma la percepción que la persona entrevistada tenía sobre cada una de las dimensiones mencionadas. Para la evaluación, las preguntas se agruparon en 6 dominios, y se realizó una transformación posterior a una escala porcentual de 0 a 100 (a mayor puntuación, mayor calidad de vida).
Para el análisis estadístico, se utilizó el software SPSS 21 (SPSS Inc., Chicago, IL, EE.UU.). Se determinó el ajuste de las variables a la normalidad mediante el test de Shapiro-Wilk y Kolmogórov-Smirnov. Se realizó un estudio descriptivo de la muestra y de las variables con valores medios, desviación estándar, mediana y rango intercuartílico, según ajuste a un modelo normal o no. Para variables cualitativas se utilizó el test chi-cuadrado o de Fisher, y se usó la t de Student para muestras relacionadas para comparar medias, una vez comprobada la normalidad de la muestra, y la prueba de los rangos con signo de Wilcoxon en caso contrario. El análisis de correlación entre variables ordinales se realizó mediante prueba de Spearman. Se ha utilizado la prueba de Kruskal-Wallis para determinar si existen diferencias significativas entre los distintos grupos. Se han realizado comparaciones con la corrección de Bonferroni para comparaciones múltiples. Para evaluar la consistencia interna de la encuesta elaborada, se realizó estimación con el alfa de Cronbach, como medida de la intercorrelación entre los ítems que conformaban la encuesta. Un resultado alfa de Cronbach superior a 0,6 se consideró aceptable. Se consideró significativo un valor de p<0,05.
ResultadosSe evaluaron 103 pacientes, 56 varones (54,4%), siendo el 73,8% de raza caucásica y el 25,2% magrebí. Las características clínicas y procedencia de derivación de los pacientes aparecen en la tabla 1, destacando que el 85,4% de los mismos tenían patología neurológica de base (parálisis cerebral, encefalopatía epiléptica o trastornos neurodegenerativos, entre otros), y según la clasificación de la actividad motora gruesa se agrupaban la mitad de los pacientes con un GMFCS≤III, y la otra mitad con un GMFCS entre IV y V. Respecto a los dispositivos externos de alimentación, en la primera evaluación, 12 pacientes (11,6%) llevaban sonda nasogástrica (SNG), un paciente (1%) sonda nasoduodenal y 4 pacientes (4,2%) eran portadores de gastrostomía (PEG), 3 de estos con abordaje endoscópico percutáneo y un paciente se había colocado sonda mediante cirugía (junto a funduplicatura Nissen).
Características clínicas de los pacientes evaluados en C-DOF (n=103)
| N | % | |
|---|---|---|
| Sexo (H/M) | 56 / 47 | 54,4/45,6 |
| Edad primera evaluación (años, mediana, RIQ) | 4,5(1,8-9,4) | |
| Raza (caucásica/magrebí) | 76/26 | 73,8/25,2 |
| Enfermedad de base | ||
| Sano | 4 | 3,9 |
| Parálisis cerebral | 22 | 21,4 |
| Trastorno del neurodesarrollo | 8 | 7,8 |
| Trastorno neurodegenerativo | 16 | 15,5 |
| Encefalopatía epiléptica | 16 | 15,5 |
| DCA | 5 | 4,9 |
| Anomalía craneofacial | 6 | 5,8 |
| Patología cardiorrespiratoria | 3 | 2,9 |
| Prematuridad | 2 | 1,9 |
| Genopatía | 21 | 20,4 |
| Origen derivación | ||
| Atención Primaria | 3 | 2,9 |
| Atención Especializada | 89 | 86,4 |
| Gastroenterología | 41 | 46,6 |
| Neuropediatría | 19 | 21,6 |
| Cuidados Paliativos/Unidad de Pacientes Crónicos Complejos | 9 | 10,2 |
| Neumología | 5 | 5,7 |
| Rehabilitación | 4 | 4,5 |
| Otras | 10 | 11,36 |
| Otro centro | 11 | 10,7 |
| Motivo derivación | ||
| Tos con la ingesta | 38 | 36,9 |
| Dificultad expansión dieta oral | 21 | 20,4 |
| Posible síndrome aspirativo crónico | 14 | 13,6 |
| Desnutrición | 12 | 11,7 |
| Otros | 18 | 17,5 |
| GMFCS | ||
| I | 34 | 33 |
| II | 12 | 11,6 |
| III | 7 | 6,7 |
| IV | 11 | 10,7 |
| V | 39 | 37,9 |
| Infecciones respiratorias repetición (Sí/No) | 32 | 33 |
| Antropometría al diagnóstico (media±DE) | ||
| Z-score peso | -1,5±1,46 | |
| Z-score talla | -2,01±2,06 | |
| Z-score IMC | -0,73±1,49 | |
| Diferencias z-score tras seguimiento (media±DE / p valor) | ||
| Diferencia Z-score peso | 0,11±0,86 | 0,25 |
| Diferencia Z-score talla | 0,14±0,94 | 0,23 |
| Diferencia Z-score IMC | 0,06±1,06 | 0,63 |
| Tiempo seguimiento en meses (mediana, RIQ) | 6,54 (0,13-12,12) | |
| Presencia de dispositivo externo de alimentación | ||
| Primera evaluación (Sí/No) | 16 | 16,7 |
| Última evaluación (Sí/No) | 24 | 26,1 |
C-DOF: consulta de disfagia orofaríngea; DCA: daño cerebral adquirido; DE: desviación estándar; GMFCS: Gross Motor Funcional Classification System; IMC: índice de masa corporal; RIQ: rango intercuartílico.
Para la evaluación de DOF, se realizó una valoración clínica por parte del facultativo especialista, ya que no se contaba con logopeda especializada en deglución en el primer año de implantación de la consulta monográfica de DOF. Todos los pacientes completaron una evaluación anatomo-funcional oromotora y posterior observación directa de la ingesta. En aquellos casos que presentaron clínica sugestiva de disfagia, se indicó la realización de prueba instrumental (VFS).
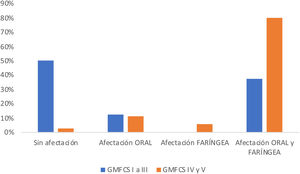
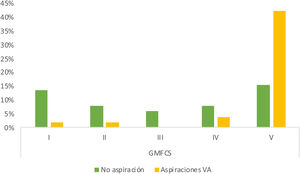
De los 103 pacientes evaluados, se realizó VFS a 51 de ellos (49,5%), resultando el 78,4% patológicas. Desglosando por fases, 7 pacientes (13,7%) presentaron afectación exclusiva de fase oral, 2 pacientes (3,9%) de fase faríngea y 34 (66,6%) tuvieron alteraciones en ambas (fig. 1). A mayor afectación motora se observó mayor proporción de pacientes con afectación simultánea de fases oral y faríngea (grupo GMFCS IV y V) de forma significativa (p=0,021). También se observó una asociación significativa entre GMFCS y la presencia de aspiraciones (p<0,05). La diferencia de prevalencia de aspiración en los niños con mayor afectación motora (grupo GMFCS IV y V) es del 52,2% más que en los niños con GMFCS≤3, significativa con un intervalo de confianza del 95% de 0,32 a 0,76. Las aspiraciones se objetivaron en un 50% de los pacientes, y de ellos hasta en el 80,8% fueron silentes (fig. 2). En los pacientes con mayor afectación motora (GMFCS IV y V) existe una diferencia media entre la frecuencia de aspiraciones silentes respecto a las encontradas en el grupo de menor afectación motora (GMFCS≤3) del 87,5%. No se detectaron desaturaciones de oxígeno <90% durante la monitorización de los procedimientos en ningún paciente. Profundizando sobre los valores obtenidos sobre las alteraciones en la seguridad detectadas, utilizando la escala Penetration Aspiration Scale (PAS), en el 21,56% de los pacientes no se objetiva entrada de material a vía aérea (PAS=1) y de estos el 36,4% tenían un GMFCS I; penetraciones a vía aérea, entendidas como una puntuación PAS entre 2 y 5, se observaron en 13 pacientes (25,5%), y aspiraciones (PAS de 6 a 8) en 27 pacientes (52,9%), en este grupo existe asociación significativa con la clasificación motora gruesa GMFCS, dado que 22/51 pacientes tenían GMFCS IV o V (ρ=0,66, p<0,05). Se ha encontrado diferencia estadísticamente significativa entre los diferentes grupos GMFCS en cuanto a la puntuación PAS categorizada (X2(4)=21,45, p<0,01). En el análisis post-hoc se han encontrado diferencias entre GMFCS I y GMFCS V (p<0,01).
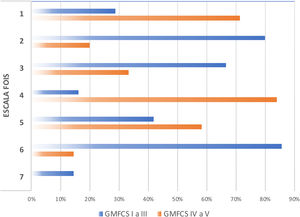
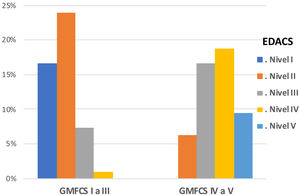
Se observó correlación alta y estadísticamente significativa entre el grado de afectación motora (GMFCS) y la gravedad de la disfagia (evaluada mediante EDACS) (ρ=0,75, p<0,05), y en este mismo sentido también se obtuvo relación estadísticamente significativa entre GMFCS y la escala funcional de ingesta (FOIS) (ρ=−0,44, p<0,05) (figs. 3 y 4). En cuanto a las escalas FOIS adaptadas a población pediátrica, no se demuestra asociación en los menores de un año con la escala FOIS-infantil y, sin embargo, sí existe correlación moderada con la versión FOIS-pediátrica (ρ=−0,34, p<0,05) y una mayor afectación motora. No se encontraron diferencias significativas entre las medianas de las escalas de severidad FOIS entre las puntuaciones obtenidas en primera valoración (Me=3) y final de seguimiento (Me=2,5) en la última visita de los pacientes (z=−1,19; p>0,05), ni en sus versiones adaptadas a población pediátrica (z=−1,23; p>0,05) ni infantil. Tampoco hubo variación en la capacidad para comer y beber según la escala EDACS (z=−0,58; p>0,05).
Valores porcentuados escala FOIS según GMFCS. FOIS: Functional Oral Intake Scale.- 1: nada por vía oral; 2: depende de dispositivo alimentación (DEA) con mínima ingesta oral; 3: DEA con ingesta oral alimento o líquido; 4: vía oral con una única consistencia; 5: vía oral con múltiples consistencias con necesidad de preparación especial o compensaciones; 6: vía oral con múltiples consistencias sin necesidad de preparación especial o compensaciones, con restricciones alimentarias; 7: vía oral sin restricciones; GMFCS: Gross Motor Funcional Classification System.
Valores porcentuados escala EDACS según GMFCS agrupado. EDACS: Eating and Drinking Ability Classification System.- Nivel I: come y bebe de forma segura y eficaz; Nivel II: come y bebe de forma segura con limitaciones de eficacia; Nivel III: come y bebe con limitaciones en eficacia y seguridad; Nivel IV: come y bebe con limitaciones significativas en seguridad; Nivel V: incapaz de comer o beber de forma segura.
De todos los pacientes evaluados, el 55,4% trabajaban con logopeda en centro externo (Atención Temprana o consultas privadas), al no contar con especialista en logopedia de deglución durante el primer año de implantación de la consulta monográfica de DOF. Tras completar evaluación con una exhaustiva observación de ingesta y la realización de VFS, en los casos seleccionados, se optimizó la adaptación de texturas y volúmenes de la dieta al 51% de los pacientes de forma individualizada (según los resultados funcionales obtenidos de seguridad y eficacia).
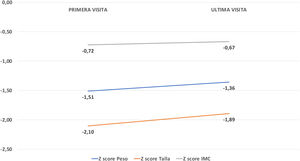
La mediana de seguimiento fue de 6,54 meses (RIQ 0,13:12,12). Se observó una mejoría en todos los parámetros antropométricos: z-score peso [(−1,5±1,46) a (−1,36±1,7), p=0,21]; z-score talla [(−2,02±2,06) a (−1,85±1,8), p=0,15] y z-score de IMC [(−0,73±1,49) a (−0,57±1,62), p=0,73] (fig. 5). En cuanto a los dispositivos externos de alimentación, se indicó colocación de gastrostomía por presentar disfagia grave no compensable a 12 pacientes (12,6%), llegando por tanto el total de pacientes portadores de PEG en la última evaluación al 16,8%; 5 dispositivos fueron retirados por buena evolución (todos ellos estuvieron con SNG previa). El 75% de las gastrostomías se colocaron vía endoscópica percutánea y el resto con abordaje quirúrgico (a un paciente se le realizó funduplicatura Nissen en el mismo acto y a otro paciente se le realizó gastroyeyunostomía).
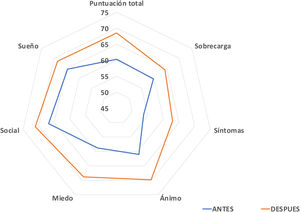
Se enviaron encuestas relacionadas con aspectos de calidad de vida a los cuidadores de 70 pacientes de la muestra. El 74,3% respondió a ambas partes y un 19% únicamente a la primera (no teniéndose en cuenta en el análisis por pares). Al 88% de los cuidadores les resultó fácil responderlo. El 61% de los encuestados objetivaron mejoría de forma global, el 4,5% no advirtió cambios, y el 34,1% percibió empeoramiento. En cuanto a la interferencia con ABVD, el 46,2% de los encuestados respondieron que el problema de DOF de sus hijos les afecta mucho o bastante, el 26,9% de los cuidadores respondieron que poco, el 19,2% que muy poco y un 7,7% refirió no encontrar interferencias llamativas. El incremento en calidad de vida de forma global resultó estadísticamente significativo [Global: 59 (RIQ 51:71) vs. 70 (RIQ 51:83,5), p=0,036]. Por subdominios, se observó mejoría en todos ellos, salvo en calidad de sueño que no se modificó: Sobrecarga familiar, 60 (RIQ 48-68) vs. 64 (RIQ 44-84), p=0,31; Síntomas: 50 (RIQ 30-70) vs. 70 (RIQ 50-80), p=0,086; Ánimo: 56,6 (RIQ 46,6-73,3) vs. 71,6 (RIQ 53,3-87,5), p=0,04; Miedo: 55 (RIQ 30-80) vs. 70 (RIQ 57,5-90), p=0,03; Esfera social: 70 (RIQ 46,2-80) vs. 80 (RIQ 48,7-100), p=0,39; Calidad de sueño: 80 (RIQ 40-100) vs. 80 (RIQ 40-100), p=0,65. En cuanto a la interferencia en las actividades de vida cotidiana, permanecieron sin cambios: 60 (RIQ 53,1-80) vs. 60 (RIQ 57,2-80), p=0,40. En la figura 6 se presentan los promedios porcentuales de cada subdominio de la encuesta de forma comparativa.
La fiabilidad de la encuesta fue muy buena, obteniéndose un coeficiente de consistencia interna (alfa de Cronbach) de 0,87 para la encuesta en su conjunto; analizando por subdominios, los valores se encontraban en un rango entre α=0,57 para el subdominio de síntomas y α=0,79 para el subdominio de estado de ánimo, lo que significa que cumplen con niveles aceptables de consistencia. La pregunta sobre la calidad de sueño de forma aislada no presentó nivel de fiabilidad suficiente (α<0,5).
DiscusiónUna correcta evaluación de los trastornos deglutorios en pediatría, mediante la utilización de técnicas instrumentales estandarizadas, y su seguimiento posterior en una consulta especializada, resultan imprescindibles para el correcto abordaje y rehabilitación de estos, disminuyendo de esta manera morbilidades que suelen acompañar a estos pacientes como la desnutrición y posibles complicaciones respiratorias.
Las características de los pacientes que se atienden en las consultas de disfagia infantil y los múltiples factores que interfieren en la adquisición de las habilidades para alimentarse hacen que el diagnóstico y el tratamiento de los problemas de alimentación sean particularmente desafiantes y complejos. La VFS es la evaluación instrumental gold standard para la valoración objetiva de la deglución25–27, tanto a nivel anatómico y funcional, ya que nos permite visualizar todas las fases de la deglución (oral, faríngea y esofágica), como para valorar la protección de la vía respiratoria2,28,29, aunque presenta variabilidad interpráctica no despreciable debido a la ausencia de protocolos debidamente estandarizados. Generalmente la tasa de exposición por segundo estándar durante la realización de VFS en pediatría es de 25-30 frames/segundo (fps), logrando identificar eventos breves de penetración y/o aspiración con una alta sensibilidad28,30. La reducción de radiación a 15fps ya ha sido valorada en otros estudios31 y, aunque controvertida, resulta una adecuada posibilidad con similar rendimiento diagnóstico a los estudios con 30fps y facilitaría además el principio de protección radiológica ALARA (as low as reasonably achievable o tan bajo como razonablemente alcanzable), disminuyendo la exposición a la radiación ionizante en niños. En cuanto al tipo de contraste, no existe uniformidad; los más utilizados son el sulfato de bario y los contrastes iodados. El bario es el principio activo más frecuentemente empleado en los estudios gastrointestinales y videofluoroscópicos. Alternativas de menor densidad como el contraste hidrosoluble isoosmolar iodixanol, como el descrito en nuestra serie, ha sido reportado previamente en la literatura25,32, resultando bien tolerado y seguro.
En un estudio realizado en una población similar al del presente estudio32 con 61 niños con DOF, se objetivaron alteraciones en la fase oral tras realización de VFS en el 50% de los pacientes, alteraciones en la fase faríngea en el 67%, y solo un 3% de los pacientes evaluados tuvieron alteraciones en la fase esofágica. Los resultados son muy similares a los obtenidos en nuestra muestra en cuanto a las alteraciones en fases oral y faríngea, que son las descritas en nuestro estudio. Hasta un 65,4% de los pacientes presentaron alteraciones en ambas fases de forma simultánea (oral y faríngea). La presencia de aspiraciones fue, al igual que en nuestro estudio, más frecuente en población con mayor afectación neurológica; similares hallazgos han sido descritos en otras series32,33. Una de las alteraciones que con frecuencia se detecta en la VFS es la penetración del alimento en la zona preepiglótica que puede ser marcador de posterior aspiración, del mismo, a la vía aérea. En un estudio34 realizado a 125 niños con sospecha de DOF, se analizaron datos tras realización de VFS, objetivándose que hasta un 81% de ellos presentaron penetración laríngea, siendo el 31% penetraciones profundas con aspiración de contenido a vía aérea finalmente en el 85% de los mismos. Los resultados obtenidos en nuestro estudio nos permiten apoyar estos datos afirmando que estas aspiraciones son más frecuentes en pacientes que tienen mayor afectación a nivel motor (según escala GMFCS), y destacando que un alto porcentaje de estas son silentes, sin activación del reflejo tusígeno o desaturación de oxígeno, por lo que un adecuado diagnóstico resulta esencial para evitar complicaciones respiratorias.
En pacientes con deterioro neurológico, como niños con parálisis cerebral, es frecuente encontrar datos de malnutrición, de origen multifactorial pero donde la presencia de DOF es una constante en grupos de mayor afectación motora. En una serie reciente con 260 niños con PCI se demuestra que el 38% presenta desnutrición y que esta prevalencia aumenta según lo hace la puntuación en la escala GMFCS35; datos similares ya han sido recogidos en otros estudios previos36. Al igual que en nuestra serie, se demuestra que tras recibir una adecuada evaluación de trastorno deglutorio y tratamiento se produce una mejoría significativa de los parámetros37, aunque se necesitarán más estudios para conocer otros factores que puedan estar influyendo.
Un estudio reciente38 analiza la percepción de las dificultades que presentan los cuidadores de pacientes con parálisis cerebral moderada-grave para desarrollar las ABVD concluyendo, en consonancia con estudios previos39, que la prevalencia de comorbilidades como DOF y gravedad del deterioro neurológico de estos pacientes merma directamente la calidad de vida de los cuidadores. Además, DOF y deterioro nutricional suelen ir de la mano, siendo sin duda otro factor que condiciona la dificultad en los cuidados40. La calidad de vida del cuidador se está convirtiendo en un componente esencial del análisis de coste/efectividad de las intervenciones en el niño con parálisis cerebral39. En la misma línea, nuestros datos parecen sustentar que una optimización del diagnóstico adecuado de DOF e inicio temprano de las recomendaciones y adaptaciones específicas de alimentación más oportunas en los pacientes puede ayudar a mejorar tanto la situación nutricional como la percepción de mejora en calidad de vida para los cuidadores.
La implantación de una consulta monográfica de DOF en nuestro hospital ha permitido facilitar el trabajo colaborativo con radiólogos, rehabilitadores, logopeda y dietista-nutricionista, dando forma a la creación de unidad multidisciplinar para el abordaje del paciente pediátrico con DOF.
En cuanto a las limitaciones, la principal debilidad de nuestro estudio es su carácter retrospectivo. Los primeros datos obtenidos sobre la encuesta pilotada sobre calidad de vida de los cuidadores presentan un nivel de fiabilidad interno bueno, a pesar del bajo tamaño muestral y la baja cantidad de ítems de algunos subdominios. Se necesitarán más estudios para poder validar la encuesta como cuestionario más robusto que mida la autopercepción de los cuidadores de pacientes pediátricos con DOF de su calidad de vida.
En conclusión, la correcta evaluación y tratamiento de la DOF pediátrica de forma objetiva resulta imprescindible para poder proporcionar a las familias recomendaciones respecto a la alimentación de los pacientes y estructurar programas de rehabilitación individualizados. Asegurar la vía de alimentación más eficaz y segura para cada paciente, buscando las compensaciones a las alteraciones deglutorias objetivadas en la evaluación cuando sea posible es primordial. Así mismo, es fundamental continuar investigando nuevas técnicas de valoración fiables que nos permitan ser más específicos en las alteraciones descritas en las fases de la deglución, así como la incorporación de personal especializado en evaluación y rehabilitación oromotora para poder abordar el tratamiento de estos pacientes de forma interdisciplinar. Por otro lado, implementar protocolos de actuación en todos los centros pediátricos que atienden a población con trastornos deglutorios sería una labor fundamental que llevaría de la mano una mejora en la calidad de vida de los pacientes y sus familiares.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.