Las complicaciones neurológicas (CN) suponen una parte importante de la morbimortalidad del postoperatorio del trasplante pediátrico de órgano sólido (TPOS).
El objetivo fue exponer la experiencia de nuestro hospital, un centro de referencia de trasplante pediátrico cardiaco, hepático y pulmonar.
Pacientes y métodosEstudio descriptivo retrospectivo de 140 pacientes receptores de TPOS en el periodo 2000-2011.
ResultadosPresentaron CN 23 pacientes receptores de TPOS (16,4% de casos), con una mediana de edad de 6 años. Las sintomatologías más frecuentes fueron: crisis epilépticas sintomáticas agudas (12 pacientes) y encefalopatía aguda (11 pacientes), seguidas por debilidad neuromuscular (4 niños), temblor (4 niños), cefalea (2 niños), dolor neuropático (2 niños) y alteraciones visuales (2 niños). Las principales etiologías de las CN fueron: neurotoxicidad de los inmunosupresores (12 casos), hipoxia-isquemia cerebral (6 casos), infecciones (2 casos), compresión mecánica de nervio periférico durante la cirugía (2 casos) y trastorno metabólico (un caso). Cinco pacientes presentaron síndrome de encefalopatía posterior reversible (SEPR). Fallecieron 7 pacientes, 4 por encefalopatía hipóxico-isquémica grave. Los pacientes con SEPR evolucionaron favorablemente.
ConclusionesLas CN que se presentan en el postoperatorio del TPOS tienen una incidencia considerable, siendo las crisis epilépticas y la encefalopatía aguda las manifestaciones más comunes. No encontramos diferencia de CN en los diferentes tipos de trasplante. La neurotoxicidad de los inmunosupresores y la hipoxia-isquemia cerebral son las principales causas de CN, teniendo un manejo y evolución diferentes. El pronóstico en la mayoría de casos es favorable, salvo en los afectados por encefalopatía hipóxico-isquémica moderada o grave.
Neurological complications (NC) are a significant cause of morbidity and mortality in paediatric patients receiving solid organ transplants. Our aim was to describe the experience of our hospital with NC in paediatric patients receiving heart, lung and liver transplants.
Patients and methodsA retrospective study was conducted on 140 paediatric patients who received a solid organ transplant during the period 2000-2011.
ResultsA total of 23 paediatric solid organ transplant recipients (16.4% of cases), with a median age of 6 years, had NC. The symptoms were, in order of frequency: acute symptomatic seizures (12 patients); acute encephalopathy (11 patients); neuromuscular weakness (4 children), tremor (4 children), headache (2 children), neuropathic pain (2 children), and visual disturbances (2 children). The aetiologies of NC were: the neurotoxicity of the immunosuppressive drugs (12 patients), post-hypoxic-ischaemic encephalopathy (6 patients), infections (2 cases), mechanical compression of peripheral nerve during surgery (2 cases), and a metabolic complication (1 case). The five patients who met the criteria of posterior reversible encephalopathy syndrome had a favourable outcome. Seven patients died, four of them due to hypoxic-ischaemic encephalopathy.
ConclusionsNC are common in paediatric patients receiving heart, liver, lung, and renal transplants, with acute symptomatic seizures and acute encephalopathy being the most common clinical signs. No differences were found in the NC with the different types of transplants. Neurotoxicity of the immunosuppressive drugs and hypoxic-ischaemic encephalopathy were the main causes of NC, having different management and outcomes. The prognosis was favourable in most of the patients, except for those who had moderate or severe post-hypoxic-ischaemic damage.
El desarrollo de los trasplantes de órganos sólidos ha supuesto un importante avance en la terapéutica de determinadas enfermedades hepáticas, pulmonares, cardiacas y renales que ha permitido mejorar la supervivencia y la calidad de vida de muchos pacientes pediátricos y adultos1. Entre los problemas médicos que se presentan tras el trasplante pediátrico de órganos sólidos (TPOS), destacan las complicaciones neurológicas (CN) por su incidencia elevada y la morbimortalidad que suponen. Se han publicado muchos estudios acerca de las CN después del trasplante de órgano sólido en el adulto2–4, sin embargo la literatura sobre este tema en la población pediátrica es escasa1,5–7.
La incidencia de CN –tanto en adultos como en niños– en los trasplantes hepático, pulmonar y cardiaco muestra un rango muy amplio en los diferentes estudios, oscilando desde el 8 al 75% en el trasplante hepático1,8,9, del 30 al 68% en el pulmonar10 y del 3 al 48% en el trasplante cardiaco4,11,12.
Los factores etiológicos de las CN tras el TPOS más frecuentemente implicados son: la neurotoxicidad de los inmunosupresores, fundamentalmente tacrolimus y ciclosporina13, las infecciones, y las alteraciones metabólicas, hidroelectrolíticas y hemodinámicas8,12. El espectro clínico de las CN postrasplante incluye la encefalopatía, las crisis epilépticas (CE), los trastornos del movimiento, los desórdenes neuromusculares y los síntomas neuropsiquiátricos. Una de las entidades más frecuentes y características es el síndrome de encefalopatía posterior reversible (SEPR), cuadro clínico-radiológico descrito por Hinchey et al.14 en 1996 relacionado directamente con el tratamiento inmunosupresor. La mayoría de las CN se presentan en los 3 primeros meses postrasplante15.
El tratamiento de estas CN es etiológico y sintomático, sustituyendo o modificando dosis de los fármacos inmunosupresores, corregir las alteraciones metabólicas e hidroelectrolíticas o tratar las crisis epilépticas, según se precise16.
El pronóstico de las CN después del TPOS está condicionado fundamentalmente por su etiología, siendo en muchos casos favorable a largo plazo. Varios trabajos, como el de Zivkovic et al.15, han descrito una menor frecuencia de CN en niños que en adultos, pero una mayor gravedad de estas17. Revisamos de forma retrospectiva 140 pacientes receptores de TPOS (hepático, pulmonar y cardiaco) para evaluar la incidencia de las CN en el periodo postrasplante, su etiología, tratamiento y evolución.
Pacientes y métodosSe revisaron todos los pacientes menores de 14 años que recibieron TPOS –corazón, pulmón, hígado o combinado– en nuestro centro, hospital de referencia para este tipo de procedimientos, desde enero de 2000 a junio de 2011. De los 140 pacientes pediátricos trasplantados, 23 individuos presentaron alguna CN postrasplante. Se registraron los siguientes datos: edad, sexo, indicación del trasplante, órgano trasplantado, inmunosupresión y características de la CN: presentación, etiología, tratamiento y evolución.
Todas las alteraciones neurológicas aparecidas después del trasplante fueron evaluadas por un neuropediatra. Se diagnosticó de SEPR al paciente con clínica y neuroimagen compatibles de acuerdo a los criterios sugeridos por Hinchey et al.14: cuadro agudo o subagudo de alteraciones del nivel de conciencia, CE, temblor y/o alteraciones visuales, con alteraciones de la intensidad de señal en sustancia blanca cortico-subcortical y regiones vasculares frontera de predominio posterior en la RM craneal en secuencias T2 y FLAIR.
Los datos se obtuvieron de la revisión de las historias clínicas de los casos y se obtuvieron estadísticas descriptivas de cada variable. Se realizó análisis estadístico empleando la prueba estadística Chi-cuadrado para comparar la incidencia de las CN en los distintos tipos de TPOS.
ResultadosEn el periodo analizado (enero de 2000-junio de 2011) se realizaron en nuestro centro 140 TPOS incluyendo trasplante hepático, pulmonar, cardiaco y hepático-pulmonar.
La valoración neurológica previa al trasplante estuvo en límites normales en todos los pacientes que presentaron CN salvo en un paciente diagnosticado de un error congénito del metabolismo del ciclo de la urea, déficit de ornitintranscarbamilasa, que había presentado episodios recurrentes de hiperamoniemia antes del trasplante hepático y mostraba, como secuelas, un retraso psicomotor y un síndrome cerebeloso leves.
Los trasplantes y sus cuidados postoperatorios fueron realizados mediante técnicas y procedimientos convencionales en todos los pacientes. Los inmunosupresores empleados para el manejo postrasplante fueron: tacrolimus, micofenolato y corticoides, utilizándose específicamente basiliximab en el trasplante cardiaco. Se emplearon ciclosporina y everolimus como fármacos de segunda línea.
Como exámenes complementarios se emplearon: determinación de niveles séricos de inmunosupresores, electroencefalograma (EEG), electroneurograma (ENG), electromiograma (EMG) y RM craneal empleando secuencias T1, T2, FLAIR y de difusión para evaluar el coeficiente de difusión aparente cuando se estimaron clínicamente indicados.
Las CN se presentaron en 23 pacientes (16,4% de los casos), 13 varones y 10 mujeres, con una mediana de edad de 6 años. Se distribuyeron por órgano trasplantado de la siguiente manera: 14 pacientes con CN de 85 receptores de trasplante hepático (16,4%), 4/27 (14,8%) receptores de trasplante pulmonar, 4/27 (14,8%) receptores de trasplante cardiaco y 1/1 (100%) receptor de trasplante hepático-pulmonar.
Las enfermedades de base que motivaron la realización de los TPOS se presentan en la tabla 1.
Enfermedad de base de los pacientes que desarrollaron CN
| Tipo de trasplante | Indicaciones | Número |
| Hepático | Atresia de vías biliares extrahepática | 7 |
| Cirrosis criptogénica | 2 | |
| Colestasis neonatal idiopática | 1 | |
| Enfermedad de Wilson | 1 | |
| Colestasis intrahepática familiar | 1 | |
| Déficit de ornitintranscarbamilasa | 1 | |
| Enfermedad de Caroli | 1 | |
| Bipulmonar | Fibrosis quística | 3 |
| Síndrome bronquiectásico no filiado | 1 | |
| Cardiaco | Miocardiopatía dilatada | 2 |
| Cardiopatía congénita malformativa compleja | 2 | |
| Hepático-pulmonar | Fibrosis quística | 1 |
Las sintomatologías más frecuentes fueron (tabla 2): CE sintomáticas agudas (12 casos) y encefalopatía aguda (11 casos), seguido por debilidad neuromuscular (4 casos), temblor (4 casos), cefalea (2 casos), dolor neuropático (2 casos) y alteraciones visuales (2 casos). Las CN tras el TPOS aparecieron en los 2 primeros meses postrasplante (tabla 3).
Manifestaciones clínicas de las CN postrasplante
| Síntomas | Grupo etiológico | Número de pacientes |
| Crisis epilépticas sintomáticas agudas (parciales/generalizadas) | Total | 12 (7/5) |
| Inmunosupresor (SEPR) | 8 (4) | |
| Hipoxia-isquemia | 2 | |
| Origen infeccioso | 1 | |
| Origen metabólico | 1 | |
| Encefalopatía aguda | Total | 11 |
| Inmunosupresor (SEPR) | 4 (4) | |
| Hipoxia-isquemia | 6 | |
| Origen infeccioso | 1 | |
| Temblor | Inmunosupresor (SEPR) | 4 (2) |
| Debilidad neuromuscular | Total | 4 |
| DNMPC | 2 | |
| Compresión durante cirugía | 2 | |
| Cefalea | SEPR | 2 |
| Alteraciones visuales (visión borrosa, ceguera) | SEPR | 2 |
CN: complicaciones neurológicas;DNMPC: debilidad neuromuscular del paciente crítico; SEPR: síndrome de encefalopatía posterior reversible.
Complicaciones neurológicas postrasplante de órgano sólido
| Trasplante/edad (años)/indicación | Síntomas (+ día de crisis) | Diagnóstico/etiología | Tratamiento y evolución | |
| 1 | Hepático-Bipulm./13/FQ | CTCG (4 episodios + 40 a 46) | CE sintomática aguda/toxicidad por FK | Ajuste de dosis de FK. VPA durante 3 meses, libre de crisis |
| 2 | Bipulm./13/FQ | Coma | EHI grave/hipoxia-isquemia | Éxitus |
| 3 | Bipulm./9/S. bronquiectásico no filiado | Coma | EHI grave/hipoxia-isquemia | Éxitus |
| 4 | Bipulm./12/FQ | Dolor neuropático ciático | Neuropatía ciática/compresión durante cirugía | Gabapentina. Evolución favorable |
| 5 | Bipulm./11/FQ | Paresia musculatura extensora miembro inferior | Neuropatía ciático poplíteo externo/compresión durante cirugía, inmovilización | Rehabilitador. Evolución favorable |
| 6 | Hepático/3 m/colestasis neonatal idiopática | Debilidad generalizada, predominio distal | NdPC/multifactorial (relajantes neuromusculares, corticoides, inmovilización) | Rehabilitador. Evolución favorable. Éxitus a los 7 meses por disfunción hepática |
| 7 | Hepático/9/cirrosis criptogénica | Dos CE parciales complejas (+20). Ceguera. Cefalea | SEPR/toxicidad por FK | Ajuste de dosis FK. Tratamiento con fenitoína durante 10 días, libre de crisis |
| 8 | Hepático/10/Wilson | 1) Debilidad generalizada | 1) NdPC; y 2) Temblor postural y de acción: 1) Multifactorial (relajantes neuromusculares, corticoides, inmovilización); 2) Toxicidad por FK | Rehabilitador |
| 2) Temblor postural | Ajuste de dosis de FK | |||
| 9 | Hepático/2/AVBE | Letargia | EHI moderada/hipoxia-isquemia | Evolución con retraso madurativo. Éxitus a los 5 años por hepatopatía |
| 10 | Hepático/16 m/AVBE | CTCG (día +15) | CE sintomática aguda/sepsis bacteriana | Antibiótico. BZD durante 2 semanas, libre de crisis |
| 11 | Hepático/7 m/AVBE | CTCG (+6) | CE sintomática aguda/hipoxia-isquemia | Fenitoína y BZD. Éxitus día +13 por disfunción hepática |
| 12 | Hepático/5 m/AVBE | Coma | EHI grave/hipoxia-isquemia | Éxitus |
| 13 | Hepático/5 m/AVBE | CE parciales (+6) | CE sintomáticas agudas/encefalopatía hepática e hipoxia-isquemia | Control de las CE con BZD y fenitoína. Éxitus día +21 por disfunción hepática |
| 14 | Hepático/4 m/cirrosis | CE parciales (+30) | CE sintomáticas agudas/toxicidad por FK | LVT durante 2 meses. Libre de crisis |
| 15 | Hepático/13/AVBE | Temblor postural y de acción distal | Temblor postural y de acción/toxicidad por FK | Ajuste de dosis de FK. Evolución favorable |
| 16 | Hepático/2/colestasis intrahepática familiar | Fiebre | Encefalitis/infecciosa | Antibiótico y antiviral. |
| Letargia | Evolución favorable | |||
| 17 | Hepát/23 m/Déficit de OTC | CE parciales (en postoperatorio inmediato y tardío). Letargia | CE sintomáticas agudas/toxicidad por FK-vascular | LVT hasta actualidad. Encefalopatía secuelar con trastorno motor y cognitivo (también previo) |
| 18 | Hepático/11/AVBE | CE generalizadas (+5 y 6) | CE sintomáticas agudas/toxicidad por FK | LVT durante un mes, hasta la actualidad |
| 19 | Hepático/10/Caroli | CE parciales (+2 y 3) | SEPR/toxicidad por FK | Retirada transitoria de FK. LVT durante 2 meses |
| 20 | Cardiaco/19 m/CCC | Letargia, temblor | SEPR/toxicidad por FK | Ajuste de dosis de FK. Evolución favorable |
| 21 | Cardiaco/9/CCC | Letargia, temblor, visión borrosa, CE parciales (+3) | SEPR/toxicidad por FK hipomagnesemia | LVT durante 6 meses. Evolución favorable |
| 22 | Cardiaco/9/MCD | Cefalea, letargia/CE parcial (+2) | SEPR/toxicidad por FK | Ajuste de dosis de FK |
| 23 | Cardiaco/3/MCD | CTCG (día +0) | CE sintomática aguda/toxicidad por FK | Ajuste de dosis de FK |
AVBE: atresia de vías biliares extrahepática; Bipulm.: bipulmonar; BZD: benzodiacepinas; CCC: cardiopatía congénita compleja; CTCG: crisis tónico-clónica generalizada; NdPC: neuropatía del paciente crítico; FK: tacrolimus; FQ: fibrosis quística; LVT: levetiracetam; MCD: miocardiopatía dilatada; OTC: ornitintranscarbamilasa; SEPR: síndrome de encefalopatía posterior reversible; Tisq: tiempo de isquemia del injerto.
Según su etiología se clasificaron como:
CN relacionadas con el tratamiento inmunosupresor, que aparecieron en 12 pacientes. Todos estos pacientes estaban recibiendo tratamiento con tacrolimus como inmunosupresor.
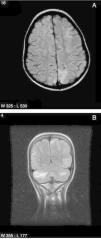
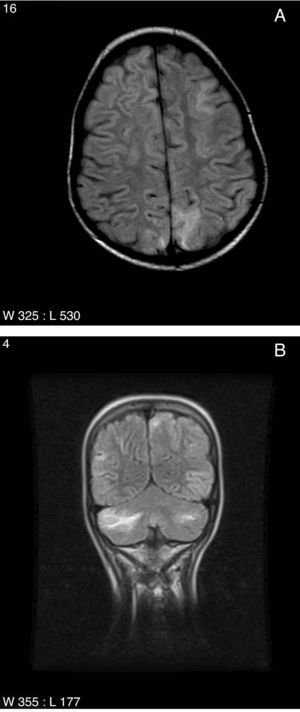
En 5 pacientes, las manifestaciones neurológicas cumplieron criterios de SEPR. En estos la sintomatología predominante consistió en: CE parciales (4 individuos), encefalopatía leve (4 individuos), cefalea (2 casos), temblor (2 casos) y alteraciones visuales (2 casos, uno visión borrosa y otro ceguera transitoria), desapareciendo progresivamente la sintomatología en las primeras 4 semanas de evolución. En un caso se detectó hipomagnesemia como factor predisponente. No se detectaron alteraciones significativas de la presión arterial ni de los niveles sanguíneos de tacrolimus en ningún paciente. En los estudios de RM craneal (fig. 1) se encontraron alteraciones de la intensidad de la señal de la sustancia blanca, mostrando en la secuencia FLAIR lesiones córtico-subcorticales fundamentalmente en lóbulos occipitales y parietales y, menos frecuentes, en lóbulos frontales y en cerebelo sugerentes, según el resultado del cálculo del coeficiente de difusión aparente en la difusión, de edema vasogénico. En el EEG, 3 pacientes presentaron actividad fundamental enlentecida para la edad y 2 pacientes actividad paroxística focal (punta-onda de localización parieto-occipital). Dos pacientes se trataron con levetiracetam de manera transitoria. Los controles posteriores de EEG fueron normales en todos los casos.
A) Resonancia magnética, imagen axial en secuencia FLAIR. Alteración de la intensidad de señal córtico-subcortical de localización occipital bilateral y frontal izquierda en territorio vascular frontera, características del SEPR. B) Resonancia magnética, imagen coronal en secuencia FLAIR. Múltiples hiperintensidades córtico-subcorticales en ambos hemisferios cerebelosos, y en áreas córtico-subcorticales parietal y temporal izquierdas compatibles con SEPR.
Otros 5 pacientes presentaron CE sintomáticas agudas, 2 crisis focales y 3 crisis generalizadas tónico-clónicas. En estos casos, el tacrolimus se redujo o retiró transitoriamente, y 4 casos recibieron tratamiento con ácido valproico o levetiracetam. Se suspendió el tratamiento antiepiléptico entre los 2 y 6 meses, permaneciendo todos los pacientes libres de CE posteriormente. Estas manifestaciones se asociaron a la toxicidad por inmunosupresor sin poder encuadrarse en un SEPR.
Otra manifestación relacionada con los inmunosupresores fue un intenso temblor postural de las manos que presentaron 2 casos, desapareciendo con la disminución de la dosis de tacrolimus.
El segundo grupo etiológico en frecuencia fue el de las CN relacionadas con episodios hipóxico-isquémicos agudos acontecidos en el postoperatorio inmediato y relacionados con el complejo manejo hemodinámico de estos pacientes, que se presentaron en 6 individuos con encefalopatía, con CE asociadas en 2 de ellos. Tres pacientes presentaron en el postoperatorio precoz una encefalopatía hipóxico-isquémica muy grave a pesar de la buena función del injerto y fallecieron. Un caso presentó una encefalopatía hipóxico-isquémica moderada, con evolución a retraso madurativo moderado y falleció por fallo del injerto a los 3 años postrasplante. Una paciente mostró una encefalopatía aguda grave y CE, encontrándose lesiones hipóxico-isquémicas en la neuroimagen y detectándose una hiperamoniemia severa en el contexto de un rechazo hepático agudo. La paciente falleció al mes postrasplante por fallo del injerto. Otro paciente presentó una encefalopatía moderada y CE de origen hipóxico-isquémico, evolucionando a un retraso madurativo leve-moderado y permaneciendo libre de crisis en tratamiento con levetiracetam.
En 4 pacientes aparecieron CN que manifestaron signos de disfunción del sistema nervioso periférico: 2 casos se diagnosticaron de una polineuropatía del paciente crítico dado que presentaron una debilidad generalizada más acentuada distal acompañada de hiporreflexia universal, inicialmente manifestada por intentos fallidos de retirada de la ventilación mecánica y con un EMG/ENG compatibles con polineuropatía desmielinizante. Recibieron tratamiento rehabilitador y de forma lentamente progresiva se recuperaron hasta la normalidad. En los otros 2 casos la sintomatología inmediata al postoperatorio fue de dolor en un miembro inferior y debilidad de los territorios de los nervios ciático y ciático poplíteo externo atribuidos a compresión mecánica de nervio periférico durante la cirugía. Ambos pacientes recibieron un trasplante bipulmonar y habían sido sometidos durante la intervención a un vendaje de los miembros inferiores como medida preventiva de la trombosis venosa profunda. Recibieron tratamiento rehabilitador y gabapentina para el dolor neuropático, evolucionando favorablemente.
Las CN relacionadas con infecciones se presentaron en 2 casos. Un paciente presentó una crisis tónico-clónica generalizada durante una sepsis de origen bacteriano, sin otra etiología aparente de la CE, y el otro presentó fiebre junto a una encefalopatía aguda leve-moderada con pleocitosis linfocitaria en el líquido cefalorraquídeo y un estudio de neuroimagen normal, compatible con encefalitis de presumible origen viral, no identificándose el agente etiológico. Ambos pacientes tuvieron una evolución favorable.
Al comparar la incidencia de CN en los diferentes tipos de trasplante no se observaron diferencias significativas (χ2=0,3969, con p=0,82).
DiscusiónLas CN suponen una parte importante de la morbimortalidad del postoperatorio del TPOS. Existe un importante número de estudios que analizan las CN en pacientes adultos receptores de trasplantes de órganos sólidos1,10,12, sin embargo, hay pocos trabajos que analicen estas CN en niños1,5–7. Respecto a las diferencias con las series de adultos destaca en primer lugar la indicación del trasplante o enfermedad de base que motiva la realización del trasplante, que posiblemente condicione al menos en cierto modo el desarrollo y evolución de las CN. La enfermedad más frecuente en nuestros pacientes trasplantados hepáticos, al igual que en otras series pediátricas, es la atresia de vías biliares extrahepática, mientras que las afecciones más habituales en adultos son la enfermedad hepática alcohólica, la cirrosis biliar primaria y las hepatopatías virales2,7,18. En nuestra serie, las cardiopatías congénitas y la miocardiopatía dilatada son las causas de trasplantes cardiacos pediátricos, a diferencia de la principal causa en el adulto, la cardiopatía isquémica. La enfermedad de base de los trasplantados pulmonares en nuestro centro, al igual que en otras series pediátricas y del adulto, es la fibrosis quística. Otros factores diferenciadores descritos en la literatura respecto al adulto que influyen en el desarrollo y la evolución de las CN, son una menor inmunidad adquirida en el niño y la mayor vulnerabilidad de un cerebro en desarrollo15,17.
En los estudios previamente publicados que analizan las CN tras el TPOS, la frecuencia de estas es muy variable, desde el 3% al 75%1,17. Un rango tan amplio de incidencia puede deberse al tratarse de trabajos separados por más de una década a la influencia de múltiples factores, como los avances que se han producido en la preservación de los órganos, las técnicas quirúrgicas, el manejo perioperatorio y los tratamientos inmunosupresores. En nuestro centro desarrollaron CN el 16,4% de los pacientes, una frecuencia relativamente baja comparando con otras series pediátricas como la de Erol et al.1 con un 35%5,6,18, teniendo unas indicaciones parecidos. Esta incidencia es similar para pacientes receptores de trasplantes hepático, cardiaco y pulmonar. Estadísticamente, no encontramos diferencias significativas en la frecuencia de CN según el órgano trasplantado al igual que en otras series publicadas19, sin embargo es destacable que 3 de los 5 casos de SEPR se presentaron en trasplantados cardiacos, una incidencia superior a la acontecida en otros tipos de trasplantes, probablemente en relación con la mayor frecuencia de complicaciones hemodinámicas que se presentan en este tipo de trasplante.
Respecto a las etiologías de las CN, la más frecuente es la neurotoxicidad de los inmunosupresores.
Entre los pacientes con manifestaciones asociadas a la toxicidad del inmunosupresor, 5 casos se clasificaron como SEPR cumpliendo los criterios clínicos-radiológicos propuestos por Hincheyet al.14. En ellos, no se detectaron alteraciones en los niveles del inmunosupresor. Esta entidad con frecuencia se presenta como reacción idiosincrásica al tratamiento con inhibidores de la calcineurina, independientemente de los niveles sanguíneos del fármaco13,20. Tampoco se detectaron alteraciones en la presión arterial ni hidroelectrolíticas, factores involucrados en la patogenia del SEPR. Únicamente en un caso se detectó una hipomagnesemia, probablemente relacionada también con el tratamiento con tacrolimus21–23. Las lesiones cerebrales en los estudios de RM craneal se localizaron con mayor frecuencia en lóbulos occipitales y parietales, si bien encontramos también lesiones cerebrales anteriores, en áreas vasculares frontera de territorios de arteria cerebral anterior y media, y en cerebelo. Respecto al pronóstico, el empleo de la secuencia de difusión y la medida del coeficiente de difusión aparente es de utilidad pronóstica, ya que un coeficiente elevado en un área con alteración de la intensidad de la señal se correlaciona con edema vasogénico potencialmente reversible, mientras que el cociente de difusión bajo indica edema citotóxico e irreversibilidad16,24,25. La evolución en todos nuestros pacientes fue muy favorable desapareciendo la sintomatología y las lesiones en la RM en los meses posteriores como corresponde a este síndrome que cursa habitualmente con buen pronóstico26,27.
En nuestra serie, las manifestaciones clínicas más frecuentes fueron las CE sintomáticas agudas (52% del total de CN), en contexto de SEPR o no1,8. Ante un paciente pediátrico trasplantado que presenta CE debe realizarse un exhaustivo diagnóstico diferencial considerando un amplio abanico de causas (metabólicas, tóxicas, hipoxia-isquemia, vasculares e infecciosas, entre otras), si bien en un número considerable de casos el origen no puede ser atribuido a un único factor, como sucedió en algunos de nuestros pacientes15,28,29. En general, cuando las CE se relacionan con la toxicidad de los inmunosupresores, el pronóstico es muy favorable. En nuestra serie se instauró tratamiento antiepiléptico en 6 pacientes, con levetiracetam en 5 individuos y con ácido valproico en uno, y en todos ellos se pudo retirar el tratamiento posteriormente. Consideramos el levetiracetam una buena opción terapéutica ya que presenta un bajo número de interacciones con otros fármacos y su aclaramiento no se modifica en la insuficiencia hepática30. En nuestra serie, la cefalea y el temblor aparecieron como síntomas aislados atribuibles a la terapia inmunosupresora con inhibidores calcineurínicos. Estos síntomas son considerados efectos neurotóxicos menores de estos agentes5,31 y son corregibles con el ajuste o sustitución del inmunosupresor.
La encefalopatía pos-hipóxico-isquémica fue la CN de peor pronóstico en nuestra serie. Cuatro pacientes fallecieron en los primeros días postrasplante y 2 pacientes desarrollaron un retraso motor y cognitivo moderado, en contraste con la evolución de los pacientes que presentaron una encefalopatía por SEPR9,32,33. Un paciente desarrolló una epilepsia parcial que fue tratada con levetiracetam manteniéndose libre de crisis.
Las crisis epilépticas y la encefalopatía aguda son las manifestaciones clínicas más comunes de las CN. Ambas son las formas de presentación tanto de la neurotoxicidad de los inmunosupresores como de la hipoxia-isquemia cerebral, siendo estas a su vez las causas de CN más frecuentes. Este diagnóstico diferencial es importante de cara al manejo del paciente y del pronóstico. Respecto al manejo, en los casos en que se sospecha que la causa es la neurotoxicidad de los inmunosupresores, se procede a sustituir el fármaco o modificar sus dosis, descartar posibles alteraciones hemodinámicas e hidroelectrolíticas que favorecen la toxicidad, como la hipertensión arterial o la hipomagnesemia y tratar las crisis epilépticas según se precise. Respecto al pronóstico, suele ser favorable en los pacientes con CN relacionadas con la neurotoxicidad de los inmunosupresores y desfavorable en el daño cerebral pos-hipoxia-isquemia. En las CE que aparecen en el postrasplante suele ser posible la retirada precoz del tratamiento antiepiléptico salvo en las que cursan con lesiones pos-hipoxia-isquemia15,34.
Respecto a las CN que manifestaron signos de disfunción del sistema nervioso periférico, la debilidad neuromuscular del paciente crítico es una de las CN clásicas en el postoperatorio del TPOS, como ocurrió en 2 pacientes de nuestra serie. Habitualmente se manifiesta con fracaso en la retirada de la ventilación asistida. Su etiología es multifactorial: la inmovilización prolongada, el síndrome de respuesta inflamatoria sistémica, el empleo prolongado de relajantes musculares no depolarizantes y de corticoides. Puede cursar con miopatía, polineuropatía, o una combinación de ambas. El EMG/ENG confirmó una polineuropatía en nuestros casos, siendo este estudio generalmente de utilidad diagnóstica e interés pronóstico a partir de la tercera semana de evolución, ya que puede estimar el potencial de reinervación35. El tratamiento incluye limitar en lo posible los agentes causales, la rehabilitación y en ocasiones tratar el dolor neuropático acompañante. La recuperación no siempre es completa2,36.
Las CN asociadas a infecciones sistémicas del paciente trasplantado tuvieron una evolución favorable en nuestros 2 casos. Su pronóstico depende de la gravedad de la infección28,29.
Desde el punto de vista pronóstico, en comparación con los adultos, algunos autores como Zivkovic et al.15 afirman que las CN son menos frecuentes, pero más graves en los niños17,18. En nuestra serie, con una relativa baja frecuencia de CN en comparación con otras series de la literatura, el pronóstico de las CN tras un TPOS fue favorable salvo en aquellos pacientes con daño cerebral pos-hipoxia-isquemia grave.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.