El tejido adiposo blanco (TAB) subcutáneo (Sc) humano podría variar dependiendo de su localización anatómica, con diferencias en su perfil proteómico.
Pacientes y métodosSe obtuvieron aspirados de TAB-Sc de 6 mujeres con IMC>25kg/m2, a las que se les había realizado una liposucción. Dicho TAB-Sc se obtuvo de 6 localizaciones anatómicas: abdominal superior e inferior, muslo, dorsal, flanco y cadera, analizándose su perfil proteómico mediante electroforesis bidimensional. En muslo y abdomen superior se compararon, además, las muestras obtenidas de las 2 capas del TAB-Sc (profunda y superficial).
ResultadosSe detectaron 21 proteínas que mostraban una intensidad de expresión diferente entre las 6 localizaciones anatómicas y 14 entre las capas superficial y profunda de una misma región. Entre las proteínas identificadas se incluyen: vimentina (proteína estructural); proteínas heat shock (HSP), superóxido-dismutasa (estrés/chaperoninas); proteína fijadora de ácidos grasos 4 (FABP-4) y α-enolasa (metabolismo lipídico y de los hidratos de carbono, respectivamente) y ATP-sintetasa (producción de energía). Entre las regiones estudiadas, el TAB-Sc dorsal mostraba un perfil proteómico particular, con menor expresión de proteínas implicadas en la producción de energía y metabolismo (ATP-sintetasa, alfa-enolasa, HSP y FABP-4) que el resto de regiones.
ConclusionesLos niveles de expresión de diversas proteínas en el TAB-Sc humano no son homogéneos, difiriendo entre localizaciones anatómicas. Esto señala la existencia de diferencias funcionales en el TAB-Sc de acuerdo con su localización anatómica, lo que debe considerarse antes de asumir la extrapolación de los datos derivados del TAB-Sc de una determinada localización al de otras partes de la anatomía.
Human subcutaneous (SQ) white adipose tissue (WAT) can vary according to its anatomical location, with subsequent differences in its proteomic profile.
Patients and methodsSQ-WAT aspirates were obtained from six overweight (BMI>25kg/m2) women who underwent extensive liposuction. SQ-WAT was removed from six different locations (upper abdominal, lower abdominal, thigh, back, flank, and hip), and the protein profiles were determined by two-dimensional gel electrophoresis. In addition, the proteomic profiles of upper abdominal and hip SQ-WAT were subjected to further analysis, comparing samples obtained from two layers of WAT (deep and superficial).
ResultsTwenty one protein spots showed differential intensities among the six defined anatomical locations, and 14 between the superficial and the deep layer. Among the proteins identified were, vimentin (structural protein), heat-shock proteins (HSPs), superoxide-dismutase (stress-resistance/chaperones), fatty-acid-binding protein (FABP) 4, and alpha-enolase (lipid and carbohydrate metabolism), and ATP-synthase (energy production). Among the WAT samples analyzed, the back sub-depot showed significant differences in the levels of selected proteins when compared to the other locations, with lower level of expression of several proteins involved in energy production and metabolism (ATP-synthase, alpha-enolase, HSPs and FABP-4).
ConclusionsThe levels of several proteins in human SQ-WAT are not homogeneous between different WAT depots. These changes suggest the existence of inherent functional differences in subcutaneous fat depending upon its anatomical location. Thus, caution must be used when extrapolating data from one subcutaneous WAT region to other depots.
El tejido adiposo blanco (TAB) es complejo, existiendo diferencias fisiológicas entre sus distintos depósitos1,2. Entre ellos, el subcutáneo (Sc) es fisiológicamente trascendental, por ser el mayor, cuantitativamente3, y por su secreción de adipocinas, cuyo perfil varía influido por su ubicación1.
Se han comunicado diferencias estructurales y funcionales en el TAB, de acuerdo con su localización, en composición celular, vascularización y drenaje linfático, con repercusión funcional sobre aquel4–6. La constatación de estas diferencias ha conducido al postulado de la existencia de diferentes «órganos adiposos» de acuerdo con su localización7, con particularidades tanto anatómicas como funcionales, incluyendo gran variabilidad en su producción hormonal8. La mayor parte de los estudios se centran en las diferencias existentes entre el TAB visceral (Vis) y el TAB-Sc, con información limitada respecto a las eventuales diferencias entre distintos «subdepósitos» del TAB-Sc según su localización anatómica. Además, se distinguen 2 capas en el TAB-Sc, superficial (TAB-Sc-S) y profunda (TAB-Sc-P), con características estructurales y funcionales diferentes2,9 y, la última, con similitudes en su perfil de expresión proteómico con el TAB-Vis en el hombre10 y con una tasa lipolítica menor que la del TAB-Sc-S2. La estructura y consistencia del sistema fascial superficial, que separa ambas capas, también varía entre las distintas partes del cuerpo11.
Debido a la evidencia de diferencias estructurales y funcionales regionales en el TAB-Sc, se podría hipotetizar sobre la existencia de variaciones en los niveles de expresión de proteínas en el TAB-Sc humano de acuerdo con su localización anatómica y disposición en profundidad. En este estudio descriptivo empleamos la electroforesis bidimensional (2 DE), previamente usada para el aislamiento e identificación de un gran número de proteínas, así como de las distintas isoformas de las mismas12–17, para evaluar comparativamente el proteoma de distintos subdepósitos de TAB-Sc humano. Dicho proteoma fue esencialmente similar entre subdepósitos, pero se observaron diferencias significativas en los niveles de expresión de determinadas proteínas, cuya investigación podría contribuir a la explicación de las diferencias fisiológicas existentes entre los subdepósitos de TAB-Sc.
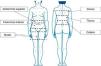
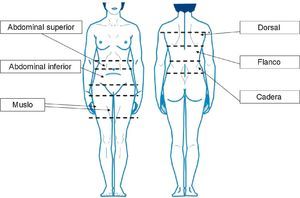
Pacientes y métodosPacientes y muestrasTras obtener el consentimiento informado por escrito, se extrajeron, bajo anestesia general, muestras de aspirado de TAB-Sc de 6 mujeres (IMC>25kg/m2) sin enfermedad conocida, que se habían sometido a liposucción en el Hospital Mount Carmel East (Columbus, Ohio) por el mismo cirujano (DWB). Dichas muestras provenían de 6 localizaciones anatómicas diferentes (abdominal superior [A-S], abdominal inferior [A-I], muslo [M], dorsal [D], flanco [F] y cadera [C]; fig. 1), en adelante subdepósitos, y se diferenciaron según proviniesen de la capa profunda o superficial (excepto en el muslo, donde esta diferenciación no fue posible).
Localizaciones anatómicas definidas para la obtención de muestras: abdominal superior (entre la línea umbilical y la costilla inferior), abdominal inferior (entre la línea umbilical y el pliegue abdominal), muslo, cadera (entre la cresta ilíaca y la costilla inferior), flanco (entre la costilla inferior y la línea escapular) y dorsal (por encima de la línea escapular).
Tras la incisión cutánea y la instilación de solución tumescente (suero salino+mezcla de lidocaína y adrenalina al 0,01%), se diseccionó mecánicamente el TAB-Sc, aspirándose mediante cánula (invariable entre depósitos). Dichos aspirados se centrifugaron inmediatamente en tubos cónicos a durante 10 min a 3.400g; separando la capa celular/tisular y congelándola en hielo seco (protocolo aprobado por el Comité Ético del Hospital Mount Carmel East y por el Ohio University Institutional Review Board).
Comparaciones establecidasLas comparaciones establecidas fueron:
- -
Capas superficial vs. profunda del TAB-Sc. Tanto en una localización «central» (abdominal superior) como en una «periférica» (cadera).
- -
Comparación entre subdepósitos. Se emplearon las muestras de la capa superficial de los 6 subdepósitos de TAB-Sc definidos, con la excepción del muslo (sin diferenciación entre capas).
Las muestras fueron homogeneizadas, diluidas en una cantidad fija de tampón, sonicadas, incubadas y centrifugadas según descrito previamente13–17, ajustando a una concentración proteica fija de 150μg de proteína en un volumen total de 350μl.
Electroforesis bidimensionalTodos los procedimientos de electroforesis bidimensional (2DE), procesamiento y análisis de imágenes, espectrometría de masas (MS) y MS secuencial (MS/MS), así como su proceso de análisis (MALDI-TOF) están detallados en anteriores publicaciones de nuestro grupo tanto para muestras humanas como murinas13–17. Las identificaciones proteicas mediante MS y MS/MS se obtuvieron mediante la contrastación de los datos generados con las bases de datos disponibles en red mediante el software Mascot (www.matrixscience.com) según se ha descrito previamente15–17.
Análisis estadísticoTodos los datos de intensidad fueron transformados logarítmicamente. En la comparación entre TAB-Sc-S y TAB-Sc-P se empleó el test de la t de Student, para aquellos datos con distribución normal (p>0,05 en el test de Shapiro-Wilk) e igualdad de varianzas, empleándose el test de rangos de Wilcoxon para el resto. Para la comparación entre subdepósitos, en caso de distribución normal se empleó un test de ANOVA, con corrección de Greenhouse-Geisser para los datos sin esfericidad (p<0,05 en el test de Mauchly), seguido del test post-hoc de Tukey en los casos con diferencias significativas. Los datos restantes se analizaron mediante el test de Friedman seguido del de Bonferroni-Dunn, si se hallaban diferencias significativas. El nivel de significación se estableció en p<0,05. El software empleado fue SPSS v. 14.0. (MapInfo Corporation, Troy, NY, Estados Unidos).
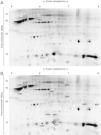
ResultadosComparación entre las capas superficial y profunda del tejido adiposo blanco subcutáneoSe diferenciaron un total de 228 proteínas, comparándose su intensidad entre las capas superficial y profunda tanto en el subdepósito abdominal superior como en la cadera.
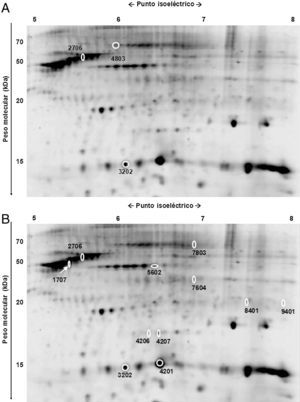
En el subdepósito abdominal superior, tres de ellas mostraban mayor intensidad en la capa superficial (fig. 2 A, tabla 1). Se identificaron como vimentina (2706), proteína fijadora de ácidos grasos (FABP) 4 (3202) y proteína heat shock (HSP) 8 (4803).
Comparación del proteoma entre las capas superficial y profunda del tejido adiposo blanco subcutáneo
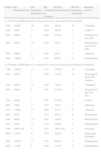
| Región anatómica | Número | PM/pI | Capa superficial vs. capa profunda | Identidad proteica |
| Abdominal superior | 2706 | ∼50kDa/∼5,5 | 11.049±2.775 vs. 1.799±1.098 | Vimentina |
| 3202 | ∼15kDa/∼6,1 | 9.680±3.086 vs. 7.504±2.017 | FABP-4 | |
| 4803 | ∼70kDa/∼5,9 | 14.880±14.160 vs. 1.519±817 | Proteína heat shock 8 | |
| Cadera | 1707 | ∼48kDa/∼5,3 | 12.377±11.734 vs. 6.104±5.257 | No identificada |
| 2706 | ∼50kDa/∼5,5 | 8.173±2.598 vs. 2.067±979 | Vimentina | |
| 3202 | ∼15kDa/∼6,1 | 7.039±1.904 vs. 10.304±2.823 | FABP-4 | |
| 4201 | ∼15kDa/∼6,5 | 4.451±1.415 vs. 8.700±4.520 | No identificada | |
| 4206 | ∼17kDa/∼6,3 | 504±54 vs. 341±116 | No identificada | |
| 4207 | ∼17kDa/∼6,5 | 1.983±497 vs. 1.042±391 | Proteína heat shock β6 | |
| 5602 | ∼50kDa/∼6,4 | 7.059±2.316 vs. 4.181±898 | No identificada | |
| 7604 | ∼30kDa/∼6,9 | 1.346±221 vs. 1.833±349 | No identificada | |
| 7803 | ∼70kDa/∼6,9 | 21.401±25.580 vs. 5.434±5.560 | Albúmina | |
| 8401 | ∼20kDa/∼7,5 | 2.161±676 vs. 4.519±1.338 | No identificada | |
| 9401 | ∼19kDa/∼7,8 | 1.376±796 vs. 4.055±2.092 | No identificada |
FABP-4: proteína fijadora de ácidos grasos número 4; PM: peso molecular; pI: punto isoeléctrico.
Nota: Intensidades relativas (media±DE) de las potenciales proteínas que mostraron diferencias significativas entre las capas superficial y profunda en la región abdominal superior y en la cadera, respectivamente.
En la cadera, 6 proteínas potenciales mostraban mayor intensidad en la capa superficial: vimentina (2706), HSP-β6 (4207), albúmina (7803) y 3 no identificadas (1707, 4206 y 5602). Por el contrario, 5 mostraron una intensidad superior en la capa profunda: FABP-4 (3202), β-hemoglobina (8401) y 3 no identificadas (4201, 7604 y 9401) (fig. 2 B, tabla 1).
Los datos de MS y MS/MS de las proteínas caracterizadas se muestran en la tabla 2. Varias proteínas potenciales recibieron la misma caracterización de acuerdo con sus datos de MS y MS/MS. Sus diferencias en peso y carga se deben, probablemente, a modificaciones postransduccionales, refiriéndose como distintas isoformas de una misma proteína.
Caracterización de las proteínas mediante espectrometría de masas y de espectrometría de masas secuencial
| Número | MS Puntuación/corte | MS Fragmentos emparejados | MS Cobertura de secuencia | MS-MS Puntuación/corte | MS-MS Fragmentos emparejados | Identidad proteica |
| A. Proteínas identificadas en la comparación entre capas superficial y profunda | ||||||
| 2706 | 105/66 | 20 | 50% | 300/41 | 10 | Vimentina |
| 3202 | 74/66 | 6 | 51% | 583/41 | 6 | FABP-4 |
| 4207 | 69/66 | 8 | 60% | 221/41 | 7 | Proteína heat shock β6 |
| 4803 | 66/64 | 12 | 24% | 47/41 | 4 | Proteína heat shock 8 (70kDa) |
| 7803 | 80/66 | 9 | 26% | 82/41 | 5 | Albúmina |
| 8401 | 136/66 | 17 | 95% | 664/41 | 9 | Hemoglobina |
| B. Proteínas identificadas en la comparación entre las localizaciones anatómicas estudiadas | ||||||
| 1706 | 126/66 | 17 | 51% | 258/39 | 10 | Vimentina |
| 2603 | 68/66 | 7 | 23% | 114/70 | 23 | Subunidad β de la ATP sintetasa |
| 2705 | 98/66 | 13 | 44% | 155/41 | 7 | Vimentina |
| 3801 | 50/66 | 6 | 14% | 223/70 | 7 | Proteína heat shock 60kDa |
| 4201 | 86/66 | 7 | 67% | 267/70 | 2 | FABP-4 |
| 4607 | 70/66 | 8 | 23% | 70/70 | 6 | Albúmina |
| 4707 | 124/66 | 14 | 26% | 133/41 | 8 | Albúmina |
| 4805 | 85/70 | 7 | 10% | 93/70 | 4 | Hemopexina |
| 6101 | 68/66 | 12 | 81% | 358/41 | 6 | Hemoglobina |
| 6102 | 83/66 | 11 | 81% | 369/41 | 6 | Hemoglobina |
| 7706 | 100% (CI) | 9 | 23% | 100% (CI) | 4 | α-Enolasa |
| 8202 | 144/41 | 4 | 25% | 144/41 | 4 | Superóxido dismutasa |
| 8401 | 136/66 | 17 | 95% | 664/41 | 9 | Hemoglobina |
| 8402 | 111/66 | 8 | 84% | 215/41 | 5 | Hemoglobina |
FABP4: proteína fijadora de ácidos grasos número 4.
Nota: Especificación de los datos de espectrometría de masas (MS) y de MS secuencial (MS-MS) de las proteínas identificadas entre las que mostraban diferencias significativas de intensidad en la comparación entre las capas superficial y profunda y entre las distintas localizaciones anatómicas (A y B, respectivamente).
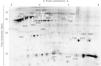
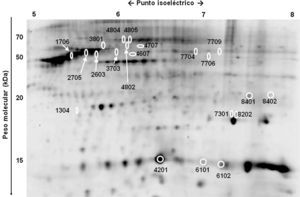
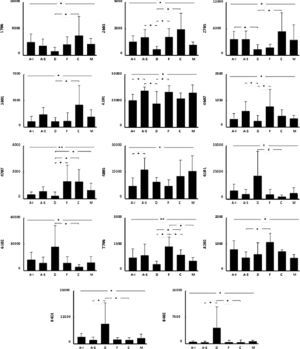
Se encontraron diferencias significativas en el nivel de expresión de 21 proteínas potenciales al comparar el proteoma de los distintos subdepósitos definidos de acuerdo con su localización anatómica (fig. 3 y fig. 4). Se pudo establecer la identidad de 14 de ellas (tabla 2), sin alcanzarse a identificar las 7 restantes (1304, 3703, 4802, 4804, 7301, 7704 y 7709).
Los diagramas representan el nivel de expresión (media±DE) de las proteínas identificadas en cada uno de los subdepósitos de tejido adiposo blanco subcutáneo definidos. Los asteriscos en la línea superior reflejan el nivel de significación de la comparación entre todos los depósitos. Las líneas inferiores con asteriscos muestran los resultados de los análisis post-hoc, entre parejas de subdepósitos. *p<0,05; **p<0,01. A-I: abdominal inferior; A-S: abdominal superior; C: cadera; D: dorsal; F: flanco; M: muslo.
Entre las proteínas identificadas, se incluían múltiples isoformas de hemoglobina, albúmina y vimentina, además de la subunidad β de la ATP-sintetasa (2603), la proteína mitocondrial HSP-60kDa (3801), FABP-4 (4201), hemopexina (4805), α-enolasa (7706) y superóxido dismutasa (SOD) (8202).
Varias proteínas mostraban una localización preferente en alguna de las regiones anatómicas. Por ejemplo, el subdepósito dorsal mostró niveles elevados de hemoglobina, pero reducidos de albúmina y de otras 5 proteínas: vimentina (1706 y 2705), ATP-sintetasa (β) (2603), HSP-60kDa (3801), FABP-4 (4201) y α-enolasa (7706) (fig. 4). También en el TAB-Sc del flanco se observó un incremento de la expresión de α-enolasa (7706) y SOD (8202), mientras que en la cadera existía una sobreexpresión de vimentina (1706 y 2705) y de HSP-60kDa (3801) (fig. 4). Finalmente, encontramos diferencias también entre los 2 subdepósitos abdominales, con el inferior mostrando una menor expresión de FABP-4 (4201) y hemopexina (4805) respecto al superior (fig. 4).
DiscusiónNuestros resultados muestran que los perfiles proteómicos del TAB-Sc son similares, pero no idénticos en toda la economía corporal. La profundidad de la capa de tejido adiposo y la localización anatómica del mismo determinan importantes diferencias en su expresión proteica. Es de destacar que la mayor parte de estudios comparan el TAB-Vis con una única localización de TAB-Sc. Sin embargo, sobre la base de nuestros hallazgos, consideramos que es importante distinguir entre las distintas capas y ubicaciones de este TAB-Sc al realizar dichas comparaciones5,6.
Las escasas diferencias en el perfil proteómico entre las capas superficial y profunda del TAB-Sc al estudiar una localización central (abdominal superior), mayores en la localización periférica (cadera), podrían indicar que la diferenciación neta entre ambas capas depende de la localización anatómica9,18. La existencia de mayores cantidades de hemoglobina en la capa profunda del TAB-Sc de la cadera podrían ser consecuencia del sangrado más profuso, observado durante el procedimiento quirúrgico, debido a una mayor proximidad de los vasos sanguíneos (lo que se observó también en el subdepósito dorsal respecto al resto)19. Resulta interesante que los niveles de expresión de albúmina mostraron un perfil exactamente opuesto al de la hemoglobina, con mayor intensidad en la capa superficial de la cadera (comparada con la profunda) y en el depósito dorsal (comparado con el resto). Estas diferencias podrían estar influidas por el papel de la albúmina en el control de la presión osmótica intersticial y a una mayor proximidad de los vasos sanguíneos en estas localizaciones10,20.
La vimentina es un miembro de la familia de las proteínas de los filamentos intermedios, que se encuentra, fundamentalmente, en el tejido conjuntivo. Las diferencias observadas en los niveles de vimentina, con mayor expresión en la cadera que en otras localizaciones y también en la capa superficial de cadera y abdomen, respecto a la profunda, resultan interesantes. El incremento observado en las capas superficiales podría ser consecuencia de la estructura fibrosa y densa propia de esta capa del TAB-Sc, en contraste con la capa profunda, con un estroma conjuntivo menos organizado9. Asimismo, se ha descrito cómo la vimentina participa en la lipólisis mediante interacción directa con la lipasa sensible a hormonas21, por lo que nuestra observación podría indicar la existencia de una tasa lipolítica superior en la capa superficial respecto a la profunda2. Además, la vimentina es un componente mayor del citoesqueleto y su síntesis, tanto en fibroblastos como en células epiteliales, se ha relacionado con la expansión celular22. Todas las pacientes estudiadas fueron mujeres con sobrepeso en las que, habitualmente, la cadera es el sitio de depósito graso preferente23. Por lo tanto, el hallazgo de niveles elevados de expresión de vimentina en la cadera podría estar reflejando esos cambios expansivos del tejido adiposo, más intensos en esta localización y particularmente en la capa superficial, mientras que su menor expresión en el subdepósito dorsal mostraría la situación opuesta. Esto concuerda con la menor tendencia de las mujeres al depósito de TAB-Sc en localizaciones dorsales tras ganancia ponderal, en comparación con los hombres24. Finalmente, la vimentina es necesaria para la translocación de los gránulos que contienen el transportador de glucosa GLUT-425. Así, estas diferencias observadas en la expresión de vimentina entre distintas capas y localizaciones anatómicas del TAB-Sc podrían tener una implicación funcional en la utilización de glucosa y no reflejar, exclusivamente, diferencias estructurales.
El patrón de cambios en la expresión de diferentes HSP curiosamente mostró una distribución similar a la descrita para vimentina. Es decir, incremento en las capas superficiales respecto a las profundas (HSP-8 y HSP-β6 en abdomen y cadera, respectivamente), con expresión de la HSP mitocondrial de 60kDa-HSP incrementada en la cadera y particularmente disminuida en el subdepósito dorsal. Se han descrito múltiples funciones de las HSP, incluida la inmunomodulación26, la contribución a la configuración morfológica de otras proteínas27 o la senescencia celular28. La HSP-β6 pertenece a las llamadas HSP pequeñas (20kDa) HSP, con actividad chaperonina e influencia sobre las interacciones del citoesqueleto y el transporte de glucosa e insulina29. La HSP-8 pertenece a la familia de las HSP de 70kDa y sus niveles de expresión en el hipocampo se han visto influidos por la realización de ejercicio físico30. La HSP-60kDa es una proteína asociada a la matriz mitocondrial que pertenece a la familia de las chaperoninas y cuyos niveles de expresión se ha comprobado que se reducen tras la ingesta de grasa tanto en el tejido adiposo murino31 como humano32. En conjunto, las HSP están relacionadas con la respuesta al estrés, al tiempo que el estrés oxidativo se ha propuesto como vínculo entre obesidad, resistencia a la insulina e inflamación33. Por lo tanto, los cambios anatómicos observados en su expresión podrían suponer un vínculo entre la acumulación local de tejido adiposo y sus comorbilidades mediadas por estrés oxidativo34.
Las proteínas fijadoras de ácidos grasos (FABP) son proteínas pequeñas localizadas en el citoplasma, fundamentalmente en adipocitos y macrófagos35. Pueden unirse reversiblemente con gran afinidad a moléculas hidrofóbicas, incrementando la solubilidad de los ácidos grasos libres (AGL) y su transporte a compartimentos celulares específicos regulando así su biodisponibilidad35. Por tanto, las FABP están relacionadas con la regulación de la acumulación lipídica y de la expresión génica mediada por lípidos36, siendo esenciales para el proceso de lipólisis37. Sobre la base de estas acciones, las FABP de los adipocitos y de los macrófagos se han implicado en el desarrollo de arteriosclerosis y síndrome metabólico38. Así, el contraste entre el incremento de expresión de FABP-4 en la capa superficial del TAB-Sc abdominal y su disminución en la de la cadera podría indicar que su distribución y función en el TAB-Sc varía entre las distintas partes del cuerpo. Las diferencias observadas en la comparación de los niveles de expresión de FABP-4 entre los distintos subdepósitos anatómicos fueron particularmente interesantes, y mostraron niveles significativamente menores en el dorsal frente al flanco y en el depósito abdominal inferior frente al superior. Esto podría indicar diferencias específicas entre subdepósitos en la captación de ácidos grasos y en lipólisis que podrían, al menos parcialmente, explicar por qué nuestros hallazgos no son exactamente comparables a estudios previos que no encontraron diferencias entre las distintas capas del TAB-Sc2,10.
De forma adicional, el hecho de que las diferencias halladas en los perfiles proteómicos de las 2 localizaciones abdominales estudiadas no se limitaban a FABP-4, sino que se hace extensivo a la expresión de hemopexina, apoya esta hipótesis. La hemopexina tiene capacidad para tamponar los grupos hemo derivados del metabolismo de la hemoglobina y la mioglobina, para la modulación de la inflamación y para la inhibición de la adhesión celular39. La reducción en la expresión de hemopexina en la región abdominal inferior, en comparación con la superior, podría reflejar un menor potencial expansivo (inhibición de la adhesión celular) de la misma.
Por otra parte, los subdepósitos del flanco y dorsal también mostraron diferencias entre sí pese a su proximidad anatómica, con mayor nivel de expresión de α-enolasa en el flanco. Esta proteína está implicada en la glucólisis y se encuentra en menor cantidad en los adipocitos de localización ectópica (intramuscular) que en los localizados en el TAB40, por lo que este hallazgo podría orientar también hacia la existencia de diferencias funcionales del TAB-Sc respecto al metabolismo de los hidratos de carbono dependiendo de su localización.
El análisis del proteoma del subdepósito dorsal mostró el mayor número de diferencias respecto al resto de subdepósitos. Observamos menor expresión de HSP-60kDa HSP (estrés oxidativo), FABP-4 (metabolismo lipídico), α-enolasa (metabolismo de los hidratos de carbono) y subunidad β de la ATP-sintetasa (metabolismo energético). Juntos, estos hallazgos señalan que el TAB-Sc de localización dorsal muestra una actividad metabólica menor que el de otras áreas anatómicas.
Nuestros resultados demuestran que los perfiles proteómicos de las capas superficial y profunda del TAB-Sc no son completamente superponibles y que existen diferencias entre los proteomas del TAB-Sc de distintas localizaciones anatómicas. Encontramos cambios tanto en proteínas estructurales como funcionales entre las distintas regiones anatómicas estudiadas, así como dependiendo de la profundidad de localización de dicho tejido adiposo. Estos resultados son críticos a la hora de interpretar los datos derivados de cualquier comparación entre TAB-Vis y TAB-Sc, ya que el depósito de TAB-Sc seleccionado para la comparación puede diferir significativamente dependiendo de su localización. Hasta la fecha y en nuestro conocimiento, este es el primer estudio que muestra la existencia de diferencias en los perfiles proteómicos de distintos subdepósitos de TAB-Sc.
FinanciaciónGabriel A. Martos-Moreno recibió un «Contrato Río Hortega» del Instituto de Salud Carlos III (FIS CM05/00100). Este trabajo fue financiado en parte por el Programa Eminent Scholar del estado de Ohio, que incluye una donación de Milton & Lawrence Goll, por los proyectos del NIH DK075436-01, AG019899-06, y por la Diabetes Research Initiative y el BioMolecular Innovation and Technology Partnership de la Universidad de Ohio; por el CIBER Fisiopatología de la Obesidad y Nutrición (CIBERobn), del Instituto de Salud Carlos III; por el Fondo de Investigación Sanitaria (FIS, PI09/91060 y PI10/00747); por la Fundación Endocrinología y Nutrición, y por Mutua Madrileña (AP2561/2008).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.