El citomegalovirus (CMV) es el principal agente causante de infecciones de transmisión vertical, congénitas o adquiridas. El objetivo es conocer la relevancia clínica de dicha infección en prematuros extremos.
Pacientes y métodoSe incluye a los prematuros de edad gestacional ≤ 31 semanas y peso de nacimiento ≤ 1.500g atendidos entre marzo del 2006 y diciembre del 2010, a los que se aplicó el protocolo de cribado de la infección por CMV. Se determinó la serología para CMV a sus madres. Cuando la serología era positiva, se congelaba la leche a –20°C durante 72h a partir de los 7 días. A las 5 semanas se determinaba el ADN para CMV en orina. Si era positivo se investigaba ADN-CMV en leche materna y en la muestra de sangre seca del cribado metabólico.
ResultadosSe estudió a 342 prematuros extremos con 53 (15,5%) infecciones: 8 (2,3%) congénitas, 35 (10,2%) adquiridas y 10 (2,9%) en las que no se pudo precisar su tipo. Una IgM+ en la madre se halló en 2 infecciones congénitas y 2 adquiridas. Los neonatos con citomegalovirosis congénita presentaron un menor peso de nacimiento, más retraso de crecimiento intrauterino, trombopenia, transfusiones de plaquetas, sepsis precoz (incluyendo las clínicas) y alteraciones en la ecografía cerebral. Entre los que presentaron una infección adquirida fueron más frecuentes las sepsis tardías.
ConclusionesLas infecciones por CMV, tanto congénitas como adquiridas, son frecuentes en los prematuros extremos y el protocolo presentado permite diagnosticarlas y probablemente prevenir algunas formas adquiridas al seleccionar a las pacientes a quienes congelar la leche.
Cytomegalovirus (CMV) is the most common congenital and acquired vertically transmitted viral infection in humans. The aim of the study is to determine the clinical relevance of this infection in very low birth weight (VLBW) infants in our area.
Patients and methodPreterm infants (gestational age ≤ 31 weeks) with a birth weight ≤ 1500g treated between March 2006 and December 2010 were included. They underwent the screening protocol for diagnosing CMV infection. CMV serology was performed on the mothers. When it was positive, their breast milk was frozen at –20°C for 72hours from the 7th day of birth. At 5 weeks, the urine of the newborn was tested for CMV-DNA. In case of a positive result, CMV-DNA was performed in breast milk and in the dry blood sample from metabolic screening.
ResultsA total of 342 preterm infants were studied, with 53 (15.5%) infected by CMV: 8 (2.3%) with congenital infection, 35 (10.2%) with acquired infection, and 10 (2.9%) in which it was impossible to determine precisely. IgM-CMV+in the mother was found in two congenital infections and two acquired infections. Newborns affected by congenital CMV infection showed a lower birth weight, more intrauterine growth restriction, thrombopenia, need for platelet transfusions, early sepsis (including clinical sepsis), and cerebral ultrasound anomalies. Late sepsis was more frequent in cases of acquired CMV infection.
ConclusionsCongenital or acquired CMV infections are frequent in VLBW infants, and our protocol enables them to be diagnosed and probably prevents some acquired CMV infections by selecting which patients should freeze the breast milk.
El citomegalovirus (CMV) es el principal agente causante de infecciones de transmisión vertical1. La seroprevalencia en la población adulta (30-70% en los países desarrollados) influye en la frecuencia de las infecciones congénitas2. En Europa se afectan entre el 0,15-0,5%3 de los recién nacidos (RN) y en Estados Unidos entre el 0,2 y el 2,2%2. En casos de primoinfección durante la gestación, la tasa de infección fetal es del 20-50% y es inferior al 1% en caso de una reinfección o reactivación4. Un 5-10%5 de los niños infectados serán sintomáticos, con afección grave al nacimiento, afectación del SNC (microcefalia, calcificaciones cerebrales y ventriculomegalia), mortalidad del 30%2 y mal pronóstico respecto del neurodesarrollo5-7. Del 90-95% de los niños asintomáticos al nacer, un 10-15% puede presentar hipoacusia o retraso psicomotor en su evolución8,9. El riesgo de presentar hipoacusia parece estar relacionado con la carga viral y se puede reducir al administrar ganciclovir10.
Los prematuros extremos pueden presentar una infección congénita por CMV que haya motivado su nacimiento prematuro. La enfermedad fetal por CMV11 suele cursar con restricción del crecimiento fetal, hepatoesplenomegalia, hiperecogenicidad intestinal, calcificaciones hepáticas o craneales, o ascitis, si bien estas alteraciones no suelen verse antes de la semana 26 de gestación. Las infecciones congénitas por CMV sintomáticas presentarán además una ictericia precoz y trombopenia. Sin embargo, en el prematuro extremo predominan las infecciones adquiridas por CMV, que se presentan antes del mes de vida y pueden asociarse a un curso grave11. El origen de las infecciones adquiridas por CMV puede estar en el parto, por contacto con secreciones infectadas, o después del nacimiento, sobre todo a través de la lactancia materna (LM) o con leche humana de banco, aunque también puede adquirirse tras la administración de sangre o derivados hemáticos. Igualmente cabe la posibilidad de infección horizontal, de paciente a paciente o por parte de los cuidadores2. La forma de infección más aceptada es a través de la leche materna12, ya que hasta en el 95% de las madres seropositivas para el CMV se produce excreción del mismo por su leche en algún momento de la lactancia12,13. Los estudios serológicos de estas mujeres muestran IgG+ y ausencia de IgM, no detectándose CMV ni en su orina ni saliva, por lo que la reactivación parece ocurrir solo en la glándula mamaria13. La tasa de transmisión a los prematuros expuestos oscila entre el 5 y el 50%, y las diferencias podrían deberse a variaciones en las prácticas de alimentación y tratamiento de la leche materna. Se consideran factores de riesgo para la transmisión la aparición precoz del virus y la elevada carga viral (ADN-CMV) en la leche14. Clínicamente, suelen manifestarse como episodios de sospecha de infección en los que no se aísla una bacteria, o como agravación de displasia broncopulmonar, enfermedad gastrointestinal o neumonitis15-17. En las formas con sintomatología grave se considerará el tratamiento con ganciclovir.
El objetivo del trabajo es conocer la relevancia clínica de la infección por CMV, tanto congénita como adquirida, en prematuros extremos (≤ 31 semanas y ≤ 1.500g) en nuestro medio.
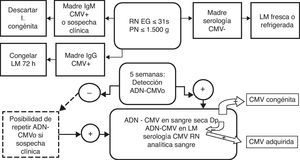
Pacientes y métodoSe estudia a los prematuros de edad gestacional (EG) ≤ 31 semanas y peso al nacimiento ≤ 1.500g. Solo se excluyó a los fallecidos en el periodo perinatal inmediato. La aplicación del protocolo del cribado de la infección por CMV en el prematuro extremo (fig. 1) se inició en marzo del 2006 y se refieren los resultados hasta diciembre del 2010.
Se solicitó al Servicio de Obstetricia la determinación de la serología específica para CMV a las madres de los prematuros extremos. De las que tenían serología positiva (IgG o IgM), se congelaba la leche a −20°C durante 72h a partir de los 7 días. Si había sospecha de infección por CMV, por la clínica o los antecedentes, se solicitaba inmediatamente ADN-CMV en orina del RN; en caso contrario, la determinación se realizaba a las 5 semanas. Los casos positivos se consideraban como infectados y se les practicaba un hemograma, perfil hepático y serología anti-CMV. También se investigaba su origen a través del ADN-CMV en la leche materna y en la muestra de sangre seca del cribado metabólico, para lo que se solicitaba consentimiento informado a los padres. Los criterios de repetición del estudio fueron la aparición de datos clínicos o analíticos de sospecha de infección por CMV. Los casos en que no pudo detectarse ADN-CMV en orina se consideraron como no infectados. Las serologías y los estudios de ADN practicados se resumen en la primera columna de la tabla 1.
Serología IgG e IgM en sangre de madres y recién nacidos, ADN-CMV en orina, leche materna y muestra del cribado neonatal, según el tipo de infección neonatal
| RN sin infección | RN con infección congénita | RN con infección adquirida | ||||
| Madre (n = 174) | RN (n = 289) | Madre (n = 5) | RN (n = 8) | Madre (n = 29) | RN (n = 35) | |
| IgG+/IgM− | 105 (60,3%) | 3 (60%) | 2/6 (33,3%) | 22 (75,8%) | 12/26 (46,1%) | |
| IgG+/IgM+ | 15 (8,6%) | 2 (40%) | 4/6 (66,6%) | 2 (6,9%) | 7/26 (26,9%) | |
| IgG−/IgM− | 54 (30,8%) | 5 (17,2%) | 6/26 (23%) | |||
| IgG−/IgM+ | 1/26 (3,8%) | |||||
| ADN-CMV-orina | 289 negativos | 8/8 (100%) | 35 (100%) | |||
| ADN-CMV-leche | 3/3 (100%) | 22/28 (78,5%) | ||||
| ADN-CMV-Cribado | 4/4 (100%) | 0/32 (0%) | ||||
Con los resultados serológicos aportados por los obstetras y los obtenidos en los neonatos, se establecieron las díadas madre hijo en función del diagnóstico neonatal. También se analizó la clínica que presentaron los RN (primera columna de la tabla 2) según la situación frente al CMV. Las cifras de sepsis tardías representan solamente las hemocultivo-positivas y se han debido preferentemente a estafilococo epidermidis, seguido de Escherichia coli. Las cifras de sepsis precoces incluyen tanto las hemocultivo-positivas (presentes solo en el grupo sin infección por CMV), como las hemocultivo-negativas o clínico-analíticas.
Características de los RN según el tipo de infección por CMV
| RN sin infección por CMV (n = 289) | RN con infección adquirida (n = 35) | RN con infección congénita (n = 8) | P | |
| Edad gestacional (semanas) | 28±1,8 (24-31) | 27,5±2,2 (24-31) | 28,3±2,2 (25-30) | 0,190 |
| Peso nacimiento (g) | 1.034,2±239 (460-1.500) | 1.012,9±246 (620-1420) | 805±163 (620-1015) | 0,027 |
| CIR | 50 (18,0%) | 6 (17,1%) | 7 (87,5%) | < 0,001 |
| Sexo varón | 145 (50,6%) | 18 (51,4%) | 6 (75%) | 0,399 |
| Gemelar | 117 (40,9%) | 12 (34,3%) | 5 (62,5%) | 0,338 |
| EMH grave | 140 (49,0%) | 20 (57,1%) | 4 (50%) | 0,622 |
| Sepsis precoz (HC+ y clínicas) | 13 (4,4%) | 1 (2,8%) | 3 (37,5%) | < 0,001 |
| Sepsis tardía HC+ | 49 (16,9%) | 14 (40%) + 2 ITU | 2 (25%) | 0,040 |
| ECN | 11 (3,8%) | 1 (2,9%) | 1 (12,5%) | 0,432 |
| Trombopenia (< 100.000/mm3) | 43 (15,0%) | 11 (31,4%) | 7 (87,5%) | < 0,001 |
| Transfusión plaquetas | 19 (6,6%) | 5(14,2%) | 4 (50%) | < 0,001 |
| Transfusión hematíes | 98 (34,3%) | 11 (31,4%) | 6 (75%) | 0,053 |
| Eco cerebral alterada | 62 (21,4%) | 11 (31,4%) | 5 (62,5%) | 0,013 |
Edad gestacional y peso de nacimiento: media ± desviación estándar (rango).
CIR: retraso de crecimiento; ECN: enterocolitis necrotizante; EMH: enfermedad membrana hialina.
La serología de CMV se realizó por enzyme immunoassay kits (IgG Axsym Abbot, Chicago, EE. UU.; ELISA) y la IgM Immunofluorescence (IFA Virgo, Columbia, EE. UU.). La detección de CMV-ADN se hizo por PCR-Herplex (Genómica S.A.U., Madrid, España) y a partir de 2009 por PCR real time (NANOGEN, Milán, Italia).
El tratamiento estadístico incluyó la descripción de las variables analizadas (media ± desviación estándar en las cuantitativas y porcentaje en las cualitativas) y la comparación de las mismas según los 3 tipos de infección por CMV (ausente, adquirida o congénita), mediante la prueba de Kruskal-Wallis en las variables cuantitativas y el test de la chi al cuadrado en las cualitativas. Se aceptó como significativa una p<0,05.
ResultadosEn este periodo se estudió a 342 prematuros extremos con 53 (15,5%) infecciones por CMV: 8 (2,3%) infecciones congénitas, 35 (10,2%) infecciones adquiridas y 10 (2,9%) infecciones en las que no se pudo precisar el tipo, sobre todo por no disponer de una muestra de sangre seca fiable.
Inicialmente hubo 294 RN con determinación del ADN-CMV en orina negativa, realizada a una edad promedio de 34,8 días (3-129). Se repitió la determinación en 62 RN a una edad promedio de 47,7 días (25-99), siendo positiva en 5 RN a los 70,7 días (46-105), que pasaron a considerarse infecciones adquiridas, e indetectable en 57 RN a los 46,9 días (25-99). Por lo tanto, 289 RN se asumieron como no infectados.
Tres de las 8 infecciones congénitas tenían diagnóstico prenatal con confirmación neonatal por detección de ADN en orina en los primeros días. Dos se diagnosticaron en los primeros 15 días de vida, un RN asintomático y otro sintomático (CIR, microcefalia y trombopenia). Los otros 3 se diagnosticaron a los 42,6 días (36-49) al detectarse ADN-CMV en orina y sangre seca del cribado metabólico. En los 35 RN con infección adquirida el diagnóstico fue a través de la detección del ADN-CMV en orina a los 35,7 días (25-60). En 32 fue negativa la determinación en la muestra de sangre seca y en 3 existió una detección previa negativa en orina. Los 10 RN en que no se pudo establecer con certeza su estado frente al CMV fueron excluidos del estudio comparativo.
La tabla 1 resume las serologías IgG e IgM en sangre de madres y RN. Cabe destacar que la presencia de IgM+ en la madre se halló en 2 infecciones congénitas y 2 adquiridas. En el RN, la IgM para CMV se positivizó en 4/6 (66,7%) de las infecciones congénitas y 8/26 (30,7%) de las adquiridas. El 23% de los RN con infección adquirida por CMV (6/26) tenían la serología (IgG e IgM) negativa en el momento del diagnóstico, mientras que ningún RN con infección congénita presentó una serología negativa. El ADN-CMV en leche materna fue positivo en los 3 casos de infecciones congénitas en que se practicó y en 22 de los 28 casos de infecciones adquiridas (78,5%).
En la tabla 2 se muestran las características clínicas de los RN distribuidos según el tipo de infección por CMV. En el análisis de las sepsis precoces se incluyeron las hemocultivo-negativas o clínico-analíticas, ya que la mayoría de las gestantes de estos prematuros extremos habían recibido antibioterapia, la cual podía negativizar el hemocultivo.
Se detectaron diferencias significativas en un menor peso de nacimiento, más retraso de crecimiento intrauterino, trombopenia, transfusiones de plaquetas, sepsis precoz y alteraciones en la ecografía cerebral, más frecuentes en los niños con infección congénita. Cinco de ellos nacieron de embarazos gemelares: 2 monocoriales y 3 bicoriales. En las 2 gestantes monocoriales se afectaron los 2 hermanos; en una gestante bicorial solo se afectó uno de los fetos y en las otras 2, ambas bicoriales, había fallecido intraútero uno de los fetos (un feticidio selectivo en la semana 22 por mielomeningocele sacro y el otro fallecido en la semana 24 en el curso de una corioamnionitis, con estudio anátomo-patológico que descartaba la infección por CMV). En las 8 infecciones congénitas los hallazgos clínicos más frecuentes fueron: hepatoesplenomegalia (4), neutropenia (5), colostasis (4), coagulopatía (2), coriorretinitis (1) e íleo meconial (1). Tres se trataron con ganciclovir, de los que 2 presentaron neutropenia con trombopenia grave en uno de ellos. Falleció un niño afectado de enterocolitis necrotizante.
Entre los que presentaron infección adquirida, fueron más frecuentes las sepsis tardías, todas ellas hemocultivo-positivas, y producidas mayoritariamente por estafilococo epidermidis. En 2 casos se vieron afectados los 2 hermanos de una gestación múltiple. Los datos clínicos más frecuentes fueron crisis de apnea (3), colostasis (2) e íleo meconial (1), si bien son propios de la prematuridad y no tienen por qué tener relación con la infección por CMV. Ninguno se trató con ganciclovir y hubo un fallecimiento por presentar una enterocolitis necrotizante tardía. En el grupo de neonatos sin infección por CMV no hubo fallecimientos.
DiscusiónEn los prematuros extremos se diagnosticó infección congénita por CMV en el 2,4%, infección adquirida en el 10,2% y en el 2,9% no pudo establecerse el momento de la infección. La serología neonatal en las infecciones congénitas fue positiva para IgM en el 66,6% y para IgG en el 100%, mientras que en las adquiridas fue positiva en el 30,7 y el 73%, respectivamente. La frecuencia de infecciones congénitas es similar a la hallada por Yamamoto et al.18. Pérez Payá et al.19 encuentran positivización de la IgM en el 41% de los que se estudiaron, siendo IgG + el 83% de los mismos, porcentajes similares a los nuestros. Esta escasa expresividad serológica se puede explicar por la menor respuesta inmunológica del RN, en especial prematuro extremo.
Como era de esperar, las infecciones congénitas se acompañaron de menor peso y más afectación clínica, precisando más transfusiones de plaquetas. El porcentaje de CIR en las formas adquiridas era similar al del grupo sin infección, mientras que en las formas congénitas ascendía al 87,5%. El aumento de sepsis tardías hemocultivo-positivas en las infecciones por CMV, especialmente adquiridas, no tiene una explicación clara, si bien podría estar relacionado con el trastorno de la inmunidad que provoca la infección por CMV. El tipo de gérmenes y las edades gestacionales fueron similares a los del grupo sin infección. Tres infecciones congénitas se trataron con ganciclovir2,5,10. Dados los riesgos de este fármaco, probablemente superiores en los prematuros extremos, se fue muy selectivo en su aplicación solo a los casos sintomáticos graves. En un neonato los padres se opusieron a la utilización prolongada del ganciclovir, pero aceptaron el uso del valganciclovir por vía oral5 hasta los 6 meses de vida, con buena tolerancia. Se produjeron fallecimientos en el grupo de infecciones congénitas (2 en la época fetal y uno por enterocolitis necrotizante) y en el de infecciones adquiridas (uno por enterocolitis necrotizante tardía), sin existir una aparente relación con la infección por CMV. La ausencia de fallecidos en el grupo sin infección por CMV debe valorarse teniendo en cuenta que las formas consideradas negativas tras el cribado se veían en supervivientes a la quinta semana de vida.
En nuestro trabajo, casi el 80% de las infecciones adquiridas presentaron ADN-CMV en leche materna. Una leche positiva para CMV será probablemente el foco de contagio, ya que las transfusiones de sangre (administradas en nuestro trabajo a algo más del 30% de tanto CMV adquiridas como RN sin infección por CMV) serán desleucotizadas y de donantes seronegativos (norma constante en nuestro hospital), además de ser irradiadas para evitar la enfermedad injerto-contra-huésped. Las transfusiones de plaquetas son más peligrosas, pero menos utilizadas. La transmisión horizontal es poco frecuente. En 6 de los niños que presentaron infección adquirida por CMV no se detectó ADN-CMV en la leche materna, lo cual podría deberse a que en el momento de la recogida de la muestra esta fuera negativa o a la transmisión a través de otro mecanismo.
Los primeros estudios sobre adquisición a través de la LM llevados a cabo por Stagno et al.20 en neonatos a término manifestaron que los RN infectados no mostraban síntomas y el seguimiento prolongado no evidenciaba secuelas neurológicas ni sensoriales. El riesgo de infección por CMV aumenta cuando se alimenta con leche infectada a prematuros, los cuales pueden presentar infecciones de diversa gravedad5. Sin embargo, no parecen detectarse secuelas en prematuros tras un seguimiento de 2-4,5 años21, si bien recientemente Bevot et al.6 refieren que, en < 32 semanas o < 1.500g, el padecimiento de una infección por CMV adquirida a través de la LM parece condicionar un peor pronóstico neurológico.
En los últimos años, para evitar que la LM sea origen de la infección adquirida, se han emitido recomendaciones al respecto12,22-26, desde prescindir de la LM en la alimentación del prematuro27 hasta someterla a diferentes sistemas de pasteurización. El valor nutricional e inmunológico de la leche materna para el prematuro pesa más que la posibilidad de transmitir una infección prácticamente sin secuelas12,15,21,24. La Sociedad Austríaca de Pediatría recomienda la pasteurización Holder de la leche de madres seropositivas para CMV hasta el final de la semana 34 de edad corregida28 y la Autoridad de la Seguridad alimentaria francesa recomienda no alimentar a los prematuros de menos de 32 semanas con leche materna cruda29. Los diferentes tratamientos de la leche (pasteurización Holder y congelación –20°) encaminados a disminuir su capacidad infectiva tienen una eficacia conocida: la primera reduce completamente la posibilidad de infección, aunque afecta a la calidad de la leche, y la congelación no afecta a la calidad pero no anula completamente su infectividad en el prematuro12,20,30. Hayashi et al.23 encuentran un 4,3% de prematuros infectados y asintomáticos tras alimentarse con leche materna congelada, mientras que otros autores detectan un 1531 y un 6%32. Sin congelar la leche, la transmisión alcanza al 35-38%24, de las que el 48% son sintomáticas12. Se ha comprobado la utilidad de otra técnica de pasteurización en que se aplica temperatura de 62°C durante 5 s, manteniéndose la actividad enzimática de la leche en un 85% y sin destruir los anticuerpos específicos frente al CMV12,33. Tomando la presencia de IgG como marcador de madre portadora de CMV, en nuestra unidad neonatal se congela durante 3 días la leche de todas las madres IgG-CMV positivas antes de administrarla a sus hijos. La proporción de infecciones adquiridas que se acompañaron de presencia de CMV en la leche materna fue similar a la de Jim et al.31, que también empleaban la congelación. Sin embargo, al igual que Meier et al.13, en nuestra unidad se comprobó la presencia de ADN-CMV en la leche de una madre con serología negativa que contagió a su hijo, así como en 2 niños alimentados con leche de banco. Se detectó ADN-CMV en la leche en las 2 ocasiones. Meier13 justifica este hecho por un falso negativo en la detección de anticuerpos anti-CMV, o por la presencia de anticuerpos no detectables por la técnica.
Actualmente, son pocos los estudios orientados al diagnóstico sistemático de las infecciones por CMV en los prematuros, por lo general limitados a series cortas34. Barbi et al.35, basándose en la frecuente afectación auditiva en caso de infección congénita por CMV, apuntan la posibilidad de un cribado universal mediante la extracción de ADN viral en la muestra de sangre seca del cribado metabólico. Fowler et al.36 recomiendan el cribado de la infección congénita por CMV y el mantenimiento de las pruebas de detección de sordera con evaluaciones repetidas hasta pasados los 3 primeros años. Este cribado puede condicionar angustia en los padres, si bien hasta un 80% de los mismos están a favor de llevarlo a cabo37.
En nuestra unidad neonatal se limitó el cribado de la infección por CMV a todos los prematuros extremos, ya que estos son los que presentan mayor número de infecciones. El momento de la recogida de la muestra para detección de CMV se escogió a partir de las 4 semanas para cubrir el periodo de incubación2 y encontrar a la madre en fase excretora del CMV. De esta manera, se diagnosticaban las formas adquiridas y las congénitas asintomáticas, ya que de haberse sospechado antes se habría adelantado la práctica del estudio. La PCR mediante amplificación del ADN viral en orina es un método con sensibilidad del 89% y una especificidad del 95%, según Warren et al.38, al compararlo con el cultivo viral. En sangre seca de papel de filtro, la sensibilidad es del 95% y la especificidad del 100%39, aunque la sensibilidad podría ser algo inferior (82%)40.
La mayoría de los problemas en la realización del protocolo de cribado ha sido en la obtención del resultado de las serologías maternas, que fue responsable ocasional del retraso en la congelación de la leche. Este resultado debería conocerse antes de la primera semana posparto, ya que durante este tiempo la presencia de ADN en calostro solo es positiva en un 20%, mientras que a los 15 días alcanza el 90%30 y hasta las 4-8 semanas el número de copias/ml va aumentando14. La opción de congelar todas las leches que se deben administrar a los prematuros extremos sin tener en cuenta la serología materna anti-CMV casi duplicaría el trabajo, pues un 40% de las gestantes jóvenes pueden ser seronegativas.
En conclusión, las infecciones por CMV (congénitas y en especial las adquiridas) son frecuentes en los prematuros extremos (15,5%). La aplicación del protocolo de estudio sugerido en este trabajo permite diagnosticar la infección por CMV en el prematuro extremo y probablemente prevenir algunas formas adquiridas al seleccionar a las pacientes a quienes congelar la leche.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.