La deficiencia de vitamina A (DVA) constituye un problema de salud pública a nivel mundial. Estudios epidemiológicos de prevalencia de DVA se han realizado en individuos con carga cromosómica y potencial genético acorde con la población general; no obstante, son escasos los estudios en pacientes con síndrome de Down (SD). El objetivo fue determinar la prevalencia de DVA y estado nutricional en pacientes con SD.
MétodosSe realizó un estudio prospectivo y transversal, en 50 controles (10,4±3,7 años) citogenéticamente normales (CN) y 38 pacientes con SD (8,2±4,1 años), seleccionados aleatoriamente. Se determinó retinol sérico por HPLC según el método de Bieri, utilizando valores de referencia internacional que definen DVA <20μg/dl. Se aplicó el programa SAS/STAT para el análisis estadístico.
ResultadosLa prevalencia de DVA en pacientes con SD fue 18,4% y en controles CN 4% (OR: 5,64; IC 95%=1,10–28,93; p=0,03). Los niños con SD entre 2–6 años mostraron una reducción significativa de los valores de retinol sérico (p=<0,05). La talla y el peso en pacientes con SD se observó significativamente por debajo de individuos CN (p=<0,001).
ConclusiónLa alta prevalencia de DVA en individuos con SD debe ser considerada un problema de salud pública. De este modo, la trisomía del cromosoma 21 constituye un factor de riesgo asociado a DVA.
Vitamin A deficiency (VAD) is a worldwide public health problem. Epidemiological studies of VAD prevalence have been conducted in individuals with chromosome load and genetic potential compared with the general population; however, there are few studies in patients with Down's syndrome (DS). The objective of this study was to determine the prevalence of VAD and analyse nutritional status in patients with DS.
MethodsA prospective and cross-sectional study was performed, with 50 karyotypically normal (KN) individuals (10.4±3.7 years old) and 38 randomly selected patients with DS (8.2±4.1 years old). Serum retinol was determined by HPLC using the Bieri method, with an international reference standard to define VAD (serum retinol <20μg/dL). The data were analysed using the SAS/STAT statistical program.
ResultsThe prevalence of VAD was 18.4% in individuals with DS and 4% in KN individuals (OR: 5.42; 95% CI=0.93–40.64; p=0.02). Children with DS between two and six years old shown a significativily lower serum retinol (p=<0.05).The patients with DS also showed a significant decrease in height and weight compared to KN (p=<0.001).
ConclusionsThe prevalence of VAD detected in patients with DS could be considered a public health problem. Also, the chromosome 21 trisomy represent a risk factor associated with VAD.
La vitamina A (VA) y sus derivados retinoides son micronutrientes esenciales que participan en la homeostasis de importantes procesos biológicos como visión, crecimiento, respuesta inmunitaria, reproducción, procesos de oxidorreducción, regulación de la expresión génica y neurogénesis1–4. La deficiencia de vitamina A (DVA) es un problema de salud pública a nivel mundial, se estima que aproximadamente 127 millones de niños pertenecientes a 118 naciones tienen DVA5. En América Latina, la DVA es predominantemente subclínica afectando cerca de 14,5 millones de niños menores de 5 años6, constituyendo un factor que incrementa significativamente el riesgo de morbilidad y mortalidad por causa de infecciones prevalentes (enfermedades diarreicas, respiratorias y sarampión) durante la niñez7,8.
Aunque existe amplia evidencia basada en estudios epidemiológicos de prevalencia de DVA en individuos normales, son escasas las investigaciones realizadas en la población con Síndrome de Down (SD)9; a pesar que en estos últimos existe un mayor riesgo de enfermedades infecciosas prevalentes durante la infancia8.
La trisomía del cromosoma 21 o SD, constituye la aneuploidía y causa de retardo mental de origen genético más frecuente a nivel mundial, que afecta aproximadamente a 1/700 a 800 nacidos vivos10. El SD se origina por la existencia de una copia extra del cromosoma 21, que involucra la sobreexpresión de 225 genes distribuidos en su región crítica (21q22.3) y en el resto de su brazo largo11. Por ello, el fenotipo del SD es complejo y variable en su severidad; incluyendo: déficit cognitivo e intelectual, defectos cardiacos, hipotonía, disfunción del sistema inmunitario, riesgo incrementado de leucemia y una condición neurodegenerativa similar a la enfermedad de Alzheimer11–13.
La evaluación del estado nutricional de la VA en pacientes con SD orientada en la búsqueda de DVA, puede contribuir en el análisis y reducción de desordenes nutricionales que comprometen su calidad de vida y desarrollo. Cabe enfatizar, que la DVA puede coexistir con otros factores nutricionales como la desnutrición proteicocalórica14, la anemia por deficiencia de hierro y el estrés producido por los estados infecciosos15, lo cual puede deteriorar el estado de salud de los pacientes con SD.
Dado que la DVA y el SD representan graves problemas de salud pública y social en países en desarrollo, donde es constante la ineficacia gubernamental en el suministro de alimentos y planes de seguridad social para individuos discapacitados por condiciones especiales de salud; la presente investigación tiene por objeto establecer la prevalencia de DVA y analizar el estado nutricional asociado a esta deficiencia en pacientes con SD en Maracaibo, Venezuela.
Materiales y métodosSe realizó un estudio prospectivo y transversal, en una muestra probabilística de 90 individuos con edades entre 2 y 16 años, de ambos sexos; constituido por 50 individuos citogenéticamente normales (CN) según evaluación citogenética (femenino=27; masculino=23), y 40 individuos con SD (femenino=15; masculino=25), seleccionados al azar en sus respectivas Unidades de Educación Primaria y Secundaria localizadas en Maracaibo, Venezuela, durante el segundo semestre del año 2007. La población fue clasificada en tres grupos de edades: 2–6 años, 7–10 años y 11–16 años.
El presente estudio recibió la aprobación del Consejo Técnico del Instituto de Investigaciones Biológicas de la Facultad de Medicina y la Comisión Científica del Consejo de Desarrollo Científico y Humanístico de la Universidad del Zulia (CONDES-LUZ). Así mismo, fue aprobado por la Coordinación Regional de las Escuelas Bolivarianas de la Dirección Regional de Educación y por la Junta Directiva de las respectivas Unidades Educativas. Además, se obtuvo el consentimiento informado por escrito de los padres y/o representantes legales. Ambos grupos fueron procedentes de los estratos socioeconómicos IV y V según la escala de Graffar modificada para Venezuela por Méndez Castellano y Méndez16.
El criterio principal de inclusión estuvo constituido por individuos CN (46 XX o XY) e individuos con SD (47 XX o XY+21) según el análisis del cariotipo de los participantes en el estudio, el cual fue realizado por especialista técnico en citogenética del Laboratorio de Citogenética de la Unidad de Genética Médica de la Universidad del Zulia.
La evaluación clínica fue realizada por personal médico capacitado, considerándose como criterios de exclusión: Individuos con al menos un episodio de temperatura axilar >37°C durante los últimos 15 días, tres o más evacuaciones líquidas en menos de 24h y/o procesos infecciosos activos. Además, se realizó examen oftalmológico para detectar signos clínicos de DVA (xerosis conjuntival o corneal, manchas de Bitot, ulceración corneal) o conjuntivitis17.
La evaluación nutricional antropométrica fue realizada por una licenciada en Nutrición y Dietética, considerando variables como edad, sexo, peso y talla, para establecer el IMC, utilizando para su análisis en individuos normales las tablas de FUNDACREDESA18. En tanto que, las variables antropométricas peso y talla en individuos con SD fueron analizadas utilizando las tablas Americanas elaboradas por Cronk et al19.
Se obtuvo una muestra de sangre por punción venosa periférica teniendo en cuenta que hubiesen transcurrido por lo menos ocho horas de ayuno. La sangre fue recolectada en 2 tubos; el primer tubo sin anticoagulante, fue sometido a centrifugación (3000rpm×10min) para la obtención de suero, que posteriormente fue separado en tubos Eppendorf para la determinación de retinol sérico y proteína C reactiva. El contenido de un segundo tubo con heparina fue empleado para procesar el cariotipo de los participantes del estudio. Las muestras fueron protegidas de la luz durante el procedimiento de extracción y procesamiento.
La proteína C reactiva fue analizada mediante la prueba semicuantitativa de aglutinación en placa (Wiener Lab, Argentina). Se excluyeron pacientes con proteína C reactiva positiva.
El retinol sérico fue determinado por cromatografía líquida de alta eficiencia (HPLC) según el método de Bieri et al20, utilizando un equipo de cromatografía líquida (WATERS, modelo 2695, USA) con columna de fase reversa (3,9mm×150mm), Atlantis C18 (4,6×150mm y 5μm) y un detector de absorbancia dual de rango UV (WATERS, modelo 2487, EE.UU.). Para establecer el estado nutricional de la VA, se utilizó como punto de corte de retinol sérico: <20μg/dl (deficiente) según Grupo Consultivo de Vitamina A (IVACG)17,21,22.
El análisis estadístico de los datos se realizó con el uso del programa estadístico SAS/STAT, versión 8.1 (SAS Inst. Inc, Cary, Nc, EE.UU). Los datos fueron expresados en valores promedio±desviación estándar «D.S» y porcentajes. Para estimar las diferencias entre los valores promedio de las concentraciones séricas de VA de los individuos CN y con SD, se utilizo la prueba t de Student y análisis de la varianza (ANOVA) con prueba Post hoc Games-Howell. Además, se empleo la prueba exacta de Fischer para establecer asociación entre DVA en la población estudiada. Para el análisis de riesgo, se calculó odds ratio (OR) considerando el 95% como índice de confiabilidad estadística y una p<0,05 como significancia estadística.
ResultadosEn el presente estudio se evaluaron 90 individuos de ambos sexos y edades comprendidas entre 2 y 16 años. Fueron excluidos 2 pacientes con SD por presentar proteína C reactiva positiva. Se analizaron 50 individuos (46 XX o XY) CN (10,4±3,7 años) y 38 pacientes (47 XX o XY+ 21) con SD (8,2±4,1 años). No se observaron síntomas o signos clínicos sugestivos de DVA o cuadros infecciosos activos en ambos grupos estudiados.
La tabla 1 muestra los valores promedio de las características antropométricas de la población estudiada. Nótese que los pacientes con SD mostraron una disminución significativa de los valores promedio de peso y talla (p=<0,001). Sin embargo, el IMC se encontró en el rango de normalidad. En pacientes con SD los indicadores peso/edad y talla/edad se encontraron por encima del percentil 50 (normal).
Características antropométricas generales de controles CN (46 XX o XY) y pacientes con SD (47 XX o XY+21)¿
| Variables antropométricas | CN (n=50) | SD (n=38) |
| Edad (años) | 10,7±3,5 | 8,2±4,1 |
| Peso (kg) | 33,4±13,5 | 24,0±12,3¿¿ |
| Talla (cm) | 133,1±20,8 | 110,8±21,0¿¿ |
| IMC (kg/m2) | 17,9±2,4 | 18,1±3,2 |
CN: citogenéticamente normales; SD: Síndrome de Down.
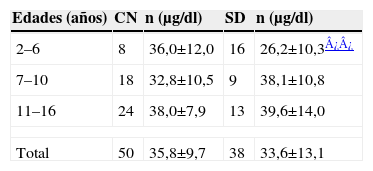
La tabla 2 muestra los valores séricos de retinol de la población estudiada según la edad. A pesar de que los valores séricos de retinol no mostraron diferencias estadísticamente significativas entre los individuos CN y aquellos con SD, los pacientes con SD entre 2–6 años presentaron una reducción significativa de los valores promedio de las concentraciones séricas de retinol (26,2±10,3μg/dl) con respecto al resto de los grupos estudiados (p=<0,05).
Valores promedio de retinol sérico en controles CN (46 XX o XY) y pacientes con SD (47 XX o XY+21) según la edad¿
| Edades (años) | CN | n (μg/dl) | SD | n (μg/dl) |
| 2–6 | 8 | 36,0±12,0 | 16 | 26,2±10,3¿¿ |
| 7–10 | 18 | 32,8±10,5 | 9 | 38,1±10,8 |
| 11–16 | 24 | 38,0±7,9 | 13 | 39,6±14,0 |
| Total | 50 | 35,8±9,7 | 38 | 33,6±13,1 |
CN: citogenéticamente normales; SD: Síndrome de Down.
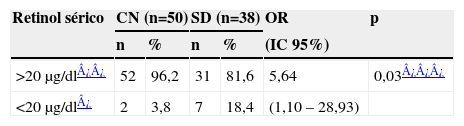
La tabla 3 muestra la distribución de la población estudiada según los valores de retinol sérico. Nótese que la prevalencia de DVA pacientes con SD fue 18,4% (n=7) y en individuos CN 3,8% (n=2). Además, se observó asociación estadísticamente significativa entre la condición SD y DVA (F=5,25; p=0,03), con probabilidad 5,6 veces mayor de DVA en pacientes con SD (OR=5,64; IC 95% =1,10–28,93), respecto a los controles CN.
Prevalencia de DVA¿ en controles CN (46 XX o XY) y pacientes con SD (47 XX o XY+21)
| Retinol sérico | CN (n=50) | SD (n=38) | OR | p | ||
| n | % | n | % | (IC 95%) | ||
| >20μg/dl¿¿ | 52 | 96,2 | 31 | 81,6 | 5,64 | 0,03¿¿¿ |
| <20μg/dl¿ | 2 | 3,8 | 7 | 18,4 | (1,10–28,93) | |
CN: citogenéticamente normales; IC: intervalo de confianza; OR: odds ratio; SD: Síndrome de Down.
En el presente estudio la prevalencia de DVA (18,4%) en pacientes con SD, se estima superior a la observada en individuos no afectados por el SD4,6–8. Al respecto, cifras estimadas por la Organización Panamericana de la Salud (OPS), consideran como problema de salud pública la presencia de DVA en más de un 15% de la población general7,17. No obstante, es pertinente señalar que las estadísticas planteadas por la OPS y estudios previos de DVA a nivel internacional no relacionan condiciones citogenéticas anormales y DVA presentes en pacientes con SD.
La reducción significativa de las concentraciones séricas de retinol en pacientes con SD en edades entre los 2 y 6 años observada en esta investigación, pueden relacionarse con problemas de alimentación manifestados frecuentemente en el 50–80% de los casos, en este rango de edad23. De allí que, la presencia de hipotonía y problemas de coordinación motora en pacientes con SD dificultan los movimientos de la mandíbula y control pleno del bolo alimenticio desde la boca hasta la faringe24; causando disfunción en la deglución y alimentación, circunstancias que pueden favorecer la reducción de concentraciones séricas de retinol a temprana edad en pacientes con SD, y por consiguiente el aumento de DVA en esta población.
Aunque el origen de DVA en la población mundial puede ser de diversa índole, en la actualidad la ingesta inadecuada de alimentos ricos en proVA, alteraciones en la absorción intestinal relacionadas con infestaciones parasitarias debidas a Ascaris lumbricoides o Giardia lamblia; y perdida exacerbada del micronutriente, predominan como factores causales7,8,15. Sin embargo, una otra causa atribuible de DVA constituye la reducción de las concentraciones de retinol sérico en respuesta a su acción antioxidante frente a los radicales libres25.
En este orden de ideas, estudios de genética molecular en individuos con SD han demostrado la existencia de un «efecto de dosis génica» que implica la sobreexpresión de genes localizados en el cromosoma 2126. Entre estos, el gen que codifica la enzima súperoxido dismutasa «SOD» localizado (21q22.1) cercano a la región crítica (21q22.3) para SD27, provoca un incremento de la actividad de esta enzima en varios tejidos, originando en consecuencia un aumento en la producción de radicales libres de oxígeno27–30. Este aumento brusco en las concentraciones de SOD en individuos con trisomía del cromosoma 21, constituiría además un factor importante en la reducción de las concentraciones séricas del retinol, sugiriendo que la condición citogenética alterada pueda estar vinculada con un riesgo mayor de DVA en pacientes con SD. Sin embargo, investigaciones bioquímico-genéticas en base a sobre-expresión de SOD como factor de riesgo para DVA en pacientes con SD son necesarias.
Existen otros factores que se encuentran relacionados con el riesgo de DVA, estos pueden independientemente de la condición citogenética del individuo, modificar de forma desfavorable el estado nutricional de este micronutriente en la población. Al respecto, Castejón et al (2001) señalaron que en Venezuela4, un país tropical donde pese a la abundancia de frutas y vegetales ricos en proVA, existen factores de riesgo en la población que conducen a DVA, entre los que destacan; pobreza, marginalidad socioeconómica, bajo nivel de escolaridad de las madres, suministro irregular de agua potable, parasitosis intestinal y alta prevalencia de desnutrición o nutrición inadecuada en la población infantil marginal; condiciones que contribuyen con las elevadas tasas de morbi-mortalidad debida a infecciones gastrointestinales y respiratorias que constituyen las causa más frecuentes de hospitalización de origen infeccioso en la población de pacientes con SD31,32.
Cabe destacar que el estado nutricional del retinol y derivados retinoides, favorece el desarrollo embriológico del sistema nervioso central y neurogénesis in vivo, promoviendo la diferenciación neuronal temprana y supervivencia de las mismas, de forma que intervienen críticamente como componente de la plasticidad sináptica en el adulto, necesaria en los procesos de aprendizaje y memoria en el hipocampo33. Además, existen estudios neuropatológicos realizados en fetos con SD34 que reportan una disminución de la densidad neuronal; de modo que, el compromiso del estado nutricional de VA puede contribuir a ocasionar daño neuronal en estadios tempranos del desarrollo del sistema nervioso central, alterando eventualmente los procesos de diferenciación y sobrevivencia neuronal, coadyuvando en el deterioro de los procesos de memoria y aprendizaje, con probable repercusión sobre las funciones cognitivas e intelectuales de pacientes con SD35.
Es relevante señalar, que la alta prevalencia de DVA observada en pacientes con SD no escapa del retroceso nutricional que han experimentado los venezolanos como consecuencia de la crisis socioeconómica, política y cultural que vive el país, durante la cual se han sucedido diversos cambios con relación al acceso de alimentación balanceada, el control de calidad de los alimentos y la cobertura de programas sociales, que afectan a los grupos más vulnerables.
Desde el punto de vista preventivo y de salud nutricional, es obligatorio el desarrollo de programas de intervención con dietas no monótonas ricas en alimentos con proVA de consumo habitual, que representan un método eficaz y de bajo costo para mejorar la nutrición y corregir la deficiencia de este micronutriente; sin embargo, existen estudios que señalan que las modificaciones dietéticas no constituyen una estrategia que puedan normalizar el estado nutricional de la VA, por tanto debe acompañarse de suplementación periódica de VA que constituye la intervención más difundida a nivel mundial para controlar la DVA en países en desarrollo36.
No obstante, aunque el uso de la suplementación de VA es una de la principales soluciones estratégicas en contra de la DVA; estudios realizados en animales reportan efectos secundarios posteriores a la administración de dosis terapéuticas y megadosis de VA, que inducen incrementos en la actividad de SOD, exacerbando las concentraciones de especies reactivas de oxígeno en el hipocampo de ratas adultas37. En tanto, suplementar con VA pacientes con SD podría resultar tóxico para el hipocampo y corteza cerebral por inducción de estrés oxidativo. En consecuencia, es prudente realizar estudios terapéuticos de suplementación de VA y concentraciones de SOD en pacientes con SD, y no recomendar el uso periódico de la suplementación con VA en estos pacientes, aún con las dosis terapéuticas sugeridas por IVACG para la población normal.
En conclusión, nuestros resultados señalan que la trisomía del cromosoma 21 constituye un factor citogenético de riesgo para DVA; incluso en ausencia de otros factores de riesgo nutricionales. En consecuencia, es necesario a corto plazo: 1) promover dietas saludables, ricas en proVA en esta población; 2) orientar a los padres o cuidadores de individuos con SD acerca del consumo de alimentos ricos en este micronutriente; 3) realizar estudios de suplementación con VA y SOD en individuos con SD; 4) promover investigaciones nutricionales en pacientes afectados por enfermedades genéticas que contribuyan con las bases para el desarrollo futuro de estrategias nutrigenómicas que consoliden un tratamiento nutricional adecuado en estas poblaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue financiado por el Consejo de Desarrollo Científico y Humanístico (CONDES) de la Universidad del Zulia. Nuestro agradecimiento para el Instituto de Educación Especial Zulia e instituciones que colaboraron con los niños con SD, este trabajo es para ustedes.