El exceso de metionina puede ser causa de alteraciones del sistema nervioso central, tales como edema cerebral difuso y trastornos de la mielinización.
Pacientes y métodoEstudio ambispectivo observacional durante un período de 15 meses de los recién nacidos prematuros ingresados en nuestro hospital que presentaron hipermetioninemia en las pruebas de cribado neonatal por espectrometría de masas en tándem. Seguimiento evolutivo de estos neonatos hasta el año de edad con valoración de sus niveles de metionina en relación con la alimentación, parámetros somatométricos y desarrollo neurológico.
ResultadosDe una población de estudio de 187 neonatos pretérmino, 16 de ellos presentaron hipermetioninemia aislada. El peso y la alimentación de estos recién nacidos con una fórmula de inicio especial enriquecida en metionina está relacionada con el aumento del número de casos de hipermetioninemia aislada transitoria (el 62,6% recibieron un aporte de metionina superior a 97mg/kg/día), además se halló una correlación estadísticamente significativa entre los días que los pacientes recibían esa fórmula y el tiempo que tardaron en normalizarse las cifras de metionina en plasma (r: 0,791; p: 0,000). No observamos correlación entre las cifras máximas de metionina alcanzadas en plasma y la puntuación obtenida en el test de Brunet Lézine a los 6 meses de edad corregida.
ConclusionesEste estudio pone de relevancia la importancia del suplemento de aminoácidos, concretamente de metionina, en las leches de fórmula de los recién nacidos prematuros por la trascendencia que pueden suponer para su desarrollo neurológico.
Excess methionine can cause central nervous system disorders such as diffuse cerebral edema and disorders of myelin.
Patients and methodA retrospective and prospective (ambispective) observational study in preterm newborns admitted to our hospital over a period of 15 months and who had hypermethioninemia in neonatal screening tests by tandem mass spectrometry. The progress of these infants was monitored during the first year of life, assessing their methionine levels, diet, somatometric parameters and neurodevelopment.
ResultsFrom a study population of 187 preterm infants, 16 of them showed isolated hypermethioninemia. Weight and feeding the babies with a special formula enriched with methionine is related to an increased number of cases of transient isolated hypermethioninemia (62.6% received a higher contribution of methionine than 97mg/kg/day). We also found a statistically significant correlation between the days that patients received the formula and the time it takes to normalize the levels of methionine in plasma (R 0.791, p=0.000). There was no correlation between the methionine peak reached in plasma and the score on the Brunet Lézine test, at the corrected age of 6 months.
ConclusionsThis study highlights the importance amino acid supplements, particularly methionine, in premature infants’ formulas due to the impact they may have on neurological development.
Un adecuado aporte de aminoácidos desde los primeros días de vida es fundamental para asegurar el correcto desarrollo de los recién nacidos prematuros, especialmente en aquellos de menor edad gestacional1–3.
Entre los aminoácidos esenciales se encuentra la metionina que, como tal, debe ser incorporada a la alimentación de los neonatos. Además, se trata de un elemento fundamental para el adecuado desarrollo del sistema nervioso central por el papel que juega sobre la formación de la mielina.
La vía catabólica de la metionina o de transulfuración se inicia mediante una reacción catalizada por el complejo enzimático metionina adenosil transferasa (MAT) que convierte la metionina en S-adenosilmetionina (AdoMet). Esta sustancia es un importante dador de grupos metilo, necesarios para la formación de compuestos esenciales para el organismo, entre los que destacan los fosfolípidos, fosfatidilcolina y esfingomielina. Por otra parte, el AdoMet es utilizado por el hígado para convertirlo, tras su unión a la fosfatidiletanolamina, en fosfatidilcolina endógena, que es a su vez precursora de la síntesis de esfingomielina4,5.
Por todos estos motivos, clásicamente se ha considerado beneficioso el enriquecimiento de las leches de fórmula empleadas para la alimentación de los neonatos pretérmino con metionina, por las ventajas que esto podría aportar de cara al adecuado desarrollo neurológico de estos pacientes.
Sin embargo, los estudios de imagen llevados a cabo en pacientes afectos de homocistinuria o en pacientes con un déficit del complejo enzimático MAT I/III sugieren que el exceso de metionina puede producir los efectos contrarios a sus niveles fisiológicos, esto es, la desmielinización cerebral como consecuencia del feed back negativo que ejerce el exceso de metionina sobre la producción de fosfolípidos, y por el déficit de AdoMet asociado y el desarrollo de edema cerebral ocasionado por la inhibición de la bomba de Na+-K+-ATPasa de la membrana neuronal6–9.
El proceso de cribado neonatal mediante la técnica de espectrometría de masas en tándem (MS/MS) ofrece una información de gran fiabilidad en cuanto al análisis y cuantificación de los distintos aminoácidos, incluyendo la medida de metionina, lo que permite la detección tanto de homocistinuria como de hipermetioninemia aislada10,11. Dicha información nos permitió estimar la calidad de la alimentación de los recién nacidos pretérmino ingresados en la Unidad Neonatal de nuestro centro, poniendo en relación los aportes proteicos y de aminoácidos esenciales que recibían estos pacientes con el perfil metabólico determinado mediante esta técnica.
Pacientes y métodosSe estudiaron los neonatos pretérmino (edad gestacional inferior a 37 semanas) que ingresaron en el Servicio de Neonatología de nuestro centro durante el período de enero de 2007 hasta marzo de 2008 y que presentaron alteraciones en las determinaciones de los aminoácidos en las pruebas de cribado neonatal. Es un estudio analítico, observacional y ambispectivo.
Se valoraron hasta un total de 21 amioacidopatías, prestando especial atención a los aminoácidos esenciales, incluidos los semiesenciales tirosina y cisteína. Se realizó un seguimiento posterior con una duración total de 12 meses.
Se descartó la presencia de procesos intercurrentes o tratamientos que pudieran ser causa de aminoacidopatías, así como la existencia de antecedentes familiares de alteraciones metabólicas.
Aunque el cribado metabólico se realizó en todos los pretérminos ingresados, se establecieron criterios de exclusión del estudio basados en la existencia de malformaciones graves, cardiopatías complejas, patología al nacimiento incompatible con la vida, o prematuridad extrema (edad gestacional inferior a 25 semanas).
En aquellos pacientes en los que se detectó hipermetioninemia, se descartaron otras causas responsables —al margen de alteraciones nutricionales— mediante la determinación plasmática de los restantes aminoácidos (de forma especial cistationina, homocisteína y S-adenosilmetionina) y análisis de las enzimas de función hepática (transaminasas y enzimas de colestasis).
Las pruebas metabólicas se llevaron a cabo a las 48h de recibir alimentación con lactancia materna-mixta o leche de fórmula y se repitieron al cabo de 2 semanas de la primera muestra y, a partir de ese momento, cada vez que se recibía la notificación de hipermetioninemia hasta su normalización. Las muestras fueron obtenidas de sangre de talón impregnada en papel secante y analizadas por espectrometría de masas en tándem.
Al revisar las historias de estos pacientes se investigaron posibles causas nutricionales de alteración de aminoácidos: tipo de alimentación recibida (lactancia mixta—ninguno recibió lactancia materna exclusiva—, alimentación parenteral o leche de fórmula), concentración y duración de la misma, factores perigestacionales, edad gestacional, peso al nacimiento y otros.
En los alimentados mediante nutrición parenteral se determinó la duración, el aporte máximo de proteínas y de aminoácidos por kilogramo de peso durante ese período. En los alimentados con leche de fórmula o lactancia mixta, la fórmula de inicio de utilización inmediata fue la misma en todos los casos, la única adaptada a prematuros disponible en nuestro centro en el período estudiado (y a la que denominaremos como fórmula). Cuando estos pacientes alcanzaban un peso superior o igual a 2000g, se cambiaba a otras fórmulas de inicio del niño a término.
Se cuantificó el tiempo de alimentación, la concentración máxima de la leche y el aporte máximo de metionina por kilogramo de peso. En los pacientes en los que se detectaron alteraciones en los niveles de este aminoácido se valoraron las cifras máximas alcanzadas en plasma y el tiempo en que tardaron en normalizarse para cada paciente.
Posteriormente, se analizó la evolución pondoestatural de estos pacientes, recogiendo los datos somatométricos y los percentiles al ingreso, al alta, y a los 3, 6, 9 y 12 meses de edad corregida.
Se valoró el desarrollo neurológico de los pacientes mediante el test de Brunet-Lézine, realizado a los 6 meses de edad corregida.
Los padres fueron informados de la intencionalidad del estudio obteniéndose el consentimiento informado de los mismos. La investigación se realizó con la autorización del Comité Ético de nuestro centro.
Los datos fueron analizados mediante el programa informático SPSS 15 para Windows. Se utilizó la U de Mann-Whitney como prueba estadística no paramétrica para la comparación de variables y el test no paramétrico de correlación de Spearman para el cálculo de asociación entre variables. Se consideró una p significativa inferior a 0,05.
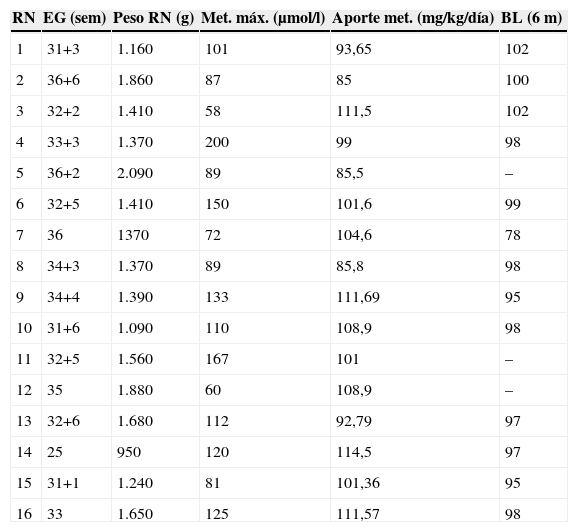
ResultadosDe una población de estudio de 187 neonatos pretérmino, presentaron aminoacidopatías 16 pacientes (el 8,5% de los pacientes ingresados por prematuridad en nuestra Unidad Neonatal) de los cuales 10 eran niñas (el 62,5%) y 6 niños (el 37,5%) (tabla 1).
Resumen de las características de los pacientes
| RN | EG (sem) | Peso RN (g) | Met. máx. (μmol/l) | Aporte met. (mg/kg/día) | BL (6m) |
| 1 | 31+3 | 1.160 | 101 | 93,65 | 102 |
| 2 | 36+6 | 1.860 | 87 | 85 | 100 |
| 3 | 32+2 | 1.410 | 58 | 111,5 | 102 |
| 4 | 33+3 | 1.370 | 200 | 99 | 98 |
| 5 | 36+2 | 2.090 | 89 | 85,5 | – |
| 6 | 32+5 | 1.410 | 150 | 101,6 | 99 |
| 7 | 36 | 1370 | 72 | 104,6 | 78 |
| 8 | 34+3 | 1.370 | 89 | 85,8 | 98 |
| 9 | 34+4 | 1.390 | 133 | 111,69 | 95 |
| 10 | 31+6 | 1.090 | 110 | 108,9 | 98 |
| 11 | 32+5 | 1.560 | 167 | 101 | – |
| 12 | 35 | 1.880 | 60 | 108,9 | – |
| 13 | 32+6 | 1.680 | 112 | 92,79 | 97 |
| 14 | 25 | 950 | 120 | 114,5 | 97 |
| 15 | 31+1 | 1.240 | 81 | 101,36 | 95 |
| 16 | 33 | 1.650 | 125 | 111,57 | 98 |
Aporte met.: aporte máximo de metionina; BL: Brunet-Lézine a los 6 meses de vida; EG: edad gestacional; Met. máx.: valores máximos de metionina alcanzados en plasma; Peso RN: peso al nacimiento.
El 100% presentaron hipermetioninemia aislada, sin encontrarse a lo largo del período de estudio otras aminoacidopatías. El rango superior de normalidad para metionina por nuestro laboratorio de metabolopatías es de 57μmol/l, que corresponde al percentil 99 de la población neonatal estudiada, para garantizar la detección de la hipermetioninemia ocasionada por la homocistinuria.
La edad gestacional media fue de 33,32±3,29 semanas, y el peso al nacimiento medio de 1.467,5±305,12g.
Cuatro pacientes recibieron nutrición parenteral; dos de ellos durante menos de 5 días, uno entre 5 y 10 días y, el cuarto, más de 10 días. En todos ellos la nutrición enteral se inició al 2.° día de vida, aumentándose de forma progresiva.
En la alimentación con la fórmula para prematuros, los aportes máximos de metionina promedio por kilogramo y día fueron: <97mg/kg/día en el 37,5% de los pacientes, 97–107mg/kg/día en el 31,3% y >107mg/kg/día en el 31,3% restante. El cálculo de los aportes se realizó mediante la herramienta para cálculo dietético Odimet® (www.odimet.es). Se hicieron estas valoraciones pues la ingesta media calculada por Formon y Bell12 para neonatos varones entre los 14–28 días de vida (el período de máxima ingesta) es de 62–97mg/kg/día. No existen valores claros de referencia en neonatos prematuros. En recién nacidos sanos, basándose en la composición de la leche materna, la ingesta recomendada es de 33mg/kg de metionina y cisteína.
Con respecto a las cifras máximas de metionina alcanzadas en plasma, encontramos una media de 111±37,38μmol/l, con un valor máximo de 200μmol/l y un mínimo de 60μmol/l.
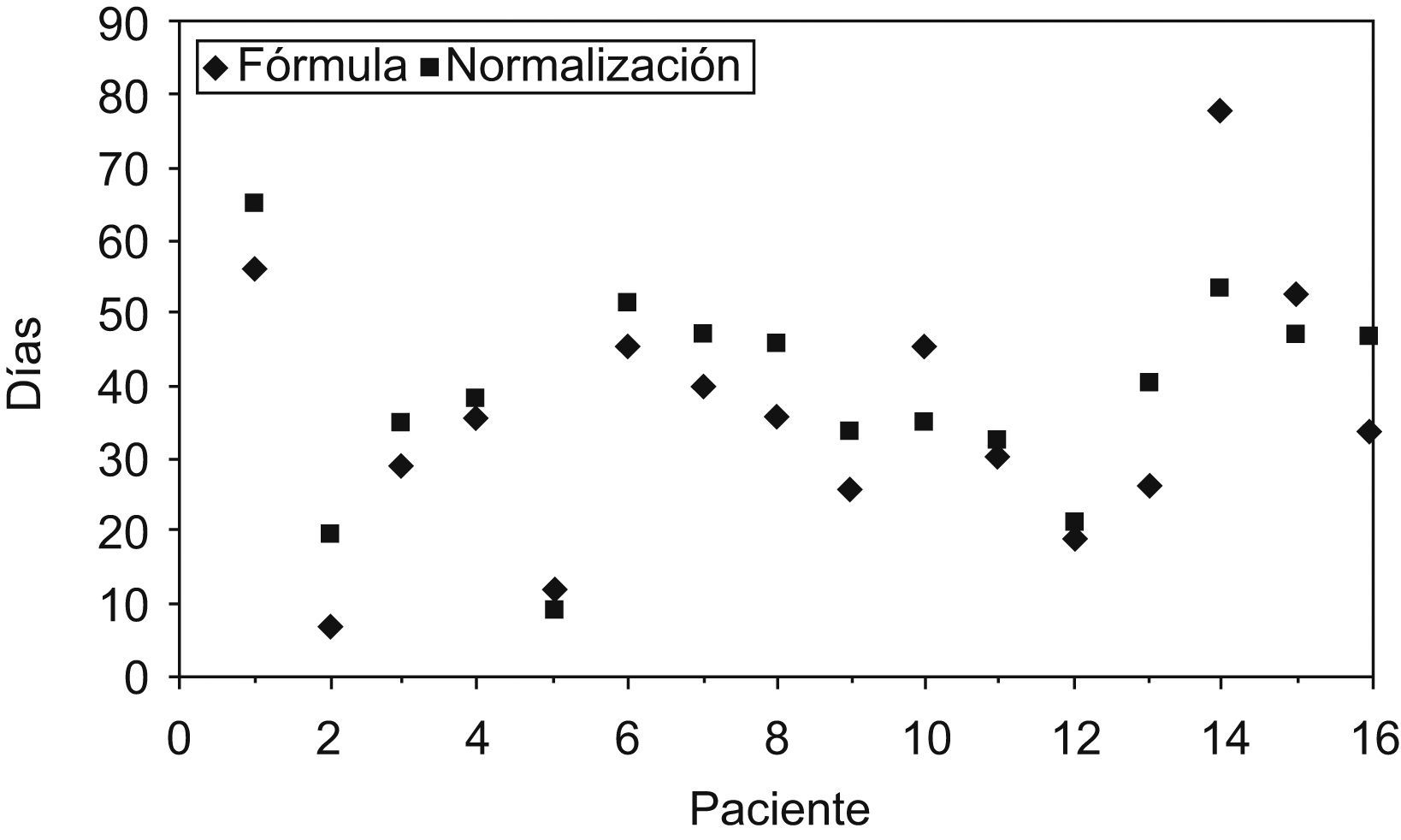
En la figura 1 se muestra la representación gráfica de la relación entre el período de administración de la fórmula para cada uno de los pacientes y el tiempo que tardaron en normalizarse las cifras de metionina en plasma. Mediante la prueba de Spearman, se halló una correlación estadísticamente significativa entre los días en que los pacientes recibían la fórmula y la normalización de metionina (r: 0,791; p: 0,000).
Analizamos el posible efecto del peso y de la edad gestacional sobre la alteración de la metionina de nuestros pacientes, encontrando diferencias estadísticamente significativas (p=0.031) al comparar el tiempo que tardaban en normalizar las cifras de metionina en plasma en función del peso al nacimiento (más tiempo en los menores de 1.500g).
Respecto a la edad gestacional, consideramos tres grupos de pacientes, <32 semanas, 32–35 semanas y >35–<37 semanas, no encontrando diferencias estadísticamente significativas entre estos grupos en función de los días en que tardaba en normalizarse la metionina plasmática ni tampoco con el nivel máximo de metionina alcanzado en plasma.
Con respecto a la evolución de estos pacientes, analizamos la existencia de una posible correlación entre las cifras máximas de metionina alcanzadas en plasma y la puntuación obtenida en el test de Brunet Lézine a los 6 meses de edad corregida, sin encontrar diferencias estadísticamente significativas.
DiscusiónDentro de los aminoácidos esenciales se encuentra la metionina que, como tal, debe ser incorporada a la alimentación de los neonatos. El aporte de este aminoácido en las distintas fórmulas de inicio es muy variado12–14. Generalmente, estas variaciones no suponen ningún problema cuando se trata de recién nacidos a término y con adecuado peso para su edad gestacional, pero en el caso de los prematuros, la situación es distinta, en ellos existe una inmadurez del sistema metabólico, que de forma individual puede ocasionar una intolerancia a esos aportes excesivos de metionina a través de la lactancia artificial, y conducir a una situación de hipermetioninemia que se corrige al disminuir el aporte de metionina en la dieta. Este hecho es lo que constituye la hipermetioninemia aislada transitoria y se objetiva con mayor frecuencia en neonatos ingresados en unidades de cuidados intensivos15.
Mudd et al16 presentaron en el 2003 una serie de 10 pacientes con hipermetioninemia, encontrando que 9 de los 10 recién nacidos habían sido alimentados con la misma leche de fórmula, y que esta había experimentado un aumento en el aporte de metionina de forma reciente. Al sustituir esta leche por otras, los niveles de metionina de los pacientes se normalizaron.
Desde el comienzo de la utilización de la espectrometría de masas en tándem para la determinación de metionina en el laboratorio de metabolopatías de nuestro centro hasta febrero de 2006, se utilizó el reactivo ácido clorhídrico-3N-butanol de Regis Technologies (Inc.) para su butilación. A partir de esa fecha, se utilizó el mismo reactivo pero de la compañía Riedel-de-Haën suministrado por Sigma, observándose de forma general un aumento en el rendimiento de la reacción. Este aumento de sensibilidad del método repercutió de forma significativa en el número de detecciones de hipermetioninemia aislada transitoria en neonatos pretérmino. Sin embargo, al margen de dicho cambio en los reactivos utilizados, este aumento de casos de hipermetioninemia aislada transitoria, prácticamente no se detectó en las muestras de cribado metabólico enviadas desde otros centros de nuestra Comunidad Autónoma.
Teniendo en cuenta que la causa más frecuente de hipermetioninemia aislada transitoria en neonatos prematuros radica en el exceso de aporte de metionina a través de las leches de fórmula empleadas para su alimentación15,16, postulamos que la causa de este fenómeno radicaba en la fórmula que estábamos empleando. Esta contiene 479mg de metionina por cada litro de fórmula preparada a una concentración del 14%, cifra que si bien no resulta excesiva para un neonato a término y con un adecuado peso al nacimiento, sí puede serlo para un recién nacido pretérmino.
Parece existir una susceptibilidad individual para padecer este fenómeno, puesto que no todos los prematuros de nuestra unidad lo experimentan a pesar de ser alimentados todos con la misma fórmula. En este sentido, juega un papel importante la inmadurez del sistema metabólico de cada individuo. Esta inmadurez se supone en relación con la edad gestacional y el peso al nacimiento, que son los otros factores que fueron considerados como favorecedores de hipermetioninemia aislada transitoria en este estudio. De los resultados obtenidos, podemos deducir que el peso es el factor que más influye sobre el desarrollo de hipermetioninemia, probablemente no tanto por el efecto que el bajo peso pueda tener sobre la inmadurez metabólica de los sujetos, como por el hecho de que el cambio en la alimentación se ve marcado por la ganancia ponderal de los mismos, de forma que aquellos con menor peso están expuestos a la fórmula durante más tiempo que los que presentan mayor peso al nacimiento.
Mudd et al16 objetivaron la existencia de edema cerebral en la RNM realizada a 2 de los pacientes con hipermetioninemia transitoria, el cual remitió tras la restricción de metionina en la dieta. Otros autores también objetivaron daño cerebral, tanto en humanos como en experimentación en animales, fundamentalmente edema y desmielinización cerebral en relación con hipermetioninemia mantenida o persistente6,9,17–19. En los pacientes descritos por Mudd et al16,17, los valores de metionina alcanzados fueron superiores a los observados en nuestros casos, hecho que podría justificar la no existencia de estas complicaciones en nuestra serie.
Valoramos el desarrollo neurológico mediante la realización del test de Brunet-Lézine a los 6 meses de edad corregida, encontrando tan sólo un caso de retraso del desarrollo evolutivo. Esta paciente se trataba de una prematura de 34 semanas de edad gestacional, hija de madre adicta a drogas por vía parenteral, con un peso al nacimiento de 1.370g. El cociente de desarrollo (CD) a los 6 meses de edad corregida fue del 78%. Se llevó a cabo estimulación por parte de la Unidad de Atención Temprana de nuestro centro, con mejoría de los ítems analizados a los 9 meses de edad corregida (CD: 82%) y pendiente del desarrollo evolutivo.
No encontramos correlaciones estadísticamente significativas entre los aportes de metionina con la fórmula y la puntuación obtenida mediante el test de Brunet-Lézine a los 6 meses de edad corregida, ni tampoco entre las cifras máximas de metionina alcanzadas en plasma por nuestros pacientes y la puntuación obtenida en dicho test, por lo que concluimos que o bien el tiempo durante el que nuestros pacientes presentaron esta alteración metabólica fue breve o bien no se alcanzaron cifras de metionina en plasma tan nocivas como para afectar la evolución del desarrollo neurológico de los mismos.
Nuestro estudio cuenta con ciertas limitaciones. La principal radica en no contar con un grupo control, ya que todos nuestros pacientes recibían la misma fórmula. De todas formas, consideramos que el hecho de que el incremento del número de casos de hipermetioninemia aislada transitoria se haya objetivado preferentemente en nuestro hospital, da consistencia al hecho de que la fórmula empleada para la alimentación de nuestros prematuros sea la responsable principal de este fenómeno (en el período estudiado, sólo hay constancia de dos casos de hipermetioninemia detectada en otros centros de nuestra Comunidad).
Nuestro estudio es de los primeros y el de mayor tamaño muestral que se realiza para evaluar el efecto de las leches de fórmula sobre las aminoacidopatías. Serán necesarios posteriores estudios para corroborar nuestros resultados, por la trascendencia que pueden suponer para el adecuado desarrollo neurológico de los pacientes prematuros.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.