La tuberculosis continúa siendo uno de los problemas sanitarios más importantes en el mundo. En países desarrollados se está asistiendo a un aumento de casos, incluidos los niños, por diferentes motivos. El más determinante parece ser la inmigración procedente de zonas con elevada endemia de tuberculosis.
Es prioritario que se establezcan las medidas necesarias para optimizar el diagnóstico precoz y adecuado de las distintas formas clínicas de tuberculosis en niños. Para ello, la Sociedad Española de Infectología Pediátrica (SEIP) y la Sociedad Española de Neumología Pediátrica (SENP), ambas pertenecientes Asociación Española de Pediatría, han decidido realizar el presente documento de consenso con el objetivo de unificar los criterios de actuación diagnóstica en la edad pediátrica.
Tuberculosis is one of the most important health problems worldwide. There are an increased number of cases, including children, due to different reasons in developed countries. The most likely determining cause is immigration coming from high endemic areas.
Measures to optimize early and appropriate diagnosis of the different forms of tuberculosis in children are a real priority. Two Societies of the Spanish Pediatric Association (Spanish Society of Pediatric Infectology and Spanish Society of Pediatric Pneumology) have agreed this Consensus Document in order to homogenize diagnostic criteria in pediatric patients.
La tuberculosis (TB) continúa siendo un problema de magnitud mundial, planteando un verdadero reto para la medicina, debido al aumento de su incidencia en nuestro medio, así como a la emergencia de cepas resistentes. En la edad pediátrica, las dificultades añadidas más importantes son: a) una mayor probabilidad de progresión desde la infección a la enfermedad, incluidas formas graves y extrapulmonares; b) los problemas diagnósticos, incluyendo la dificultad para discernir entre infección y enfermedad, el difícil aislamiento microbiológico, y c) las dificultades terapéuticas por los escasos estudios, sobre todo con fármacos de segunda línea, la escasez de formulaciones pediátricas y la problemática de la cumplimentación del tratamiento.
Actualmente siguen existiendo muchas dudas en ciertos aspectos diagnósticos, como la indicación de realizar una u otra técnica para el aislamiento microbiológico (jugo gástrico versus esputo inducido), TC de tórax o estudio endoscópico. En los últimos años, además, se han producido modificaciones en la interpretación de las pruebas clásicas, como la prueba de tuberculina (PT), debido a cambios epidemiológicos recientes, y se han producido algunos avances importantes, como el desarrollo de los tests de producción de interferón gamma y las técnicas de biología molecular. Todos los métodos disponibles, no obstante, siguen siendo insuficientes para asegurar un abordaje diagnóstico óptimo de esta enfermedad, sobre todo en niños pequeños y en inmunodeprimidos, donde aún hay menor experiencia.
Las autoridades y los profesionales responsables deben rentabilizar al máximo las técnicas diagnósticas, así como optimizar las medidas preventivas y terapéuticas para el control adecuado de esta enfermedad infecciosa y evitar al máximo su propagación. La Sociedad Española de Infectología Pediátrica (SEIP) y la Sociedad Española de Neumología Pediátrica (SENP), ambas pertenecientes a la Asociación Española de Pediatría (AEP), han estimado necesaria la realización de un documento de consenso en relación al diagnóstico de la TB en la edad pediátrica, con el objetivo de homogeneizar las actuaciones en este ámbito y así optimizar el abordaje de esta enfermedad.
Historia clínicaAnamnesisLa anamnesis es un elemento esencial en cualquier proceso diagnóstico y alcanza su valor máximo en pediatría (datos de la familia), ante enfermedades contagiosas (información referente al foco de transmisión), en procesos con poca expresividad clínica (importancia de signos y síntomas sutiles) o en infecciones que cursan con síntomas inespecíficos (fiebre, vómitos, pérdida de peso, etc.) como sucede en la TB.
Antecedentes familiaresSe debe incluir:
- •
Una historia detallada de los casos de TB y de manifestaciones no bien definidas compatibles con ella (por ejemplo: fiebre prolongada, eritema nodoso), especificando las fechas y las actuaciones médicas llevadas a cabo, tanto en los enfermos como en sus familiares, con especial atención al caso motivo de la historia clínica.
- •
Cuando se haya diagnosticado un caso de TB en un niño, interesa recopilar todos los datos de la familia que pudieran predisponer o sugerir la existencia de resistencias1: área geográfica de origen (país, región), contagio a partir de personas con infección por el virus de la inmunodeficiencia humana o que hayan estado en prisión o realizado un tratamiento inadecuado (mal cumplimiento, pauta de medicación antituberculosa insuficiente) o hayan tenido una recaída.
- •
Posibilidad de que haya otros contactos (familiares, escuela, etc.) que estén infectados.
- •
Posibilidad de que existan otros contactos (familiares, escuela, etc.) infectados que puedan contagiar la enfermedad tras haber descartado como fuente, a los familiares más cercanos.
Además de los antecedentes fisiológicos y patológicos estándar sobre embarazo, parto, lactancia, vacunaciones y enfermedades en general, hay que indagar específicamente sobre:
- •
Antecedente de vacunación con bacilo Calmette-Guerin (BCG).
- •
Antecedentes de TB y de realización de una PT.
- •
Intensidad de exposición a la posible fuente de contagio y características de esta (bacilífera o no, riesgo de resistencias).
- •
Inmunodeficiencias y enfermedades inmunosupresoras, haciendo especial hincapié en las inmunodeficiencias selectivas predisponentes a infecciones por micobacterias.
- •
Tratamientos inmunosupresores.
Es muy importante conocer si existen antecedentes de infección o enfermedad tuberculosa en pacientes que vayan a ser sometidos a tratamiento inmunosupresor para poder darles quimioprofilaxis, así como realizar una PT a quienes vayan a ser tratados con corticoides sistémicos, citostáticos o fármacos biológicos como los anti-factor de necrosis tumoral (anti-TNF) relacionados con riesgo de desarrollar TB2, siendo infliximab y el adalimumab más predisponentes que etanercept según un estudio reciente de adultos3.
En los pacientes que hayan recibido previamente tratamiento antituberculoso, parcial o completo, se deben precisar las fechas, los fármacos, la posología y el cumplimiento terapéutico.
Enfermedad actualLa TB es a menudo asintomática o poco expresiva. En ocasiones cursa con febrícula o fiebre prolongada, cansancio, anorexia y pérdida de peso4,5 y, dependiendo de la forma de presentación podría aparecer también tos y dificultad respiratoria (neumonía, TB miliar)6, estridor o sibilancias (adenopatías mediastínicas, granuloma endobronquial)7, dolor en punta de costado con o sin fiebre (pleuresía)8, signos y síntomas de afectación del sistema nervioso central (meningitis, tuberculoma cerebral)9, adenopatía o adenopatías con mayor o menor expresión inflamatoria según la fase (adenitis); sinovitis de una articulación grande o más raramente pequeña (artritis), cifosis progresiva o dolor de espalda con o sin afectación de nervios periféricos (espondilitis); dolor abdominal o franca peritonitis (TB abdominal); hematuria o piuria estéril (TB renal y de vías urinarias); abscesos o úlceras cutáneas u otras manifestaciones de localizaciones infrecuentes8,9; signos de hipersensibilidad tuberculínica, como eritema nodoso o conjuntivitis flictenular10.
Exploración físicaLos hallazgos físicos de la TB infantil son inespecíficos y usualmente muy poco significativos en las formas leves y moderadas de la enfermedad. En los estadios de exposición y de infección latente son inexistentes. A veces, el eritema nodoso o la conjuntivitis flictenular pueden ser los únicos signos clínicos en un niño recientemente infectado con Mycobacterium tuberculosis11.
El eritema nodoso es una reacción tóxico-alérgica en forma de lesiones nodulares dermoepidérmicas, de unos 2–3cm de tamaño, que se ubica en las zonas de extensión de los miembros, sobre todo en las crestas tibiales. Suelen ser bilaterales, dolorosas de forma espontánea y exageradamente bajo presión. Se acompañan a menudo de faringitis, fiebre y artralgias o artritis y afectan con mayor frecuencia a niñas mayores de 6 años de edad12. Su detección obliga a plantear un diagnóstico diferencial con otras etiologías.
La conjuntivitis flictenular es una queratoconjuntivitis alérgica caracterizada por la presencia de pequeñas vesículas, únicas o múltiples, de color amarillento, rodeadas de una zona congestiva, que usualmente evolucionan a úlceras y se resuelven sin escaras. Suelen causar fotofobia, lagrimeo y blefaroespasmo12.
Las manifestaciones de la TB pulmonar primaria tienden a diferenciarse según la edad. Los lactantes (80–90%) y adolescentes, suelen tener mayor expresividad clínica que los niños de edad escolar en los que, a menudo, la enfermedad es silente (50–60%)13,14. Los signos físicos son sorprendentemente escasos en relación a la extensión de los hallazgos radiológicos observados15. Cuando existen, lo más común es detectar una disminución de los ruidos respiratorios o la presencia de estertores o sibilancias, muchas veces localizadas, mimetizando una aspiración de cuerpo extraño16. Estos ruidos se producen como consecuencia de la compresión o erosión bronquial producida por el agrandamiento de los ganglios linfáticos hiliares y mediastínicos, que provoca la obstrucción parcial o total del bronquio16. En las formas más extensas, la tráquea o las vías aéreas medias pueden verse afectadas, apareciendo estridor17.
Cuando existe neumonía o atelectasias, que también son más frecuentes en el niño pequeño, es habitual la existencia de taquipnea, matidez a la percusión, aleteo nasal, egofonía y crepitantes. Si la consolidación parenquimatosa es amplia y rodea a un bronquio abierto, puede oírse un soplo tubárico, mientras que la presencia de una cavidad daría lugar a un sonido respiratorio distante, hueco, anfórico, como si se soplara a través de un vasija.
El derrame pleural, complicación más común en los niños mayores, suele provocar en sus primeros estadios, dolor torácico persistente4, que se incrementa en la inspiración profunda y da lugar a una respiración entrecortada. Provoca una disminución de los ruidos respiratorios a la auscultación, matidez a la percusión y, ocasionalmente, datos de desplazamiento mediastínico.
En un niño pequeño con historia de tos y signos de distrés respiratorio debería considerarse la posibilidad de una TB miliar. Muy a menudo su comienzo es insidioso aunque, en el intervalo de unas semanas, la mitad de los casos presentan hepatoesplenomegalia y linfoadenopatías generalizadas. Por último, se hacen patentes los signos respiratorios que incluyen taquipnea o disnea, cianosis, sibilancias y/o crepitantes16. Entre 30–50% de los niños con TB miliar tienen también meningitis. Por ello, se debe realizar una cuidadosa exploración neurológica y una punción lumbar en los menores de 24 meses o ante la mínima sospecha clínica. En los primeros momentos suele ser negativa, dado el curso insidioso de esta afectación, pero cuando progresa se puede apreciar rigidez de nuca, alteración de los reflejos tendinosos profundos, letargia y/o parálisis de los nervios craneales, fundamentalmente del sexto par. En este momento en el fondo de ojo se puede apreciar un papiledema y/o la presencia de tubérculos coroideos. Puede haber también desorientación y alteraciones del habla. En los estadios finales ya es fácil que exista coma, convulsiones, movimientos anormales (coreoatetosis, paresias, parálisis), etc., que se pueden acompañar de opistótonos o de una postura de descerebración o decorticación12.
Respecto a otras formas de TB extrapulmonar, la más frecuente es la linfoadenopatía periférica dado el alto tropismo que M. tuberculosis muestra por los nódulos linfáticos, sobre todo en los niños pequeños. Los ganglios mediastínicos son los más comúnmente afectados, pero en el 25–35% de los casos se infectan los ganglios del cuello, lo que se conoce como escrófula12. Dado que este tipo de afectación puede ser causado por micobacterias no tuberculosas (MNT), sobre todo en los niños menores de 5 años, se debe plantear siempre este diagnóstico.
La escrófula se manifiesta casi exclusivamente por unos ganglios cervicales aumentados de tamaño, localizados habitualmente en la región posterior, o en la zona supraclavicular. Mucho menos frecuentemente pueden afectarse los ganglios submandibulares, submentonianos, axilares o inguinales. Inicialmente tienen una consistencia dura, no son fluctuantes, ni dolorosos o eritematosos, pero tras la caseificación pueden supurar, drenar espontáneamente y necrosarse18.
La TB ósea, como forma de TB silente, puede pasar desapercibida durante meses o años a causa de la falta de signos o síntomas. Puede afectar a huesos y articulaciones, habitualmente los de mayor sobrecarga, como vértebras (50%), caderas (15%) y rodillas (15%)19. La destrucción ósea con aparición de deformidades es el último signo de la enfermedad, con manifestaciones como angulación de la columna vertebral y cifosis grave por destrucción de los cuerpos vertebrales lo que se conoce como «enfermedad de Pott» o, si se afecta la columna cervical, con subluxación de la articulación atlantoaxial produciendo paraplejia o cuadriplejia. En estos casos suelen existir participación adenopática de las regiones inguinal, epitroclear o axilar.
Diagnóstico inmunológico de la infección tuberculosaDiagnóstico de la infección «in vivo»: prueba de tuberculinaLa PT es el método más útil para el diagnóstico de la infección tuberculosa y una ayuda muy valiosa para el de la enfermedad, tanto en niños como adolescentes20–22. Se basa en que la infección por M. tuberculosis produce una hipersensibilidad retardada a ciertos componentes antigénicos del bacilo.
La técnica debe ser rigurosa y realizarse por personal entrenado para conseguir resultados óptimos. La tuberculina debe conservarse a 4°C y preservada de la luz. Se recomienda emplear la técnica de Mantoux, que permite la cuantificación de la reacción. Con aguja de calibre 27, en la cara anterior del antebrazo, se realiza la inyección intradérmica de 0,1ml/2UT de PPD RT-23 con Tweeen-80, se debe producir una pápula de 6–10mm que es crucial para que la técnica sea la adecuada. La reacción debe ser leída a las 72h después de la inyección, cuando consigue la máxima induración, aunque el intervalo permitido es entre el segundo y el cuarto día. Sólo se debe valorar la induración producida, no el eritema, medida en milimetros, del diámetro máximo transversal al eje mayor del antebrazo, y debe anotarse con fecha y firma en la historia clínica del niño. Si no existe induración debe anotarse 0mm en lugar de negativo. La reactividad tuberculínica aparece a las 2–12 semanas después de la infección inicial, con una mediana de intervalo de 3–4 semanas. La induración con vesiculación o necrosis es indicativa de infección TB. No se aconseja realizar cribados repetidos con PT en la población infantil de bajo riesgo por su bajo rendimiento; las recomendaciones mas recientes en este sentido son evaluar el riesgo de TB, mediante cuestionarios o preguntas dirigidas en la primera consulta con el niño, cada 6 meses en los primeros 2 años y luego anualmente20,21.
Las vacunas de virus vivos atenuados (sarampión, ruebeola, parotiditis, varicela, polio oral, fiebre amarilla y tifoidea oral), pueden producir anergia tuberculínica durante 4–6 semanas23. La PT puede realizarse simultáneamente a la administración de estas vacunas, pero en caso de administración previa de las mismas, la prueba debe posponerse 4–6 semanas21. Por otro lado, la realización de una PT no debe hacer retrasar la administración de estas vacunas, ya que aquella no inmunodeprime.
Interpretación de la prueba de tuberculinaUna induración ≥5mm se considera reacción cutánea relevante, pero la probabilidad de que se corresponda con una infección tuberculosa real, estará en función del riesgo de la situación que se esté analizando. Según dicho riesgo, se aceptan 2 puntos de corte de positividad de la reacción de Mantoux, situando el dintel de la PT en el menor tamaño (≥5mm) para los niños con riesgo elevado de desarrollar la enfermedad, aplicando la induración de mayor tamaño (≥10mm) para niños en situación de menor riesgo22,24,25 (tabla 1).
Dinteles de positividad de la reacción de Mantoux en nuestro medio
| Con induración ≥5mm |
|
| Con induración ≥10mm |
|
Una PT ≥5mm obliga a descartar TB activa (estudio radiológico) y hacer estudio de contactos ascendente en su entorno más inmediato, por si existe una fuente de infección aún no detectada.
Un motivo de error en la interpretación de la PT es el «efecto de empuje o sumación» (en inglés: booster effect) que se produce en los vacunados con BCG, infectados por MNT y en las infecciones antiguas. Todos ellos, cuando se les practica una PT, reaccionan por debajo del dintel de positividad y se consideran negativos, pero los antígenos inyectados estimulan la memoria inmunológica por lo que al practicar una segunda prueba, pasados unos 7 días desde la primera, la reacción es positiva y el individuo puede ser catalogado erróneamente como convertor por infección reciente. Para obviarlo, se sugiere que cuando se pase de una induración menor de 10mm a una mayor de 10mm, se considerará que existe una infección tuberculosa latente (ITBL) si la segunda PT es 6mm o más, superior a la primera PT23,26,27.
Los CDC no recomiendan la realización del test tuberculínico en 2 etapas para la provocación del efecto de empuje en los estudios de contactos28.
Una PT negativa no excluye ni ITBL, ni enfermedad TB. Los falsos negativos pueden estar justificados por: a) factores dependientes del huésped: corta edad, infección reciente (período prealérgico), comorbilidad, vacunaciones y tratamientos que produzcan inmunosupresión y TB diseminada o con afectación de las serosas (miliar, meningitis), y b) factores relacionados con la técnica (administración y lectura defectuosas).
Recomendaciones para la realización de una prueba de tuberculina en niños y adolescentesPueden observarse en la tabla 2.
Recomendaciones para la realización de una prueba de la tuberculina en niños y adolescents
| PT inmediata |
|
| PT anual |
|
Existen técnicas basadas en la producción de interferón-gamma (IFN-γ) por las células T sensibilizadas frente a M. tuberculosis, denominadas Interferon Gamma Release Assays (IGRA). Se dispone de preparados para medir la cantidad de IFN-γ (QuantiFERON®-Gold-In tube; Cellestis, Victoria, Australia) o el número de células que lo producen (T-SPOT.TB®; Immunotec, Oxford, Reino Unido). Para la estimulación celular se utilizan antígenos como la proteína secretada de 6kD (ESAT6) y la proteína presente en los filtrados de cultivos, CFP10, que pertenecen a la región genómica RD1, presente en MTB complex y en un número escaso de MNT (M. kansasii, M. szulgai y M. marinum) y ausentes en M. bovis BCG. Recientemente se ha incorporado la proteína TB7.7 de la región RD11.
En el momento actual se sabe que aunque no existe una prueba gold estándar para diagnosticar la ITBL, las técnicas IGRA tienen una mayor especificidad si se comparan con la PT29–31. Se ha demostrado la utilidad de las IGRA en el diagnóstico de la ITBL en el grupo de contactos de un caso de TB bacilífera, al haber observado asociación con: a) el incremento del riesgo de exposición, b) tener contacto diario superior a 6h y c) un tiempo de exposición al caso índice mayor de 30 días32. Para el estudio de contactos, T.SPOT-TB® ha demostrado ser más sensible que la PT para el diagnóstico de la ITBL, mientras que QuantiFERON® proporciona una sensibilidad similar a la de la PT.
Todos los estudios coinciden en demostrar que los resultados no se afectan por la vacunación con BCG y que la repetición del análisis no provoca efecto booster, lo que incrementa la utilidad de las IGRA en el diagnóstico de ITBL en vacunados con BCG.
Ambas técnicas IGRA han demostrado una alta sensibilidad y especificidad (superior al 80%) en el diagnóstico de enfermedad tuberculosa, tanto en adultos como en niños, siendo superior T.SPOT-TB® (sensibilidad >80%) frente a QuantiFERON® (sensibilidad >70%)33–35, al igual que antes. Las técnicas IGRA ayudan en el diagnóstico de enfermedad en los casos difíciles, como en niños, pacientes inmunodeprimidos y TB extrapulmonar (TB miliar y meníngea)32,36.
Una de las características de las IGRA es la existencia de resultados «indeterminados», que no permiten obtener una conclusión. Aunque este tipo de resultado se puede producir por diversos mecanismos, en general se debe al fallo del control positivo. El porcentaje de resultados indeterminados oscila entre 1,5–32%, siendo más frecuente con el test de QuantiFERON® que con el de T-SPOT.TB®. Estos resultados indeterminados se han asociado a estados de inmunosupresión, edad avanzada, edad inferior a 3–5 años (sobre todo lactantes pequeños) y PT negativa37,38. Una causa importante de resultados indeterminados en niños se asocia a la obtención de un número insuficiente de células mononucleares en la sangre periférica extraída por venopunción. Es recomendable analizar si existe una causa justificada y repetir la prueba para su comprobación32. Si el resultado sigue siendo indeterminado, se debe de interpretar junto a la clínica, los antecedentes epidemiológicos, las pruebas de imagen y las técnicas microbiológicas para la toma de decisiones, con un control cercano y una reevaluación frecuente.
En ocasiones tambien se observan falsos negativos en niños con enfermedad tuberculosa39 y en casos de ITBL con exposición muy antigua38,40.
En el momento actual y sujeto a posteriores revisiones, se pueden hacer las siguientes recomendaciones:
- 1.
La PT sigue siendo el test de elección en el cribado de la ITBL.
- 2.
Las IGRA se utilizan como prueba complementaria para incrementar la especificidad, reduciendo la interferencia de la vacunación BCG previa o la infección por MNT.
- 3.
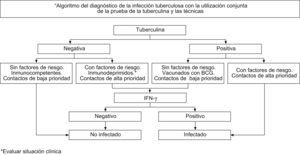
En el «estudio convencional de contactos» (ECC), las IGRA deben ser utilizadas para el diagnóstico de ITBL en función del riesgo de ITBL y de inmunosupresión (Fig. 1). Para el ECC debe seguirse el esquema de los círculos concéntricos y a partir de un caso índice investigar a sus contactos estableciendo «prioridades» según la probabilidad de infección TB y de los resultados potenciales de esta infección. Tienen alta prioridad para ser investigados los contactos de enfermos bacilíferos, pero además las personas que tienen contacto estrecho o prolongado, los niños menores de 5 años y las personas con alteraciones del sistema inmunitario. Contactos de prioridad mediana son aquellos en los que el contacto es diario, pero menor de 6h al día y los contactos de baja prioridad son los que el contacto es esporádico (no diario). Los principales factores de riesgo para el desarrollo de la enfermedad son la infección reciente (menos de dos años tras la primoinfección), la edad (los niños menores de 5 años, los adolescentes y los adultos jóvenes) y la presencia de otras comorbilidades o tratamientos que alteren la inmunidad41.
La confirmación bacteriológica mediante el aislamiento del M. tuberculosis en cultivo es considerada como el patrón oro de diagnóstico, pero es difícil de conseguir en niños y el resultado requiere varias semanas. Su sensibilidad es baja y depende de la forma de presentación de la enfermedad y del tipo de muestra. Con excepción de los niños mayores y adolescentes que puedan expectorar, tradicionalmente se recogen aspirados gástricos en 3 días consecutivos, a primera hora de la mañana, en ayunas y con el niño ingresado, si bien no parecen existir diferencias significativas cuando se toman de forma ambulatoria42.
Recogiendo varias muestras de jugo gástrico, la sensibilidad del cultivo oscila entre el 30–40%, siendo mayor en lactantes y en los casos de enfermedad pulmonar avanzada43. El lavado broncoalveolar también presenta baja sensibilidad para el aislamiento44, pero puede tener un valor diagnóstico adicional en los casos en los que se sospeche una TB endobronquial o se intente hacer un diagnóstico diferencial con otros procesos infecciosos, como ocurre por ejemplo en el niño inmunodeprimido45.
La recogida de un aspirado nasofaríngeo basal o tras la inducción de esputo con suero salino hipertónico, tiene una sensibilidad similar a la de los aspirados gástricos, por lo que pueden ser una alternativa para los niños no ingresados46. Posiblemente el mejor rendimiento se obtenga realizando en el mismo día el esputo inducido y el jugo gástrico47. Sin embargo, la mayoría de estos estudios se han realizado en el ámbito hospitalario por lo que no son extrapolables a los niños ambulatorios. Además, cuando se efectúe con esputo inducido, deben extremarse las medidas de seguridad para evitar posibles contagios en el personal sanitario.
La tinción directa del frotis de jugo gástrico, generalmente mediante la técnica de Ziehl-Neelsen o con auramina, tiene una sensibilidad menor del 15% en niños con TB, aumentando en los que presentan una enfermedad tipo adulto. Los resultados falsamente positivos son poco frecuentes, por lo que una tinción positiva tiene la suficiente relevancia diagnóstica como para valorar el inicio del tratamiento especifico, en espera del cultivo. La tinción directa no es específica en aquellas situaciones donde sean frecuentes las MNT como ocurre en pacientes con patología pulmonar estructural (fibrosis quística, bronquiectasias) o inmunodeficiencias, así como en las muestras de adenitis.
Otras muestras clínicasEn muestras de líquido pleural o empiema se aísla M. tuberculosis en menos del 40% de los casos, pero la biopsia pleural mejora la sensibilidad del cultivo y puede visualizar los típicos granulomas que orientan el diagnóstico, aumentando este hasta en el 80% de los casos48. En la meningitis tuberculosa, el cultivo de LCR también tiene baja sensibilidad, por lo que deben de recogerse además otras muestras clínicas del paciente para mejorar el rendimiento diagnóstico. La punción aspiración de las adenitis y la biopsia tienen mejor rentabilidad microbiológica, teniendo en cuenta que la tinción directa también es positiva en las adenitis causadas por MNT.
Métodos de amplificación de ácidos nucleicosLas técnicas de amplificación de ácidos nucleicos, como la reacción en cadena de la polimerasa (PCR), son más rápidas y sensibles que el cultivo para el diagnóstico de TB en niños, pudiendo conocer su resultado en pocas horas o días. Las PCR realizadas manualmente parecen ofrecer mejor rendimiento que las comerciales con una sensibilidad del 40–80% en muestras de jugo gástrico49. La sensibilidad de la PCR en el aspirado nasofaríngeo basal o tras inducción de esputo parece inferior que en jugo gástrico posiblemente por la menor cantidad de muestra. Existen técnicas que diferencian las distintas micobacterias, siendo de especial interés en los casos de adenitis50.
Pueden aparecer falsos negativos (escasez de micobacterias, presencia de inhibidores de la reacción) y falsos positivos por contaminación de amplificados de pruebas previas, por lo que su uso se limita a los casos de diagnóstico difícil o urgente, en centros con experiencia en la técnica y siempre en correlación con los hallazgos clínicos49.
Genotipado de cepasLas técnicas de genotipado permiten obtener un «DNI genético» de cada cepa, que en el contexto de una TB recurrente permite diferenciar reactivación de reinfección, conocer la composición clonal de la infección por M. tuberculosis e identificar de forma precisa las cadenas de transmisión de M. tuberculosis. Las más evaluadas y utilizadas son el RFLP-IS610 y el spoligotipado, pero en los últimos años han aparecido técnicas de genotipado basadas en PCR (VNTR-MIRU, ETR, VNTR), que aceleran la obtención de resultados51.
En la población pediátrica, estas herramientas han desvelado aspectos sorprendentes, como el hecho de que en un 15% de los casos de transmisión en un medio familiar52, las cepas aisladas del niño difieren de las del caso índice teórico. Estos datos indican que la epidemiología molecular mejora el conocimiento de las rutas de transmisión y revela que aún queda mucho por conocer acerca de la epidemiología de la infección, tanto en niños como en adultos. Pero estas técnicas no deben sustituir al estudio convencional de contactos, sino que deben complementarse, especialmente en los pacientes menores de 15 años53.
El estudio de las líneas de transmisión de la TB entre las comunidades de autóctonos e inmigrantes mediante la epidemiologia molecular demuestra la actual transmisión bidireccional entre ambas comunidades54.
Métodos de detección de resistenciasDebido a la creciente amenaza que representa la TB multirresistente (TB-MDR) y la TB con resistencia-ampliada (TB-XDR), se considera cada vez más necesario el estudio de las resistencias de M. tuberculosis. Por ello, el «Plan para la prevención y control de la tuberculosis en España»41 recomienda que, en todos los casos en que se obtenga el aislamiento e identificación de M. tuberculosis en una muestra clínica, se realice su antibiograma.
El conocimiento del perfil de sensibilidad a los antituberculosos convencionales de aislados de M. tuberculosis tiene 3 posibles fines: servir como guía para el tratamiento antituberculoso, confirmar la existencia de resistencias a los antituberculosos en casos de fallo terapéutico ayudando a elegir nuevos fármacos y, por último, estimar la prevalencia de la resistencia primaria y adquirida de las cepas clínicas de M. tuberculosis en una población.
Hoy en día podemos plantear 2 métodos de estudio de sensibilidad a los fármacos antituberculosos: la detección genotípica de la resistencia a partir de una muestra directa, o bien la clásica detección fenotípica a partir de un cultivo.
El método fenotípico es el de las proporciones según el número de unidades formadoras de colonias que crecen en un medio con el/los fármaco(s) estudiado(s) y en un medio control. Se considera que una cepa es resistente cuando el 1% del inóculo en estudio es resistente a una concentración prefijada de un determinado fármaco55. Los métodos automatizados en cultivo líquido son la opción más utilizada por su rapidez y fiabilidad para la detección de resistencias a fármacos de primera línea. El sistema más utilizado en los laboratorios de micobacterias actualmente es el BACTEC MGIT 960®56. Este sistema permite conocer el patrón de sensibilidad para isoniazida, rifampicina, etambutol, estreptomicina y pirazinamida, con una concordancia del 96–8% en menos de 10 días. Por otro lado, actualmente se carece de criterios estandarizados de evaluación e interpretación para las pruebas de sensibilidad a los fármacos de segunda línea55,57.
La detección genotípica no está disponible en la mayoría de los laboratorios. Consiste en el rastreo de las mutaciones habitualmente asociadas al desarrollo de resistencias, directamente en muestras clínicas sin necesidad de cultivo58. Se pueden realizar para rifampicina (detección de mutaciones del gen rpoB) e isoniacida (detección de mutaciones en el gen katG e inhA). Existen múltiples métodos moleculares aplicables, como las técnicas de secuenciación de DNA, en electroforesis o en técnicas de hibridación, que permiten la obtención del antibiograma incluso el mismo día como el GENOTYPE MTBDR plus (Hain-Lifescience). Estos métodos no conllevan una especial complejidad siendo rápidos y rentables. El principal inconveniente es que no se conocen todas las mutaciones genéticas relacionadas con las resistencias57.
Otras pruebas diagnósticasLas técnicas basadas en la demostración de anticuerpos frente a M. tuberculosis se han investigado durante mucho tiempo, pero hasta el momento no existe ningun procedimiento que reemplace a la microscopía y al cultivo31. Tampoco existe ningún método suficientemente sensible, específico o práctico para ser utilizado en el diagnóstico clínico de la TB. La especificidad está obstaculizada por la interferencia que producen las reacciones cruzadas en la infección por MNT, lo que da resultados falsamente positivos. La sensibilidad es alta en los enfermos con baciloscopia positiva, pero es muy baja en los niños, en los pacientes con TB extrapulmonar, en la coinfección con el VIH y en los casos con baciloscopia negativa59.
Tanto el aumento de la adenosindeaminasa en el líquido pleural, como el cociente lisozima en líquido/lisozima en suero (superior a 1,2 es característico) podrían ser útiles en la TB pleural60. La más conocida, la adenosideaminasa tiene baja especificidad, con falsos positivos en otros tipos de derrames (empiemas, artritis y lupus)61.
Diagnóstico radiológico de la tuberculosis pulmonarFisiopatología de la primoinfección tuberculosaLa principal vía de infección de la TB en el niño es la inhalación de gotitas de secreciones pulmonares aerosolizadas, eliminadas con la tos o el estornudo de adultos bacilíferos. La zona del parénquima pulmonar donde se produce la penetración alveolar del bacilo se conoce como chancro de inoculación y no suele ser visible radiológicamente. En las primeras 4–6 semanas se produce una linfangitis local y la infección se propaga, a través de los vasos linfáticos, a los ganglios linfáticos regionales. Los lóbulos superiores drenan a los ganglios paratraqueales ipsilaterales, mientras que el resto del pulmón drena a los ganglios perihiliares y subcarinales. La combinación del chancro de inoculación, linfangitis local y adenopatías regionales constituye el complejo primario de Ghon. En la mayor parte de los casos, la infección es controlada por el sistema inmunitario y el complejo de Ghon se resuelve espontáneamente, en ocasiones con calcificación. Sin embargo, la infección tuberculosa puede progresar a enfermedad a partir del chancro de inoculación, de las adenopatías regionales, o de ambos. La progresión del chancro suele originar un infiltrado parenquimatoso, o derrame pleural tras su ruptura al espacio pleural. Mucho más frecuente es el aumento de tamaño de los ganglios linfáticos regionales debido a la caseificación central y al edema inflamatorio circundante62,63. Su crecimiento puede ocasionar compresión de la pared del bronquio, dando lugar a una obstrucción bronquial incompleta (atrapamiento aéreo) o a una obstrucción bronquial completa con colapso distal (atelectasia). En ocasiones, la adenopatía puede infiltrar y romper la pared bronquial, y el drenaje del material caseoso origina la formación intraluminal de pólipos y tejido de granulación que, nuevamente, producen fenómenos obstructivos o diseminación broncógena63.
Radiografía simpleLas manifestaciones radiológicas de la TB en el niño son muy variables. No hay ninguna lesión patognomónica, y suele adoptar alguna de las siguientes formas62–65:
- A.
Formas adenopáticas. La presencia de adenopatías hiliares o mediastínicas es el hallazgo radiológico más frecuente en la TB pediátrica66. Suelen presentarse como un aumento de densidad generalmente de bordes poco definidos, y pueden acompañarse de áreas de atrapamiento aéreo o atelectasia62. Su interpretación en la radiografía de tórax es complicada y, a menudo, no hay concordancia entre observadores, ocasionando falsos positivos y negativos67.
- B.
Formas neumónicas. Pueden ocasionarse por evolución del chancro de inoculación, o por diseminación broncógena tras el drenaje de una adenopatía. Radiológicamente, se presentan como condensaciones segmentarias o lobares, de bordes mal definidos, de difícil diferenciación con una neumonía bacteriana63. Con frecuencia se acompañan de adenopatías hiliares o mediastínicas y, con menor frecuencia de derrame pleural66.
- C.
Formas cavitadas. Son raras en el niño. Pueden producirse por progresión del foco inicial en los lactantes muy pequeños o niños inmunodeprimidos (TB primaria progresiva), o, con más frecuencia, en los adolescentes (formas postprimarias o «tipo adulto»)64. La forma posprimaria se produce por reactivación o reinfección en pacientes que han tenido contacto previo con el bacilo. La existencia de inmunidad previa desencadena una gran respuesta inflamatoria local con destrucción tisular, expulsión bronquial del caseum, y formación de cavernas. Las lesiones suelen localizarse en los segmentos apicales y posteriores de los lóbulos superiores65.
- D.
Formas endobronquiales. Se producen habitualmente en niños menores de 4 años tras la fistulización de una adenopatía a un bronquio adyacente. Pueden ocasionar obstrucción bronquial, originando áreas de atrapamiento valvular o de atelectasia, o diseminación bronquial, dando lugar a infiltrados neumónicos o nódulos pulmonares62.
- E.
Formas miliares. Se originan por diseminación hematógena, con siembra pulmonar de numerosos tubérculos de aproximadamente 2mm de diámetro62. Suelen mostrarse como micronódulos de densidad aumentada y contornos nítidos no confluentes de predominio en los lóbulos inferiores65. Esta forma de la enfermedad es propia de niños con pobre inmunidad celular como sucede en lactantes, malnutridos o inmunodeficientes63.
- F.
Otras formas. La TB evolucionada puede manifestarse como una masa pulmonar, habitualmente con áreas de calcificación, necrosis y cavitación. En los niños inmunodeprimidos pueden aparecer además patrones atípicos, como infiltrados intersticiales difusos que, en pacientes con infección por VIH, pueden confundirse con una neumonía intersticial linfoide65.
La radiografía de tórax es muy subjetiva y con poca sensibilidad y especificidad para la detección de adenopatías paratraqueales o subcarinales67–69. Esto explica que hasta un 10% de los niños con TB demostrada por cultivo presenten radiografías de tórax normales70. La ecografía torácica, la resonancia magnética y, en especial, la TC con contraste son métodos más objetivos y precisos para la detección de adenopatías71. En la TC, las adenopatías patológicas suelen tener entre 5–10mm y muestran hipodensidad central y realce periférico tras la inyección de contraste72.
Los estudios que han realizado TC sistemático en niños con PT positiva, radiografía de tórax normal y cultivos de jugo gástrico negativos, han evidenciado un aumento del tamaño de las adenopatías hiliares o mediastínicas en el 50–63% de los casos68,73. Estos estudios han abierto un debate sobre la necesidad de realizar una TC sistemática a todos los niños con infección tuberculosa y sin enfermedad aparente en la radiografía de tórax, tratando como enfermedad activa la presencia de adenopatías. Sin embargo, las recomendaciones oficiales nacionales e internacionales no apoyan esta actuación69. En el niño asintomático, el aumento moderado de los ganglios linfáticos pulmonares forma parte natural de la primoinfección tuberculosa y en la gran mayoría de los casos se resuelve de forma espontánea64. Aunque estas lesiones contienen bacilos y pueden detectarse ocasionalmente mediante cultivo o PCR, la población bacilar de las adenopatías es baja (102–105) y, en todo caso, menor que la posibilidad de que aparezcan mutantes resistentes a isoniazida (105–106)69. Por tanto, el tratamiento con isoniazida es suficiente para el tratamiento de estos niños, como lo demuestra su excelente eficacia en la ITBL antes del desarrollo de la TC74. Además, carecemos de patrones de referencia sobre el tamaño y la morfología de las adenopatías torácicas normales en el niño y la TC somete al paciente a una intensa radiación, a un contraste intravenoso y, en ocasiones, a una sedación moderada-profunda69. Por tanto, en el caso de niños con contacto bacilífero, PT positiva y radiografía de tórax normal, la TC podría considerarse en caso de existir síntomas (para conocer si éstos pudieran estar en relación con la TB), y no existe evidencia clara de que esté indicado sistemáticamente en caso de contacto bacilífero multirresistente o en menores de 2 años (en los que podría existir mayor riesgo de progresión a enfermedad), debiendo valorarse junto a otros factores (clínicos, epidemiológicos y sociales).
La TC debe realizarse en niños inmunodeprimidos con contacto conocido (independientemente de la PT), en aquellos con PT positiva y radiografía de tórax dudosa o no concluyente (a pesar de técnica rigurosa y valoración por facultativo experto). Para definir mejor algunas complicaciones como adenopatías compresivas, áreas de atrapamiento aéreo o atelectasia, cavitaciones, bronquiectasias o fístulas broncopleurales, podría emplearse la TC si existen dudas con la radiografía convencional. Ante otras complicaciones, como derrame pleural o pericárdico, puede realizarse ecografía torácica en vez de TC. Ver tabla 3.
Indicaciones orientativas de la TC torácica en la tuberculosis pediátrica
|
Recomendación débil, por existir menor evidencia:
|
El uso de la fibrobroncoscopia (FBC) como ayuda diagnóstica en la TB en niños, no está indicada de forma rutinaria10,65, a pesar de que la afectación de las adenopatías hiliares y/o paratraqueales, así como la existencia de complicaciones, son muy frecuentes en la infancia, sobre todo en los menores de 5 años7. La incidencia real de TB endobronquial es desconocida7, aunque el porcentaje oscila entre 41–63% de las FBC realizadas en casos de TB44,75–79, llegando hasta el 96,6% en alguna serie77. La TB endobronquial puede ser una primera manifestación de la TB o aparecer en el transcurso de la misma. El diagnóstico precoz y el tratamiento adecuado es importante para disminuir las complicaciones secundarias, como las bronquiectasias y la estenosis bronquial75.Actualmente las indicaciones para realizar una FBC en un niño en relación con la TB son7,10:
- 1)
Sospecha de lesiones endobronquiales: sobre todo si existen alteraciones radiológicas como atrapamiento aéreo, atelectasia, lesión parenquimatosa persistente, estrechamiento de las vías respiratorias, etc.77,79,80. Hay que tener en cuenta que una radiografía de tórax normal no descarta la existencia de una TB endobronquial7,76,77,81.
Las lesiones endobronquiales más frecuentemente encontradas son79,82
- a)
Granuloma: Protusión localizada de la mucosa bronquial, a menudo en forma de cono, de superficie lisa, eritematosa y con un vértice blanquecino. Aparece entre 1875–32%44 de los casos. Es la forma mas frecuente de TB endobronquial en niños81, por la perforación gangliobronquial, más propia de la primoinfección.
- b)
Caseum endobronquial. Una de las indicaciones de la FBC es la extracción endoscópica del caseum que esté causando obstrucción de la vía aérea81.
- c)
Formaciones polipoideas endobronquiales.
- d)
Bronquitis. Es más frecuente en el adulto82 y puede ser simple (pared bronquial engrosada y enrojecida, de superficie lisa), granulosa (pared bronquial engrosada, de superficie y coloración irregulares, a veces francamente mamelonada) o ulcerada (pared bronquial engrosada, de superficie mamelonada, irregular, con ulceraciones recubiertas de material blanquecino denso).
- a)
- 2)
Sospecha de compresión extrínseca (por adenopatías tuberculosas): aparece en el 37–64% de los casos44 y es, para algunos autores, el hallazgo endoscópico más frecuente en la TB pulmonar44,72,76. Cuando se realiza la exploración endoscópica, clásicamente se distinguen 2 manifestaciones: primero, el grado de obstrucción mayor o menor del 50% de la luz bronquial, y segundo, el aspecto de la mucosa, normal o patológica77.
- 3)
Diagnóstico diferencial con otros procesos: enfisema lobar congénito83, cuerpos extraños84, etc. Dado que en los lactantes pequeños, con sospecha de TB pulmonar, la PT puede ser negativa, la FBC podría ayudar al diagnóstico diferencial, sobre todo si se detectan anomalías en la radiografía de tórax, como atrapamiento aéreo o atelectasias83,84.
- 4)
Toma de decisiones terapéuticas: uso de corticoides. Con objeto de reducir las estenosis producidas por los granulomas endobronquiales80, aunque no hay estudios que evalúen claramente su eficacia85,86, clásicamente se han empleado corticoides durante las primeras semanas, a dosis similares a las empleadas en meningitis tuberculosa, concretamente prednisona a 2mg/kg/día (dosis máxima 60mg/día), durante 4 semanas, descendiendo gradualmente la dosis durante 4–6 semanas10,44,75,76. Estarían indicados ante la presencia de lesiones endobronquiales avanzadas (penetración de una adenopatia tuberculosa a través de la pared bronquial, tejido de granulación, caseum, pólipos, etc.) y compresiones extrínsecas que superen el 50% del diámetro bronquial44,75,76,87. En los casos de inflamación de la mucosa bronquial, sin lesiones endobronquailes ni compresiones extrínsecas, no es necesario su uso79.
- 5)
Respuesta inadecuada al tratamiento. Ante la falta de respuesta al tratamiento, o bien una lenta evolución clínica y/o radiológica, la FBC puede aportar datos sobre las posibles complicaciones (granulomas endobronquiales, atelectasias, etc.) que justifiquen esa situación. Antes de decidir realizar la exploración endoscópica hay que tener en cuenta que es habitual que se produzca una mejoría clínica con una lenta evolución de las lesiones radiológicas, e incluso con un empeoramiento de las mismas75.
- 6)
Valoración de la evolución de las lesiones bronquiales. La resolución de las lesiones bronquiales en la TB oscila entre 6 semanas y 4 meses44,75,76. Por ello, en los casos en los que inicialmente se efectuó FBC, podría estar justificado un nuevo control endoscópico a los 2 meses aproximadamente75.
- 7)
Toma de muestras. En adultos, es el método mas recomendado en aquellos que no expectoran para la recogida de muestras88. Hay que efectuar el estudio microbiológico del broncoaspirado, del lavado broncoalveolar y de las biopsias de posibles lesiones endobronquiales, debiéndose realizar además estudio histológico de estas últimas. En niños, cuando se comparan ambos métodos, la eficacia del aspirado gástrico parece superior al del lavado broncoalveolar en todas las series44,77,85,89,90, excepto en una91. Por tanto, la FBC no está indicada de forma rutinaria para la toma de muestras en niños con TB7,92, aunque puede tener un valor diagnóstico adicional en algunos casos45.
En resumen, la FBC no suele mejorar el diagnóstico microbiológico de la TB, pero es muy útil para valorar el tratamiento más adecuado en caso de TB endobronquial. En algunos casos, la TC puede hacer innecesaria la exploración endoscópica, pero en otros casos, la FBC o el uso del broncoscopio rígido pueden ser terapéuticos, como por ejemplo, ante una obstrucción bronquial por caseum.
Situaciones especialesInmunodeprimidosTodas las personas con alteraciones inmunitarias, congénitas o adquiridas, presentan con frecuencia resultados falsos negativos en la PT. La sensibilidad de la prueba también es menor en lactantes, tanto más cuánto más pequeños sean. Por esta razón, en todos estos casos deben plantearse paralelamente otras pruebas diagnósticas, aunque sean más invansivas, como tests de IGRA, TC, lavado broncoalveolar, biopsias bronquiales, ganglionares o incuso hepáticas o de médula ósea para PCR y estudio histológico. Se debe intentar aislar la micobacteria en fluidos como sangre y orina, con buena sensibilidad en el inmunodeprimido. El rendimiento de los tests IGRA es también inferior en personas con alteraciones de la inmunidad, pero la sensibilidad sigue siendo superior a la PT30. Por tanto, se recomienda la realización de IGRA en estos casos a la vez que una PT, incluyendo niños menores de 2 años.
Antecedentes de vacunación con BCGClásicamente se tenía en cuenta este antecedente para la interpretación de la PT, sobre todo si la persona había recibido la vacuna en los 15 años anteriores. Actualmente existen datos que sugieren que el antecedente de vacunación con BCG es poco relevante para la interpretación de la PT. En un estudio realizado recientemente en nuestro medio, en el que se incluyeron más de 600 niños procedentes de adopción internacional y vacunados con BCG, 90% de los cuales eran menores de 2 años, se observó que el antecedente de BCG se acompañaba de una PT positiva solamente en un 10% de los casos25.
En estas situaciones, los tests IGRA presentan una elevada especificidad. Por lo tanto, en caso de antecedente de vacunación con BCG, se recomienda efectuarlas como prueba complementaria a la PT si esta ha sido positiva.
Tuberculosis extrapulmonarSiempre que sea posible se recomienda obtener una muestra adecuada del sitio afectado, si es necesario a través de biopsia o punción-aspiración con aguja fina, para el análisis histológico, la baciloscopia, la PCR y el cultivo. Es aconsejable depositar la muestra obtenida en un recipiente Bactec 13A o en un tubo de lisis centrifugación; si no disponemos de ellos podemos utilizar un recipiente seco y estéril y enviarla al laboratorio para su procesamiento, lo más rápido posible. No se debe guardar la muestra en formol dado que pueden destruir los bacilos. No obstante, la mayoría de los casos infantiles son formas paucibacilares, es decir, con escasa cantidad de micobacterias. Por esta razón, la baciloscopia, el cultivo y la PCR suelen presentar, como en la TB pulmonar, un rendimiento subóptimo, aunque su especificidad sea elevada.
La PCR, para los tests comercializados, muestra una sensibilidad conjunta del 62% y una especificidad del 98% aunque también con heterogeneidad en los resultados. Estas técnicas aportan un valor confirmatorio de TB pleural aunque tienen un valor limitado para descartar la enfermedad93. Numerosos estudios han evaluado las pruebas de biología molecular para el diagnóstico de la TB meníngea. Una revisión sistemática localizó un total de 49 estudios de diagnóstico, generalmente de baja calidad, 14 de los cuales evaluaron tests comerciales. Estos últimos son relativamente recientes, incluyendo la mayoría un escaso número de pacientes (inferior a 10). Los resultados en su conjunto muestran unos valores relativamente bajos de sensibilidad (71%) con una buena especificidad (95%), aunque con una importante variabilidad. Los resultados para las pruebas comercializadas fueron más homogéneos, pero con una sensibilidad menor (56%) y una especificidad del 98%94. Una aportación extra de la PCR es la capacidad para difierenciar entre M. tuberculosis y micobacterias ambientales50.
La medición del ADA puede ser de utilidad en la pleuritis y meningitis, aunque tiene sus limitaciones: ADA elevado en presencia de gran cantidad de leucocitos, como en los empiemas; ADA normal en las fases iniciales de las meningitis TB. Por otro lado, en países de baja prevalencia (inferior al 5%), la probabilidad de diagnosticar una TB pleural tras la determinación de ADA pleural es sólo del 41%, mientras que en países de alta prevalencia (85%) esta probabilidad asciende al 99%95. Existe escasa experiencia con los tests IGRA en la TB extrapulmonar de momento, habiéndose publicado algunos datos de su aportación en el diagnóstico diferencial en linfadenitis36. En la TB pleural, la detección de interferón-gamma en el líquido pleural se ha mostrado como una buena técnica96.
La citología puede mostrar datos altamente sugestivos de TB, como la presencia de granulomas caseificantes.
Las pruebas de imagen del órgano o sistema que se sospecha afectado pueden servir también de ayuda.
Todas estas dificultades diagnósticas comentadas hacen que, con frecuencia, el diagnóstico de la TB extrapulmonar sea de presunción, basándose en los datos clínicos, radiológicos, anatomopatológicos y en la respuesta al tratamiento. Además, al grave incoveniente de no disponer de un diagnóstico bacteriológico se añade no poder contar con una prueba de susceptibilidad a los fármacos antituberculosos de la cepa.
Tuberculosis perinatalSe recomienda realizar un estudio anatomopatológico de la placenta, una exploración minuciosa del neonato, una PT, una prueba IGRA y una radiografía de tórax97. Ante la sospecha de TB congénita, deben realizarse cultivos de jugo gástrico y líquido cefalorraquídeo, estudio oftalmológico del fondo de ojo y ecografía cerebral y abdominal e instaurar un tratamiento antituberculoso inmediato basado en la sensibilidad de la cepa materna si se conoce97. En caso de quimioprofilaxis primaria, se debe repetir la PT y la prueba IGRA a los 3 meses98. Si son negativas y la madre cumple bien su tratamiento o lo ha finalizado, se suspenderá la profilaxis, aunque conviene repetir nuevamente la PT y la prueba IGRA a los 6 meses y al año de edad97.
En caso de enfermedad tuberculosa multirresistente materna, se aconseja vacunación con BCG, sin poder establecerse una recomendación clara de profilaxis en el niño97. En cualquier caso, se debe mantener un estrecho seguimiento clínico con controles de PT, IGRA y radiológicos a los 3, 6, 12, 18 y 24 meses. Las pruebas de detección de interferón gamma evitan la interferencia con la vacunación BCG y permiten un diagnóstico precoz de la infección97,98.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.