Presentamos el Documento de Consenso sobre tratamiento de la osteomielitis aguda y la artritis séptica no complicadas, elaborado por la Sociedad Española de Infectología Pediátrica, la Sociedad Española de Reumatología Pediátrica y la Sociedad Española de Ortopedia Pediátrica.
En este documento se revisa el abordaje y el tratamiento médico-quirúrgico de la infección osteoarticular aguda, considerada como aquella que presenta una evolución inferior a 14 días, no complicada, de origen comunitario en niños, basándonos en las mejores evidencias científicas disponibles y valorando las diversas opciones disponibles en la actualidad. En función de dichas evidencias, se aportan una serie de recomendaciones para la práctica clínica.
This is a Consensus Document of the Spanish Society of Paediatric Infectious Diseases (Sociedad Española de Infectología Pediatrica), Spanish Society of Paediatric Rheumatology (Sociedad Española de Reumatología Pediátrica) and the Spanish Society of Paediatric Orthopaedics (Sociedad Española de Ortopedia Pediátrica), on the treatment of uncomplicated acute osteomyelitis and septic arthritis.
A review is presented on the medical and surgical treatment of acute osteoarticular infection, defined as a process with less than 14 days of symptomatology, uncomplicated and community-acquired. The different possible options are evaluated based on the best available scientific knowledge, and a number of evidence-based recommendations for clinical practice are provided.
Este documento es la segunda parte de uno previo en el que se desarrolló la etiopatogenia y el diagnóstico de las infecciones osteoarticulares (IOA). En este, se abordará el tratamiento, con numerosas nuevas aportaciones en los últimos años1-10, además del seguimiento y pronóstico. Se incluyen tanto la osteomielitis aguda (OmA) como la artritis séptica (AS), y se revisan, fundamentalmente, las infecciones comunitarias de causa hematógena y evolución aguda (< 14 días de síntomas).
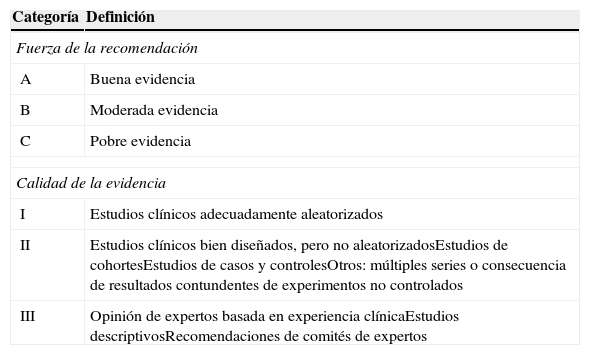
Al final del documento, se recogen las principales recomendaciones de cada sección o apartado, añadiéndose el nivel de evidencia y el grado de recomendación, según queda definido en la tabla 111.
Nivel de evidencia y fuerza de recomendación utilizados en este consenso
| Categoría | Definición |
|---|---|
| Fuerza de la recomendación | |
| A | Buena evidencia |
| B | Moderada evidencia |
| C | Pobre evidencia |
| Calidad de la evidencia | |
| I | Estudios clínicos adecuadamente aleatorizados |
| II | Estudios clínicos bien diseñados, pero no aleatorizadosEstudios de cohortesEstudios de casos y controlesOtros: múltiples series o consecuencia de resultados contundentes de experimentos no controlados |
| III | Opinión de expertos basada en experiencia clínicaEstudios descriptivosRecomendaciones de comités de expertos |
Modificado de Khan et al.11
La etiología ha sido descrita en el documento anterior, aunque se expone brevemente en la tabla 2.
Etiología más frecuente de la infección osteoarticular en función de la edad y de los factores de riesgo asociados
| Edad | Bacterias |
|---|---|
| < 3 mesesa | S. aureusS. agalactiaeEnterobacterias (especialmente Escherichia coli) |
| 3 meses-5 añosb | S. aureusK. kingaeS. pyogenes |
| > 5 añosc | S. aureusS. pyogenes |
| Situación de riesgo | Bacterias |
|---|---|
| Herida punzante en pie con calzado deportivo | P. aeruginosa |
| Varicela y heridas | S. pyogenes |
| Drepanocitosis | Salmonella sp. |
| Déficit de complemento | Neisseria meningitidisd |
| Recién nacido con patologías complejas, inmunodeficiencias, pacientes con prótesis o material de osteosíntesis | Staphylococcus plasmocoagulasa negativos; S. epidermidis, S. hominis, S. saprophyticus, S. haemolyticus, S. lugdunensis. Candida sp., así como otros cocos y bacilos grampositivos y bacilos gramnegativos |
| Agammaglobulinemia | Mycoplasma pneumoniae |
| Enfermedad granulomatosa crónica | S. aureus, Serratia marcescens y Aspergillus fumigatus, entre otros |
| Pacientes procedentes de países con alta endemia de tuberculosis, inmunodeficiencias que afectan al eje gamma interferón-interleucina 12 y tratamientos con inmunomoduladores biológicos que interfieren con la producción de interferón | Mycobacterium tuberculosis |
Otros microorganismos ocasionalmente asociados a infección osteoarticular en recién nacidos son: Neisseria gonorrhoeae, Staphylococcus plasmocoagulasa negativo o Candida.
Dentro de Staphylococcus aureus, cabe diferenciar las cepas sensibles (SASM) y resistentes a meticilina (SARM) por modificación de las proteínas ligadoras de penicilina, y entre estas, las adquiridas en la comunidad (SARM-AC) y las intrahospitalarias. En España, la mayor parte de las infecciones en niños están ocasionadas por SASM (> 90%); no obstante, hay que tener en cuenta la alta tasa de SARM-AC que hay en otras zonas geográficas, como en algunos estados de Estados Unidos, Latinoamérica, norte de África y Europa del este12, lo que habrá que considerar en niños provenientes de estas áreas. La resistencia a meticilina es un indicador de resistencia al resto de betalactámicos, incluidas las cefalosporinas (con excepción de ceftarolina) y los carbapenemes.
SARM-AC suele tener pocas resistencias antibióticas asociadas, siendo normalmente sensible a clindamicina, cotrimoxazol (TMP-SMX), glucopéptidos (vancomicina y teicoplanina), rifampicina y linezolid12. Kingella kingae suele ser sensible a betalactámicos, incluida ampicilina y cefalosporinas, por lo que no suele ocasionar problemas de tratamiento, salvo en el caso de utilizar clindamicina o cloxacilina en monoterapia. Otras bacterias como Streptococcus pyogenes o Streptococcus pneumoniae suelen responder bien a penicilina.
TratamientoLos niños con IOA deberían ingresar, inicialmente, para una primera orientación y tratamiento antibiótico por vía intravenosa (IV). Estas infecciones precisan de un enfoque multidisciplinar con participación del traumatólogo, el reumatólogo y el pediatra infectólogo, según cada caso.
Tratamiento intervencionistaArtritis sépticaClásicamente, el tratamiento de toda AS ha incluido la realización de una artrotomía (drenaje quirúrgico) evacuadora, con lavado del material purulento, colocación de un drenaje externo para evitar la reacumulación de líquido, y la inmovilización de la articulación para evitar subluxaciones, especialmente en cadera13. La evacuación de la articulación afectada y el lavado es aceptado universalmente, pero no es tan evidente cuál es la mejor manera de realizarlo (artrotomía, artroscopia o artrocentesis) al no existir estudios adecuados que avalen una u otra actitud, aunque, tradicionalmente, se ha recomendado la artrotomía del hombro y, especialmente, de la cadera, dado el mayor riesgo de secuelas13. La necesidad de drenaje quirúrgico es, siempre, más probable en infecciones por microorganismos con elevada virulencia, como S. aureus productor de toxinas, como la proteína de pantón-valentine (PVL) (generalmente SARM, y en ocasiones SASM), y cuando la evolución de la infección es más prolongada13.
Artrocentesis: punción articular, aspiración con aguja y lavado articularLa realización de artrocentesis de la articulación afectada es básica para obtener el diagnóstico microbiológico, conseguir la descompresión del espacio articular (evitando el compromiso vascular en hombro y cadera) y favorecer la eficacia del antibiótico tras la evacuación del material purulento14. Debe acometerse en condiciones de asepsia, siendo una técnica sencilla (más compleja en cadera y hombro), con escasos riesgos, que puede orientar el diagnóstico15. No existen contraindicaciones absolutas, salvo infección local en la zona de punción, sepsis grave o shock. Debe realizarse lo antes posible (preferiblemente, antes de iniciar el antibiótico), aunque podría demorarse unas horas (por ejemplo, 6-12 h), siendo especialmente importante la precocidad en AS de cadera y hombro14,16. La mayoría de los autores de este documento son partidarios de una evacuación articular y el inicio de antibioterapia lo antes posible, sin poder dar una recomendación exacta del tiempo necesario para evitar complicaciones o secuelas.
La ecografía puede ser de gran ayuda para localizar la zona de punción. El niño debe recibir una adecuada sedoanalgesia, pudiendo administrarse óxido nitroso inhalado.
Tanto la artrocentesis como la artrotomía permiten el lavado de la articulación con suero fisiológico. La artrocentesis tiene la ventaja de ser una técnica menos traumática y conseguir una recuperación más rápida del paciente, asociándose a un descenso más acelerado de la proteína C reactiva (PCR), lo que podría disminuir la duración del antibiótico IV y la estancia hospitalaria.
La realización precoz de la artrocentesis, la valoración clínica diaria y la repetición de la misma cuando precise con lavado articular, son las claves del éxito de esta aproximación terapéutica17.
Cualquier articulación, incluidas hombro y cadera, podrían ser abordadas mediante artrocentesis terapéutica, como demuestran diversos trabajos1,4,5,17-20. Así, en un estudio aleatorizado en niños con artritis de hombro, no se encontraron diferencias en el pronóstico ni duración de la hospitalización en pacientes tratados con aspiración vs. artrotomía1. En cuanto a la cadera, también existen estudios que apoyan la buena evolución de niños tratados con aspiración/lavado5. Estos autores consideran factores de mal pronóstico, y por tanto, de necesidad de cirugía abierta,>6 días de evolución de los síntomas, una PCR > 10mg/dl, > 15.000 neutrófilos/mm3 y una velocidad de sedimentación globular (VSG) >50mm/h5. Se ha evaluado, también, la aspiración repetida de la articulación de la cadera, objetivándose una recuperación y deambulación más rápidas, sin secuelas19, aunque algunos pacientes precisaron drenaje abierto.
En conclusión, en la mayoría de los casos, salvo en el recién nacido (RN) donde no existe una evidencia adecuada de la evolución sin artrotomía quirúrgica18, los niños con clínica reciente (< 5-6 días) podrían ser subsidiarios de artrocentesis evacuadora y antibioterapia4,6,18. En las AS de hombro y cadera, la decisión dependerá de la precocidad de la actuación, de la evaluación analítica y de la experiencia del equipo encargado del paciente. En todos estos casos, los niños deberían ingresar en un hospital con traumatólogo experimentado, para la realización de un abordaje quirúrgico, en caso necesario.
ArtrotomíaEs la principal técnica quirúrgica avanzada en el tratamiento de la AS. En principio, puede realizarse a nivel de cualquier articulación. Existen autores que la consideran esencial en el abordaje de las AS de la cadera13, aunque algunos estudios más recientes apuntan la posibilidad de abordajes no quirúrgicos en estas localizaciones4,19. Igualmente, otros autores indican la intervención quirúrgica si no se evacúa de forma satisfactoria el líquido articular tras 2 o 3 artrocentesis17. La artrotomía podría estar indicada, de entrada, en caso de un mayor tiempo de evolución, dada la mayor dificultad de evacuar un material más denso y organizado13,16, en caso de parámetros inflamatorios muy aumentados, de patógenos muy virulentos (SARM) y en neonatos y lactantes pequeños5,19. El objetivo de la técnica quirúrgica puede considerarse triple21: vaciado del contenido purulento y material necrótico, disminución de la presión intraarticular y evaluación directa de la lesión, así como la toma de muestras microbiológicas y anatomopatológicas. Además, permite la colocación de un drenaje externo para evitar nuevas colecciones13,22. A pesar de que no existen estudios bien diseñados, muchos autores sugieren dejar este tipo de drenaje para irrigación-aspiración13, especialmente en cadera, debiendo ser retirados precozmente (< 48-72 h).
Dado que se procede a una apertura de la articulación, puede ser necesario, en algunos casos, la estabilización de la articulación mediante la tracción cutánea o el uso de férulas, para evitar luxaciones en el postoperatorio, aunque debe procurarse la movilización precoz para evitar problemas posteriores, como rigidez o flexo13.
Otros autores proponen la artroscopia como método menos agresivo que la artrotomía para el abordaje de la AS en el niño6,23,24. Las principales limitaciones son la edad de los pacientes y la dificultad de la técnica.
Drenaje quirúrgico en osteomielitisSe ha objetivado que > 90% de los pacientes con OmA evolucionan favorablemente con tratamiento antibiótico si se instaura precozmente7,18,25,26, realizándose el drenaje quirúrgico cuando se objetive la existencia de una colección o secuestro a nivel óseo o subperióstico18, cuando no se produzca una mejoría clínica tras 48-72 h de antibioterapia y en la OmA aguda no hematógena (OANH). No obstante, abscesos subperiósticos, incluso>3mm, podrían evolucionar favorablemente sin drenaje quirúrgico18. Al igual que en el caso de las AS, deberán tomarse muestras microbiológicas, así como anatomopatológicas cuando se considere, siendo imprescindible la colocación de un drenaje externo para evitar colecciones posquirúrgicas.
Conviene destacar que algunos expertos tienen muy buena experiencia con la realización de una punción ósea inicial, lo que podría mejorar el diagnóstico etiológico y la evolución.
Tratamiento médicoEn los últimos años se está produciendo una tendencia a la simplificación del tratamiento antibiótico en las IOA no complicadas, con la utilización de tratamiento parenteral y secuencial oral posterior, con dosis elevadas de antibioterapia y menor duración, tanto del tratamiento IV8-10 como del total2,3. Esta tendencia se basaba en la experiencia pionera de un ensayo clínico controlado publicada por Peltola et al.7, que ha sido confirmada posteriormente en estudios prospectivos de cohortes o aleatorizados2,3,7,8,10. Recientemente, se han publicado las guías inglesas donde ya se recogen parte de estas recomendaciones14. La validez de estas estrategias en los casos de IOA por microorganismos de elevada virulencia, como S. aureus productor de PVL, podría no ser adecuada, dada su mayor gravedad y peor pronóstico27,28, recomendándose una mayor duración del tratamiento antibiótico28.
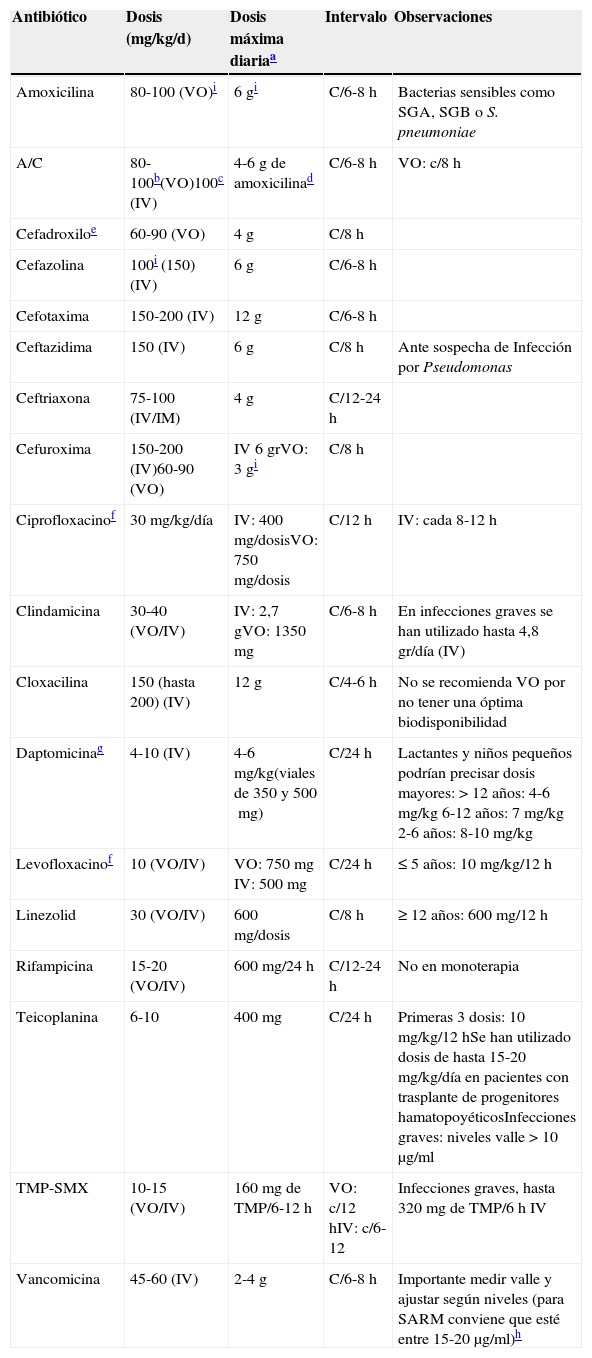
Tratamiento empírico inicialAnte toda sospecha de IOA en un niño se debería iniciar tratamiento antibiótico IV precozmente (tabla 3), tras la obtención adecuada de muestras microbiológicas25.
Antibióticos más frecuentemente utilizados en IOA en niños (expuestos por orden alfabético)
| Antibiótico | Dosis (mg/kg/d) | Dosis máxima diariaa | Intervalo | Observaciones |
|---|---|---|---|---|
| Amoxicilina | 80-100 (VO)i | 6 gi | C/6-8h | Bacterias sensibles como SGA, SGB o S. pneumoniae |
| A/C | 80-100b(VO)100c (IV) | 4-6g de amoxicilinad | C/6-8h | VO: c/8h |
| Cefadroxiloe | 60-90 (VO) | 4g | C/8h | |
| Cefazolina | 100i (150) (IV) | 6g | C/6-8h | |
| Cefotaxima | 150-200 (IV) | 12g | C/6-8h | |
| Ceftazidima | 150 (IV) | 6g | C/8h | Ante sospecha de Infección por Pseudomonas |
| Ceftriaxona | 75-100 (IV/IM) | 4g | C/12-24h | |
| Cefuroxima | 150-200 (IV)60-90 (VO) | IV 6 grVO: 3 gi | C/8h | |
| Ciprofloxacinof | 30mg/kg/día | IV: 400mg/dosisVO: 750mg/dosis | C/12h | IV: cada 8-12h |
| Clindamicina | 30-40 (VO/IV) | IV: 2,7 gVO: 1350mg | C/6-8h | En infecciones graves se han utilizado hasta 4,8 gr/día (IV) |
| Cloxacilina | 150 (hasta 200) (IV) | 12 g | C/4-6h | No se recomienda VO por no tener una óptima biodisponibilidad |
| Daptomicinag | 4-10 (IV) | 4-6mg/kg(viales de 350 y 500mg) | C/24h | Lactantes y niños pequeños podrían precisar dosis mayores: > 12 años: 4-6mg/kg 6-12 años: 7mg/kg 2-6 años: 8-10mg/kg |
| Levofloxacinof | 10 (VO/IV) | VO: 750mg IV: 500mg | C/24h | ≤ 5 años: 10mg/kg/12h |
| Linezolid | 30 (VO/IV) | 600mg/dosis | C/8h | ≥ 12 años: 600mg/12h |
| Rifampicina | 15-20 (VO/IV) | 600mg/24h | C/12-24h | No en monoterapia |
| Teicoplanina | 6-10 | 400mg | C/24h | Primeras 3 dosis: 10mg/kg/12hSe han utilizado dosis de hasta 15-20mg/kg/día en pacientes con trasplante de progenitores hamatopoyéticosInfecciones graves: niveles valle>10μg/ml |
| TMP-SMX | 10-15 (VO/IV) | 160mg de TMP/6-12h | VO: c/12hIV: c/6-12 | Infecciones graves, hasta 320mg de TMP/6h IV |
| Vancomicina | 45-60 (IV) | 2-4 g | C/6-8h | Importante medir valle y ajustar según niveles (para SARM conviene que esté entre 15-20 μg/ml)h |
A/C=amoxicilina-ácido clavulánico; d: día; h: horas; IM: intramuscular; IV: vía intravenosa; SGA: S. pyogenes; SARM: S. aureus resistente a meticilina; SGB: S. agalactiae; VO: vía oral.
Se podría considerar aumentar la dosis de amoxicilina IV hasta 120-150mg/kg/día, utilizando formulaciones con menor cantidad de ácido clavulánico (concentración amoxicilina:clavulánico 10:1; viales de 2 g/200mg o 500mg/50mg).
Evitar administrar>125mg de ácido clavulánico por dosis (añadiendo, si es necesario, amoxicilina sola). Considerar administrar un probiótico, especialmente si aparecen efectos secundarios gastrointestinales.
En el momento de escribir estas guías se había suspendido en España la comercialización de la solución de 250mg/5ml de cefadroxilo.
En ficha técnica: en<18 años, ciprofloxacino para esta indicación y levofloxacino para cualquiera, serían off label, aunque existe una amplia experiencia en niños.
Daptomicina no está aprobada en<18 años (tratamiento compasivo) y no es recomendable en el caso de sospecha de afectación pulmonar por embolismos sépticos, ya que se inactiva por el surfactante pulmonar. Los niños más pequeños podrían requerir 6mg/kg/12 h.
Debería utilizarse un antibiótico con buena actividad frente a SASM y S. pyogenes, al ser los agentes etiológicos más frecuentes2,10,27,30. En caso de OmA por punción de hueso del pie (a través de zapatilla deportiva), debería cubrirse, además, Pseudomonas aeruginosa. En niños<5 años, convendría utilizar un antibiótico con buena actividad frente a K. kingae29, y en niños con<3 dosis de vacuna frente a H. influenzae tipo b o S. pneumoniae (especialmente en < 2 años) deberían cubrirse estos microorganismos30. En zonas geográficas donde la prevalencia de infecciones por SARM sea>10% de las infecciones por S. aureus, debería utilizarse un antibiótico con buena cobertura para esta bacteria.
Los antibióticos más utilizados y con los que existe más experiencia en niños son cefazolina, cloxacilina y clindamicina25,30. Este grupo de expertos considera cefazolina el antibiótico de elección en niños>2 años adecuadamente vacunados de zonas geográficas donde la prevalencia de infecciones por SARM-AC sea<10%. En niños ≤ 2 años o con<de 3 dosis vacunales, se recomienda tratamiento con cefuroxima y, como alternativas, cloxacilina (con escasa actividad frente a K. kingae31) asociada a cefotaxima o amoxicilina-clavulánico. En niños<3 meses se recomienda asociar cloxacilina y cefotaxima, siendo cefazolina y gentamicina una combianción también adecuada. Cloxacilina asociada a ceftazidima sería la pauta antibiótica más adecuada en las OmA de huesos del pie por herida punzante. En la tabla 4 se exponen estas recomendaciones.
Tratamiento empírico inicial de las infecciones osteoarticulares en función de la edad y determinadas situaciones de base del paciente
| Edad | Antibióticos empíricosa |
|---|---|
| < 3 meses(incluye recién nacido) | Cloxacilina+cefotaxima/gentamicinaaAlternativa: consultar con especialista en infectología pediátrica |
| 3 meses-5 añosb | Cefuroxima en monoterapia o cloxacilina+cefotaximacAlternativa: A/CAlternativas en>2 años sin sospecha de S. pneumoniae:Cefazolina o cloxacilinad |
| 5 años | Cefazolina o cloxacilina |
| Adolescentese | Penicilina G (25.000 U/kg/6h) IV o ceftriaxona IV/IM |
| Situaciones especiales |
|---|
| Anemia de células falciformes: cloxacilina+cefotaxima o A/C en monoterapia |
| Anaerobios: clindamicina (alternativas: A/C o metronidazol)f |
| Antecedentes de punción: cloxacilina+ceftazidima |
| Sobreinfección prótesis: vancomicina/linezolid/ciprofloxacino/levofloxacino+- rifampicina |
| Alergia a betalactámicos: clindamicina, y como alternativas, TMP-SMX o quinolonas. Se podría considerar asociar rifampicina a cualquiera de ellos. Para otras opciones convendría consultar con un especialista en infectología pediátrica. En estos casos conviene recordar la posibilidad de K. kingae en niños < 2-5 años y enterobacterias en<3 meses, los cuales podrían no quedar bien cubiertos con estos antibióticos |
| Situaciones gravesg |
| Glucopéptido (o linezolid)±rifampicina±clindamicina |
| Alternativa: daptomicina (no aprobado en niños) si no existe afectación pulmonar, cuando no pudieran emplearse glucopéptidos o linezolid |
A/C: amoxicilina-ácido clavulánico; IM: intramuscular; IV: vía intravenosa; SARM: S. aureus resistente a meticilina; TMP-SMX=trimetoprim-sulfametoxazol.
En > 2 años se podría utilizar la misma pauta que en > 5 años, siempre que estén adecuadamente vacunados, dado que tanto Kingella como S. pneumoniae son poco frecuentes.
En caso de sospecha de Kingella habría que considerar asociar otro betalactámico otro betalactámico (al igual que en el caso de utilizar clindamicina en monoterapia).
El tratamiento empírico sería igual que el de > 5 años y esta opción sería solo para el caso de sospecha de N. gonorrhoeae.
Considerar anaerobios siempre ante una evolución tórpida. Por ejemplo, Fusobacterium necrophorum ha sido implicado en ocasiones.
Niños con afectación de varias localizaciones, con sepsis asociada o con tromboembolismos pulmonares. Hasta que no exista confirmación diagnóstica de un SARM, habría que valorar añadir un betalactámico, dado que son antibióticos con mayor actividad frente a S. aureus sensible a meticilina.
hEstas dos combinaciones permitirían cubrir la mayoría de los microorganismos, incluyendo Streptococcus agalactiae. Gentamicina (o amikacina, en ciertas ocasiones) podría ser superior para bacterias Gram negativas de origen hospitalario.
En zonas con alta prevalencia de SARM, este grupo de expertos recomienda la utilización de clindamicina, asociada a un betalactámico25 en<5 años para cubrir K. kingae. En todos los casos, ante la sospecha o confirmación de infección por SARM, podría añadirse al tratamiento rifampicina32. Las opciones más adecuadas en caso de infección grave por SARM (sepsis grave, shock séptico y/o embolismos pulmonares sépticos) quedan recogidas en la tabla 414,32-34. Los antibióticos más comúnmente utilizados en la IOA en niños, tanto por vía oral como IV, están expuestos en las tablas 3–5.
Tratamiento antibiótico vía oral
| Tratamiento oral empírico (sin aislamiento microbiológico) | |
|---|---|
| Edad | Antibiótico |
| Recién nacidoa y<3 meses | Cefuroxima-axetiloAlternativa: A/C |
| 3 meses-5 años | Cefuroxima-axetilo; cefadroxilob en>2 añosAlternativa: A/C |
| > 5 años | Cefadroxilob o cefuroxima axetilo |
| Tratamiento específico según aislamiento microbiológicod | |
|---|---|
| Microorganismo | Antibiótico |
| S. aureus sensible a meticilina | Cefadroxilob |
| S. aureus resistente a meticilina | Clindamicina/ciprofloxacino/TMP-SMXc±rifampicinaAlternativa: linezolid |
| Hib | Cefuroxima-axetiloAlternativa: A/C |
| SGB, SGA, S. pneumoniae | Amoxicilina |
A/C: amoxicilina-ácido clavulánico; Hib: Haemophilus influenzae tipo b; SGA: S. pyogenes; SGB: S. agalactiae; TMP-SMX: trimetoprim-sulfametoxazol.
En el momento de escribir este consenso, cefadroxilo en solución había dejado de comercializarse en España; cefuroxima axetilo es una alternativa adecuada, pero también con problemas de suministro, dejando amoxicilina-ácido clavulánico en solución o la preparación desde comprimidos, como únicas opciones (véase el texto). En caso de alergia se podrían considerar las alternativas orales de los antibióticos comentados en la tabla 4.
En el caso de obtener un aislamiento microbiológico, se ajustará el tratamiento, eligiendo el antibiótico con el espectro más reducido.
Hospitalización y duración del tratamiento por vía intravenosaLos niños con una IOA deberían permanecer ingresados para tratamiento empírico inicial IV durante un mínimo de 2-5 días2,3,10,14,35. Los niños < 3 meses podrían precisar una duración de tratamiento IV más prolongado y los < 1 mes deberían recibir la mayor parte del tratamiento antibiótico por esta vía35.
La duración del tratamiento, tanto IV como total, en el caso de infección por SARM o por SASM productor de PVL, debería ser más prolongado, vigilando las posibles complicaciones27,28. Este grupo de expertos recomienda un mínimo de 10-14 días de tratamiento IV en estos casos. La duración del tratamiento de las IOA complicadas debería individualizarse.
La PCR es muy útil para monitorizar la respuesta al tratamiento y para valorar el paso del tratamiento antibiótico a vía oral2,18. Con evoluciones favorables, la PCR se normaliza entre 7-10 días y la VSG en 3-4 semanas36. El aumento, o no descenso, de la PCR es un marcador muy específico de evolución desfavorable o de complicaciones. Para el paso a antibioterapia oral y alta hospitalaria debería objetivarse un descenso del nivel de PCR de, al menos, un 30%, desaparición de la fiebre durante 24-48 h y una mejoría de los signos y síntomas de la infección.
Tratamiento ambulatorio y seguimientoSiempre que sea posible, este grupo de expertos recomienda la utilización de cefadroxilo por vía oral, siendo cefuroxima axetilo una alternativa adecuada (en el momento de escribir este consenso existe un desabastecimiento de la solución oral de cefadroxilo en España, así como serios problemas de suministro de todos estos antibióticos en solución oral —http://www.aeped.es/comite-medicamentos/noticias/retirada-mercado-antibiotico-cefadroxilo-no-todo-esta-perdido-informe-c—. quedando, prácticamente como única opción, el uso de amoxicilina-clavulánico o de comprimidos de adultos pulverizados). En caso de S. pyogenes o S. pneumoniae sensible a penicilina, se recomienda la utilización de amoxicilina por vía oral.
Para el tratamiento oral de SARM-AC, se sugiere, según sensibilidad, clindamicina32 o TMP-SMX37, asociados o no a rifampicina14,32. Existe más experiencia con clindamicina, aunque su tolerancia oral es peor. Una quinolona podría ser una alternativa a aquéllos.
En el caso de que no exista un aislamiento microbiológico, se debería continuar con un antibiótico de espectro similar al utilizado de forma IV. En caso de cefazolina o cloxacilina, se continuaría con cefadroxilo o cefuroxima. En la tabla 5 están expuestos los antibióticos por vía oral recomendados en diferentes situaciones.
Tras el alta hospitalaria, conviene un estrecho seguimiento del paciente, en especial de la adherencia y efectos adversos, con evaluación a los 5-7 días para confirmar una evolución clínica favorable y tolerancia al antibiótico.
La duración total del tratamiento antibiótico nunca debería sermenos de10-14 días en el caso de AS y de 20 días en el caso de OmA. En infecciones por SARM o SAMS productor de PVL, se recomienda un mínimo de 3-4 y 4-6 semanas, respectivamente, para AS y OmA32. La infección por Salmonella, especialmente en niños con drepanocitosis, requiere tratamientos más prolongados (4-6 semanas). Las OmA de pelvis y columna también requieren duraciones mínimas de 4 semanas16.
Mientras persista el tratamiento antibiótico, este grupo de expertos recomienda la realización cada 10-14 días de, al menos, hemograma y PCR como control de la infección y de efectos adversos, aunque conviene individualizar. No hubo consenso total en la utilización de VSG para el seguimiento. Así, algunos autores consideraron la realización de VSG, sobre todo antes de finalizar el tratamiento; sin embargo, otros no lo consideraron dado que su descenso es lento y una elevación prolongada podría alargar innecesariamente el tratamiento, sin que signifique una mala evolución o complicaciones36.
La suspensión del tratamiento siempre debería ir condicionada a la desaparición de la clínica y normalización de la PCR2,3. Se recomienda una visita al terminar el tratamiento antibiótico y otra un mes tras la finalización del mismo. Convendría realizar un seguimiento más estrecho en casos complicados, afectación axial o pélvica y en lactantes<3 meses.
Tratamiento adyuvanteLos antiinflamatorios no esteroideos son recomendables en la fase aguda para aliviar el dolor y la fiebre. Se ha demostrado que el tratamiento precoz de la AS con corticoides (2-4 días), al inicio del cuadro, podría disminuir la sintomatología y acelerar el alta hospitalaria. No obstante, los únicos 2 estudios aleatorizados fueron discrepantes en cuanto a la prevención de secuelas38,39. Por tanto, dada la baja frecuencia de secuelas en nuestro medio y la posibilidad de interferir con el diagnóstico de artritis no infecciosas o de enmascarar la evolución del proceso, este grupo de expertos no recomienda de forma rutinaria la utilización de corticoides, quedando restringida a infecciones confirmadas con gran componente inflamatorio (dexametasona, 0,2mg/kg/8 h)39.
Complicaciones y pronósticoLas complicaciones y/o secuelas de las IOA agudas en niños en nuestro medio, con un diagnóstico precoz, oscilan entre el 5 y el 10%, siendo más frecuentes en infecciones por SARM y/o con la presencia de factores de virulencia como la PVL, lactantes < 3 meses, AS de cadera y retrasos del diagnóstico5,13,16,19,40. En países con pocos recursos, las secuelas pueden ser elevadas (hasta 30%).
Complicaciones agudasLas complicaciones de las IOA deberían identificarse de manera precoz.
Complicaciones localesLa complicación más frecuente es la extensión del foco primario hacia tejidos adyacentes, en especial en niños más pequeños. La OmA puede desarrollar un absceso subperióstico, extenderse a la articulación (osteoartritis) o asociar afectación muscular (piomiositis), especialmente en localizaciones pélvicas, siendo relativamente frecuente en caso de SARM16. Se deben sospechar ante la persistencia de fiebre, hemocultivos persistentemente positivos o elevación mantenida de la PCR.
Una complicación mucho menos frecuente, pero grave, es la aparición de una trombosis venosa profunda (TVP), siendo más frecuente en varones adolescentes con osteomielitis del fémur o tibia causada por S. aureus, especialmente por SARM28.
Complicaciones sistémicasEn raras ocasiones, la IOA por S. aureus puede asociar un cuadro séptico grave, con hipotensión y afectación multiorgánica, que requiere ingreso en una unidad de cuidados intensivos, y que puede ser letal27,28. Otra complicación poco frecuente asociada a la TVP de las osteomielitis por S. aureus es el tromboembolismo pulmonar séptico, con dificultad respiratoria y dolor torácico, y que se presenta como imágenes nodulares y cavitaciones bilaterales en las imágenes radiológicas28.
SecuelasLas consecuencias de una IOA no tratada adecuadamente pueden ser devastadoras. La complicación más frecuente es la necrosis avascular de las epífisis (cadera y hombro), seguido de la discrepancia de longitud o deformidad angular de las extremidades y las fracturas patológicas16. El pinzamiento articular puede inducir un deterioro precoz de la articulación (pérdida de movilidad y dolor).
Algunos factores asociados más frecuentemente a secuelas son: retraso del inicio de la antibioterapia, afectación de la cadera, infección con SARM y RN (61%). El tratamiento de las secuelas debe ser individualizado.
En la tabla 6 se exponen las recomendaciones más relevantes de este consenso con el grado de evidencia.
Resumen de recomendaciones y evidencia
| • En la mayoría de los casos de AS, los niños con clínica reciente serán subsidiarios de artrocentesis evacuadora y antibioterapia, sin que sea imprescindible la realización de artrotomía (BII), debiendo considerar esta tras 48-72 h o 2-3 punciones evacuadoras, si la respuesta no es satisfactoria (AII) |
| • En las artritis de hombro y cadera, la decisión de drenaje quirúrgico dependerá de la precocidad de la actuación, de la evaluación analítica y de la experiencia del equipo encargado del paciente, pudiendo ser suficiente en muchas ocasiones, la artrocentesis evacuadora y lavado de la articulación, que puede requerir ser repetido (BII). Estos pacientes deben ser tratados donde exista un equipo experto en este tipo de infecciones en niños. La necesidad de drenaje quirúrgico es siempre más probable en infecciones por microorganismos con elevada virulencia como S. aureus productor de PVL (AII). En el caso de RN y lactantes pequeños, y dada la escasa evidencia, en la mayoría de las situaciones debería realizarse una artrotomía quirúrgica (AIII) |
| • En el caso de realización de artrotomía, se debería considerar la colocación de un drenaje quirúrgico, especialmente en cadera y hombro, y en los lactantes más pequeños, durante un máximo de 48-72 h (BIII), así como una inmovilización de la articulación tras la cirugía para evitar complicaciones, procurando una movilización pasiva precoz (CIII). Este punto no alcanzó un consenso total, y algunos miembros del grupo de expertos no recomiendan la colocación del drenaje ni la inmovilización, en la mayoría de los casos (CC, RM) |
| • Ante la sospecha de IOA en un niño, se debería iniciar tratamiento antibiótico IV lo antes posible (AII), tras la adecuada obtención de muestras microbiológicas, incluyendo, siempre, hemocultivo (AI). No debería retrasarse el inicio del tratamiento antibiótico más allá de 6-12 h y la administración IV debería tener una duración mínima de 2-5 días (AII) |
| • Los niños < 3 meses y, de forma notable, los menores de un mes, deberían recibir una gran parte del tratamiento antibiótico por vía IV (AII). La duración del tratamiento, tanto IV como total, en el caso de infección por SARM o por SASM productor de PVL, debería ser más prolongado e individualizado, y de un mínimo de 10-14 días en la forma IV (AII). Igualmente, la duración del tratamiento en el caso de IOA complicada podría necesitar prolongarse, debiendo individualizarse |
| • En todos los casos, debería utilizarse un antibiótico empírico con buena actividad frente a SASM y a S. pyogenes (AI). En niños < 5 años convendría utilizar un antibiótico con buena actividad frente a K. kingae (AI) y en aquellos niños < 5 años con < 3 dosis de vacuna frente a H. influenzae tipo b o S. pneumoniae (especialmente en menores de 2 años) debería utilizarse un antibiótico con buena cobertura frente a estos microorganismos (AII) |
| • Cefazolina es el antibiótico de elección inicial en niños>2 años. Otras opciones son cloxacilina y clindamicina (esta última, especialmente si la prevalencia de SAMR es superior al 10%) (AII). En caso de utilizar clindamicina o cloxacilina en ≤ 2-5 años, convendría combinarlo con otro antibiótico con buena actividad frente a Kingella, normalmente un betalactámico (AII) |
| • En niños < 2 años o con < 3 dosis vacunales, se recomienda tratamiento con cefuroxima, y como alternativa, amoxicilina-clavulánico. Otra opción incluiría cloxacilina asociada a cefotaxima (BII). Esta última alternativa sería la indicada para niños<3 meses (AI) |
| • En caso de infección grave, definida como sepsis grave o shock séptico, y/o sospecha de embolismos pulmonares sépticos, el antibiótico más adecuado sería vancomicina con/sin rifampicina (AII), preferiblemente asociado a un betalactámico con adecuada cobertura para SASM hasta el aislamiento microbiológico. En caso de identificar SARM existen otras alternativas que podrían incluir clindamicina, linezolid o daptomicina, en diversas combinaciones, con o sin rifampicina (BIII) |
| • La duración del tratamiento IV nunca debería ser<2-5 días (AII) |
| • Los AINE son recomendables en la fase aguda para alivio del dolor y de la fiebre en la IOA (AII). La utilización de corticoides queda limitada a situaciones con alto componente inflamatorio, especialmente si la etiología infecciosa se confirma o es muy probable (BII) |
| • Un descenso de los niveles de PCR de, al menos, un 30%, con desaparición de la fiebre durante ≥ 24-48 h y mejoría de los signos y síntomas de la infección, permiten iniciar tratamiento con antibiótico oral y valorar el alta hospitalaria (AII) |
| • La evolución de las IOA con tratamiento antibiótico debe ser favorable. La falta de respuesta al tratamiento antibiótico indicaría un patógeno resistente, el desarrollo de una complicación o un diagnóstico no infeccioso (BII) |
| • Siempre que sea posible, este panel recomienda, en nuestro medio, la utilización de cefadroxilo oral dada su buena tolerancia, espectro reducido e importante experiencia clínica (AII). Cefuroxima axetilo o amoxicilina-clavulánico serían alternativas, si existe desabastecimiento. En caso de S. pyogenes o S. pneumoniae con buena sensibilidad a penicilina, se recomienda amoxicilina oral (AII) |
| • Para el tratamiento oral de SARM de adquisición comunitaria, siempre que sea sensible frente a estos antibióticos, este grupo de expertos recomienda la utilización de clindamicina (AII), TMP-SMX (BII) o ciprofloxacino (BII), asociados o no a rifampicina (CIII). Se debería evitar el tratamiento de quinolonas en monoterapia. |
| • Si no existe un aislamiento microbiológico, se debería continuar con un antibiótico de espectro similar al utilizado de forma IV (AII) |
| • Convendría citar al paciente en las consultas externas en un plazo de 5-7 días (BIII) |
| • La duración total del tratamiento antibiótico nunca debería ser < 10-14 días en el caso de AS (AII) y de 20 días en el caso de OA (AII). La suspensión del tratamiento siempre debería ir condicionado a la desaparición de la clínica y normalización de la PCR (AII) |
| • Debería realizarse un seguimiento más prolongado por parte de Traumatología y/o Reumatología de RN y lactantes pequeños, afectación de cadera e IOA complicadas (AIII) |
Los autores declaran no tener ningún conflicto de intereses.
Al Grupo de Infecciones Osteoarticulares de SERPE.