Las vacunaciones constituyen una de las principales herramientas de salud pública para el control de las enfermedades inmunoprevenibles. Si un niño es etiquetado de haber presentado una reacción alérgica a una vacuna es probable que se suspendan las siguientes inmunizaciones, con los riesgos que ello conlleva. La tasa de reacciones alérgicas graves es muy baja, oscilando entre 0,5 y 1/100.000 dosis. Las proteínas causantes de las reacciones alérgicas, más que los propios antígenos vacunales, son frecuentemente componentes residuales del proceso de fabricación, como son la gelatina y el huevo, y más raramente las levaduras o el látex. La mayoría de las reacciones son leves y localizadas en el lugar de la inyección, aunque en algunos casos pueden producirse reacciones anafilácticas graves. Si se sospecha que se ha producido una reacción alérgica inmediata a la vacuna, o si debemos vacunar a un niño con alergia a alguno de sus componentes, se deberá realizar un correcto diagnóstico de la posible alergia y conocer los componentes habituales de cada vacuna con el fin de determinar si la vacunación puede continuarse de forma segura.
Vaccinations are one of the main public health tools for the control of vaccine-preventable diseases. If a child is labeled to have had an allergic reaction to a vaccine, the next immunizations will probably be suspended in that child, with the risks involved in this decision. The rate of severe allergic reactions is very low, ranging between 0.5-1/100,000 doses. The causes of allergic reactions to vaccines, more than the vaccine itself, are often due to residual protein components in the manufacturing process, such as gelatin or egg, and rarely to yeast or latex. Most of vaccine reactions are mild, localized at the site of injection, but in some circumstances, severe anaphylactic reactions can occur. If an immediate-type allergic reaction is suspected when vaccinating, or a child allergic to some of the vaccine components has to be vaccinated, a correct diagnosis of the possible allergy has to be made. The usual components of each vaccine should be known, in order to determine if vaccination can be performed safely on the child.
El objetivo de los programas de vacunación es proteger al niño vacunado y evitar que el receptor padezca la enfermedad frente a la que se ha vacunado. Se intenta inmunizar al mayor número posible de sujetos susceptibles, para generar un ambiente protector colectivo que englobe a toda la comunidad.
Si se etiqueta a un niño de haber presentado una reacción alérgica a una vacuna (RAV), se interrumpirán las siguientes inmunizaciones y ese niño entrará a formar parte de la bolsa de susceptibles a enfermedades frente a las que ha dejado de vacunarse. Por ello, es fundamental hacer un diagnóstico certero de la RAV y confirmar si existe una relación directa entre la reacción alérgica y el acto vacunal.
La actitud ante un niño con sospecha de RAV debe comenzar respondiendo a la pregunta de si los signos o síntomas que ha presentado están directamente relacionados con la administración de la vacuna, resolver la reacción alérgica y posteriormente estudiar si el efecto adverso ha sido una reacción alérgica frente al propio antígeno vacunal o a alguno de sus componentes, ya que esto condicionará la continuación de futuras dosis de esa misma vacuna o similares1.
Las RAV son muy variadas, generalmente leves, en forma de reacción local y en casos excepcionales, graves, de tipo anafiláctico incluso con desenlace fatal2.
Composición de las vacunas: antígenos, conservantes y adyuvantesLas vacunas no contienen solamente el antígeno encargado de estimular la respuesta inmunológica en el individuo vacunado, sino que puede contener distintos componentes (tabla 1).
Composición de las vacunas
| • Antígeno inmunizante |
| • Líquido de suspensión: puede contener proteínas u otros productos derivados de los cultivos |
| • Antibióticos: para evitar la contaminación |
| • Conservantes: amplían la caducidad |
| • Estabilizantes: el más conocido, la gelatina |
| • Adyuvantes: aumentan la inmunogenicidad de los antígenos |
Las RAV son infrecuentes y generalmente no guardan relación causal con la inmunización. Se han comunicado RAV, como auténticas reacciones de hipersensibilidad, en rangos que varían desde 1 por 50.000 dosis para la vacuna DTP hasta 0,5-1 de reacción por un millón de dosis para otras vacunas1. La Brighton Anaphylaxis Working Group estima que la cifra de verdaderas reacciones anafilácticas graves a vacunas oscila entre 0,5 y 1/100.000 dosis3. Se han comunicado cifras de fallecimientos por anafilaxia secundaria a vacunación en torno a 1/50 millones de dosis4.
En nuestro país existen pocos datos publicados, habiéndose comunicado incidencias de 0,59-1,27% de reacciones supuestamente asociadas a vacunas en primeras visitas de una Unidad de Alergología Pediátrica2.
Dentro de las reacciones alérgicas atribuidas a proteínas residuales, las más comunes son las relacionadas con el huevo, tanto en vacunas fabricadas a partir de fibroblastos de embriones de pollo como de las obtenidas a partir de huevos embrionados.
Es conveniente completar un cuestionario previo a la vacunación5, en el que se pregunte a los padres de niños que van a ser vacunados si presentan ciertas situaciones que pueden llevar a considerar la vacunación contraindicada temporal o permanentemente o a que se tomen precauciones especiales (tabla 2).
Cuestionario previo a la vacunación
| Retrasar la vacunación: | |
|---|---|
| ¿Ha estado enfermo en los últimos días? | |
| Enfermedad aguda moderada o graveFiebre > 38,5°CEpisodios alérgicos o asmáticos en fase agudaNeoplasias en fase evolutivaInsuficiencia cardiaca descompensadaNefropatías agudas | Hasta curación o situación estable |
| Sarampión | 2 meses desde el inicio del exantema |
| Tuberculosis activa | 2 meses desde el inicio del tratamiento |
| Enfermedad neurológica evolutiva, inestable o que predispone a convulsiones, como encefalitis agudas, esclerosis tuberosa o epilepsia no controlada | Retrasar tosferina hasta que la situación neurológica se estabilice |
| Contraindicadas: | |
|---|---|
| Inmunodeficiencia congénita, tumores sólidos o hematológicos, terapia inmunosupresora de larga duración | Triple vírica, varicela, rotavirus |
| Infección VIH con inmunodeficiencia grave (porcentaje de linfocitos T-CD4+ específicos por edad <15%) | Triple vírica, varicela, rotavirus |
| Antecedente de invaginación intestinal o malformación congénita gastrointestinal | Rotavirus |
| Precaución: | |
|---|---|
| Enfermedad o tratamiento que produzca alteraciones de la coagulación o trombocitopenia | Para vacunas parenterales, utilizar la vía subcutánea si lo permite la ficha técnica. Si es necesaria la vía intramuscular, utilizar solo agujas 25 G o 23 G, presionar en el punto de inyección durante 2 min, no masajear y vigilar la aparición posterior de hematoma |
| Retrasar la vacunación (desde el fin del tratamiento) | |
|---|---|
| ¿Toma algún medicamento o recibe algún tratamiento? | |
| Derivados de la sangreGammaglobulinasMás tiempo para dosis muy altas de gammaglobulina (consultar) | 3-6 meses para triple vírica y varicela (según el producto) |
| Corticoterapia sistémica a dosis alta (≥ 2 mg/kg o 20 mg al día de prednisona o equivalente) de más de 2 semanas de duración o ≥ 1 mg/kg durante más de un mesNo hace falta retrasar la vacunación si la corticoterapia es de corta duración, no sistémica, en dosis pequeñas, a días alternos o de tipo sustitutorio | Un mes para triple vírica y varicela |
| Aciclovir, famciclovir, valaciclovir | Una semana para varicela |
| Si es mujer ¿sabe o sospecha si está embarazada? | |
| Si está embarazada | Contraindicadas triple vírica y varicela |
| Si está en el primer trimestre de embarazo | Evitar cualquier vacunación, excepto gripe (valorar el riesgo particular) |
| ¿Ha recibido recientemente alguna otra vacuna? | |
| Si ha recibido alguna dosis de una vacuna viva atenuada inyectable (triple vírica, varicela, fiebre amarilla) | Retrasar la vacunación, al menos, 4 semanas para aplicar otra vacuna viva atenuada (triple vírica, varicela, fiebre amarilla) |
| ¿Ha tenido alguna reacción grave a vacunaciones anteriores? | |
| Reacción alérgica grave (anafilaxia) tras una dosis anterior o a un componente de la vacuna | Contraindicada la vacuna responsible |
| Encefalopatía en los 7 días siguientes a la administración de vacuna DTP/DTPa sin otra causa identificable | Contraindicada tosferina |
| Tras una dosis de DTP/DTPa:- Fiebre > 40,5°C, colapso hipotónico, llanto inconsolable que dura ≥3 h, en las 48 h siguientes- Convulsiones en los 3 días siguientes | Precaución con tosferina |
| Síndrome de Guillain-Barré en las 6 semanas siguientes tras una vacunación | Precaución con la vacuna responsable |
| Reacción de hipersensibilidad tipo Arthus tras una dosis de vacuna con toxoide tetánico | Retrasar cualquier otra dosis de tétanos, al menos, 10 años |
| Contraindicadas: | |
|---|---|
| ¿Es alérgico/a a algún componente de la vacuna? | |
| Solo en caso de alergias de tipo anafiláctico (reacción inmediata y potencialmente grave) | |
| Alergia a neomicina | Hepatitis A (Havrix®), hepatitis A + B, hexavalentes, gripe (Chiroflu®, Chiromas®, Dotaricin®, Inflexal V®, Intanza®, Mutagrip®, Vaxigrip®), pentavalentes, polio inyectable, rabia, triple vírica y varicela |
| Alergia a estreptomicina | Hexavalente (Hexyon®), pentavalente (Pentavac®) y polio inyectable |
| Alergia a polimixina B | Gripe (Inflexal V®), hepatitis A (Epaxal®), hexavalentes, pentavalentes y polio inyectable |
| Alergia a gentamicina | Gripe (Fluarix®, Fluenz®, Influvac®) |
| Alergia a kanamicina | Gripe (Chiroflu®, Chiromax®, Dotaricin®) |
| Alergia a gelatina | Fiebre tifoidea (Vivotif®), triple vírica (MMRVaxpro®) y varicela (Varivax®) |
| Alergia a levadura de panadería | Hepatitis A + B, hepatitis B, hexavalentes y VPH4 (Gardasil®) |
| Alergia a proteínas de huevo | Encefalitis centroeuropea, fiebre amarilla, gripe, hepatitis A (Epaxal®) y rabia (Rabipur®). La alergia a proteínas de huevo no es contraindicación para la triple vírica |
VPH4: virus del papiloma humano tetravalente.
Fuente: Modificado de Fernández Cuesta et al.5
Se define reacción alérgica como una respuesta adversa producida por un mecanismo inmunológico. Pueden incluir multitud de síntomas que pueden afectar a piel, aparato respiratorio y cardiovascular. La anafilaxia se puede confirmar por la determinación de la triptasa sérica.
La alergia es mucho menos frecuente que otro tipo de reacciones adversas. En muchas ocasiones la RAV no se confirma y el paciente puede continuar su vacunación con el mismo preparado6.
Se clasifican según su extensión en locales o sistémicas y, según el tiempo transcurrido desde la aplicación de la vacuna y la aparición de síntomas, en inmediatas o retardadas. Este criterio ayuda a distinguir las reacciones mediadas por IgE de las que no lo son1.
Reacciones inmediatasComienzan en la primera hora tras vacunarse (desde minutos hasta 4 h). Pueden incluir multitud de síntomas que pueden afectar a piel, aparato respiratorio y cardiovascular.
Reacciones tardíasComienzan horas o días después de la vacunación y hay muy poca probabilidad de que sean mediadas por IgE. No suelen producirse por mecanismo inmunológico y no deberían diagnosticarse de alergia a las vacunas. Son cuadros autolimitados que no contraindican futuras dosis de la misma vacuna.
Diagnóstico diferencial de las reacciones alérgicas durante y después del acto de la vacunaciónEl diagnóstico preciso de una RAV es importante por 2 aspectos: en primer lugar el sujeto que sufre una alergia mediada por IgE, en especial una anafilaxia, podría experimentar nuevas reacciones graves tras la vacunación, y en segundo lugar, el sobrediagnóstico de RAV podría incrementar el número de niños que interrumpen su vacunación, con el riesgo individual y colectivo de pérdida de protección frente a enfermedades inmunoprevenibles.
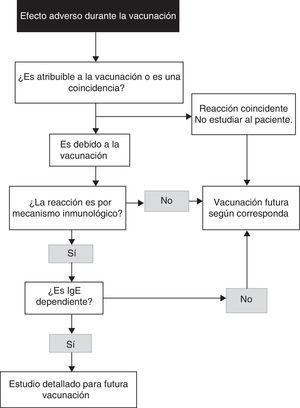
Se puede consultar el algoritmo de aproximación diagnóstica en la figura 17.
Algoritmo para la identificación de una reacción alérgica a vacunas (modificado de Kelso et al.7).
Las reacciones retardadas o tardías son inespecíficas y, en general, no tiene utilidad la determinación de anticuerpos IgE o test cutáneos; aunque son reacciones que generan malestar, no suponen una amenaza para la vida8.
Componentes de las vacunas que pueden ocasionar reacciones alérgicasLos componentes de vacunas comercializadas en España y que pueden estar involucrados en RAV se pueden consultar en el Manual de vacunas en línea de la AEP (http://vacunasaep.org/documentos/manual/anx-ii9). Ninguna de las vacunas actualmente comercializadas en España contiene en su composición tiomersal.
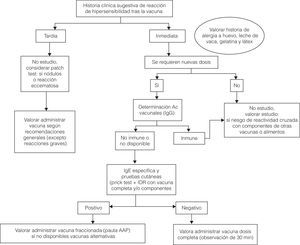
Vacunación del niño que ha presentado una probable reacción alérgica tras una inmunización. Pauta de actuaciónUn diagnóstico preciso de las RAV se basa en la historia clínica y en el estudio alergológico por medio de pruebas «in vivo» e «in vitro»10.Se puede consultar el algoritmo de actuación en la figura 2.
Mediante la historia clínica se determinará si el tipo de reacción de hipersensibilidad que ha presentado el niño ha sido inmediata o tardía.
- •
Si se sospecha una reacción inmediata mediada por IgE, se debe practicar estudio alergológico, sobre todo si son necesarias nuevas dosis de la vacuna y para evitar riesgo de reactividad cruzada con componentes de otras vacunas o alimentos10.
- •
En el caso de que se sospeche una reacción no inmediata, la vacuna podrá ser administrada de forma convencional en la mayoría de los casos8.
La determinación de anticuerpos IgG frente al agente vacunal puede ser de utilidad, si el paciente ha recibido menos dosis de las recomendadas, para valorar el nivel de inmunización. Si existen títulos protectores, se podrían evitar nuevas dosis, aunque la duración de la inmunidad podría ser menor7. Estos niveles están establecidos para algunas vacunas (tabla 3).
Niveles de anticuerpos vacunales protectores (IgG)
| Vacuna | Niveles Ac IgG protectores |
|---|---|
| Difteria | ≥ 0,1 UI/ml |
| Haemophilus influenzae b | ≥ 0,15μcg/ml |
| Hepatitis A | ≥ 10 mUI/ml |
| Hepatitis B (Ac superficie) | ≥ 10 mUI/ml |
| Sarampión | ≥ 120 título PRN |
| Polio (1, 2,3) | ≥ 1:8 título Ac neutralizantes |
| Rabia | ≥ 0,5UI VNA/ml |
| Rubeola | ≥ 10 UI/ml |
| Tétanos | ≥ 0,1 UI/ml |
| Fiebre amarilla | ≥ 0,7 UI/ml |
Ac: anticuerpos.
Fuente: Kelso et al.13.
Si se requieren nuevas dosis o no se puede determinar la cifra de anticuerpos protectores, el estudio se realizará con la vacuna completa o con sus componentes, si se sospecha una alergia a los mismos.
- •
Si es negativo, se valorará administrar la vacuna completa con un periodo de observación de 30 min.
- •
Si es positivo, se valorará la administración fraccionada, si no se dispone de una vacuna sin el componente al que el paciente es alérgico10.
- •
Historia detallada de la reacción adversa: edad del paciente, fecha de la reacción, preparado comercial de la vacuna administrada, número de lote, tiempo de latencia, sintomatología, atención médica urgente, tratamiento recibido, duración de la reacción.
- •
Composición de la vacuna.
- •
Exposición simultánea a otros alérgenos: medicamentos, alimentos, látex, etc.
- •
Tolerancia previa o posterior de otras vacunas.
- •
Tolerancia de componentes.
Las pruebas cutáneas (PC) se inician con prick sin diluir y si el resultado es negativo se realiza prueba ID con dilución 1/100 en suero fisiológico11.
Estudio alergológico de las reacciones adversas a vacunas
| Pruebas alérgicas cutáneas: |
| Pruebas intraepidérmicas de puntura o «prick» |
| Pruebas intradérmicas (ID) |
| Pruebas epicutáneas o de parche (24). |
| Pruebas serológicas con determinación de IgE sérica específica por técnica inmuno-CAP (RAST) considerando valores superiores a 0,35 KU/l |
Ante reacción anafiláctica grave se debe iniciar estudio con prick a la dilución 1/10 y la prueba intradérmica (ID) con dilución 1/1.000.
No se ha establecido la sensibilidad y especificidad de las PC con vacunas para confirmar o excluir la alergia a una vacuna o a sus componentes, pero si las PC son negativas es poco probable que el paciente tenga IgE frente a la vacuna o a sus componentes.
Si ha transcurrido más de un año desde la reacción mediada por IgE, puede haber muy poca IgE circulante y las PC en ocasiones resultar negativas por lo que la administración del medicamento puede que no provoque reacción, aunque si el paciente está sensibilizado se produce un efecto booster y puede aparecer reacción al volverse a administrar tras un intervalo de tiempo12.
Estudio de sensibilización a componentes de la vacunaSi la PC con la vacuna completa da un resultado positivo, se pasará al estudio de sensibilización a los componentes de la vacuna, con el fin de intentar prevenir la reacción con otras vacunas que tengan los mismos componentes.
Pruebas disponibles para el estudio de componentes:
- a.
Toxoide tetánico: determinación de IgE sérica específica (sensible, pero poco específica).
- b.
Huevo: PC y determinación de IgE sérica específica para clara y ovoalbúmina.
- c.
Leche de vaca: PC con extractos de leche de vaca, alfa-lactoalbúmina, beta-lactoglobulina, caseína y seroalbúmina bovinas; determinación de IgE específica para estas mismas proteínas.
- d.
Gelatina: PC no estandarizadas utilizando polvo de gelatina comercial (5g de gelatina disueltos en 5ml de suero fisiológico)13; determinación de IgE específica.
- e.
Látex: PC con látex y determinación de IgE específica.
Estudio de sensibilización a componentes contenidos en la vacuna
Pacientes que han presentado reacción eccematosa con vacuna que contiene fenoxietanol o formaldehído:
a. Prueba de parche a la concentración estandarizadaPacientes con reacción eccematosa o nódulos cutáneos persistentes con vacuna que contiene aluminio13:
a. Pruebas de parche con:
- i.
Metal de aluminio con cámara de Finn Chamber vacía.
- ii.
Cloruro de aluminio hexahidratado al 2% en glicerina con cámara de plástico.
Si el estudio alergológico con la vacuna y componentes es negativo, la vacuna puede ser administrada permaneciendo, al menos, 30 min en observación. Si existe historia de reacción grave, se administrará la vacuna en 2 dosis: primera dosis 1/10 seguida a los 30 min del resto de la dosis con observación posterior de, al menos, 30 min. No se han publicado casos de pacientes con pruebas ID negativas con la vacuna que hayan presentado una reacción anafiláctica grave tras la revacunación.
Si las PC o IgE específica son positivas en un paciente con historia de reacción mediada por IgE a uno de los componentes de la vacuna, se utilizará si es posible una vacuna que no los contenga. Si no existe y es necesaria la administración de la vacuna sospechosa o de otra vacuna que contenga el componente sospechoso, se realizará mediante administración fraccionada, en medio hospitalario, siguiendo la pauta de la tabla 5.
Administración fraccionada de la vacuna en ml
| 1.ª dosis: | 0,05 de la dilución 1:10 en suero fisiológico |
| 2.ª dosis: | 0,05 sin diluir |
| 3.ª dosis | 0,10 sin diluir |
| 4.ª dosis | 0,15 sin diluir |
| 5.ª dosis | 0,20 sin diluir |
| 6.ª dosis | Dosis de 0,5 (para vacunas que requieren un volumen de 1) |
Recomendaciones de la Academia Americana de Pediatría16.
Si el estudio alergológico no es concluyente y la reacción se produjo con la administración simultánea de varias vacunas, la revacunación se debe realizar con las vacunas separadas en diferentes días.
Revacunación en pacientes con reacción alérgica tardía14,15La revacunación debe valorarse en función de su necesidad y de la naturaleza y gravedad de la reacción adversa previa. Si se decide su administración debe permanecer en observación durante 30 min.
Si se administraron simultáneamente varias vacunas, la revacunación debe realizarse por separado en diferentes días, empezando por la que se sospeche de menor riesgo.
Las PC no se han demostrado útiles para predecir la aparición de reacción tardía en posteriores administraciones de la vacuna.
En pacientes que han presentado nódulos cutáneos persistentes tras la administración de una vacuna que contiene sales de aluminio y con la prueba de parche positiva, si es posible se deben utilizar vacunas que no las contengan. Si está sensibilizado y precisa dosis de vacuna que contenga sales de aluminio, se recomienda su administración intramuscular profunda para reducir la reacción local.
Vacunación del niño con sospecha o diagnóstico de alergia a algunos de los componentes de las vacunas. Pauta de actuaciónAl plantear la vacunación de un niño puede darse la situación de que sea alérgico a alguna de las proteínas residuales de su proceso de elaboración o a cualquier otro producto que se utilice en su preparación. En los niños atópicos no existe evidencia científica de que tengan mayor riesgo de reacciones alérgicas después de la vacunación y deben recibir todas las vacunas recomendadas16,17.
Niño alérgico a proteínas de huevoLa alergia al huevo es la primera causa de alergia alimentaria en el niño18, con una prevalencia estimada del 2,5% en los primeros 2 años de vida19. La vacuna triple vírica está desarrollada en fibroblastos de embriones de pollo mientras que la vacuna antigripal (VAG) y la de la fiebre amarilla son cultivadas en huevos embrionados que pueden contener mayores cantidades de proteínas de huevo. Otras vacunas que contienen proteínas de huevo son la vacuna antihepatitis A Epaxal® y la vacuna frente a la encefalitis centroeuropea. Una de las vacunas antirrábicas comercializadas en España no está cultivada en embriones de pollo, sino en células diploides humanas.
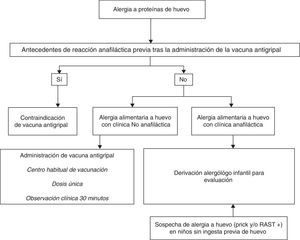
Triple víricaNo contiene proteínas de huevo capaces de desencadenar una reacción alérgica y por ello, a todos los niños con alergia al huevo, incluso con clínica de anafilaxia, se les debe administrar esta vacuna en su centro de vacunación habitual20. Aquellos niños que hayan tenido una reacción con una dosis previa de triple vírica deberán ser evaluados por un alergólogo/alergólogo pediátrico. Estas reacciones se producen por alergia a otros componentes de la vacuna.
Vacuna antigripalSe recomienda la administración de VAG a niños mayores de 6 meses pertenecientes a determinados grupos de riesgo21. Si los niños no han comenzado la ingesta de huevo y se sospecha que puedan ser alérgicos, deben ser valorados antes de su vacunación por un alergólogo pediátrico.
La VAG puede contener cantidades residuales de ovoalbúmina22 y, como no se somete a tratamiento con calor durante su manufacturación, las proteínas termolábiles alergénicas del huevo permanecen intactas, pudiendo ocasionar reacciones incluso a niños que toleran el huevo cocinado.
En casos de anafilaxia tras la VAG, no se administrarán nuevas dosis (fig. 3).
En casos con alergia al huevo sin anafilaxia grave, una VAG que contenga menos de 0,6-1μg/dosis de ovoalbúmina es segura23 por lo que puede administrarse en su centro habitual24,25 en dosis única y sin necesidad de realizar PC previas26. La inmunización antigripal con vacunas con bajo contenido en ovoalbúmina en pacientes con alergia al huevo con manifestaciones anafilácticas graves, sin fraccionamiento de la dosis, se ha demostrado segura e incluso en niños con anafilaxia a huevo se emplearon vacunas con alto contenido en ovoalbúmina sin complicaciones graves27–29.
Vacuna de la fiebre amarillaCultivada en embriones de pollo, puede contener cantidades significativas de proteínas de huevo30. Si se precisa su administración, los niños alérgicos al huevo deberán ser evaluados por un alergólogo/alergólogo pediátrico. Si el estudio es negativo puede realizarse la vacunación de la forma habitual y, si es positivo y la vacuna es imprescindible, deberá realizarse su administración en medio hospitalario, fraccionando la vacuna31,32.
Niño con alergia a la leche de vacaLa presencia de derivados lácteos en el contenido de vacunas es un hecho excepcional. En la ficha técnica de las vacunas comercializadas en España no figura que puedan contener proteínas de leche de vaca, aunque puede producirse contaminación inadvertida procedente del medio de cultivo. Algunas vacunas contienen, como excipiente, lactosa, pero está libre de proteínas lácteas. Desde un punto de vista práctico, la vacunación del niño alérgico a leche de vaca es segura.
Niño con alergia a antibióticos, gelatina, hongos, levaduras y aluminioNeomicina y otros antibióticosAminoglucósidos (gentamicina, kanamicina), polimixina, clortetracicilina y neomicina se añaden a las vacunas para evitar la contaminación bacteriana durante la fabricación.
La neomicina puede producir reacciones alérgicas sistémicas que contraindican la administración de vacunas que la contengan33 y reacciones locales, tipo dermatitis de contacto, que precisan cantidades de neomicina muy superiores a las que contienen habitualmente las vacunas y que no contraindican la vacunación34.
Con el resto de los antibióticos no se han notificado reacciones desencadenadas por la vacunación35,36.
GelatinaLa gelatina es una proteína animal del tejido conectivo del ganado bovino y porcino. Se utiliza como estabilizante en vacunas de virus atenuados7. Si se es alérgico a la gelatina debe realizarse, previamente a la vacunación, una prueba de prick con la vacuna. Si el resultado es positivo, y no hay otra vacuna que no contenga gelatina, se deberá administrar de una forma fraccionada y, si es negativo, se hará en la forma habitual13.
Hongos y levadurasLa vacuna de la hepatitis B y una de la vacunas del virus del papiloma humano se producen obteniendo los antígenos de cultivos celulares de cepas recombinantes de Saccharomyces cerevisae. La cantidad de levadura que contiene una vacuna puede ser de hasta 5mg por ml en la vacuna del virus de la hepatitis B y menor en la del virus del papiloma7. Si el paciente tiene sospecha de alergia a las levaduras, deberá realizarse determinación de IgE específica y prick cutáneo. Si los resultados son negativos, podrá realizarse la vacunación normalmente. Si son positivos y la vacunación es absolutamente necesaria, deberá realizarse de una forma fraccionada16.
AluminioEl aluminio se utiliza como adyuvante para potenciar la respuesta inmunológica37. La reacción que desencadena habitualmente es la presencia de nódulos dolorosos y pruriginosos en las zonas de la inyección que no contraindican su uso38. Apenas hay referencias en la literatura sobre reacciones de hipersensibilidad del tipo de eccema generalizado39, por lo que no existe evidencia científica para no recomendar la vacunación en niños sensibilizados al aluminio diagnosticados por pruebas epicutáneas40.
Niños con alergia al látexLos niños con alergia confirmada al látex deben ser vacunados en un ambiente libre de látex. La mayoría de los productos empleados son sintéticos (goma de butilo, goma de clorobutilo, goma de estireno, halobutilo), si bien alguno tiene un cierre elastomérico tipo I con un 10% de látex.
Si la clínica que refiere el niño es únicamente alergia de contacto con látex, puede vacunarse de la forma habitual10. Si la reacción ha sido anafiláctica, debe garantizarse la administración de la vacuna en un medio exento de látex.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.