La exposición ambiental al tabaco incrementa el riesgo de patología respiratoria en la infancia. Sin embargo, el impacto del tabaquismo materno en el desarrollo de bronquiolitis aguda ha sido escasamente evaluado. El objetivo del estudio fue determinar la incidencia de bronquiolitis aguda y analizar el efecto del tabaquismo materno prenatal y posnatal en el desarrollo de esta patología.
Pacientes y métodosEstudio observacional, prospectivo, que incluyó recién nacidos sanos de un hospital terciario entre octubre de 2015 y febrero de 2016. Se realizaron encuestas a las madres al alta de maternidad y seguimiento durante 2años, que recogieron información sobre tabaquismo prenatal y posnatal, estilo de vida, antecedentes familiares y personales, y desarrollo de bronquiolitis. Se realizó análisis de regresión logística bivariante y multivariante.
ResultadosSe incluyeron 223 recién nacidos; el 13,9% estuvieron expuestos a tabaquismo durante la gestación, el 21,4% en período posnatal y el 12,4% en ambos momentos. La incidencia de bronquiolitis fue del 28,7% al año de vida y del 34,5% a los 2años. El análisis multivariante demostró que la exposición prenatal y posnatal al tabaco es un factor de riesgo independiente para el desarrollo de bronquiolitis (OR4,38; IC95%: 1,63-11,76), mientras que la lactancia materna prolongada es un factor protector (OR0,13; IC95%: 0,04-0,48). Otros factores que resultaron estadísticamente significativos fueron: dermatitis atópica (OR2,91; IC95%: 1,26-6,73) y edad gestacional (OR1,42; IC95%: 1,08-1,88).
ConclusionesLos niños expuestos a tabaquismo materno prenatal y posnatal presentan un mayor riesgo de padecer bronquiolitis. La disminución del hábito tabáquico en mujeres con intención de embarazo debe ser una prioridad en medicina preventiva.
Environmental exposure to tobacco increases the risk of respiratory disease in infants. However, the impact of maternal smoking on the development of acute bronchiolitis has hardly been assessed. The aim of this study was to determine the incidence of acute bronchiolitis and to analyse the effect of prenatal and postnatal maternal smoking on the development of this disease.
Patients and methodsA prospective, observational study was performed on healthy newborns from a third level hospital born between October 2015 and February 2016. Questionnaires were completed by the mothers at discharge from maternity and followed-up for 2years. These collected information about prenatal and postnatal smoking, lifestyle, family and personal history, and the development of bronchiolitis. A bivariate and multivariate logistic regression analysis was performed.
ResultsA total of 223newborns were included, of whom 13.9% were exposed to tobacco smoking during gestation, 21.4% in the postnatal period, and 12.4% in both times. The incidence of bronchiolitis was 28.7% at one year of life, and 34.5% at 2years. The multivariate analysis demonstrated that the prenatal and postnatal exposure to tobacco is an independent risk factor for the development of bronchiolitis (OR4.38; 95%CI: 1.63-11.76), while prolonged breastfeeding is a protective factor (OR0.13; 95%CI: 0.04-0.48). Other factors that were statistically significant were: atopic dermatitis (OR2.91; 95%CI: 1.26-6.73), and gestational age (OR1.42; 95%CI: 1.08-1.88).
ConclusionsChildren exposed to prenatal and postnatal maternal smoking have a higher risk of suffering bronchiolitis. Reducing the smoking habit in women that intend to become pregnant must be a priority in preventive medicine.
El hábito tabáquico durante la gestación supone un importante problema de salud pública por sus efectos nocivos sobre el curso del embarazo y el desarrollo fetal1,2. Aunque sus efectos perjudiciales son bien conocidos, el consumo de tabaco continúa siendo elevado en mujeres gestantes, con variabilidad según las distintas zonas geográficas. En Europa, la prevalencia de tabaquismo durante el embarazo se encuentra en torno al 20%. En España, alrededor del 30-43% de las mujeres embarazadas son fumadoras al comienzo de su embarazo y el 13-25% continúan fumando hasta el parto3.
Las consecuencias de la exposición intrauterina al tabaco se manifiestan en la edad neonatal y durante toda la infancia. El tabaquismo materno durante la gestación puede afectar a la función pulmonar del niño tras el nacimiento, lo que podría condicionar un incremento del riesgo de patología respiratoria4-7. No obstante, como el 90% de las mujeres que fuman durante el embarazo continúan haciéndolo en años posteriores, no es fácil diferenciar si el efecto adverso del tabaco en el niño es atribuible a un daño en el desarrollo del feto intraútero o a la exposición al tabaco después del nacimiento8-10.
El papel del tabaquismo pasivo posnatal como factor de riesgo de enfermedades respiratorias ha sido demostrado en algunos trabajos publicados. Existe mayor riesgo de contraer infecciones respiratorias en los hijos de padres fumadores, así como también una relación entre la exposición pasiva al tabaco en edades tempranas y el posterior desarrollo de hiperreactividad bronquial11-13.
Las infecciones respiratorias de vías bajas son frecuentes en la infancia y en ocasiones potencialmente graves, generando una elevada carga en todos los niveles asistenciales y un alto coste económico para la sanidad pública14,15. La bronquiolitis aguda (BA) es la principal causa de ingreso por infección respiratoria de vías bajas en los menores de 2años. El agente etiológico principal es el virus respiratorio sincitial (VRS), aunque del 10 al 20% de los casos pueden estar producidos por otros virus, observándose coinfecciones en el 30% de los casos16,17. El VRS infecta a la mayoría de niños durante los dos primeros años de vida, pero solo el 20-30% desarrollan BA, requiriendo hospitalización del 1 al 5%4,17,18. Este porcentaje aumenta en presencia de factores de riesgo, tales como prematuridad, cardiopatías congénitas, displasia broncopulmonar e inmunodeficiencias12,17,19. Además de los factores descritos clásicamente, algunos estudios han demostrado que el tabaquismo pasivo posnatal aumenta la incidencia y la gravedad de la BA5,8,11,13,20. Sin embargo, hasta la fecha son escasos los estudios prospectivos que han evaluado el impacto de la exposición prenatal al tabaco en la presentación de la BA4,12,21-23.
El objetivo del presente estudio es determinar la incidencia de BA y analizar el efecto del hábito tabáquico materno prenatal y posnatal en el desarrollo de esta patología durante los dos primeros años de vida.
Pacientes y métodosSe realizó un estudio observacional, prospectivo, que incluyó a una cohorte de recién nacidos (RN) sanos con edad gestacional mayor de 35semanas y peso superior a 2.000g ingresados en la maternidad del Hospital Clínico Universitario de Valladolid durante el período comprendido entre octubre de 2015 y febrero de 2016. Se excluyeron los RN que presentaron patología neonatal y requirieron hospitalización.
Se llevó a cabo un muestreo consecutivo de todas las madres con deseo de participar en el estudio, quienes realizaron encuestas autocumplimentadas al alta de maternidad en las que se registró el hábito tabáquico durante la gestación y consumo diario de cigarrillos. Además, se recogieron antecedentes sociodemográficos, gestacionales, perinatales y tipo de lactancia. Los datos referentes a los antecedentes obstétricos y perinatales se corroboraron con la historia clínica.
Se realizó seguimiento de la cohorte de RN hasta los 2años, mediante entrevistas telefónicas realizadas a los progenitores (madre y/o padre) a los 6, 12 y 24meses, para conocer si el niño había sido diagnosticado de BA, la edad del diagnóstico, si requirió ingreso hospitalario por esta causa y si había presentado episodios de sibilancias posbronquiolitis. Se ha considerado BA al primer episodio de dificultad respiratoria que cursa con sibilancias y/o estertores crepitantes y está precedido por un cuadro catarral de vías altas, y que afecta a niños menores de 2años19. El diagnóstico de BA se confirmó con la historia clínica informatizada de atención primaria y especializada, según la Clasificación Internacional de Enfermedades 9° Modificación Clínica (CIE-9 MC), con código CIE-9 466.1 para BA y sus categorías (CIE-9 466.11 bronquiolitis por VRS, CIE-9 466.19 BA debida a otros organismos infecciosos). Dada la variabilidad diagnóstica de esta patología, sobre todo durante el segundo año de vida, además se consideró BA al primer cuadro clínico de infección y dificultad respiratoria con sibilantes y/o crepitantes, codificados como bronquitis aguda con broncoespasmo (CIE-9: 466.0). Se realizó revisión de los registros de visitas a urgencias, hospitalizaciones y consultas a atención primaria. En caso de contradicción entre la información ofrecida por los padres y los datos de la historia clínica, prevaleció la información de la historia clínica electrónica sobre la aportada por los padres.
La encuesta de seguimiento también recabó información sobre el hábito tabáquico materno y paterno, consumo diario de cigarrillos, historia familiar de atopia (asma o rinitis alérgica en padres o hermanos), historia personal de atopia (dermatitis atópica y alergia alimentaria o farmacológica), asistencia a guardería, existencia de hermanos mayores y meses de alimentación con lactancia materna (LM).
El diagnóstico de dermatitis atópica se confirmó con la historia clínica informatizada, según la clasificación por código CIE-9 691.8, descartando los casos que no habían sido diagnosticados por el pediatra de atención primaria o especializada, con la finalidad de evitar el sobrediagnóstico. De la misma forma, se comprobó el diagnóstico de alergia alimentaria o farmacológica, considerando concluyente el diagnóstico realizado por un pediatra. La información sobre la presentación de dermatitis atópica y alergias se recogió en cada entrevista telefónica realizada durante el seguimiento hasta los 2años.
El resumen de las preguntas realizadas en las encuestas de maternidad y seguimiento se presenta en la tabla 1.
Información recogida en las encuestas de maternidad y seguimiento
| Encuesta maternidad | ||
|---|---|---|
| Características sociodemográficas | Factores perinatales | Encuesta de tabaquismo |
| Edad materna | Edad gestacional | ¿Fumó durante todo el período de embarazo? |
| Procedencia | Peso al nacimiento | Sí, diariamente |
| Española | Tipo de parto | Sí, ocasionalmente |
| Extranjera | Vaginal | Si fumó diariamente, ¿cuántos cigarrillos al día fumó? |
| Nivel de estudios de la madre | Cesárea | |
| Básico (graduado escolar) | Sexo del recién nacido | |
| Grado medio | Tipo de lactancia | |
| Superior (universitarios) | Materna | |
| Artificial | ||
| Preguntas realizadas en las encuestas de seguimiento (6, 12 y 24 meses) |
|---|
| Información referente al diagnóstico de bronquiolitis aguda |
| ¿El niño o niña ha presentado bronquiolitis aguda? |
| ¿Precisó ingreso hospitalario por bronquiolitis? |
| Edad de presentación de bronquiolitis aguda (meses) |
| ¿Ha presentado otros episodios de sibilancias después del diagnóstico de bronquiolitis aguda? |
| ¿Cuántos episodios de sibilancias posbronquiolitis ha presentado? |
| Antecedentes familiares y personales de atopia |
| ¿La madre, padre o hermanos presentan asma o rinitis alérgica? |
| ¿El niño/a presenta dermatitis atópica? ¿Ha sido diagnosticado por algún pediatra? |
| ¿El niño/a tiene algún tipo de alergia a alimentos o a fármacos? |
| Exposición al tabaco |
| ¿La madre fuma? |
| Sí, diariamente |
| Sí, ocasionalmente |
| En caso de tabaquismo diario materno: número de cigarrillos al día que fuma la madre |
| ¿El padre fuma? |
| En caso de tabaquismo diario paterno: número de cigarrillos al día que fuma el padre |
| Otros |
| ¿Tiene hermanos mayores? |
| ¿Asiste a guardería actualmente? |
| ¿Asistía a guardería cuando presentó bronquiolitis?a |
| ¿Recibe lactancia materna? |
| Si ha descontinuado la lactancia materna: ¿cuántos meses tomó lactancia materna? |
La recolección de los datos fue realizada por el equipo investigador formado por pediatras y residentes de pediatría, quienes efectuaron la encuesta al momento del alta de maternidad y el seguimiento telefónico.
El estudio fue aprobado por la Comisión de Investigación y Comité Ético del Hospital Clínico Universitario de Valladolid, siguiendo la normativa de la declaración de Helsinki.
Análisis estadísticoEl análisis estadístico se realizó con el programa IBM SPSS 20.0 para Windows® (SPSS Inc., Chicago, Illinois, Estados Unidos). Las variables categóricas se expresaron con porcentajes e intervalos de confianza al 95% (IC95%) y las variables cuantitativas con media y desviación estándar (DE) en caso de ser normales, o mediana y rango intercuartílico si no tuvieron distribución normal.
Se calculó la incidencia de BA en la cohorte de estudio, el riesgo relativo (RR) y la fracción atribuible en expuestos a tabaquismo materno prenatal y posnatal. Se realizó análisis de regresión logística bivariante y multivariante, considerando como variable dependiente el diagnóstico de BA. Para el análisis multivariante se utilizó el método de selección de pasos hacia atrás según la razón de verosimilitud y se incluyeron las variables que mostraron asociación casi significativa en el análisis bivariante (p<0,10) y aquellas con relevancia clínica descritas en estudios previos. Para el resultado definitivo se consideró estadísticamente significativo el valor de p<0,05. Los resultados se presentan como odds ratio (OR) y sus IC95%.
Se calculó la potencia estadística del estudio considerando el número de pacientes expuestos a tabaquismo materno prenatal que completaron el seguimiento.
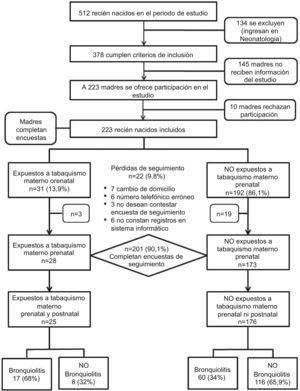
ResultadosEn el período de estudio se atendieron un total de 512 RN en nuestro centro, de los cuales 378 ingresaron en la maternidad y cumplieron criterios de inclusión. Se ofreció la participación en el estudio a 233 madres, y 10 rechazaron realizar la encuesta. Debido a la mayor carga asistencial generada durante días festivos y fines de semana, 145madres no fueron informadas sobre la posibilidad de participar en el estudio.
Un total de 223 RN fueron reclutados tras completar sus madres la encuesta al alta de maternidad (fig. 1). El 13,9% (n=31) de las madres fumaron durante la gestación, con una mediana de consumo de 3 cigarrillos al día (RIQ2-5). Las características de la cohorte de RN se muestran en la tabla 2.
Características generales de la población (encuesta realizada al alta de Maternidad)
| n=223 (%) | |
|---|---|
| Edad materna, años; mediana [RIQ] | 34 [30,5-37] |
| Procedencia española | 197 (88,3) |
| Nivel de estudios materno | |
| No contesta | 34 (15,2) |
| Básicos | 43 (19,3) |
| Medios | 60 (26,9) |
| Superiores | 86 (38,6) |
| Sexo mujer | 116 (52) |
| Peso al nacimiento, gramos; media (DE) | 3215 (407) |
| Bajo peso al nacimiento (< 2.500 g) | 10 (4,5) |
| Edad gestacional, semanas; mediana [RIQ] | 39,5 [39,5-40,5] |
| Prematuridad (36 semanas) | 4 (1,8) |
| Tipo de parto (cesárea) | 52 (23,3) |
| Madre fumadora durante la gestación | 31 (13,9) |
| De forma ocasional | 11 (5) |
| Diariamente | 20 (9) |
| Número de cigarrillos/día durante la gestación; mediana [RIQ] | 3 [2-5] |
| Tipo de alimentación al alta de maternidad | |
| Lactancia artificial | 22 (9,9) |
| Lactancia materna | 201 (90,1) |
Las variables categóricas están expresadas en valor absoluto y porcentaje (%), y las variables cuantitativas en media y desviación estándar (DE) o mediana y rango intercuartílico [RIQ].
Desarrollaron BA 77 pacientes, con una incidencia acumulada a los 2años del 34,5% (IC95%: 28,1-41); 64 de ellos fueron diagnosticados durante el primer año de vida (28,7%; IC95%: 22,5-34,9). La mediana de edad al diagnóstico fue de 5meses (RIQ3,3-11). Requirieron ingreso hospitalario 10pacientes (4,4%), y 47 presentaron sibilancias recurrentes (21,07%), con una mediana de 2episodios posbronquiolitis (RIQ1-4).
El 90,1% de los pacientes completaron el seguimiento hasta los 2años (n=201): 28/31 del grupo de expuestos a tabaquismo materno prenatal y 173/192 de los no expuestos. Las pérdidas de seguimiento se debieron a cambio de domicilio, ausencia de registros en el sistema informático con imposibilidad de comprobar los datos de las encuestas, y retirada de los padres del estudio con rechazo a responder la encuesta de seguimiento.
El riesgo de desarrollar BA en el grupo de niños expuestos a tabaquismo materno prenatal fue del 64,3% (18/28) vs el 34,1% (59/173) en el grupo de no expuestos, con un RR de 1,9 (IC95%: 1,3-2,6) y una fracción atribuible en expuestos a tabaquismo materno prenatal del 46,9% (IC95%: 25,1-62,4).
Respecto a los resultados sobre exposición posnatal al tabaco, observamos que de los 201 niños que completaron el seguimiento, 43 madres fumaron después del parto (21,4%), con una mediana de consumo de 10cigarrillos al día (RIQ6-10). El riesgo de BA en los hijos de madres que fumaron después del embarazo fue del 53,5% (23/43) vs 34,2 (54/158) en el grupo de hijos de madres no fumadoras, con un RR de 1,56 (IC95%: 1,1-2,2) y una fracción atribuible en expuestos a tabaquismo materno posnatal del 36,1% (IC95%: 9,1-55). Observamos que 25niños (12,4%) estuvieron expuestos al tabaco en ambos momentos (prenatal y posnatal), con un riesgo de BA del 68% (17/25) vs el 34% (60/176) en los no expuestos, un RR de 2 (IC95%: 1,42-2,80) y una fracción atribuible en expuestos a tabaquismo pre y posnatal del 49,9% (IC95%: 29,7-64,3). La figura 1 muestra el diagrama de flujo de la evolución de la cohorte de estudio según la exposición prenatal y posnatal al tabaco.
Por otra parte, 66 niños tenían padre fumador (32,8%), con una mediana de consumo de 10cigarrillos al día (RIQ6-15), 76 tenían al menos un progenitor fumador (37,8%) y en 33 niños ambos progenitores eran fumadores (16,4%). Las características de los pacientes que completaron el seguimiento y su distribución según el diagnóstico de BA se muestran en la tabla 3.
Características de los pacientes que completaron el seguimiento de 2 años y su frecuencia según el diagnóstico de bronquiolitis aguda
| Total n=201 (%) | Bronquiolitis aguda | OR (IC95%) | p | ||
|---|---|---|---|---|---|
| Sín=77 (%) | Non=124 (%) | ||||
| Edad maternaa | 34,5 [31-37,5] | 34,5 [31-37,5] | 34,5 [31,5-37,5] | 1,02 (0,97-1,07) | 0,509 |
| Procedencia | |||||
| Española | 179 | 71 (92,2) | 108 (87,1) | Ref. | 0,264 |
| Extranjera | 22 | 6 (7,8) | 16 (12,9) | 0,57 (0,21-1,53) | |
| Nivel de estudios | |||||
| Desconocido | 29 (14,4) | 8 (10,3) | 21 (16,9) | Ref. | |
| Básicos | 40 (19,9) | 19 (24,7) | 21 (16,9) | 2,38 (0,85-6,61) | 0,098 |
| Medios | 57 (28,4) | 20 (26) | 37 (29,8) | 1,42 (0,53-3,78) | 0,484 |
| Superiores | 75 (37,3) | 30 (39) | 45 (36,3) | 1,75 (0,69-4,46) | 0,241 |
| Sexo | |||||
| Mujer | 103 (51,2) | 37 (48,1) | 66 (53,2) | Ref. | 0,476 |
| Varón | 98 (48,8) | 40 (51,9) | 58 (46,8) | 1,23 (0,70-2,17) | |
| Edad gestacionala, semanas (DE) | 39,4 (1,23) | 39,3 (1,0) | 39,6 (1,3) | 1,25 (0,98-1,60) | 0,070 |
| Peso al nacimientoa, gramos (DE) | 3.206 (407) | 3.204 (434) | 3.207 (391) | 1 (0,99-1,01) | 0,955 |
| Bajo peso al nacimiento | 10 (5) | 3 (3,9) | 7 (5,6) | 0,68 (0,17-2,70) | 0,581 |
| Madre fumadora gestación | |||||
| No fumadora | 173 (86,1) | 59 (76,6) | 114 (91,9) | Ref. | |
| De forma ocasional | 11 (5,5) | 10 (13) | 1 (0,8) | 19,3 (2,4-154,6) | 0,005 |
| Diariamente | 17 (8,5) | 8 (10,4) | 9 (7,3) | 1,72 (0,63-4,68) | 0,290 |
| Madre fumadora posparto | |||||
| No fumadora | 158 (78,6) | 54 (70,1) | 104 (83,9) | Ref. | |
| De forma ocasional | 2 (1) | 1 (1,3) | 1 (0,8) | 1,93 (0,12-31,4) | 0,645 |
| Fuma 1-9 cigarrillos/día | 19 (9,5) | 10 (13) | 9 (7,3) | 2,14 (0,82-5,58) | 0,120 |
| Fuma ≥ 10 cigarrillos/día | 22 (10,9) | 12 (15,6) | 10 (8,1) | 2,31 (0,94-5,69) | 0,068 |
| Hábito tabáquico materno | |||||
| No fumadora | 155 (77,1) | 53 (68,8) | 102 (82,3) | Ref. | |
| Solo tabaquismo prenatal | 3 (1,5) | 1 (1,3) | 2 (1,6) | 0,96 (0,09-10,9) | 0,975 |
| Solo tabaquismo posnatal | 18 (9) | 6 (7,8) | 12 (9,7) | 0,96 (0,34-2,71) | 0,942 |
| Tabaquismo pre y posnatal | 25 (12,4) | 17 (22,1) | 8 (6,5) | 4,09 (1,66-10,1) | 0,002 |
| Padre fumador | 66 (32,8) | 30 (39) | 36 (29) | 1,56 (0,86-2,84) | 0,146 |
| Algún progenitor fumador | 76 (37,8) | 36 (46,8) | 40 (32,3) | 1,84 (1,03-3,31) | 0,040 |
| Dos padres fumadores | 33 (16,4) | 17 (22,1) | 16 (12,9) | 1,91 (0,90-4,06) | 0,091 |
| Dermatitis atópica | 34 (16,9) | 18 (23,4) | 16 (12,9) | 2,06 (0,98-4,34) | 0,057 |
| Alergia alimentos o fármacos | 17 (8,5) | 8 (10,4) | 9 (7,3) | 1,48 (0,55-4,02) | 0,440 |
| Historia familiar de atopia | 55 (27,4) | 26 (33,8) | 29 (23,4) | 1,67 (0,89-3,13) | 0,110 |
| Hermanos | 101 (50,2) | 43 (55,8) | 58 (46,8) | 1,44 (0,81-2,55) | 0,212 |
| Asistencia a guardería | 111 (55,2) | 39 (50,6) | 72 (58,1) | 0,67 (0,38-1,18) | 0,167 |
| Tipo de alimentación | |||||
| Lactancia artificial | 20 (10) | 10 (13) | 10 (8,1) | Ref. | |
| LM <6 meses | 77 (38,3) | 34 (44,2) | 43 (34,7) | 0,79 (0,30-2,12) | 0,640 |
| LM 6-11meses | 61 (30,3) | 26 (33,8) | 35 (28,2) | 0,74 (0,27-2,05) | 0,565 |
| LM ≥12meses | 43 (21,4) | 7 (9,1) | 36 (29) | 0,19 (0,06-0,64) | 0,007 |
IC95: intervalo de confianza al 95%; LM: lactancia materna; OR: odds ratio; Ref: categoría de referencia.
OR e IC95% están calculadas para cambios de una unidad en las variables cuantitativas (1año de edad materna, 1semana de edad gestacional, 1g de peso al nacimiento).
Las variables categóricas están expresadas en valor absoluto y porcentaje (%), y las variables cuantitativas en media y desviación estándar (DE) o mediana y rango intercuartílico [RIQ].
Analizamos la duración de la LM en los grupos de madres fumadoras y no fumadoras después de la gestación, observando una media de duración de 4meses (IC95%: 2,8-6,2) en la cohorte de madres con hábito tabáquico vs 6meses (IC95%: 6,6-8,6) en las no fumadoras.
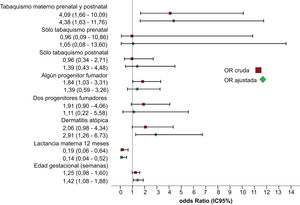
Análisis bivariante y multivarianteLos resultados del análisis bivariante se exponen en la tabla 3. El análisis multivariante identificó los factores de riesgo independientes para el desarrollo de BA (tabla 4). Se observa que el tabaquismo materno prenatal y posnatal multiplica por 4,38 (IC95%: 1,63-11,76) el riesgo de presentar BA. Otros factores que mostraron una relación estadísticamente significativa fueron: dermatitis atópica (OR2,91; IC95%: 1,26-6,73), edad gestacional (OR1,42; IC95%: 1,08-1,88) y LM igual o superior a 12meses, que demostró ser un factor protector (OR0,14; IC95%: 0,04-0,52). La figura 2 muestra el efecto del tabaquismo materno prenatal y posnatal en el desarrollo de BA y de las variables incluidas en el modelo multivariante.
Factores de riesgo de bronquiolitis aguda durante los dos primeros años de vida. Análisis multivariante (R2 de Nagelkerke 0,21)
| Variables | OR | IC95% | p |
|---|---|---|---|
| Hábito tabáquico materno | |||
| No fumadora | Ref. | ||
| Solo tabaquismo prenatal | 1,05 | 0,08-13,60 | 0,970 |
| Solo tabaquismo posnatal | 1,39 | 0,43-4,48 | 0,580 |
| Tabaquismo pre y posnatal | 4,38 | 1,63-11,76 | 0,003 |
| Tipo de alimentación | |||
| Lactancia artificial | Ref. | ||
| Lactancia materna <6 meses | 0,55 | 0,19-1,59 | 0,266 |
| Lactancia materna 6-11meses | 0,65 | 0,22-1,93 | 0,437 |
| Lactancia materna ≥12meses | 0,14 | 0,04-0,52 | 0,003 |
| Dermatitis atópica | 2,91 | 1,26-6,73 | 0,013 |
| Edad gestacional (semanas) | 1,42 | 1,08-1,88 | 0,013 |
IC95: intervalo de confianza al 95%; OR: odds ratio; Ref: categoría de referencia.
Variables incluidas en el análisis: hábito tabáquico materno, tipo de alimentación, algún progenitor fumador, dos padres fumadores, dermatitis atópica, edad gestacional (semanas).
Efecto del tabaquismo materno prenatal y posnatal en el desarrollo de bronquiolitis aguda. Se observa que el tabaquismo pre y posnatal en conjunto constituye un factor de riesgo estadísticamente significativo de padecer bronquiolitis aguda, mientras que el tabaquismo prenatal y posnatal por separado no adquieren significación estadística. Se muestra odds ratio cruda y ajustada de las variables incluidas en modelo multivariante.
Considerando una prevalencia de exposición al tabaquismo materno prenatal del 13,9%, una razón de no expuestos/expuestos (r) de 6,2 y un riesgo de BA en expuestos a tabaquismo prenatal del 64,3%, y del 34,1% en no expuestos, se obtuvo una potencia estadística del 85%.
DiscusiónLos datos obtenidos del presente estudio muestran una incidencia acumulada de BA del 28,7% al año de vida y del 34,5% a los 2años, similar a la observada en otras series24,25. El principal hallazgo del estudio sugiere que la exposición prenatal y posnatal al tabaco aumenta de forma significativa la incidencia de BA, siendo un factor de riesgo independiente para el desarrollo de esta patología durante los dos primeros años de vida.
La incidencia de BA publicada en diferentes estudios es variable, probablemente debido a la heterogeneidad entre países para establecer el diagnóstico. Mientras que en Norteamérica se consideran las sibilancias espiratorias como principal signo guía, en el Reino Unido dicho papel es atribuido a los crepitantes19. En España, los criterios más aceptados son los propuestos por McConnochie, que considera BA al primer episodio agudo de dificultad respiratoria con sibilancias precedido por un cuadro catarral que afecta a niños menores de 2años, aunque preferentemente se da en el primer año de vida18. Este amplio espectro clínico conlleva cierta variabilidad de las cifras de incidencia entre estudios. Verhulst et al.25, en un estudio prospectivo realizado en una región de Bélgica con seguimiento de 154 RN a término, observaron que el 23,5% presentaron al menos un episodio de sibilancias en los primeros 12meses de vida. En nuestro medio, los datos del Asthma Multicenter International Cohort Study (AMICS) muestran una incidencia acumulada de sibilancias en el primer año de vida del 28% en Barcelona y del 24% en Menorca24. La literatura es muy escasa respecto a la incidencia de BA durante los primeros 2años, por lo que consideramos que el presente estudio aporta resultados actualizados en nuestra población.
Tal y como se ha descrito, el 13,9% de las madres declararon haber fumado durante el embarazo. La prevalencia de tabaquismo materno prenatal observada es comparable a la publicada en otros trabajos realizados en nuestro medio26,27.
Los resultados obtenidos en el presente estudio revelan el efecto que produce el hábito tabáquico materno en el desarrollo de BA. Se observó que los hijos de las madres que fumaron durante y después del embarazo tuvieron 2veces más riesgo de presentar BA durante sus dos primeros años de vida en comparación con los hijos de las madres no fumadoras. La fracción atribuible en expuestos a tabaquismo materno en ambos momentos (prenatal y posnatal) sugiere que el 49,9% de los episodios de BA en hijos de madres fumadoras son atribuibles a este factor de riesgo.
Existe un creciente interés respecto al efecto nocivo que puede ocasionar la exposición intraútero al tabaco en el desarrollo pulmonar del feto12,18,26-31. Se ha observado que los hijos de madres que fumaron durante la gestación presentan alteración de las pruebas de función pulmonar durante la primera infancia que puede persistir hasta la edad adulta, hallándose frecuentemente obstrucción de las vías aéreas de mediano y pequeño calibre6,32-34. Estudios realizados con modelos animales para valorar los efectos de la nicotina en el desarrollo pulmonar han encontrado que la exposición a nicotina en hembras gestantes produce cambios antenatales en la formación de la vía aérea, con sorprendentes similitudes entre especies, que incluyen aumento de los depósitos de colágeno bajo la membrana basal, incremento de la expresión del gen MUC5AC (glicoproteína secretora de mucina-5AC) en el epitelio bronquial, aumento del grosor del músculo liso y reducción del calibre de la vía aérea35. Todos estos hallazgos podrían explicar las secuelas que el tabaquismo produce en el desarrollo pulmonar del feto en humanos y la consecuente predisposición para presentar episodios de sibilancias.
Se ha propuesto una influencia transgeneracional de la exposición prenatal al tabaco en el desarrollo de sibilancias y asma. En el estudio de Cohorte de Madre e Hijo de Noruega (Norwegian Mother and Child Cohort Study) se observó que el hábito tabáquico de la abuela aumentó el riesgo de presentar asma en el nieto a los 3 y 7años, independientemente de si la madre fumaba durante su embarazo. Según los autores, cambios epigenéticos transgeneracionales relacionados con la metilación del ADN podrían explicar este hallazgo36. En nuestro estudio no recogimos el estatus de fumadora de la abuela, aunque resultaría interesante analizar este factor en futuros estudios.
Diversos autores han demostrado que la exposición posnatal al tabaco constituye un factor de riesgo de infecciones respiratorias de vías bajas durante los primeros años de vida5,9,11,23. La exposición al humo del tabaco altera los mecanismos de protección de las vías respiratorias, como el aclaramiento mucociliar, y deteriora la respuesta inmune innata aumentando la susceptibilidad a infecciones respiratorias por diversos patógenos4. Debido a que la mayoría de las mujeres que fuman durante el embarazo continúan fumando después del parto, no es fácil diferenciar si el efecto adverso del tabaco es atribuible a un daño en el desarrollo del feto durante la gestación o a la exposición posnatal. Los resultados de estudios respecto a este tema son contradictorios. Cano-Fernández et al.12 analizaron el efecto de la exposición prenatal y posnatal al tabaco en el desarrollo de BA y observaron que únicamente el tabaquismo materno durante la gestación constituyó un factor de riesgo independiente para BA en el análisis multivariante (OR3,27; IC95%: 1,39-7,71). Por otra parte, Behrooz et al.23 demostraron que el tabaquismo prenatal no fue un factor de riesgo significativo para bronquiolitis, mientras que la exposición posnatal al tabaco se asoció con 4 veces más riesgo de BA en el análisis ajustado por otras variables (OR4,19, IC95%: 2,51-6,98). Ninguno de estos autores evaluó el efecto que puede producir la exposición al tabaco en ambos momentos, tal como se ha realizado en el presente estudio. Probablemente la alteración de la respuesta inmune y de los mecanismos de protección de la vía aérea ocasionados por la exposición posnatal al tabaco se suman al daño que provoca el tabaquismo prenatal en la formación de la vía aérea, aumentando el riesgo de contraer infecciones respiratorias de vías bajas y sibilancias.
Observamos que el 37,8% de los niños estaban expuestos a tabaquismo pasivo, pues al menos uno de sus progenitores era fumador (madre, padre o ambos), aunque este factor, posiblemente debido al mayor efecto que ocasiona la exposición a tabaquismo materno en el desarrollo de BA, no se relacionó de forma significativa con BA en el análisis multivariante.
Estudios previos han demostrado que el hábito tabáquico materno afecta a los niños en mayor grado que el tabaquismo paterno7, probablemente por el contacto más estrecho que las madres tienen con sus hijos.
Entre los otros factores estudiados, destacamos que los pacientes con BA presentaron mayor frecuencia de dermatitis atópica durante los dos primeros años de vida. Aunque la dermatitis atópica es un factor de riesgo conocido para el asma37, esta condición ha sido poco estudiada en pacientes con BA38. Un estudio prospectivo que incluyó una cohorte de madres gestantes con seguimiento de sus RN encontró una asociación significativa entre dermatitis atópica y BA grave durante el primer año de vida (OR2,72; IC95%: 1,60-4,63)38. Aunque los mecanismos de esta asociación son desconocidos, una de las hipótesis que plantean los autores es que una barrera epitelial alterada podría desempeñar un papel importante. Variantes de la familia de las cadherinas (glucoproteínas implicadas en la adhesión celular) han sido relacionadas con eccema, hiperreactividad bronquial y asma, y más recientemente se ha descubierto que la cadherina3 (CDHR3) es un sitio de unión para rinovirus, una causa de BA39. Al igual que en nuestra cohorte de estudio, con el análisis realizado no es posible establecer una relación causal; sin embargo, resulta interesante conocer estos resultados, que podrían orientar a futuros trabajos para estudiar el impacto clínico de esta asociación en el desarrollo del asma.
La LM con una duración de al menos 12meses demostró ser un factor protector para el desarrollo de BA. Observamos que el tabaquismo materno influyó negativamente en el mantenimiento de la lactancia, con menor duración en la cohorte de madres fumadoras, lo que podría sugerir un probable papel confusor de la LM asociado al estado de tabaquismo. Sin embargo, con el análisis multivariante se demuestra el beneficio que la LM duradera ejerce en el desarrollo de la BA en nuestra cohorte, independientemente del estado de tabaquismo materno. Los beneficios de la LM en la prevención de enfermedades infecciosas en la primera infancia son ampliamente conocidos, y su papel protector en la BA, incluso en hijos expuestos a tabaquismo ambiental, ha sido demostrado previamente13,24,25,40.
Respecto a la asociación significativa observada entre mayor edad gestacional y BA, pensamos que se trata de una relación espuria. Dado que nuestra cohorte de estudio incluyó RN a término o casi a término, el papel de la edad gestacional en este análisis tiene poca relevancia.
Ciertos factores que en la literatura se han identificado como de riesgo para BA no resultaron significativos en el presente estudio. Si bien en el grupo de pacientes con BA se observó un discreto predominio de sexo masculino, bajo nivel de estudios materno y existencia de hermanos mayores, estas variables no alcanzaron significación estadística. En contraste a lo publicado en otros estudios, no se encontró asociación entre la asistencia a guardería y BA. Destacamos que nuestra cohorte incluyó RN sanos sin morbilidad asociada ni gran prematuridad y con escasa proporción de bajo peso al nacimiento. Por lo tanto, pudimos investigar el impacto de la exposición prenatal y posnatal al tabaco en el desarrollo de BA excluyendo otros factores ampliamente estudiados.
Similar a otras series publicadas, en nuestra cohorte de estudio la mayoría de niños que desarrollaron BA presentaron un cuadro clínico leve y no requirieron ingreso hospitalario. Debido al escaso número de pacientes que presentaron BA grave, no fue posible analizar el efecto del hábito tabáquico materno sobre la necesidad de ingreso hospitalario.
Entre las fortalezas del estudio, cabe mencionar el carácter prospectivo del diseño con seguimiento hasta los 2años, proporcionando datos de incidencia de BA en nuestro medio durante los primeros 24meses de vida, donde la literatura publicada es muy escasa. Además, consideramos que el porcentaje de pérdida muestral durante el seguimiento fue bajo (9,8%), y la potencia estadística obtenida es adecuada para apoyar la validez de nuestros resultados. Como limitaciones destacamos que los datos del presente estudio se recogieron a partir de encuestas. La información proporcionada por las madres en la maternidad se obtuvo a partir de encuestas autocumplimentadas, lo que condujo a un porcentaje de falta de contestación en ciertas variables, como por ejemplo nivel de estudios maternos, probablemente por la sensación de las encuestadas de invasión a su intimidad. Esto podría constituir un posible sesgo de contestación; sin embargo, el resto de antecedentes demográficos, obstétricos y perinatales se recuperaron de la historia clínica obstétrica. Sorprendentemente, la pregunta sobre consumo de tabaco materno durante la gestación tuvo un 100% de respuestas; sin embargo, consideramos que podría existir un sesgo de información debido a un menor reconocimiento del hábito tabáquico por parte de las madres. El diagnóstico de BA se obtuvo a partir de entrevistas telefónicas; sin embargo, se confirmó con la historia clínica electrónica, incluyéndose solo los casos que cumplían los criterios establecidos. Igualmente, los datos sobre tabaquismo pasivo se basaron en la información proporcionada por los padres y no se conoce el motivo por el que algunos padres rechazaron continuar con el estudio durante el seguimiento. Posiblemente debido al estigma social que supone la condición de ser padres fumadores, pensamos que la información sobre tabaquismo pasivo posnatal podría estar subestimada, lo que supone un posible sesgo de información. Para mejorar la exactitud de evaluación del tabaquismo pasivo en los niños, sería interesante utilizar técnicas de medición como la determinación de cotinina, ya que, además de ser un método más objetivo, permite cuantificar la exposición.
ConclusionesLos hijos de madres fumadoras presentan mayor riesgo de padecer BA desde su nacimiento. El tabaquismo pasivo prenatal y posnatal es un factor de riesgo evitable, por lo que la disminución del hábito tabáquico en mujeres con intención de embarazo debe ser una prioridad en medicina preventiva. Es fundamental diseñar estrategias efectivas tendientes a evitar la exposición prenatal y posnatal al tabaco, así como medidas que promuevan el inicio y la continuidad de la LM, considerando el efecto protector que esta ofrece en el desarrollo de BA y otras enfermedades infecciosas de la infancia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores dan las gracias a Carmen Fernández García-Abril por la realización de la base de datos del estudio, a Sergio Madero Juez por sus aportaciones en la revisión del artículo y a María Fe Muñoz Moreno por su colaboración con el análisis estadístico.