No se ha establecido cuál es el aporte óptimo para mejorar el metabolismo proteico sin producir efectos adversos en lactantes gravemente enfermos. Nuestro objetivo fue analizar si un mayor aporte proteico a través de la nutrición enteral se relaciona con una mejoría en el balance proteico en lactantes críticamente enfermos.
Material y métodosSe diseñó un estudio multicéntrico, prospectivo, aleatorizado y controlado (diciembre de 2016 a junio de 2019). Se incluyeron lactantes críticamente enfermos con nutrición enteral, asignándose aleatoriamente a tres dietas con diferente contenido proteico: estándar (1,7g/100ml), hiperproteica (2,7g/100ml) e hiperproteica suplementada (5,1g/100ml). Se realizaron análisis de sangre y orina y se calculó el balance nitrogenado en el momento basal y tras 3-5días de nutrición. Se analizó la variación del balance nitrogenado y de las proteínas séricas (proteínas totales, albúmina, transferrina, prealbúmina y proteína ligada al retinol) a lo largo del periodo de estudio.
ResultadosNoventa y nueve lactantes (33 por grupo) completaron el estudio. No se encontraron diferencias entre grupos en características demográficas, puntuaciones de gravedad y otros tratamientos recibidos, salvo corticoides, administrados en una mayor proporción de pacientes del tercer grupo. Tuvo lugar un aumento significativo de los niveles de prealbúmina y proteína ligada al retinol en los grupos con nutrición hiperproteica e hiperproteica suplementada. El balance nitrogenado aumentó en todos los grupos, pero este incremento no fue significativo en el grupo de nutrición hiperproteica suplementada. No se encontraron diferencias en cuanto a tolerancia gastrointestinal. Los pacientes con nutrición hiperproteica suplementada presentaron niveles superiores de urea sérica y mayor incidencia de hiperuremia.
ConclusionesLa administración enteral de altas cantidades de proteínas mejora los niveles de proteínas séricas en lactantes críticamente enfermos. Un aporte proteico de 2,2g/kg/día es generalmente seguro y bien tolerado, mientras que aportes de 3,4g/kg/día pueden producir hiperuremia en algunos pacientes.
The optimal intake to improve protein metabolism without producing adverse effects in seriously ill infants has yet to be established. The aim of our study was to analyse whether an increased protein intake delivered through enteral nutrition would be associated with an improvement in nitrogen balance and serum protein levels in critically ill infants.
Material and methodsWe conducted a multicentre, prospective randomized controlled trial (December 2016-June 2019). The sample consisted of critically ill infants receiving enteral nutrition assigned randomly to 3 protein content groups: standard diet (1.7g/dL), protein-enriched diet (2.7g/dL) and high protein-enriched diet (5.1g/dL). Blood and urine tests were performed, and we assessed nitrogen balance at baseline and at 3 to 5days of the diet. We analysed variations in nitrogen balance and serum protein levels (total protein, albumin, transferrin, prealbumin, and retinol-binding protein) throughout the study period.
ResultsNinety-nine infants (33 per group) completed the study. We did not find any differences were between groups in demographic characteristics, severity scores or prescribed medications, except for corticosteroids, administered in a higher proportion of patients in the third group. We observed significant increases in prealbumin and retinol-binding protein levels in patients receiving the protein-enriched and high protein-enriched diets at 3 to 5days compared to baseline. The nitrogen balance increased in all groups, but the differences were not significant in the high protein-enriched group. There were no differences in gastrointestinal tolerance. Patients fed high protein-enriched formula had higher levels of serum urea, with a higher incidence of hyperuraemia in this group.
ConclusionEnteral administration of higher amounts of protein improves serum protein levels in critically ill children. A protein intake of 2.2g/kg/day is generally safe and well tolerated, whereas an intake of 3.4g/kg/day may produce hyperuraemia in some patients.
La respuesta metabólica al estrés en la enfermedad crítica supone, tras una corta fase inicial de depresión del metabolismo, con disminución del consumo de oxígeno y del gasto energético, que no suele extenderse más allá de las primeras horas, una situación de hipercatabolismo, regulada por una serie de cambios hormonales, con elevación de los niveles de insulina, glucagón, cortisol, catecolaminas y citoquinas proinflamatorias, que condiciona un aumento del recambio de glucosa y de lípidos y, de forma más característica, un aumento del turnover o reemplazo proteico1,2. Los aminoácidos procedentes del músculo esquelético son utilizados en el hígado para la síntesis de mediadores inflamatorios y proteínas estructurales y obtención de energía mediante la gluconeogénesis3. Así, tiene lugar un aumento tanto de la síntesis como de la degradación proteica, predominando esta última, lo que conduce a un metabolismo proteico netamente negativo2,3.
La administración de proteínas exógenas en la dieta no frena esta respuesta. Sin embargo, la síntesis proteica puede verse estimulada mediante un aporte energético y proteico suficiente, de forma que la instauración del soporte nutricional de forma precoz favorece la más rápida adquisición de los objetivos nutricionales del paciente, mejorando los resultados clínicos en niños críticamente enfermos4-8.
La evidencia en el campo de la nutrición en el niño crítico es limitada. Las recomendaciones internacionales actuales9-11, basadas fundamentalmente en opiniones de expertos, extrapolaciones de datos de adultos y un pequeño número de estudios pediátricos12,13, proponen un aporte mínimo de 1,5g de proteínas/kg/día para evitar el déficit proteico, si bien reconocen que las necesidades podrían alcanzar los 2,5-3g/kg/día en lactantes.
Estudios previos sugieren que la administración de una fórmula hiperproteica en lactantes favorece la adquisición del balance nitrogenado (BN) positivo14-17, mejorando los niveles séricos de proteínas, como proteína ligada al retinol (retinol-binding protein [RBP]) y prealbúmina15,17,18 y aminoácidos14,19.
La administración de aportes proteicos superiores a 3g/kg/día se ha relacionado con el desarrollo de hiperuremia y acidosis metabólica como principales efectos secundarios14,17,20, sin haberse reportado complicaciones gastrointestinales relevantes15-22.
Además del soporte nutricional, existen otros factores que podrían modificar el metabolismo proteico en niños críticos, como son la alteración de la función hepática o renal, la presencia de quemaduras o la administración de ciertos tratamientos. Pese a que en la literatura se encuentran resultados contradictorios23, clásicamente se ha propuesto que la administración de corticoides, de uso frecuente en cuidados intensivos, podría aumentar la excreción urinaria de urea, reduciendo así el BN24,25.
El objetivo de este estudio fue analizar si un mayor aporte proteico enteral mejora el metabolismo proteico, evaluado mediante el incremento del BN y los niveles de proteínas séricas (proteínas totales, albúmina, prealbúmina, transferrina y RBP), y evaluar su seguridad.
Material y métodosDiseño del estudioSe diseñó un estudio prospectivo, con intervención, abierto, aleatorizado y controlado, llevado a cabo en las unidades de cuidados intensivos pediátricos (UCIP) de tres hospitales universitarios españoles entre diciembre de 2016 y junio de 2019.
ParticipantesSe incluyeron lactantes de entre 1 y 24meses de edad ingresados en UCIP que fuesen a recibir nutrición enteral (NE) durante al menos 72horas.
Los pacientes con diabetes mellitus u otros errores congénitos del metabolismo, que recibían nutrición parenteral o perfusión de bicarbonato, con técnicas de depuración extrarrenal, o aquellos que recibían lactancia materna exclusiva u otras fórmulas especiales, fueron excluidos del estudio.
Se establecieron los siguientes criterios de retirada: desarrollo de hiperproteinemia (proteínas totales >85g/l) o hiperuremia (urea sérica >80mg/dl) en ausencia de alteración de la función renal (de acuerdo con los criterios KDIGO)26 o hipercatabolismo (condición subyacente junto con BN negativo).
Se llevó a cabo un muestreo por conveniencia.
El cálculo del tamaño muestral se llevó a cabo con el programa EPIDAT 3.1. Considerando un nivel de significación del 5%, una potencia del 80% y la detección de una diferencia estandarizada de medias mínima de 0,9, se estimó un tamaño muestral mínimo necesario de 30pacientes por grupo (incluida la corrección de Bonferroni).
Los pacientes incluidos fueron asignados, por orden de reclutamiento, a cada uno de los tres grupos de dieta establecidos (grupo control y dos grupos experimentales), utilizando una tabla de aleatorización restrictiva por bloques generada con el programa EPIDAT 3.1 (Dirección Xeral de Saúde Pública de la Consellería de Sanidade, Xunta de Galicia, en colaboración con la Unidad de Análisis de Salud y Sistemas de Información de Salud de la Organización Panamericana de la Salud).
IntervenciónTodos los pacientes recibieron NE exclusiva, a través de sonda nasogástrica o transpilórica, iniciada en las primeras 24horas de ingreso.
Los pacientes incluidos en el grupo control, denominado «nutrición enteral estándar» (NEE), recibieron el aporte nutricional habitual, siendo alimentados con una fórmula de inicio (Nidina1, Nestlé, Barcelona). Los dos grupos experimentales recibieron una fórmula polimérica (Infatrini, Nutricia, Madrid): el grupo denominado «nutrición enteral hiperproteica» (NEH) recibió dicha fórmula, mientras que el grupo denominado «nutrición enteral hiperproteica suplementada» (NEHS) recibió esta misma fórmula añadiendo 2,6g de proteínas por cada 100ml, mediante un módulo proteico a base de proteínas de leche de vaca no hidrolizadas (Resource Protein Instant, Nestlé, Barcelona) (tabla 1). Las botellas fueron preparadas en la propia unidad o en el servicio de nutrición y dietética del centro hospitalario, dependiendo del centro participante, y su contenido era conocido por el personal y por la familia.
Se administró NE a débito continuo, iniciándose a un ritmo de 0,5-1ml/kg/h, con incrementos de 0,5-1ml/kg cada 3-4horas en caso de buena tolerancia, hasta alcanzar un aporte calórico de 60-65kcal/kg/día, o los requerimientos energéticos determinados mediante calorimetría indirecta (CI), en caso de ser realizada. El paso de NE a débito continuo a bolos, en aquellos pacientes que la mejoría clínica lo permitió, no fue considerado criterio de exclusión, al mantenerse el mismo aporte nutricional diario.
El estudio finalizó tras completar 7días de NE, o antes en caso de alta de la UCIP o del cumplimiento de alguno de los criterios de retirada anteriormente descritos.
Se realizó seguimiento de los pacientes durante 7días. En los momentos denominados inicial (primeras 24horas) y final (entre los días 3 y 5tras el inicio de la NE) se obtuvieron muestras de sangre y de orina, y se realizó CI (Datex S5 monitor, E-COVX, GE Healthcare/Datex-Ohmeda, Helsinki, Finlandia), en caso de disponibilidad y en cumplimiento de los requisitos técnicos27.
Recogida de datosSe recogieron datos demográficos y antropométricos: edad, sexo, peso, longitud y diagnóstico al ingreso. Se calcularon puntuaciones de gravedad y disfunción orgánica utilizando las escalas Pediatric Index of Mortality2 (PIM2), Pediatric Risk of Mortality (PRISM) y Pediatric Logistic Organ Dysfunction (PELOD). Se registraron la presencia de shock, infección, parámetros ventilatorios y constantes vitales. Se analizaron los niveles plasmáticos de proteínas, creatinina y urea, y otros parámetros bioquímicos, como proteínaC reactiva (PCR) y gasometría, en los momentos basal y final.
Se registró el aporte total energético y proteico, así como otros tratamientos recibidos (relajantes musculares, sedoanalgesia, diuréticos, corticoides y drogas vasoactivas), calculando la escala vasoactiva-inotrópica28.
Se calculó el BN restando al aporte de nitrógeno las pérdidas de nitrógeno, incluyendo la vía urinaria, la fecal y miscelánea (piel, sudor, tegumentos)29, según la siguiente fórmula:
BN (mg/kg) = aporte de nitrógeno (mg/kg) − (nitrógeno urinario total (mg/kg) + 75mg/kg)
siendo 75mg/kg las pérdidas fecales y miscelánea30. El nitrógeno urinario total (NUT) se estimó como nitrógeno ureico (mg/kg) ×1,25, para incluir las pérdidas de nitrógeno en forma de amonio, creatinina, urato y aminoácidos31. Se utilizó el factor 6,25 para convertir el aporte proteico en aporte de nitrógeno, representando el contenido medio de nitrógeno por gramo de proteínas.
Se registraron las complicaciones gastrointestinales, así como cualquier otro evento adverso inesperado, para evaluar la seguridad de la dieta hiperproteica. La necesidad de suspender la NE fue valorada por el médico responsable del paciente en cada momento.
Todos los datos fueron recogidos de forma prospectiva desde la historia clínica del paciente y registrados en una hoja de recogida diseñada a tal efecto, posteriormente custodiada por el investigador principal, trasladándose dichos datos, anonimizados mediante el número de paciente asignado en el momento de la inclusión, a una base diseñada utilizando el software SPSS (IBM, Armonk, EE.UU.).
Análisis estadísticoLa variable de desenlace principal fue la variación de los valores del BN, en mg/kg/día a lo largo del estudio (BN final − BN inicial).
Las variables secundarias fueron la variación entre los momentos basal y final de los niveles de las proteínas plasmáticas (proteínas totales, albúmina, prealbúmina, transferrina y RBP), la incidencia por cada 1.000 pacientes/día de hiperuremia (urea sérica superior a 80 mg/dl) o hiperproteinemia (proteínas totales superiores a 85 g/l), constituyendo criterio de retirada del estudio, y la incidencia por cada 1.000 pacientes/día de complicaciones gastrointestinales (distensión abdominal, vómitos, diarrea y volumen gástrico residual excesivo) y acidosis metabólica (pH < 7,35 con bicarbonato < 24mmol/l).
Los cálculos estadísticos se realizaron con el software libre R (www.r-project.org), llevando a cabo un análisis por asignación a tratamiento. Las variables cuantitativas se describieron mediante media y desviación típica o mediana y rango intercuartílico (RIC). Las comparaciones entre grupos se llevaron a cabo mediante la prueba t de Student en las variables con distribución normal y la prueba no paramétrica Kruskal-Wallis para aquellas que no la siguen. La normalidad de las distribuciones fue valorada mediante la prueba de Kolmogorov-Smirnov.
Las variables cualitativas se representaron mediante sus frecuencias absolutas y relativas, y las comparaciones entre grupos se realizaron utilizando la prueba chi cuadrado (χ2).
La variación en las variables entre los momentos inicial y final se analizó utilizando la prueba t de Student para muestras relacionadas. Se utilizaron modelos de regresión de efectos mixtos para evaluar la variación de estas variables ajustada por el aporte energético recibido.
La incidencia de los efectos adversos más relevantes se expresó mediante intervalos de confianza (IC) al 95%. Las comparaciones entre grupos se llevaron a cabo utilizando técnicas bootstrap. Se consideraron significativos los valores de p< 0,05.
Consideraciones éticasEl estudio fue aprobado por los respectivos comités de ética de la investigación y registrado en ClinicalTrials.gov (NCT03901742)32. Se obtuvo el consentimiento informado por parte de los padres o tutores legales de los pacientes.
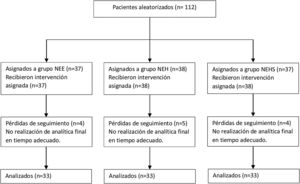
ResultadosCaracterísticas demográficasSe incluyeron 112 pacientes entre diciembre de 2016 y junio de 2019, de los que 99 concluyeron el estudio, distribuidos de forma uniforme en cada grupo de dieta (fig. 1), con edades entre 1 y 24 meses (mediana 4 meses), siendo el 36,4% mujeres.
La muestra total mostraba unas puntuaciones medianas de gravedad al ingreso de 2,3 para la escala PRISM, de 1,0 para PIM2 y de 0,1 para PELOD, con una estancia mediana de 6 días y una mortalidad del 1%. Más de la mitad de los pacientes presentaban infección, mientras que solo el 5,1% se encontraban en situación de shock. El 42,3% precisaron ventilación mecánica invasiva al ingreso. El 35,4% recibieron soporte inotrópico, con una puntuación mediana de puntuación vasoactiva-inotrópica de 0. Se administraron relajantes musculares en el 9,2% de los pacientes, y corticoides en el 8,1% (tabla 2). El 60% de los pacientes ingresaron por insuficiencia respiratoria, el 28,3% tras cirugía cardiaca, y el 11,1% restante, por otros diagnósticos.
Comparación de las características basales y principales resultados en los tres grupos de estudio
| Características del paciente | Total(n=99) | Dieta estándar(n=33) | Dieta hiperproteica(n=33) | Dieta hiperproteica suplementada(n=33) | p |
|---|---|---|---|---|---|
| Edad, mesesa | 4 (4,5) | 4 (4,5) | 4 (5,5) | 5 (5,0) | 0,189 |
| Sexo femenino, n (%) | 36 (36,4) | 8 (24,2) | 14 (42,4) | 14 (42,4) | 0,265 |
| Peso, kgb | 5,9 (2,2) | 5,4 (1,8) | 5,8 (2,3) | 6,4 (2,5) | 0,179 |
| Longitud, cmb | 60,6 (8,3) | 58,7 (5,8) | 60,9 (9,1) | 62,1 (9,3) | 0,461 |
| PRISM, %a | 2,3 (3,9) | 2,3 (3,5) | 2,8 (4,9) | 2,2 (4,9) | 0,867 |
| PIM2, %a | 1,0 (2,4) | 0,8 (1,8) | 1,8 (3,2) | 0,9 (1,7) | 0,259 |
| PELOD, %a | 0,1 (1,0) | 0 (0,1) | 0,1 (1,3) | 0,0 (0,1) | 0,265 |
| Infección | 60,2% | 66,7% | 50,0% | 63,6% | 0,342 |
| Shock | 5,1% | 3,0% | 9,4% | 3,0% | 0,444 |
| VMC | 42,3% | 33,3% | 51,6% | 42,4% | 0,344 |
| VISa | 0 (12,0) | 0 (12,0) | 0 (16,0) | 0 (10,0) | 0,342 |
| Relajantes musculares | 9,1% | 9,1% | 6,1% | 12,1% | 0,906 |
| Corticoides | 8,2% | 3,1% | 3,1% | 18,2% | 0,047 |
| Duración del ingreso en UCIP, díasa | 6,0 (7,0) | 6,0 (8,0) | 6,0 (6,0) | 6,5 (7,0) | 0,658 |
| Mortalidad | 1,0% | 3,0% | 0,0% | 0,0% | 1,000 |
PELOD: Pediatric Logistic Organ Dysfunction; PIM2: Pediatric Index of Mortality 2; PRISM: Pediatric Risk of Mortality; UCIP: unidad de cuidados intensivos pediátricos; VIS: puntuación vasoactiva-inotrópica; VMC: ventilación mecánica convencional.
No se encontraron diferencias significativas en ninguna variable clínica o antropométrica, ni en los tratamientos recibidos, a excepción de los corticoides, que fueron administrados a una mayor proporción de pacientes incluidos en el grupo NEHS (p = 0,047) (tabla 2).
Aportes nutricionales y gasto energéticoEl aporte energético medio administrado en el momento final del estudio fue de 74,2 (25,3) kcal/kg/día, siendo superior en los pacientes del grupo 2 (p=0,041). El aporte proteico medio final fue de 2,4 (1,1) g/kg/día, obteniéndose un mayor aporte proteico a mayor contenido proteico de la fórmula suministrada (tabla 3).
Aporte energético y proteico medio alcanzado en el momento final
| Fórmula nutricional | Total(n=99) | Dieta estándar(n=33) | Dieta hiperproteica(n=33) | Dieta hiperproteica suplementada(n=33) | p |
|---|---|---|---|---|---|
| Aporte energético (kcal/kg/día) | 74,2 (25,3) | 67,1 (21,3) | 84,3 (31,5) | 71,2 (18,5) | 0,041 |
| Aporte proteico (g/kg/día) | 2,4 (1,1) | 1,7 (0,6) | 2,2 (0,8) | 3,4 (1,2) | <0,001 |
Valores expresados como media (desviación típica).
Se realizó CI en 16 de los 99 pacientes, con un valor medio de 45,2 (8,9) kcal/kg/día en el momento inicial y de 50,8 (13,4) kcal/kg/día en el final. No se encontró variación significativa del gasto energético en reposo (GER) a lo largo del estudio en ninguno de los tres grupos (tabla 4). Tampoco fueron significativas las diferencias entre los tres grupos en el momento basal (p = 0,919) ni en el final (p = 0,315).
Variación del gasto energético en reposo, medido mediante calorimetría indirecta, entre los momentos basal y final
| GER (kcal/kg/día) | Total(n=16) | Dieta estándar(n=6) | Dieta hiperproteica(n=6) | Dieta hiperproteica suplementada(n=4) |
|---|---|---|---|---|
| Inicial | 45,2 (8,9) | 44,2 (11,2) | 46,1 (7,9) | 45,4 (8,9) |
| Final | 50,8 (13,4) | 42,8 (15,6) | 55,9 (11,9) | 55,2 (6,8) |
| Variación | 5,6 (11,8) | −1,4 (12,0) | 9,7 (12,3) | 9,7 (6,7) |
| p | 0,078 | 0,791 | 0,111 | 0,062 |
GER: gasto energético en reposo.
Valores expresados como media (desviación típica).
Se obtuvieron muestras de orina en 87 (87,9%) pacientes; en 36 de ellos (41,4%), mediante recogida de orina de 24 horas. En los restantes se analizó una muestra aislada obtenida a través de colector perineal, calculándose la excreción urinaria de nitrógeno diaria mediante una extrapolación de los datos, conocida su diuresis total.
El NUT en el momento final fue superior en el grupo NEHS (466,4 [232,6] mg/kg) respecto a los grupos NEE (172,2 [180,3] mg/kg) y NEH (213,2 [169] mg/kg) (p< 0,001).
El BN fue negativo en el 72,4% de los pacientes en el momento inicial, permaneciendo negativo en el 38,2% en el momento final. Como se observa en la tabla 5, los pacientes de los grupos NEE y NEH presentaron un incremento significativo del BN de 150 (274) mg de nitrógeno/kg/día y 149 (201) mg/kg/día, respectivamente, mientras que la variación en el grupo NEHS (96 [384] mg/kg/día) no fue significativa (p =0,212). Se obtuvieron valores similares de p tras realizar ajuste por el aporte energético recibido.
Variación del balance nitrogenado y proteínas séricas entre los momentos basal y final
| Total | Dieta estándar | Dieta hiperproteica | Dieta hiperproteica suplementada | |
|---|---|---|---|---|
| Balance nitrogenado (mg/kg/día) | n=83 | n=28 | n=29 | n=26 |
| Inicial | −103 (211) | −111 (180) | −107 (197) | −92 (261) |
| Final | 29 (207) | 39 (193) | 42 (207) | 5 (225) |
| Variación | 133 (290) | 150 (274) | 149 (201) | 96 (384) |
| p | < 0,001 | 0,008 | < 0,001 | 0,212 |
| p ajustadoa | < 0,001 | < 0,001 | < 0,001 | 0,188 |
| Proteínas totales (g/l) | n=87 | n=29 | n=31 | n=27 |
| Inicial | 5,3 (0,7) | 5,3 (0,7) | 5,1 (0,7) | 5,3 (0,8) |
| Final | 5,5 (0,8) | 5,5 (0,7) | 5,5 (0,7) | 5,5 (1,1) |
| Variación | 0,2 (0,9) | 0,1 (0,8) | 0,3 (0,8) | 0,2 (1,0) |
| p | 0,012 | 0,348 | 0,023 | 0,270 |
| p ajustadoa | 0,012 | 0,447 | 0,031 | 0,315 |
| Albúmina (g/l) | n=86 | n=29 | n=31 | n=26 |
| Inicial | 3,6 (0,6) | 3,7 (0,5) | 3,5 (0,6) | 3,6 (0,6) |
| Final | 3,6 (0,6) | 3,6 (0,4) | 3,6 (0,5) | 3,6 (0,7) |
| Variación | 0,0 (0,6) | 0,1 (0,5) | 0,1 (0,7) | 0,0 (0,6) |
| p | 0,830 | 0,363 | 0,768 | |
| p ajustadoa | 0,818 | 0,323 | 0,232 | 0,826 |
| Prealbúmina (mg/l) | n=77 | n=23 | n=29 | n=25 |
| Inicial | 10,2 (3,7) | 9,4 (3,2) | 10,2 (3,7) | 11,0 (4,0) |
| Final | 13,7 (6,3) | 11,0 (4,6) | 13,4 (5,3) | 16,6 (7,5) |
| Variación | 3,5 (6,0) | 1,6 (5,3) | 3,2 (5,0) | 5,6 (7,3) |
| p | < 0,001 | 0,156 | 0,002 | 0,001 |
| p ajustadoa | < 0,001 | 0,254 | 0,004 | 0,001 |
| RBP (mg/dl) | n=33 | n=9 | n=11 | n=13 |
| Inicial | 2,1 (1,1) | 2,1 (0,9) | 2,2 (1,5) | 2,1 (0,8) |
| Final | 3,8 (2,1) | 2,2 (1,1) | 3,5 (2,2) | 5,1 (1,6) |
| Variación | 1,7 (1,7) | 0,1 (1,0) | 1,3 (1,4) | 3,0 (1,3) |
| p | < 0,001 | 0,711 | 0,011 | < 0,001 |
| p ajustadoa | < 0,001 | 0,724 | 0,011 | < 0,001 |
| Transferrina (g/l) | n=71 | n=20 | n=26 | n=25 |
| Inicial | 177,5 (58,4) | 184,0 (58,3) | 175,3 (55,4) | 174,7 (63,4) |
| Final | 193,4 (54,6) | 186,7 (45,6) | 194,8 (59,9) | 197,3 (57,0) |
| Variación | 15,9 (48,2) | 2,6 (41,6) | 19,5 (53,2) | 22,6 (47,6) |
| p | 0,007 | 0,779 | 0,073 | 0,026 |
| p ajustadoa | 0,007 | 0,912 | 0,075 | 0,013 |
RBP: proteína ligada al retinol.
Valores expresados como media (desviación típica).
Al analizar el total de la muestra se observó una mejoría en los valores de todas las proteínas estudiadas, excepto la albúmina. Al estudiar esta variación en los diferentes grupos, el incremento de proteínas totales fue significativo únicamente en el grupo NEH. En los grupos NEH y NEHS se observó un aumento de los niveles de prealbúmina (3,2 [5,0] y 5,6 [7,3] mg/l, respectivamente) y RBP (1,3 [1,4] y 3,0 [1,3] mg/dl, respectivamente), siendo superior en el grupo con mayor aporte proteico. Los niveles de transferrina aumentaron solo en el grupo NEHS (tabla 5).
Influencia del tratamiento con corticoides sobre la variación de BN y proteínas séricasUna mayor proporción de pacientes del grupo NEHS recibió tratamiento con corticoides (metilprednisolona 1mg/kg/día o dexametasona 0,6mg/kg/día), por lo que se llevó a cabo un modelo de regresión de efectos mixtos para evaluar su influencia sobre el metabolismo proteico. No se encontraron efectos significativos sobre la variación del BN (p = 0,227), proteínas totales (p = 0,348), albúmina (p = 0,953), prealbúmina (p = 0,133), RBP (p = 0,490) ni transferrina (p = 0,847).
Seguridad de la dieta hiperproteica e hiperproteica suplementadaEl estudio fue finalizado prematuramente en 15 pacientes: 8 desarrollaron hiperuremia (un único paciente en el grupo NEH y 7 en el NEHS), un paciente del grupo NEH presentó diarrea y otro en el grupo NEHS sufrió una obstrucción de la sonda. Cuatro niños con quilotórax requirieron una formula específica, y un paciente en shock precisó restricción hídrica, impidiendo continuar con la NE.
Los niveles de urea sérica fueron superiores a mayor aporte proteico recibido (p < 0,001), con una mayor incidencia de hiperuremia en los pacientes incluidos en el grupo NEHS, seguido de los del grupo NEH (p = 0,003) (tabla 6). No se detectaron casos de hiperproteinemia ni de acidosis metabólica.
Niveles de urea al final del estudio e incidencia de efectos adversos
| Total (n=99) | Dieta estándar (n=33) | Dieta hiperproteica (n=33) | Dieta hiperproteica suplementada (n=33) | p | |
|---|---|---|---|---|---|
| Urea sérica (mg/dl)a | 21,0 (29,5) | 11,0 (21,0) | 16,0 (23,5) | 36,5 (31,5) | <0,001 |
| Hiperuremiab | 15,4 (6,0-26,4) | 0,0 (0,0-0,0) | 5,6 (0,0-18,6) | 41,9 (17,3-71,0) | 0,003 |
| Diarreab | 7,7 (1,8-16,1) | 0,0 (0,0-0,0) | 16,7 (0,0-37,6) | 6,0 (0,0-19,5) | 0,197 |
| Distensión abdominalb | 23,2 (11,8-35,1) | 23,4 (6,0-42,8) | 22,2 (5,2-45,5) | 24,0 (6,0-45,2) | 0,989 |
| Suspensión temporalb | |||||
| Volumen gástrico residual excesivo | 3,9 (0,0-10,0) | 0,0 (0,0-0,0) | 0,0 (0,0-0,0) | 11,9 (0,0-30,7) | |
| Distensión abdominal | 1,9 (0,0-6,2) | 0,0 (0,0-0,0) | 5,6 (0,0-18,2) | 0,0 (0,0-0,0) | 0,466 |
| Disminución del ritmo de infusión por causa digestivab | 7,7 (1,8-16,2) | 0,0 (0,0-0,0) | 5,6 (0,0-19,2) | 18,0 (0,0-37,9) | 0,150 |
Hiperuremia: urea sérica >80mg/dl.
No se encontraron diferencias entre grupos en cuanto a tolerancia gastrointestinal (tabla 6).
DiscusiónNuestro estudio evaluó el efecto del aporte enteral de tres niveles diferentes de proteínas sobre el BN, sustituto del balance proteico, y las proteínas séricas en lactantes críticamente enfermos.
La adecuación del aporte a la prescripción de proteínas en niños críticamente enfermos se ha relacionado con una menor morbimortalidad5 y duración de la ventilación mecánica6-8. Sin embargo, el aporte proteico óptimo no ha sido establecido aún.
El reemplazo proteico es un proceso energéticamente costoso3, de forma que la síntesis proteica depende no solo del aporte proteico, sino también de un adecuado aporte energético. Estudios previos han sugerido un umbral mínimo de 57kcal/kg/día y 1,5g de proteínas/kg/día para alcanzar un balance proteico positivo12,13. Nuestros pacientes recibieron una media de 74,2kcal/kg/día, superior a su GER medio medido mediante CI, lo cual debería ser suficiente para no limitar la síntesis proteica, y un aporte proteico superior a 1,5g/kg/día, superando la cifra sugerida por las principales guías internacionales en cuidados intensivos pediátricos9. Sin embargo, los pacientes incluidos en el grupo NEHS recibieron 3,4g de proteínas/kg/día, una cantidad ligeramente superior a la recomendada para lactantes14-16,19.
Tras 3-5 días de NE tuvo lugar una mejoría en el BN en el total de la muestra. De hecho, el BN se positivizó en el 27,3% de los pacientes, lo que apoya la hipótesis de que establecer una NE precoz es fundamental para evitar favorecer el catabolismo y el mantenimiento de un balance proteico negativo en pacientes críticos.
Al estudiar la variación del BN en función de la dieta se observó un aumento similar en los grupos NEE y NEH. Sin embargo, pese a que los niños alimentados con NEHS recibieron un mayor aporte proteico, el aumento del BN fue menor, sin alcanzar la significación estadística. Una alta proporción de los pacientes de este grupo fueron tratados con corticoides (tabla 2). El uso de corticoides se ha relacionado clásicamente con una disminución del BN al aumentar la excreción urinaria de urea24,25. Sin embargo, no hemos encontrado una influencia significativa de los corticoides sobre el metabolismo proteico en nuestra muestra.
Varios ensayos clínicos que analizaron el efecto de la dieta hiperproteica encontraron una asociación entre un mayor aporte proteico, una más rápida adquisición de los objetivos nutricionales y la mejoría en el BN en niños críticamente enfermos con aporte proteico en torno a 2,7g/kg/día respecto a 1,5g/kg/día14-16.
En nuestro estudio, los pacientes que recibieron NEH y NEHS presentaron un aumento de prealbúmina y de RBP, siendo este incremento mayor a mayor aporte proteico recibido. Tanto la RBP como la prealbúmina son proteínas de vida media corta, con un bajo volumen de distribución, considerados marcadores nutricionales precoces y sensibles33. Incrementos significativos de estas proteínas han sido previamente reportados en niños críticos alimentados con fórmula hiperproteica15,18. No obstante, estas variaciones deben ser interpretadas con cautela, puesto que su síntesis hepática puede verse influida negativamente en favor de la síntesis de reactantes de fase aguda en estados de inflamación33.
La suplementación proteica implica un aumento de la osmolaridad de la fórmula que podría interferir en la tolerancia digestiva34. De acuerdo con estudios previos14,15,34, en los que se reportaron casos infrecuentes y tolerables de diarrea, distensión abdominal y aumento del volumen gástrico residual como principales efectos secundarios gastrointestinales16,18, no hemos encontrado complicaciones digestivas relevantes en los pacientes que recibieron dieta hiperproteica. Sin embargo, tuvo lugar una obstrucción de la sonda nasogástrica en un lactante con NEHS, atribuible a una densidad excesiva del preparado, poniendo de manifiesto la importancia no solo de la osmolaridad, sino también de las características físicas de la fórmula a administrar.
Un aporte proteico excesivo conduce a la oxidación del excedente de proteínas, favoreciendo la elevación de los niveles plasmáticos de urea. De acuerdo con la literatura14,20, los pacientes que recibieron NEHS presentaron niveles superiores de urea, con una mayor incidencia de hiperuremia (urea > 80mg/dl). Esto sugiere que mientras que el aporte enteral de unos 2,2g/kg/día de proteínas favorece el metabolismo proteico en lactantes críticamente enfermos sin efectos secundarios relevantes, un aporte de 3,4g/kg/día podría ser excesivo en este tipo de pacientes.
LimitacionesNuestro estudio cuenta con una serie de limitaciones metodológicas. En primer lugar, una gran proporción de pacientes no portaba sonda urinaria, por lo que una parte sustancial de la recogida de orina se llevó a cabo por micción aislada. Aunque algunos estudios han mostrado una correlación aceptable entre la determinación de NUT en orina de 24 horas y periodos de recogida menores35,36, se ha demostrado una gran variabilidad en la excreción urinaria de urea en niños críticos, encontrándose en la literatura valores de NUT entre 100 y 1.000mg/kg/día14,37-39. Este dato compromete la fiabilidad de su determinación en periodos cortos de tiempo40, y por tanto la validez de nuestros resultados respecto al BN. Sin embargo, son muchos los niños críticamente enfermos sin sonda vesical, lo que hace que nuestros resultados puedan ser útiles en la práctica clínica.
Además, los pacientes de los tres grupos deberían haber recibido un mismo aporte energético para poder asegurar que la variación del metabolismo proteico sea atribuible únicamente a las diferencias en el aporte proteico. Sin embargo, hemos preferido utilizar fórmulas comerciales, en lugar de confeccionarlas especialmente para el estudio, lo que habría permitido igualar el aporte energético entre grupos, para reproducir más fielmente lo que sucede realmente en la práctica clínica. No obstante, tras el ajuste por aporte calórico, tampoco hemos encontrado cambios relevantes en nuestros resultados en cuanto a la variación de la BN y las proteínas séricas.
FortalezasNuestro estudio propone un ensayo clínico llevado a cabo con pacientes en la práctica clínica real, tratando de hacer sus conclusiones aplicables a las condiciones de trabajo asistencial de las UCIP.
ConclusionesLa administración de grandes cantidades de proteínas mejora el metabolismo proteico, evaluado mediante la variación del BN y de las proteínas séricas, en lactantes críticamente enfermos. El aporte de 2,2g de proteínas/kg/día, cantidad superior al umbral mínimo recomendado por las principales guías internacionales y al habitualmente administrado en el paciente crítico pediátrico, es generalmente seguro y bien tolerado, mientras que aportes en torno a 3,4g/kg/día pueden producir hiperuremia en algunos pacientes. Son necesarios nuevos estudios para establecer el aporte proteico óptimo, probablemente situado entre estas dos cifras.
FinanciaciónEl estudio ha sido financiado con el apoyo del Instituto de Investigación CarlosIII y del Fondo Europeo de Desarrollo Regional (ERDF) ref. PI11/00721, y la Red SAMID, RETICS, fundada por el Plan Nacional I+D+I 2008-2011. ISCIII – Subdirección General de Evaluación y Fomento de la Investigación y el Fondo Europeo de Desarrollo Regional (ERDF) ref. RD16/0022/0007.
AutoríaA. Carrillo, C. Rey y J. López-Herce han contribuido igualmente en la concepción y el diseño del estudio. J. Urbano ha contribuido al diseño del estudio; R. Fernández, J. Urbano, A. Vivanco y M.J. Solana han contribuido en la implementación del estudio en los centros participantes, en la inclusión activa de pacientes y en la adquisición de datos. S. Díaz ha contribuido al análisis de los datos. Todos los autores han participado en la redacción del texto y sus revisiones, aprobando el manuscrito enviado para su consideración.
Queremos expresar nuestro más efusivo agradecimiento a todo el personal de las unidades participantes por su apoyo y su colaboración.