En determinadas situaciones clínicas, como es el caso de la colitis ulcerosa (CU) o la enfermedad de Crohn (EC) graves, que no responden a tratamiento esteroideo intravenoso, es preciso disponer de alternativas terapéuticas a la cirugía.
Tacrolimus (FK 506) es un macrólido, similar estructuralmente a la rapamicina, con potente efecto inmunosupresor aislado del hongo Streptomyces tsukubaensis. Su mecanismo de acción es similar al de la ciclosporina A (CsA), se une a una proteína citosólica denominada FK BP12; el complejo FK BP12-tacrolimus, calcio, calmodulina y calcineurina da lugar a una inhibición de la actividad fosfatasa de la calcineurina que impide la generación del factor nuclear de las células T activadas, una proteína que inicia la transcripción de los genes de citocinas. Todo esto induce el bloqueo en la síntesis de interleucina-2 y en consecuencia también la proliferación de células T, expansión clonal y producción de citocinas implicadas en la cadena inmunológica1. Tacrolimus se ha empleado con éxito en los trasplantes hepático, intestinal, pulmonar, cardíaco, pancreático y renal2–4, en la prevención de la enfermedad injerto contra huésped tras trasplante de médula ósea y en el síndrome nefrótico5. Asimismo, se ha extendido su uso al tratamiento de hepatitis crónica autoinmune6, colangitis esclerosante primaria, enteropatía autoinmune7 y enfermedad inflamatoria intestinal (EII) refractaria8.
Aportamos nuestra experiencia acerca de la eficacia y seguridad del tratamiento con tacrolimus oral en niños con enfermedad inflamatoria intestinal grave.
Pacientes y métodoEstudio retrospectivo que incluyó a todos los pacientes menores de 18 años afectados de brote grave de CU o EC tratados con tacrolimus oral en esta unidad durante el período comprendido entre enero de 1998 y diciembre de 2007.
Criterios de inclusiónSe consideraron pacientes con EC de moderada a grave a aquellos en los que el PCDAI (pediatric Crohn's disease activity index‘índice de actividad de la enfermedad de Crohn pediátrica’)9 era superior a 30 al inicio del tratamiento. Se definió como brote grave de CU cuando había afectación del estado general, dolor abdominal intenso, deposiciones líquidas, sanguinolentas y en número superior a 5 cada 24 h. En los 2 grupos los pacientes fueron resistentes a tratamiento esteroideo intravenoso.
Criterios de exclusiónInfección intestinal activa, megacolon tóxico, perforación intestinal o peritonitis.
Antes del inicio del tratamiento se obtuvieron muestras de heces para investigación de Salmonella, Shigella, Yersinia, Campylobacter, Escherichia coli y presencia de toxina de Clostridium difficile en todos los casos. Otras determinaciones realizadas fueron hemograma, velocidad de sedimentación globular, proteína C reactiva, sodio, potasio, cloro, aminotransferasas, urea, creatinina, calcio, fósforo, magnesio, estudio de coagulación y serología para citomegalovirus. En todos los casos se obtuvo el consentimiento informado.
Todos los pacientes recibieron una dosis oral de 0,12 mg/kg/día de tacrolimus (Prograf®, Astellas Pharma) repartida en 2 tomas. Se realizó monitorización diaria durante el ingreso mediante hemograma, urea y creatinina, aminotransferasas, magnesio, presión arterial y concentraciones plasmáticas hasta alcanzar los valores deseados (5 a 10 ng/ml). Una vez alcanzados esos valores la determinación se realizó semanalmente (durante el primer mes), cada 15 días (el segundo mes) y cada mes posteriormente. Se administró magnesio oral en casos de hipomagnesemia.
Se recogieron otros datos como edad, sexo, tiempo de evolución de la enfermedad hasta el inicio del tratamiento con tacrolimus, número de brote, medicación administrada previa al tratamiento con tacrolimus, concentración plasmática (ng/ml), respuesta clínica, duración del tratamiento, necesidad de cirugía, tiempo transcurrido hasta la cirugía, tratamiento inmunomodulador después de tacrolimus en pacientes no colectomizados y los efectos secundarios observados.
Se consideró paciente respondedor en la EC si el PCDAI era inferior o igual a 10 y en CU cuando se normalizaron el número y las características de las deposiciones, desapareció el dolor abdominal, los reactantes de fase aguda alcanzaron concentraciones normales y se incrementaron las cifras de hemoglobina.
Análisis estadísticoPara el análisis estadístico y la elaboración de las curvas de supervivencia se utilizó el programa SPSS versión 15.0 para Windows. Las gráficas de supervivencia se elaboraron con el método de Kaplan-Meier. Para la comparación de las distintas variables se empleó el test estadístico exacto de Fisher y la prueba de χ2 de Pearson. Se consideró una p inferior a 0,05 como estadísticamente significativa.
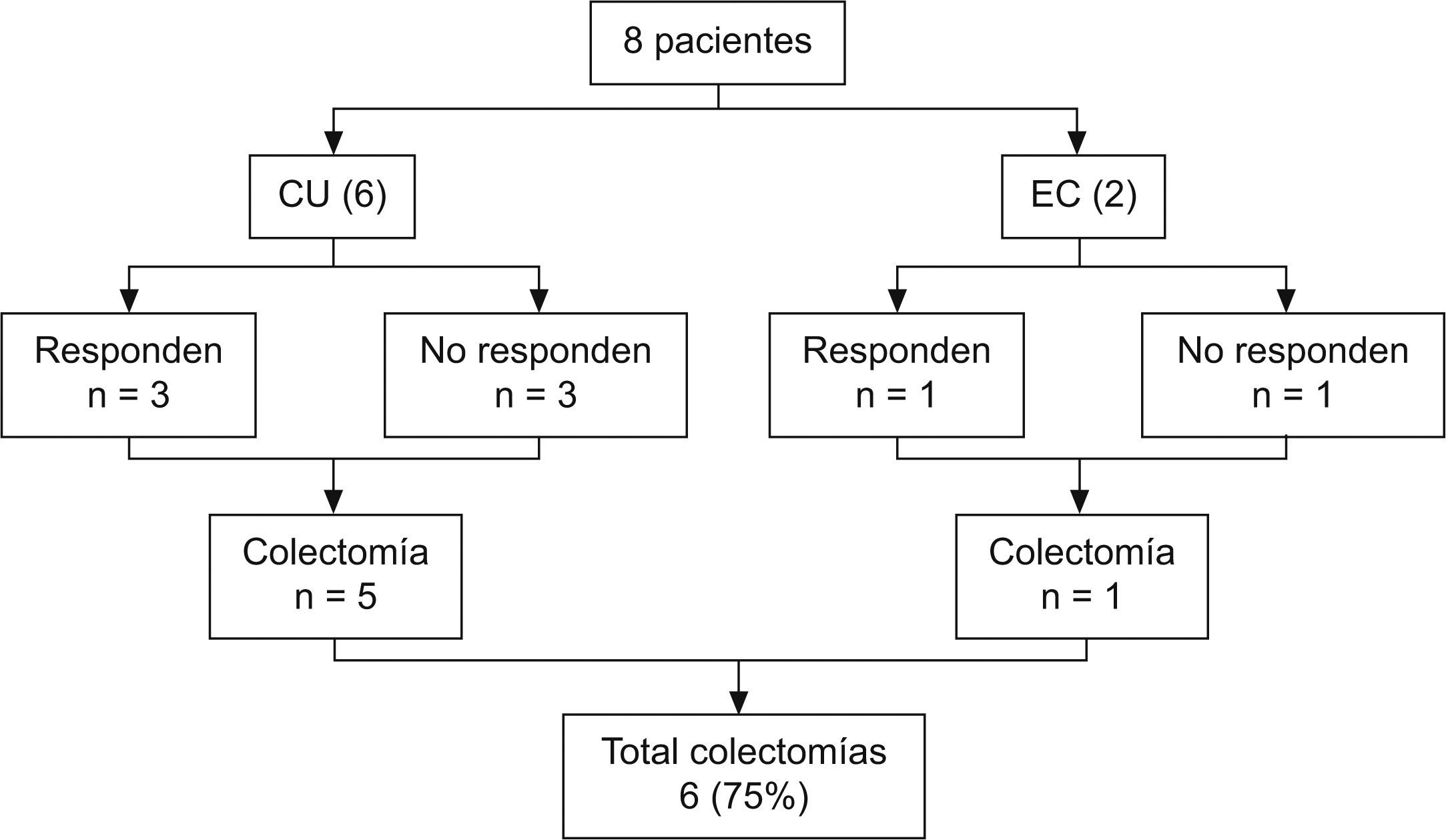
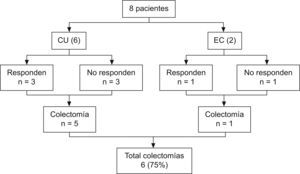
ResultadosSe incluyó a un total de 8 pacientes (4 varones): 6 afectados de CU y 2 afectados de EC (tabla 1).
Tabla 1. Características epidemiológicas, terapéuticas y evolutivas de los pacientes
| n | EII | Edad | TE | Brote | Tratamiento previo | Cp, ng/ml | R | D | C | TC | TM |
| 1 | CU | 11 años 8 meses | 30 días | 1.º | E 7 días i.v. | 6–8 | No | 7 días | Sí | 10 días | – |
| 2 | CU | 13 años 3 meses | 32 días | 1.º | E 9 días i.v. | 5–9 | No | 3 días | Sí | 3 días | – |
| 3 | CU | 3 años 9 meses | 94 días | 1.º | E 7 días i.v. | 4–11 | Sí | 5 meses | Sí | 10 meses | – |
| 4 | CU | 2 años 9 meses | 38 días | 1.º | E 3 días i.v. | 6–9 | No | 1 mes | Sí | 1 mes | – |
| 5 | CU | 16 años 7 meses | 8 meses | 2.º | E 8 días i.v. AZA 8 meses | 6–8 | Sí | 6 meses | No | AZA | |
| 6 | CU | 2 años 10 meses | 5 meses | 3.º | E 7 días i.v. | 6–10 | Sí | 4 meses | Sí | 6 años 4 meses | 6-MP |
| 7 | EC | 13 años 11 meses | 2 años | 4.º | E 8 días i.v. | 7–9 | Sí | 4 meses | No | MTX | |
| 8 | EC | 12 años | 8 años | 10.º | E 10 días i.v. 6-MP | 4–8 | No | 5 meses | Sí | 9 meses | AZA |
6-MP: mercaptopurina; AZA: azatioprina; C: cirugía; Cp: concentración plasmática; CU: colitis ulcerosa; D: duración del tratamiento; E: esteroides; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; i.v.: intravenoso; MTX: metotrexato; R: respuesta; TC: tiempo transcurrido desde el inicio del tratamiento con tacrolimus hasta la cirugía; TE: tiempo de evolución de la enfermedad hasta inicio del tratamiento con tacrolimus; TM: tratamiento mantenimiento. Evaluación de la respuesta: subgrupo de pacientes con colitis ulcerosa
En este grupo de pacientes, 4 de los 6 (66%) se encontraban en su primer brote de enfermedad; la edad al inicio del tratamiento fue de 7,7 años (rango de 2,75 a 16,58); el tiempo de evolución fue de 2,1 meses (rango de 1 a 8) y la respuesta clínica inicial se obtuvo en el 50% de los casos. Todos los pacientes no respondedores requirieron colectomía; en estos casos, la cirugía se realizó dentro del mes siguiente al inicio del tratamiento. En el subgrupo que respondió inicialmente, 2 de los 3 pacientes precisaron colectomía: uno a los 10 meses del inicio del tratamiento y el otro a los 6 años y 4 meses, coincidiendo con la suspensión del tratamiento inmunomodulador y la aparición de un nuevo brote que no respondió a tratamiento médico. Cabe destacar el caso 3, que inicialmente respondió pero presentó recaída durante el tratamiento con tacrolimus: iniciamos pauta de inducción con infliximab (0,2 y 8 semanas) que no resultó eficaz, por lo que se le realizó finalmente colectomía total con ileostomía a los 10 meses. En un caso de CU se evitó la intervención quirúrgica y en la actualidad permanece en remisión clínica y con tratamiento inmunomodulador.
Evaluación de la respuesta: subgrupo de pacientes con enfermedad de CrohnSe incluyó a 2 varones con EC, de 13,9 y 12 años de edad con un tiempo de evolución de 2 y 8 años respectivamente. El primer paciente era intolerante a las tioguaninas, presentó un brote grave que no respondió a tratamiento esteroideo intravenoso; una vez que se obtuvo la remisión con tacrolimus, éste se mantuvo mientras se iniciaba tratamiento de mantenimiento con metotrexato, y tras 4 meses de tratamiento se suspendió tacrolimus (caso 7). El otro paciente, con una forma metastásica de la enfermedad corticorresistente, respondió inicialmente a tacrolimus pero presentó una recaída mientras lo tomaba. Se intentó una pauta de inducción con infliximab sin que se observara resultado, y finalmente precisó cirugía.
En ambos grupos, las concentraciones plasmáticas de tacrolimus determinadas en valle se mantuvieron entre 5 y 11 ng/ml. La duración media del tratamiento en el grupo respondedor fue de 4,7 meses. En los pacientes respondedores, tras 7 a 10 días con tacrolimus se comenzó a disminuir la dosis de esteroides y se inició el tratamiento inmunomodulador de mantenimiento (azatioprina, 6-mercaptopurina o metotrexato). Durante el tiempo en que duró el triple tratamiento inmunosupresor (tacrolimus, esteroides y tioguaninas o metotrexato) se administró profilaxis mediante trimetoprim con sulfametoxazol. Tacrolimus fue muy bien tolerado en todos los casos; no se observaron efectos adversos, salvo leve incremento de las concentraciones plasmáticas de creatinina con respecto a la basal en un caso.
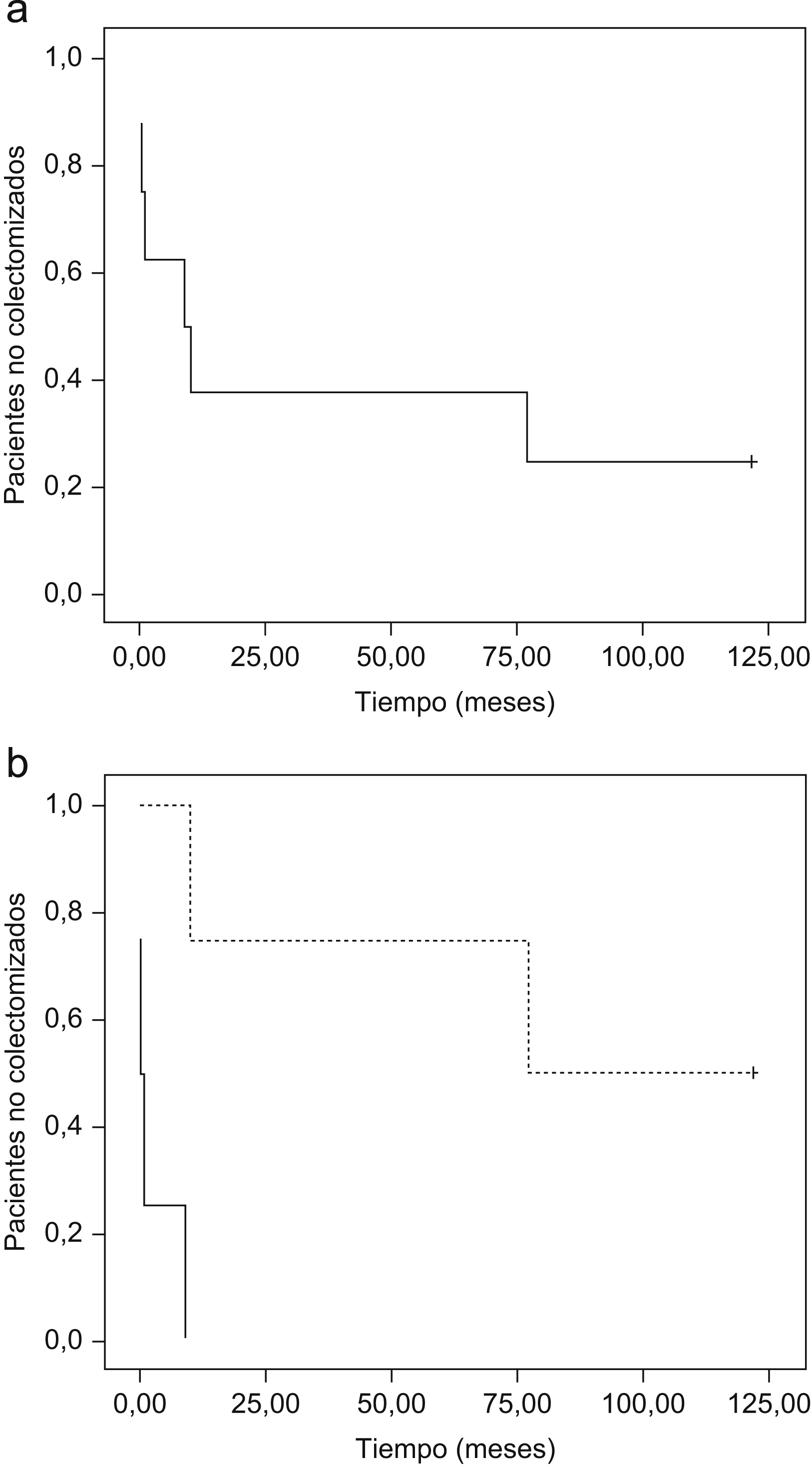
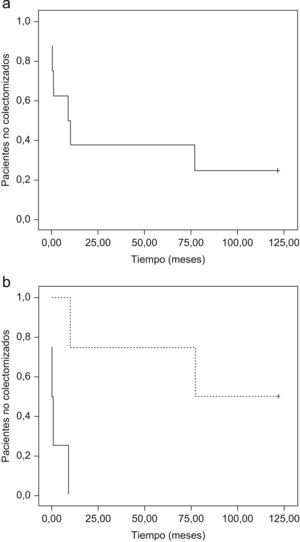
Un total de 6 de los 8 pacientes (75%) precisaron tratamiento quirúrgico (fig. 1). En un paciente con CU y en otro paciente con EC se pudo evitar la cirugía, y en 2 de los 6 pacientes con CU se pospuso la intervención quirúrgica. En las curvas de supervivencia (fig. 2a) puede observarse cómo en aquellos casos que inicialmente responden a tacrolimus y con una respuesta que se mantiene mas allá de 12 meses, si continúan con tratamiento inmunomodulador, la probabilidad de colectomía disminuye drásticamente. En la figura 2b se evidencia cómo la falta de respuesta inicial conlleva inevitablemente cirugía en los meses siguientes, curva que contrasta llamativamente con la de los pacientes con respuesta inicial (p = 0,007).
Figura 1. Respuesta al tratamiento.
Figura 2. Gráficas de supervivencia. Método de Kaplan-Meier. a) Supervivencia (libre de colectomía) global de todos los pacientes independientemente de la respuesta inicial. b) Supervivencia (libre de colectomía) global de los pacientes en relación a si hubo respuesta inicial (línea discontinua) o no (línea continua). La diferencia en las curvas de supervivencia es estadísticamente significativa (logrank; p=0,007).
DiscusiónEn el brote grave de CU o EC refractario al tratamiento esteroideo intravenoso la intervención quirúrgica debe evaluarse como opción terapéutica. La CsA por vía oral o intravenosa es efectiva en la inducción a la remisión en pacientes con CU grave y es, asimismo, capaz de evitar o posponer la colectomía en este grupo de pacientes10. Tacrolimus, con mayor potencia (100 veces más in vitro y 10 veces más in vivo) debido a la mayor afinidad de su complejo con FK BP-12 por la calcineurina, y con mejor biodisponibilidad ya que su absorción no se ve dificultada por el grado de inflamación de la pared intestinal, se erigió a principios de los años 90 como una alternativa a CsA en estos enfermos4,8. No hay ningún estudio publicado que compare tacrolimus con CsA. Infliximab también es capaz de inducir la remisión en pacientes con CU grave11 o en aquellos con EC de moderada a grave12.
La experiencia con tacrolimus en el tratamiento de pacientes con EII es muy limitada. Desde la primera descripción a cargo de Bousvaros et al en 199613 se han publicado algunas series de pacientes. En adultos con EC, tacrolimus ha demostrado ser efectivo en EC fistulizante asociada o no a azatioprina o 6-mercaptopurina14,15 en pacientes corticodependientes o en pacientes corticorresistentes que habían presentado intolerancia a las tioguaninas o a metotrexato, o en aquéllos en los que no había sido efectivo el tratamiento biológico (infliximab o adalimumab)8,16–18.
Tacrolimus se ha empleado con éxito en adultos afectados de CU19,20. En una revisión sistemática de 83 pacientes con CU refractaria tratados con tacrolimus oral se observó una remisión completa en 44 (53%) y una mejoría en 17 (20,5%)18. En otro estudio, 7 de los 10 pacientes con reservoritis mejoraron clínica y endoscópicamente tras el tratamiento con tacrolimus1.
La experiencia publicada del uso de tacrolimus en niños con EII es incluso más escasa que en adultos. Bousvaros et al21 dirigieron un estudio multicéntrico que incluyó a 14 pacientes pediátricos mayores de 5 años de edad afectados de EII grave (10 afectados de CU, 2 afectados de EC y 2 afectados de colitis indeterminada) que no respondieron al tratamiento convencional con esteroides intravenosos. Administraron una dosis inicial de 0,1 mg/kg cada 12 h para mantener las concentraciones plasmáticas entre 10 y 15 ng/ml durante 14 días, y posteriormente entre 5 y 10 ng/ml. Encontraron una tasa de respuesta inicial del 65% (el 35% restante requirió colectomía). A los 12 meses de seguimiento, 5 pacientes (38%) se encontraban en remisión, con tratamiento de mantenimiento, y no habían precisado cirugía. La duración media del tratamiento en los pacientes respondedores fue de 3,4 meses.
Ziring et al22 incluyeron a 18 niños con CU (9 corticorresistentes y 9 corticodependientes). La dosis inicial administrada fue de 0,1 mg/kg cada 12 h para mantener concentraciones de entre 10 y 15 ng/ml durante las 2 primeras semanas, y posteriormente entre 7 y 12 ng/ml. El 94% de los pacientes (17 de 18) respondió inicialmente a tacrolimus. En el momento de la publicación del trabajo, sólo 13 de los 18 llevaban más de un año de seguimiento; de ellos, 7 (53%) habían requerido colectomía durante el primer año desde el inicio de tacrolimus.
Turner et al23 trataron a 6 niños con CU grave con inhibidores de calcineurina (5 de ellos con tacrolimus y uno con CsA), y para esto siguieron el protocolo de tratamiento publicado por Bousvaros et al21 (datos no publicados, información facilitada por el autor). Tres de los 5 pacientes tratados con tacrolimus (60%) respondieron y fueron dados de alta sin colectomía. Un año después del alta, 2 pacientes (40%) continuaban en remisión clínica sin colectomía.
A diferencia del resto de los autores, Vargas24 empleó tacrolimus oral en el primer brote de enfermedad, en lugar de corticoides intravenosos en 10 pacientes con CU de moderada a grave; la dosis fue de 0,2 a 0,3 mg/kg. Se obtuvieron concentraciones plasmáticas a los 2 días, a los 14 días y a los 28 días, y posteriormente mensuales. Todos los pacientes alcanzaron concentraciones plasmáticas superiores a 10 ng/ml (rango de 10 a 24). La dosis se ajustó para mantener concentraciones plasmáticas entre 10 y 15 ng/ml. El 80% de los pacientes alcanzó la remisión clínica en los 14 días tras el inicio del tratamiento. No se publicaron datos acerca de la evolución posterior.
En nuestra serie, con concentraciones plasmáticas entre 5 y 10 ng/ml, 4 de los 8 pacientes (50%) alcanzaron la remisión clínica y, tras 12 meses de seguimiento, 3 de ellos (37%) no habían requerido cirugía.
Si se analizan conjuntamente los resultados de los 5 estudios, se puede deducir que la tasa de remisión inicial es superior, aunque no de forma significativa (p = 0,059), en aquellos regímenes terapéuticos que mantuvieron concentraciones plasmáticas más altas (10 a 15 ng/ml)21–24 durante las primeras 2 semanas, aunque a los 12 meses el porcentaje de pacientes libres de colectomía es el mismo en los 4 grupos (p = 0,966) (tabla 2).
Tabla 2. Estudios que evalúan la eficacia de tacrolimus oral en niños con enfermedad inflamatoria intestinal
| Referencia | n | Dosis, mg/kg/día | Cp, ng/ml | Respuesta inicial, n (%) | Remisión a los 12 meses, n (%) |
| Bousvaros et al21 (2000) | 14 | 0,2 | 10–15 (14 días) | 9 (65) | 5 (35) |
| 5–10 (después de los 14 días) | |||||
| Vargas et al25 (2001) | 10 | 0,2–0,3 | 10–15 | 8 (80) | ND |
| Ziring et al22 (2007) | 18 | 0,2 | 10–15 (14 días) | 17 (94) | 6 (46) |
| 7–12 (después de los 14 días) | |||||
| Turner et al23 (2008) | 5 | 0,2 | 10–15 (14 días) | 3 (60) | 2 (40) |
| 5–10 (después de los 14 días) | |||||
| Navas et al (2009) | 8 | 0,12 | 4–11 | 4 (50) | 3 (37) |
| Total (IC del 95%) | 55 | 0,12–0,3 | 4–15 | 41/55 (74) | 16 (40) |
| (60–84) | (25–56) |
Cp: concentración plasmática; IC: intervalo de confianza; ND: información no disponible.
Si bien no se observan diferencias significativas entre los 5 trabajos anteriores de acuerdo con las concentraciones plasmáticas de tacrolimus, en un estudio aleatorizado realizado en 60 adultos25 divididos en 3 grupos (concentraciones plasmáticas entre 10 y 15 ng/ml; concentraciones plasmáticas entre 5 y 10 ng/ml y placebo) se comprobó mayor tasa de remisión histológica y una mayor reducción de la dosis de esteroides en aquellos pacientes con concentraciones plasmáticas de tacrolimus altas frente a placebo (p ≤ 0,0001) aunque la diferencia, si se comparan los 2 grupos tratados con tacrolimus, no fue significativa (p = 0,067).
Los efectos secundarios de tacrolimus y CsA son neurotoxicidad (temblor, cefalea, convulsiones, afasia o hiperestesia), nefrotoxicidad (más con CsA), hipertensión arterial, hiperpotasemia, hiperuricemia, hipomagnesemia, hepatotoxicidad, alopecia, etc. Con CsA se han detectado, además, hirsutismo, hiperplasia gingival, dismorfia facial y ginecomastia. En pacientes tratados de forma prolongada con tacrolimus pueden aparecer miocardiopatía hipertrófica, alergias alimentarias, insomnio y procesos linfoproliferativos asociados al virus de Epstein-Barr (VEB). En las otras series publicadas se observaron efectos secundarios tales como cefaleas, convulsiones, temblor, enfermedad linfoproliferativa asociada a VEB, que obligaron, en algunos casos, a la suspensión del tratamiento. En nuestra serie sólo hubo un leve incremento de la creatinina plasmática en un paciente.
De acuerdo con todo lo publicado, tacrolimus podría estar indicado como tratamiento de primera o de segunda línea y como tratamiento puente en brotes graves de EII, pero es conveniente hacer algunas aclaraciones. Ziring22 et al demostraron que no todos los pacientes responden de la misma manera, de tal forma que a 6 de sus 9 pacientes corticorresistentes (66%) se les realizó intervención antes del año de evolución y a todos antes de los 4 años después de iniciar el tratamiento, a diferencia de lo que ocurre con su serie de pacientes corticodependientes. Por esto, los autores del presente artículo no comparten la idea de utilizar tacrolimus como fármaco de primera línea en el primer brote de CU grave 24, ya que los esteroides intravenosos tienen un mecanismo de acción rápido, son fáciles de dosificar y, aunque no están exentos de efectos secundarios, han demostrado ser eficaces para controlar el brote grave. Sólo en caso de brote grave resistente a los corticoides sí estaría indicado emplear un inhibidor de la calcineurina (tacrolimus o CsA) u otro fármaco de segunda línea.
En resumen, tacrolimus es útil para inducir la remisión en pacientes con brotes graves de CU y EC, evita o retrasa la intervención quirúrgica y permite preparar al paciente y a su familia para una probable intervención quirúrgica. Asimismo, puede emplearse como tratamiento puente en aquellos pacientes dependientes de los corticoides hasta que el nuevo tratamiento de mantenimiento haga efecto. Para determinar las concentraciones plasmáticas óptimas, un mejor control del brote y menos efectos secundarios es preciso la realización de estudios con mayor número de pacientes. La respuesta a tacrolimus es mejor en los pacientes corticodependientes.
AgradecimientosA la Dra. Anita Dayaldasani, Servicio de Laboratorio. Hospital Regional Carlos Haya, Málaga.
A D. Francisco Javier Barón López, Departamento de Bioestadística, Facultad de Medicina, Málaga.
Autor para correspondencia.
V.M. Navas López
Dirección: victor.navas@gmail.com