Introducción
El criterio más extendido internacionalmente para definir la pubertad precoz central (PPC) en niñas, es la aparición de caracteres sexuales secundarios antes de los 8 años de edad; sin embargo, en las últimas décadas se ha producido un adelanto secular de la pubertad en la población general, y algunos autores norteamericanos plantean descender la franja de edad a los 7 años en niñas anglosajonas y a los 6 años en niñas afroamericanas 1-5.
A diferencia de lo que acontece en los niños, la mayoría de los casos de PPC en niñas son de origen idiopático, planteando problemas derivados directamente del inicio precoz del desarrollo sexual 4,6-9. Por un lado, una pérdida de estatura en la talla adulta respecto a la talla genética, sobre todo en los casos de inicio más precoz, siendo este hecho menos evidente en la PPC diagnosticada entre los 6 y los 8 años 10. Por otro, existen repercusiones psicológicas relevantes asociadas a un inicio precoz de la pubertad: trastornos del comportamiento, depresión, maladaptación social y agresividad, entre otras 1,11,12.
Desde los años 1980 existe la posibilidad de tratar la PPC con análogos sintéticos de hormona liberadora de gonadotropinas (GnRH) 13,14, que han demostrado una eficacia contrastada en evitar la progresión puberal y, secundariamente, las consecuencias psicológicas derivadas, así como en mejorar el pronóstico de talla adulta antes del tratamiento; sin embargo, existen datos dispares en cuanto a los marcadores pronósticos de talla adulta, y fundamentalmente, en cuanto a los métodos de predicción de talla utilizados 10,15-20.
No obstante, una preocupación frecuente para el clínico radica en los potenciales efectos secundarios derivados del tratamiento con análogos de GnRH. Entre ellos, cabe destacar la posible ganancia ponderal durante dicho tratamiento y las consecuencias de éste sobre los ciclos menstruales y la fertilidad una vez suspendido 5,19-23.
Se ha realizado un estudio retrospectivo de las niñas diagnosticadas de pubertad precoz central, con los siguientes objetivos: a) describir las características iniciales de las pacientes y su evolución tras el tratamiento con análogos de GnRH; b) determinar la diferencia entre la talla adulta, la talla diana y la predicción de talla al diagnóstico; c) analizar la relación entre el tratamiento farmacológico y el índice de masa corporal (IMC) evolutivamente, y d) estudiar la aparición de la menarquia tras finalizar dicho tratamiento.
Pacientes y métodos
Se han recogido los datos de los casos de PPC en niñas, de origen orgánico o idiopático, diagnosticadas en el Servicio de Endocrinología Pediátrica del Hospital Infantil Universitario Niño Jesús de Madrid, entre los años 1990 y 2005, y que fueron tratadas con triptolerina (60-80 mg/kg de peso/28 días en inyección intramuscular). Las pacientes con patología cerebral subyacente que implicó parálisis cerebral infantil, se excluyeron del análisis.
Como criterio de pubertad precoz central se ha utilizado el inicio del desarrollo mamario en niñas de menos de 8 años de edad, junto con una respuesta de hormona luteinizante (LH) superior al pico de hormona foliculoestimulante (FSH), o superior a 7-10 mU/ml, en la prueba de estimulación con GnRH. A todas se les realizó una resonancia magnética (RM) cerebral. La eficacia del tratamiento se evaluó con un nuevo test de GnRH al mes del inicio del tratamiento y, posteriormente, por el desarrollo de los caracteres sexuales secundarios y la edad ósea.
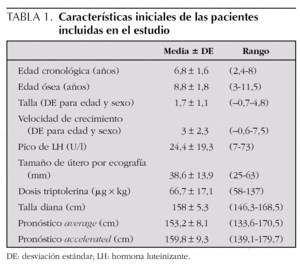
Se registraron los siguientes parámetros al diagnóstico: edad, talla en desviaciones estándar (DE), edad ósea calculada según el método de Greulich y Pyle, predicción de talla mediante el método de Bayley-Pinneau (acorde a la edad cronológica [average] y para edad ósea acelerada [accelerated]), IMC en DE, tamaño del útero según ecografía pélvica, talla diana (calculada como la media entre la talla paterna y la materna, menos 6,5 cm), etiología en función de los hallazgos de la RM cerebral, dosis de triptolerina al inicio del tratamiento y duración del mismo.
A lo largo de la evolución, se recogieron anualmente los siguientes datos: IMC en DE, velocidad de crecimiento, y edad ósea. En el grupo de pacientes que llegaron al final del tratamiento, se determinó la talla adulta, el IMC en DE un año después de suspenderse el tratamiento, y el tiempo transcurrido hasta la aparición de la menarquia. Se define como talla adulta la que alcanzan las niñas cuando presentan una velocidad de crecimiento inferior a 1 cm/año y edad ósea superior a 15 años (98 % de la talla adulta).
Se estudiaron retrospectivamente 34 niñas diagnosticadas de PPC. Las características iniciales de esta cohorte aparecen reflejadas en la tabla 1.
De un total de 34 pacientes, 25 niñas no presentaron alteraciones en la RM craneal (73 %), mientras que 9 de ellas (27 %) asociaban patología cerebral: hamartoma hipotalámico (n = 4); neurofibromatosis tipo 1 con glioma del quiasma óptico extendido hasta la región hipotalámica (n = 1); ependimoma de fosa posterior afectando a la región pineal (n = 1); antecedentes de meningitis tuberculosa (n = 1); malformación de Arnold-Chiari tipo 2 (n = 1) y encefalopatía hipóxico-isquémica de origen neonatal (n = 1).
Estadística
Los datos se expresan en media ± DE. Los cambios debidos al tratamiento fueron evaluados mediante análisis de la varianza (ANOVA) para medidas repetidas (se consideró p < 0,05 como significativo). El análisis estadístico se realizó mediante SAS software package (SAS Institute Inc., Cary, NC).
Resultados
Características iniciales de las pacientes a estudio
Al comparar la edad al diagnóstico entre las que presentaban RM normal y patológica, no se encontraron diferencias significativas: 6,9 ± 1,6 años (rango: 2,4-8,2) frente a 6,5 ± 3,1 años (rango: 3,1-8,5 años). Así mismo, el porcentaje de niñas diagnosticadas a partir de los 7 años de edad con RM craneal patológica fue de un 40 %, y con RM craneal normal un 60 %.
Evolución de la talla, velocidad de crecimiento y edad ósea
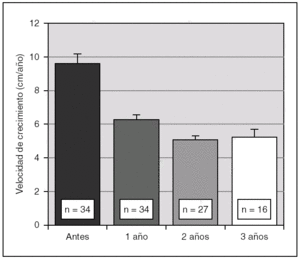
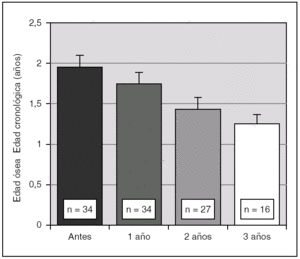
Antes de iniciar el tratamiento con análogos de GnRH la talla era de + 1,7 ± 1,1 DE para la edad y el sexo, descendiendo progresivamente durante la terapia. En efecto, al año fue de 1,6 ± 1,3 DE, a los 2 años 1,5 ± 1,3 DE y a los 3 años 1,4 ± 1,4 DE (p < 0,01). Así mismo, se objetivó una disminución significativa de la velocidad de crecimiento a partir del año de tratamiento (fig. 1). La diferencia entre la edad ósea y la edad cronológica también se fue reduciendo de manera paulatina durante el tratamiento (fig. 2).
Figura 1. Evolución de la velocidad de crecimiento (cm/ año) durante el tratamiento con triptorelina (p < 0,01 para ANOVA de medidas repetidas). Los valores se expresan en media ± error estándar.
Figura 2. Evolución de la diferencia entre edad ósea (años) y edad cronológica y durante el tratamiento con triptorelina (p < 0,01 para ANOVA de medidas repetidas). Los valores se expresan en media ± error estándar.
La duración media del tratamiento fue de 3,8 ± 1,7 años, siendo la edad cronológica al finalizarlo de 10,7 ± 0,7 años, correspondiendo a una edad ósea de 12 ± 0,6 años.
Del total de las pacientes incluidas en el estudio, 16 alcanzaron la talla adulta (158,2 ± 7,7 cm), la cual no difería de la talla diana (157,9 ± 5,3 cm), ni con el pronóstico average (PAv) (153,2 ± 8,1 cm), ni con el pronóstico accelerated (PAc) (159,7 ± 9,3 cm) antes del tratamiento. En este sentido, la diferencia entre talla adulta y talla diana fue de 0,6 ± 7,7 cm, entre talla adulta y PAv de 4,4 ± 6,1 cm, y entre talla adulta y PAc de 2,4 ± 6,8 cm, sin existir diferencias significativas entre estas diferencias.
Al comparar la talla adulta entre las pacientes con patología orgánica de base y las que presentan PPC idiopática, hemos evidenciado diferencias significativas entre ambos grupos: 151,4 ± 7,4 cm (n = 5) frente a 160,8 frente a 5,4 cm (n = 11) (p < 0,01), respectivamente.
Evolución del índice de masa corporal
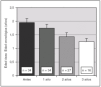
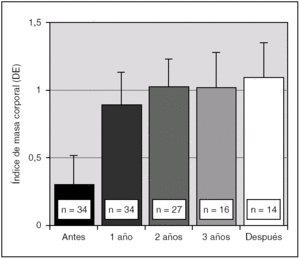
Durante el tratamiento con análogos de GnRH se evidenció un aumento significativo del IMC, que se mantuvo un año después de finalizar el tratamiento (fig. 3). Así mismo, antes del tratamiento, un 10 % de las pacientes presentaron un IMC superior a 2 DE para la edad y sexo, mientras que tras un año de terapia ese porcentaje aumentó a un 16 %; a los 2 años se mantuvo igual; a los 3 años de terapia era de un 18 %, y un año después de suspender el tratamiento era de un 20 %.
Figura 3. Evolución del índice de masa corporal (IMC) en DE para la edad y sexo durante el tratamiento con triptorelina y un año después de su interrupción (p < 0,01 para ANOVA de medidas repetidas). Los valores se expresan en media ± error estándar.
Menarquia tras finalizar el tratamiento
El tamaño uterino al diagnóstico fue de 38,6 ± 14 mm, que se corresponde con el estadio puberal de las pacientes (tabla 1). El tiempo medio trascurrido entre el final del tratamiento y la aparición de la menarquia en 14 pacientes fue de 13,3 ± 4,1 meses (rango: 8-24 meses), sin que presentaran alteraciones en los ciclos menstruales ni signos de hiperandrogenismo.
Discusión
En este estudio retrospectivo, observamos que la talla adulta tras el tratamiento con análogos de GnRH en nuestras pacientes con PPC fue normal; es decir, acorde con su talla genética. Simultáneamente apreciamos un aumento significativo del IMC, así como ausencia de alteraciones de los ciclos menstruales a posteriori.
Si bien el número de pacientes que han alcanzado la talla adulta es relativamente limitado, es de interés destacar la diferencia estadísticamente significativa observada entre la talla final de las niñas con pubertad precoz central y patología cerebral de base, con los casos de pubertad precoz central idiopática. Este hallazgo coincide con los resultados de otros estudios, aunque probablemente por el número de pacientes estudiados, no hemos encontrado que la organicidad ni ningún otro factor, sean predictores de la talla final. No obstante, existen datos contradictorios en la literatura médica a este respecto, habiéndose señalado en distintos estudios que el inicio de la clínica antes de los 6 años, un pico elevado de LH en el test de GnRH, una talla adulta estimada menor de 155 cm, y una edad ósea acelerada al menos 2 años al inicio del tratamiento con análogos de GnRH, son factores asociados a una mayor ganancia de talla con el tratamiento con análogos de GnRH. El factor que parece más constante es la aceleración de la edad ósea al diagnóstico, junto con la edad ósea al suspender el tratamiento 15-17,24-28.
Aunque no hay diferencias ni estadística ni clínicamente significativas entre talla adulta, talla genética y predicción de talla por el método de Bayley-Pinneau, es de interés reseñar que si se emplea éste para edad ósea acelerada, la predicción de talla es mayor que la talla final en todos los casos estudiados, coincidiendo con otros trabajos publicados en la literatura especializada 29-32. Por consiguiente, entendemos que sería recomendable utilizar en todos los pacientes las tablas de edad ósea acorde a la edad cronológica (average), independientemente de la patología de base, al objeto de evitar errores por exceso al estimar la talla adulta en el momento del diagnóstico.
Otro punto de controversia, surge al analizar los posibles indicadores de finalización del tratamiento. En efecto, generalmente se considera que este momento se produce hacia los 12 años de edad ósea en las niñas 5,26,30, y es lo que se ha seguido en nuestro grupo de estudio.
Ante el desarrollo de una pubertad precoz en un varón, todos los datos disponibles en la literatura médica apuntan por la necesidad de realizar pruebas de neuroimagen, por el riesgo elevado de lesión intracraneal. En el caso de las niñas, la ausencia de lesión subyacente a la pubertad precoz central es más frecuente, y por ello diferentes autores han intentado identificar factores predictores de la lesión intracraneal, sin haber llegado a conclusiones definitivas 1,2,28,33-35. No obstante, sigue siendo recomendable la realización de una prueba de imagen en todas las niñas que se diagnostiquen de pubertad precoz central, siendo la RM cerebral la exploración de elección. En nuestro estudio, el porcentaje de casos de pubertad precoz debida a patología del sistema nervioso central es de un 27 %, una cifra superior a la mayoría de las series publicadas. La falta de unos criterios universales para el diagnóstico de pubertad precoz puede ser la causa de esta diferencia, ya que otros autores pueden haber incluido en sus estudios pacientes que habrían sido diagnosticadas de pubertad adelantada.
Los datos disponibles en la literatura especializada sobre la influencia del tratamiento con análogos de GnRH en el peso corporal son dispares 22,36-40. La mayoría de los estudios han encontrado una asociación entre el aumento ponderal y del IMC y el tratamiento con análogos de GnRH, aunque hay otros que no han demostrado una relación estadísticamente significativa, y alguno puntual que ha observado incluso una relación inversa de estos parámetros 22. En nuestro estudio hemos analizado la relación con el IMC, considerado el mejor indicador de la relación entre el peso, la talla, y la proporción de tejido graso corporal, expresado en DE respecto a la edad y sexo de las pacientes. Desde el momento del diagnóstico se aprecia un IMC por encima de la media de la población general, aunque el aumento posterior es inequívoco y mantenido un año después de la suspensión del tratamiento. Este aspecto, sin embargo, es de difícil análisis, ya que está sometido a múltiples factores de confusión que, al tratarse de un estudio retrospectivo, no se han podido controlar (dieta y actividad física de cada paciente, recomendaciones médicas y enfermedades intercurrentes, entre otros). Además, utilizar la edad cronológica puede conducir a errores para estimar la DE respecto al IMC poblacional, ya que el estadio puberal y la maduración ósea son determinantes de este parámetro en cada edad. A pesar de todo, los resultados de nuestro trabajo apoyan la necesidad de realizar estudios controlados que proporcionen resultados definitivos y, entre tanto, advertir a las pacientes y sus familias sobre la posibilidad de experimentar estos cambios.
Pocos estudios hasta el momento han recogido el tiempo de transición entre el abandono del tratamiento y la aparición de la menarquia 19-21,23,40. Paterson et al 19, en una casuística de 46 niñas diagnosticadas de pubertad precoz central, que recibieron tratamiento con goserelina trimestral, destacan que el tiempo medio de aparición de la menstruación, es de 1,46 años y que, en general, se apreciaba un incremento del IMC de las pacientes durante el tratamiento. Nuestros resultados reflejan un período más corto, y al igual que en el estudio de Paterson et al 19, no hemos encontrando ningún factor asociado a este intervalo de tiempo. El seguimiento ulterior de todas estas pacientes es necesario, al objeto de valorar la posible influencia del tratamiento con análogos de GnRH en su fertilidad.
En conclusión, la presencia de patología orgánica, que debe excluirse mediante la realización de una RM craneal, es un factor decisivo en el pronóstico de talla de las pacientes con pubertad precoz central. El pronóstico de talla antes del tratamiento debe realizarse mediante el método de Bayley-Pinneau average (acorde a la edad cronológica) para evitar la sobrestimación del método accelerated (para edad ósea acelerada). Por último, la elevación del IMC durante el tratamiento con análogos de GnRH observada en nuestras pacientes plantea la necesidad de efectuar recomendaciones higiénico-dietéticas en futuros tratamientos, preferentemente en estudios prospectivos con grupo control.
Correspondencia: Prof. J. Argente Oliver.
Servicio de Pediatría. Hospital Infantil Universitario Niño Jesús.
Avda. Menéndez Pelayo, 65. 28009 Madrid. España.
Correo electrónico: argentefen@terra.es
Recibido en noviembre de 2005. Aceptado para su publicación en julio de 2006.