A pesar de la baja prevalencia infantil de infección por virus hepatitis C (VHC) y su leve clínica inicial, la infección crónica puede evolucionar a cirrosis y/o hepatocarcinoma. Es fundamental controlar su transmisión vertical. Los últimos estudios describen hasta 50% de transmisiones intraútero.
Material y métodosEstudiamos retrospectivamente 17 casos de infección por VHC en 8 años, analizando los factores de riesgo de transmisión vertical, para aplicar prevención primaria.
ResultadosSolo la adicción a drogas vía parenteral muestra riesgo significativo, sin ser la coinfección VIH factor de confusión. La carga viral, la coinfección por VIH, la disfunción hepática y el tiempo de evolución de infección no muestran mayor riesgo. La cesárea, la amniocentesis y la monitorización interna pueden ser factores de riesgo (sin significación estadística), pero no las horas de amniorrexis. La lactancia materna muestra protección.
ConclusionesPese a la importancia frecuentemente atribuida, el efecto de la carga viral sobre el riesgo de transmisión no está claramente establecido: la ausencia de viremia no descarta el riesgo de transmisión, ya que la detección de ARN viral puede ser intermitente, y por tanto, los datos al respecto deben interpretarse con cautela. La inmunosupresión secundaria a la coinfección por VIH supone mayor riesgo de transmisión, pero dicho efecto disminuye al mejorar la capacidad inmune gracias al tratamiento antirretroviral. Respecto a las características del parto, el tiempo transcurrido tras la rotura de membranas no ha mostrado ser factor de riesgo; y se desestima la cesárea como forma óptima y electiva de finalizar la gestación de estas mujeres. La lactancia materna, lejos de suponer mayor riesgo de transmisión, puede ser protectora. La escasa carga viral en la leche, su inactivación por el pH ácido gástrico y sus beneficios inmunológicos justificarían este resultado.
Dadas las limitaciones de los estudios retrospectivos, es necesario plantear análisis prospectivos para conocer mejor el papel de los posibles factores de riesgo y establecer pautas claras de prevención; de momento, es fundamental el control evolutivo de todos los hijos de madres con infección por el VHC.
Despite the low prevalence of paediatric HCV infection and its initial mild clinical expressiveness, chronic infection could progress into cirrhosis and/or hepatocarcinoma. It is essential to control vertical transmission. Recent studies show that up to 50% of transmissions occur within the uterus.
Material y methodsA retrospective study was conducted on 17 cases of (HepatitisC virus) HCV infection registered over a period of 8 years. Vertical transmission risk factors were analysed, in order to introduce primary prevention.
ResultsOnly parenteral drug addiction significantly increased the rate of HCV transmission; HIV co-infection was not a confounding factor. HCV viremia, HIV co-infection, liver dysfunction and/or duration of the infection did not appear to affect the rate of transmission. Caesarean section, amniocentesis and internal monitoring may be risk factors (not statistically significant), but not prolonged vaginal delivery after amniotic membrane rupture. Breastfeeding showed protection.
ConclusionsThe effect of viremia on the risk of transmission is not clearly established, despite the importance usually attributed. Lack of viremia does not discount the risk of transmission, due to viral RNA detection can be intermittent, so it should be interpreted cautiously. Immunosuppression secondary to HIV co-infection implies a higher risk of transmission, but this effect decreases by improving immune competence by antiretroviral treatment. With regard to the birth characteristics, time after the rupture of membranes has not shown being a risk factor; being the caesarean not advisable as a good alternative to finish the pregnancy. Breastfeeding does not increase the risk, even it can be protective. This results would be justified by the low viral content of milk, its inactivation by gastric pH and its immunological benefits.
Given that retrospective studies results are limited, prospective studies need to be carried out in order to improve the understanding of the role of possible risk factors and to provide a clear preventive guidelines. At the moment it is essential to control all the children born of mothers with HCV infection.
El virus de la hepatitis C (VHC) estuvo incluido hasta 1989 dentro del grupo de virus de hepatitis no A no B.
A pesar de su baja prevalencia en la infancia (0,1%) y su leve expresividad clínica inicial, la infección crónica por VHC constituye un importante problema de salud dada la probabilidad, entre el 10 y el 20%, de evolucionar a cirrosis y/o hepatocarcinoma a largo plazo1,2.
Por tanto, es fundamental el control de sus vías de transmisión. En los niños, la vía fundamental es la vertical (dado el control de la vía parenteral a partir de 1990 con la introducción del cribado de este virus en los hemoderivados). En mujeres, como en la población general, la infección por VHC en fases iniciales es infradiagnosticada con frecuencia, y por tanto, la transmisión vertical puede no ser detectada. En este sentido, la inclusión de la serología VHC dentro del cribado realizado en la gestación constituye uno de los primeros escalones en el control de la transmisión vertical.
El riesgo de transmisión vertical es bajo (varía entre el 2 y el 10% en diferentes series publicadas)1-4. Son múltiples los estudios que demuestran que la tasa de transmisión se relaciona con la viremia del VHC y la coinfección VIH materna3-5; ahora bien, en 2005 se publica un estudio en el que, a pesar de que se objetiva mayor riesgo de transmisión vertical VHC en aquellos casos de coinfección VIH, este efecto no muestra significación estadística en el análisis multivariante6. El riesgo de transmisión es extremadamente bajo si el ARN viral no es detectable7,8, pero es posible6,9-11.
Tradicionalmente se ha considerado que la transmisión ocurre en el momento del parto, aunque los últimos estudios consideran que hasta el 50% de las transmisiones pueden ocurrir intraútero12. Cuando la detección de ARN viral es positiva en los primeros 3 días de vida, se considera que la transmisión ha ocurrido intraútero4. Ahora bien, hay casos de negatividad en este primer control de ARN que también han adquirido la infección intraútero, pero con niveles de viremia bajos, y no detectables con la técnica de PCR empleada4. Dada la dificultad en la interpretación de la PCR temprana, las conclusiones no están claras en cuanto al efecto del modo de finalizar la gestación4. Existe un pequeño estudio publicado en 2000 que plantea el potencial beneficio de la cesárea electiva con membranas intactas13; pero este efecto protector de la cesárea frente al parto vaginal no se ha confirmado en estudios posteriores5,6,9, incluida una revisión Cochrane publicada en 201014, por lo que la infección por el VHC no es indicación de cesárea de forma electiva. En este sentido, algunos estudios muestran como factores de riesgo de transmisión el tiempo transcurrido desde la rotura de membranas, así como la monitorización interna, proponiendo la cesárea en aquellos casos en los que se prolonga el tiempo tras la rotura de membranas, pero no se establece cuál es el tiempo límite15.
La posibilidad de transmisión tras el parto es rara, pero no puede ser excluida. Se han detectado virus en la leche materna, pero en escasa cantidad; este hecho, junto con el pH ácido del estómago, que inactiva las partículas virales, hace que el riesgo de transmisión sea prácticamente inexistente (más aun si la carga viral materna es baja y no existen grietas o lesiones en el pezón). La mayoría de los estudios no encuentran relación entre la transmisión del VHC y la alimentación. Algunos autores plantean si el hecho de encontrar una primera detección de ARN positivo de forma tardía (más allá del primer mes de vida) podría sugerir que la transmisión ha ocurrido tras el parto, pero el análisis posterior establece que esta evolución sea debe a diferentes patrones de viremia más que al momento de la transmisión4.
El daño hepático, la adicción a drogas por vía parenteral, el recuento de linfocitos CD4, el peso al nacimiento, el sexo y la edad gestacional se han valorado en múltiples estudios, sin mostrar diferencias estadísticamente significativas en cuanto al riesgo de transmisión1,3. La adicción a drogas por vía parenteral se ha relacionado con la transmisión en el subgrupo de mujeres sin coinfección VIH3. En 2005 se publica el primer estudio que objetiva que el riesgo de transmisión es el doble en niñas que en niños, dato que se puede atribuir a las diferencias hormonales-genéticas en la susceptibilidad y respuesta a la infección6.
Generalmente, los anticuerpos maternos desaparecen en el niño entre los 6 y los 12 meses de vida, pero dado que a veces persisten más tiempo, el seguimiento se mantiene hasta los 18 meses de edad, para evitar sobreestimaciones.
En el Hospital Infantil La Fe de Valencia, 17 niños fueron diagnosticados de infección por VHC entre los años 1997 y 2004. Durante este periodo se registraron 341 nacimientos de madres con VHC (de 333 mujeres portadoras, con infección aguda o crónica). Coincidiendo con otros estudios1,2,13,14, corresponde a una tasa de transmisión de aproximadamente el 5%. El objetivo de esta revisión es valorar los factores de riesgo de transmisión vertical de VHC, sobre los que podemos actuar mediante medidas de prevención primaria.
Material y métodosSe trata de un estudio retrospectivo, en el que se incluyen los casos de niños diagnosticados de infección por VHC desde 1997 hasta 2004 en el Hospital Infantil La Fe (17 casos) (uno de ellos no nació en este hospital y, por tanto, se ha excluido por la falta de datos de la historia materna). Por cada caso, se tomaron 3 controles, definidos como mujeres con infección VHC que habían sido madres en este periodo sin presentar transmisión vertical de la infección. Este estudio fue aprobado por el comité de ética e investigación de nuestro hospital. En el periodo de tiempo analizado, 333 mujeres con VHC (portadora, aguda o crónica) tuvieron hijos. Uno de los casos y 10 de los controles tuvieron dos hijos en este periodo, por lo que finalmente los controles incluidos fueron 59.
Se analizan, como posibles factores de riesgo, las siguientes características clínicas y microbiológicas:
- –
Carga viral VHC: rangos: <500.000/500.000 U/ml-1.000.000/>1.000.000 U/ml
- –
Genotipo VHC.
- –
Tiempo de evolución VHC.
- –
Afectación de la función hepática: hipertransaminasemia.
- –
Coinfección VIH: carga viral, estadio clínico, recuento de linfocitos CD4 (rangos en base a las categorías de la clasificación CDC:<200/200-500/>500), tratamiento antirretroviral.
- –
Adicción a drogas por vía parenteral, enfermedades de transmisión sexual.
- –
Datos del parto: forma de finalizar la gestación: cesárea vs parto vaginal; horas de bolsa rota; amniocentesis previa, y monitorización interna.
- –
Edad gestacional (a término/pretérmino).
- –
Peso al nacimiento.
- –
Sexo del recién nacido.
- –
Lactancia materna.
- –
ARN positivo en ≥2 muestras separadas al menos 3 meses entre sí.
- –
Serología persiste positiva más allá de los 18 meses de edad.
- –
Seroconversión: reaparición de anticuerpos o aumento de su título.
La infección por VHC queda descartada cuando el ARN es negativo en al menos 2 muestras seguidas y la serología es negativa tras los 18 meses de edad.
El cribado de la infección VHC se realiza mediante técnica de enzimoinmunoensayo (EIA) para la detección de anticuerpos frente al VHC (anti-VHC). Estas técnicas serológicas han ido variando en los últimos años, con el objetivo de mejorar la sensibilidad y la especificidad: a partir del año 1993 se empezó a utilizar EIA de tercera generación en microplaca de INNOGENETICS. En la actualidad, se utilizan dos técnicas de EIA: una en microplaca (HCV IV de INNOGENETICS® de cuarta generación) y otra por quimioluminiscencia de Bayer (Adviacentaur®).
La confirmación serológica se realiza mediante el empleo de antígenos adsorbidos sobre tiras de nitrocelulosa. Desde el año 1992 se utiliza la técnica INNO-LIA de INNOGENETICS®: al principio en su versión INNO-LIA II, utilizando 4 antígenos de la región core del genoma del VHC, otro antígeno de la región que codifica la proteína no estructural NS3 y otro de la proteína no estructural NS4. Posteriormente, aparecieron nuevas generaciones, incluyendo nuevos antígenos, hasta los empleados en la actualidad: INNO-LIA IV®, que incluye dos antígenos del core, un antígeno de la región E2/NS1, otro de la región NS3, otro de la región NS4 y un último antígeno de la región NS5.
La detección cualitativa del ARN del VHC se realiza durante los años noventa mediante una doble amplificación por reacción en cadena de la polimerasa (PCR), mediante el uso de iniciadores derivados de la región 5’UTR del genoma viral. La carga viral del VHC se determina mediante 2 métodos: la prueba del ADN ramificado o bADN (Quantiplex™ HCV RNA 2.0- 3.0, Chiron Corporation; actualmente distribuido por Bayer) (expresa la carga viral en megaequivalenges/ml), y el Amplicor HCV Monitor™ Test de Roche (expresa la carga viral en copias/ml). Actualmente, ambas expresan la carga en unidades internacionales por ml (1 U/ml=5,2 copias/ml).
El genotipo VHC se determina mediante el método LiPA® (Line Probe Assay), que permite la detección de los genotipos 1- 6 del VHC mediante la hibridación reversa en tiras de membrana del producto amplificado por PCR.
ResultadosEntre 1997 y 2004, 333 mujeres con infección por VHC fueron madres en el Hospital Infantil La Fe. Dieciséis de estos niños (y un niño más que nació en otro hospital) fueron diagnosticados en este periodo de infección por VHC (transmisión vertical). Se estudian, de forma retrospectiva, estos 17 casos y 3 controles por cada caso (total 59 controles debido a que 10 de los controles y 1 de los casos fueron madres de 2 hijos). Las características de esta muestra se resumen en las tablas 1 y 2.
Análisis descriptivo de las variables categóricas
| Variables analizadas | Controles: hijo VHC negativo | Casos: hijo VHC positivo |
| ETS | 7,4% | 14,3% |
| ADVP | 36,4% | 69,2% |
| VIH | 21,7% | 42,9% |
| Tratamiento VIH | 100% | 60% |
| Estadio VIH | ||
| A1 | 1,7% | 5,9% |
| A2 | 5,0% | 0,0% |
| B1 | 1,7% | 0,0% |
| B2 | 1,7% | 0,0% |
| C3 | 1,7% | 5,9% |
| Linfocitos CD4 (células/mm3) | ||
| >500 | 10,0% | 23,5% |
| 200-500 | 10,0% | 5,9% |
| <200 | 0,0% | 0,0% |
| GOT (U/l) | ||
| <40 | 45,0% | 23,5% |
| >40 | 16,7% | 11,8% |
| GPT (UI/l) | ||
| <40 | 43,3% | 23,5% |
| >40 | 16,7% | 5,9% |
| Carga viral VHC (103U/ml) | ||
| <500 | 11,7% | 5,9% |
| 500-1.000 | 5,0% | 0,0% |
| >1.000 | 3,3% | 5,9% |
| Genotipo VHC | ||
| 1a | 8,3% | 11,8% |
| 1b | 10,0% | 11,8% |
| 3a | 3,3% | 5,9% |
| 4c-4d | 0,0% | 5,9% |
| Monitorización interna | 8,8% | 18,2% |
| Tipo de parto | ||
| Vaginal | 52,5% | 46,2% |
| Cesárea | 47,5% | 53,8% |
| Amniocentesis | 12,1% | 15,4% |
| Sexo | ||
| Varón | 50,0% | 38,5% |
| Mujer | 50,0% | 61,5% |
| Lactancia materna | 46,3% | 15,4% |
| Horas de bolsa rota | ||
| <18 | 88,3% | 64,7% |
| >18 | 8,3% | 5,9% |
| Edad gestacional (semanas) | ||
| <37 | 18,3% | 23,1% |
| >37 | 81,7% | 76,9% |
| Peso nacimiento (g) | ||
| <2.500 | 16,7% | 11,8% |
| >2.500 | 83,3% | 88,2% |
ADVP: adicción a drogas vía parenteral; ETS: enfermedad de transmisión sexual.
Análisis descriptivo de las variables cuantitativas. Media (desviación estándar)
| Variables analizadas | Casos: hijos VHC positivo | Controles: hijos VHC negativo |
| Tiempo evolución VIH (años) | 6,2 (4,1) | 8,6 (5) |
| Carga viral VIH (U/l) | 29.534,2 (55.395,9) | 1.150 (898,4) |
| Linfocitos CD 4 (células/mm3) | 120.198,2 (183.880,7) | 597,67 (297,9) |
| Tiempo evolución VHC (años) | 5,5 (5,6) | 5,3 (4,1) |
| Carga viral VHC (UI/l) | 957.027,3 (1.656.683) | 614.356,3 (1.127.603,8) |
| Edad gestacional (semanas) | 38,8 (1,4) | 38,6 (2,1) |
| Horas de bolsa rota | 5,8 (6,8) | 6,1 (8) |
| Peso nacimiento (g) | 3.133 (570) | 3.015 (527) |
El análisis univariante de los posibles factores de riesgo de transmisión vertical de VHC se realiza mediante el test exacto de Fisher en el caso de las variables categóricas y por comparación de medias/U de Mann-Whitney cuando se trata de variables cuantitativas (la mayoría de las variables cuantitativas analizadas se han transformado en categóricas por intervalo, por presentar mayor interés clínico de este modo) (tablas 3 y 4). Posteriormente se realiza el estudio multivariante mediante regresión logística de aquellas variables que en el estudio univariante se presentan como posibles factores de riesgo, así como de aquellas consideradas como tales en la literatura (tabla 5).
Análisis univariante (test exacto de Fisher) de posibles factores de riesgo de transmisión vertical VHC (variables categóricas)
| Factores de riesgo | % hijos con infección VHC | p |
| ETS | ||
| Sí | 33,3 | 0,595 |
| No | 19,4 | |
| ADVP | ||
| Sí | 31 | 0,059 |
| No | 10,3 | |
| Coinfección VIH | ||
| Sí | 31,6 | 0,170 |
| No | 14,5 | |
| Linfocitos CD4 (células/mm3) | ||
| >500 | 40 | 0,338 |
| 200–500 | 14,3 | |
| Tratamiento VIH | ||
| Sí | 18,8 | 0,065 |
| No | 100 | |
| Estadio VIH | ||
| A1 | 50 | 0,665 |
| A2 | 0 | |
| B1 | 0 | |
| B2 | 0 | |
| C3 | 50 | |
| Genotipo VHC | ||
| 1a | 28,6 | 0,368 |
| 1b | 25 | |
| 3ª | 33,3 | |
| 4c-4d | 100 | |
| Función hepática | ||
| GOT (UI/l) | ||
| <40 U/l | 12,9 | 1 |
| >40 U/l | 16,7 | |
| GPT (UI/l) | ||
| <40 U/l | 13,3 | 1 |
| >40 U/l | 9,1 | |
| Carga viral VHC (103U/ml) | ||
| <500 | 12,5 | 0,494 |
| 500–1.000 | 0 | |
| >1.000 | 33,3 | |
| Tipo de parto | ||
| Vaginal | 16,2 | 0,764 |
| Cesárea | 20 | |
| Horas de bolsa rota | ||
| <18 | 17,2 | 1 |
| >18 | 16,7 | |
| Monitorización interna | ||
| Sí | 28,6 | 0,316 |
| No | 14,8 | |
| Amniocentesis previa | ||
| Sí | 22,2 | 0,665 |
| No | 17,7 | |
| Edad gestacional (semanas) | ||
| <37 SEG | 21,4 | 0,705 |
| >37 SEG | 16,9 | |
| Peso al nacimiento (g) | ||
| <2.500 | 16,7 | 1 |
| >2.500 | 16,7 | |
| Sexo | ||
| Varón | 14,3 | 0,347 |
| Mujer | 21,1 | |
| Lactancia materna | ||
| Sí | 7,4 | 0,059 |
| No | 27,5 | |
ADVP: adicción a drogas por vía parenteral; ETS: enfermedad de transmisión sexual; HBR: horas de bolsa rota.
Análisis univariante (U de Mann-Whitney) de factores de riesgo de transmisión vertical VHC (variables cuantitativas)
| Factores de riesgo | Media±DE | IC del 95% |
| Tiempo de evolución VIH (años) | ||
| Casos | 6,2 (4,1) | –0,3-12,8 |
| Controles | 8,6 (5) | 5,3-12,2 |
| CD 4 (células/mm3) | ||
| Casos | 120.198,2 (183.880,7) | –108.119,8-348.516,2 |
| Controles | 597,67 (297,9) | 408,4-786,9 |
| Tiempo evolución VHC (años) | ||
| Casos | 5,5 (5,6) | –1,5-12,5 |
| Controles | 5,3 (4,1) | 3,6-7 |
| Carga viral VHC (U/l) | ||
| Casos | 957.027,3 (1.656.683) | –3.158.401,4- 5.071.456,1 |
| Controles | 614.356,3 (1.127.603,8) | –36.702,7- 1.265.415,3 |
| Horas de bolsa rota | ||
| Casos | 5,8-6,8 | 1,5-10,1 |
| Controles | 6,1-8 | 4-8,2 |
| Edad gestacional (semanas) | ||
| Casos | 38,8 (1,4) | 38-39,7 |
| Controles | 38,6 (2,1) | 38,1-39,2 |
| Peso nacimiento (g) | ||
| Casos | 3.133,3 (570,3) | 2.771-3.495,7 |
| Controles | 3.015,8 (527,1) | 2.879,7-3.152 |
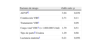
Análisis multivariante de factores de riesgo de transmisión vertical VHC
| Factores de riesgo | Odds ratio | p |
| ADVPb | 3,94 | 0,039 |
| Coinfección VIHc | 2,71 | 0,11 |
| Tratamiento VIHa | 0,99 | |
| Carga viral VHCa (>1.000.000 U/ml) | 1,79 | 0,51 |
| Tipo de partod Cesárea | 1,29 | 0,68 |
| Lactancia maternaa | 0,21 | 0,056 |
ADVP: adicción a drogas por vía parenteral; HBR: horas de bolsa rota.
Factores de confusión analizados:
Dentro de los antecedentes maternos y sus condiciones serológicas, el análisis univariante objetiva mayor riesgo de transmisión vertical VHC en aquellos hijos de madre con enfermedad de transmisión sexual, adictas a drogas por vía parenteral, coinfectadas por VIH (más aun los estadios A1 y C3), no tratadas con triple terapia antirretroviral, carga viral VHC mayor de 1.000.000 U/l y genotipo VHC 1a y 3a (seguidos del tipo 1b), pero estas diferencias sólo fueron estadísticamente significativas (p<0,1) para la adicción a drogas por vía parenteral y la falta de terapia antirretroviral. Tras el análisis multivariante, se confirma la adicción a drogas por vía parenteral como factor de riesgo (p= 0,039), sin que la coinfección VIH suponga un factor de confusión, y se descarta la significación estadística de la falta de tratamiento antirretroviral.
A diferencia de muchos estudios publicados, no se objetivó significación estadística respecto a la coinfección VIH ni a la carga viral VHC. Este hallazgo en relación con la carga viral podría explicarse por la falta de datos en esta categoría (sólo hay 14 valores disponibles) probablemente debido a la menor sensibilidad de la prueba en los años iniciales de la revisión, hecho que aún más justifica la escasez de datos referentes al genotipo. Ni la disfunción hepática ni el tiempo de evolución de la infección VIH ni el de la hepatitis C mostraron mayor riesgo de transmisión. Aquellos con mayor número de linfocitos CD 4, a diferencia de lo esperable, presentaron en nuestro estudio un mayor porcentaje de transmisión vertical, sin que esta diferencia fuera estadísticamente significativa, resultado probablemente debido a que esta variable solo se solicita en pacientes VIH positivas, y los datos son escasos.
Ni el tiempo de evolución de la infección VIH ni el de la hepatitis C representan mayor riesgo.
En cuanto a las características del parto, ni las horas de bolsa rota ni el menor peso al nacimiento suponen mayor riesgo de transmisión. Respecto a la forma de finalizar la gestación, la cesárea no solo no se muestra como protector, sino incluso supone un mayor riesgo, aunque tampoco de forma significativa. El riesgo es mayor en aquellos en los que se realizó amniocentesis, monitorización interna y en las niñas, pero esta diferencia no presenta significación estadística (p<0,1).
La lactancia materna no se mostró como factor de riesgo, sino protector, con un nivel de significación límite (p=0,056) en el análisis multivariante, y descartando la infección por VIH y la adicción a drogas por vía parenteral como posibles factores de confusión. Las ventajas inmunológicas de la leche materna superarían, por tanto, el escaso riesgo que podría suponer la existencia en ella de escasa carga viral VHC.
Las características del estudio hacen que tenga un poder estadístico del 80%.
DiscusiónA pesar de que parece importante la relación de la carga viral con el riesgo de transmisión vertical del virus de hepatitis C, este efecto no está claramente establecido. Nuestra revisión apoya el hecho, ya objetivado en otros estudios11,16, de que la ausencia de viremia no descarta el riesgo de transmisión6 debido a que la detección de ARN viral puede ser intermitente durante la gestación y a que la sensibilidad de la técnica no es del 100% (todavía menor en los primeros años de nuestra revisión; y esto justificaría que el estudio de carga viral no se solicitara en muchos casos, y que fuera negativa en algunos otros). Por todo ello, los datos al respecto de la carga viral deben ser interpretados con mucha cautela. Aquellas mujeres seropositivas VHC con ARN negativo (comprobado con varias muestras) probablemente correspondan a casos que han aclarado el virus. En este sentido, la coinfección por VIH supone una situación de inmunosupresión y, por tanto, de menor capacidad de aclaramiento viral.
El papel de los diferentes genotipos es difícil de establecer, dado que en muchos casos no se ha solicitado o no se ha podido realizar por ser necesario cierto grado de viremia.
En la mayoría de estudios publicados se objetiva una clara relación de la transmisión con la coinfección VIH, achacada a la inmunosupresión; ahora bien, un estudio publicado en 2005 demuestra que la coinfección supone un aumento de riesgo de transmisión pero no de forma estadísticamente significativa6, al igual que ocurre en nuestra revisión. Esta diferencia con el resto de estudios publicados puede deberse al efecto del tratamiento antirretroviral, capaz de mejorar la capacidad inmunitaria del organismo para disminuir la carga viral VHC. Estos datos estarían también apoyados por los resultados de un metaanálisis publicado en 2003, ya mencionado, que sí establece la coinfección por el VIH como factor de riesgo en la transmisión del VHC, pero pone de manifiesto que su efecto es menos pronunciado cuando solo se incluye a aquellas mujeres con viremia VHC detectable3.
La adicción a drogas por vía parenteral se pone de manifiesto como factor de riesgo de transmisión de hepatitis C, incluso tras descartar la posible influencia de la coinfección VIH como factor de confusión.
Respecto a las características del parto, el tiempo transcurrido tras la rotura de membranas no ha mostrado ser un factor de riesgo; la cesárea, lejos de ser protectora, ha mostrado mayor riesgo de transmisión, aunque de forma no significativa; por lo que se desestimaría como forma electiva de finalizar la gestación de mujeres con VHC.
La relación de la lactancia materna con la transmisión de VHC es un tema debatido. Nuestros resultados confirman que la leche materna, a pesar de poder contener virus, no supone mayor riesgo de transmisión, es más, puede ser protector (p=0,056). La escasa carga viral en la leche, su inactivación por el pH ácido del estómago y los beneficios inmunológicos de la lactancia materna justificarían este resultado.
La frecuencia de valores perdidos supone una gran limitación de los estudios retrospectivos, dificultando la obtención de hallazgos significativos al respecto de algunas variables, como es el caso de la carga viral. Por tanto, sería necesario plantear estudios prospectivos con intención de conocer el papel de estos factores y poder establecer pautas más claras de prevención en la transmisión de VHC.
Dada la posible evolución a cirrosis o hepatocarcinoma, la infección por el VHC constituye un importante problema de salud. Por tanto, es fundamental el control de su transmisión vertical, vía fundamental de adquirir la infección en la infancia. De los factores analizados, sólo la adicción a drogas por vía parenteral muestra un aumento de riesgo con significación estadística. La influencia de la carga viral no está clara, ahora bien, se ha demostrado que la ausencia de viremia no descarta la transmisión, dado que la detección de ARN viral es intermitente durante la gestación. La coinfección por el VIH no muestra aumento de riesgo estadísticamente significativo. La cesárea no supone disminución del riesgo de transmisión y, por tanto, no estaría indicada de forma electiva para finalizar la gestación. La lactancia materna se comporta como factor protector en nuestra revisión (p=0,056). Debido a las limitaciones de los estudios retrospectivos, sería necesario plantear análisis prospectivos para conocer mejor el papel de los posibles factores de riesgo y establecer pautas claras de prevención en la transmisión vertical de esta infección; de momento, es fundamental el control evolutivo de todos los hijos de madres con infección por el VHC.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.