Analizar el flujo tisular cutáneo en diferentes localizaciones en niños en estado crítico.
Pacientes y métodosSe realizó un estudio prospectivo observacional en 41 niños críticamente enfermos, con una edad mediana de 12 meses y un peso de 8,2kg. Se midió el flujo tisular cutáneo mediante láser Doppler de forma consecutiva en la planta del pie, el antebrazo, el muslo y el hipocondrio, y se estudió su correlación con variables demográficas, hemodinámicas y lactato.
ResultadosSe estudiaron 144 mediciones. El flujo tisular fue de 3,2±2,2ml/min/100g de tejido. Existió una correlación moderada del flujo tisular entre las localizaciones centrales; abdomen-brazo (r2: 0,574; p=0,001); abdomen-muslo (r2: 0,423; p=0,002) y muslo-brazo (r2: 0,703; p<0,000), pero no con la periférica (planta del pie). Los límites de concordancia entre los lugares de medición fueron amplios (rango de 6,1 a –2,5ml/min/100g). Existió una correlación leve-moderada del flujo tisular de la planta del pie con el peso (−0,355; p=0,039), la edad (−0,343; p=0,044), la temperatura periférica (0,503; p=0,017) y el índice de inotrópico (−0,443; p=0,008).
ConclusionesEl flujo tisular en la planta del pie se correlaciona con el peso, la edad, la temperatura periférica y el índice inotrópico. Son necesarios estudios que analicen la utilidad del flujo tisular para valorar la perfusión periférica en situaciones de shock.
To analyze skin tissue perfusion at different sites in critically ill children.
Patients and methodsA prospective observational study was performed on 41 critically ill children with a median age of 12 months and weight of 8.2kg. Skin tissue flow was measured in each patient using laser Doppler consecutively in the foot, forearm, thigh and hypochondrium, and its association with demographic and hemodynamic variables, as well as lactate and inotropic index, was analyzed.
ResultsA total of 144 tissue flow measurements were made, with a median flow of 3.2±2.2ml/min/100g tissue. There was a moderate correlation between the tissue flow measured in central locations, abdomen-arm (r2: 0.574, P=.001), abdomen-thigh (r2: 0.423, P=.002) and thigh-arm (r2: 0.703, P<.000), but not with the peripheral measurements (sole of the foot). The limits of agreement, measured between the different locations, were wide (range 6.1 to −2.5ml/min/100g). There was a slight-moderate correlation between the flow in the sole of the foot with weight (−0.355, P=.039), age (−0.343, P=.044), peripheral temperature (0.503, P=.017) and inotropic index (−0.443, P=.008).
ConclusionsTissue flow in the foot correlates with weight, age, peripheral temperature and inotropic index. Further studies are needed to analyze its usefulness in assessing peripheral perfusion in situations of shock.
La perfusión tisular es uno de los parámetros más importantes para estimar el estado de la microcirculación y el aporte de sangre y oxígeno a los tejidos. La valoración de la perfusión periférica es esencial para la detección precoz y el control del tratamiento en el shock1,2.
No existen métodos no invasivos que permitan medir de forma objetiva y cuantificar la perfusión tisular periférica, y por ello, en la práctica clínica, la valoración de la perfusión tisular periférica en los niños se realiza por métodos indirectos y/o poco objetivos, como la medición del tiempo del relleno capilar o el gradiente de temperatura central-periférica2-4. Recientemente, se han propuesto otros métodos, como la espectrometría cercana al infrarrojo5, el índice de perfusión tisular derivado del pulsioxímetro y la valoración de la microcirculación sublingual con microscopia6.
El láser Doppler es un método no invasivo que ha demostrado su capacidad para medir el flujo tisular y detectar cambios en la perfusión tisular en diferentes ámbitos. En neurocirugía se ha utilizado intraoperatoriamente para valorar la reperfusión tras la reparación de aneurismas7,8, y para la detección de hiperperfusión tras la cirugía en la enfermedad de Moyamoya9,10. También se ha utilizado en dermatología para cuantificar el flujo sanguíneo de la piel en heridas, colgajos e injertos11,12 y para estimar la profundidad de las quemaduras13,14, y en cirugía plástica para valorar la perfusión tisular de los colgajos de tejido autólogo15-18.
No existen trabajos que hayan estudiado los valores normales de flujo tisular en niños sanos. Tampoco se conoce si el láser Doppler es capaz de valorar la perfusión tisular cutánea en niños críticamente enfermos, ni si puede detectar de forma precoz estados de hipoperfusión en el shock y servir para valorar su evolución.
El objetivo de este estudio ha sido estudiar los valores de flujo tisular cutáneo medido mediante láser Doppler en diferentes localizaciones anatómicas en niños críticamente enfermos como estudio preliminar antes de valorar su utilidad en estados de hipoperfusión.
Pacientes y métodosSe realizó un estudio prospectivo observacional en el que se incluyó a 41 niños críticamente enfermos, previo consentimiento informado de sus padres. El 66% eran varones, con una mediana de edad de 12 meses (rango 0-204 meses) y una mediana de peso de 8,2kg (rango 2,7-74kg). El 85,4% de los pacientes eran cardiópatas, un 7,3% ingresaron por cuadros de insuficiencia respiratoria y 2 pacientes ingresaron para vigilancia neurológica (síndrome del niño zarandeado, tetraplejía). Ninguno de ellos estaba en situación de shock en el momento del estudio (definido como una presión arterial media < 2 desviaciones típicas de la normal para su edad, después de una expansión de al menos 20ml/kg y/o infusión de dopamina > 15 μg/kg/min y/o adrenalina o noradrenalina > 0,3 μg/kg/min). Para la medición del flujo tisular se utilizó el monitor láser Doppler BLF21A® (Transonic, EE. UU.), que mide el flujo en ml/min/por 100g de tejido, lo que equivale a 1 mm3 de tejido. Este monitor tiene diferentes sensores según el tejido en el que se mida el flujo tisular. En este estudio se utilizó el sensor R-ABLPHR, de ángulo recto, que se fijó sobre la piel desnuda y se sujetó con un apósito de gasa. Tras 4-5 min de estabilización, se leyeron los resultados. Se realizaron mediciones en 4 localizaciones consecutivas: planta del pie, muslo, brazo y abdomen (en el hipocondrio derecho). Además, se recogieron datos demográficos (edad, sexo, diagnóstico), variables hemodinámicas (presión arterial, frecuencia cardiaca, presión venosa central, temperatura central, lactato) y datos de tratamiento (índice inotrópico).
Los datos se analizaron estadísticamente mediante el programa SPSS 18.0. La correlación entre las variables se estudió mediante la correlación de Spearman y correlación intraclase, y la concordancia mediante gráficos de Bland-Altmann. Se consideró significativa una p<0,05.
ResultadosSe realizaron 144 mediciones en los 41 pacientes. El flujo tisular medio fue de 3,2±2,2ml/min/100g de tejido. La tabla 1 muestra los valores demográficos, de flujo y hemodinámicos de los pacientes.
Valores demográficos, hemodinámicos y flujo sanguíneo cutáneo
| Mediana | Rango | |
| Edad (meses) | 12 | 0,5-204 |
| Peso (kg) | 8,3 | 2,7-74 |
| Flujo tisular pie (ml/min/100 g) | 2,4 | 0,5-23,5 |
| Flujo tisular muslo (ml/min/100 g) | 1,7 | 0,5-7 |
| Flujo tisular brazo (ml/min/100 g) | 1,9 | 0,8-11,2 |
| Flujo tisular abdomen (ml/min/100 g) | 3,8 | 1,6-12 |
| FC (lpm) | 132 | 93-182 |
| PAM (mmHg) | 61 | 44-95 |
| PVC (mmHg) | 11 | 5-24 |
| Presión de perfusión (PAM-PVC) | 46 | 31-83 |
| Temperatura periférica (°C) | 30,7 | 21,2-37,1 |
| Gradiente de temperatura (°C) | 6,9 | –2,2-13,8 |
| Láctico (mmol/l) | 1,1 | 0,6-8,4 |
| Índice inotrópico | 14,5 | 0-30 |
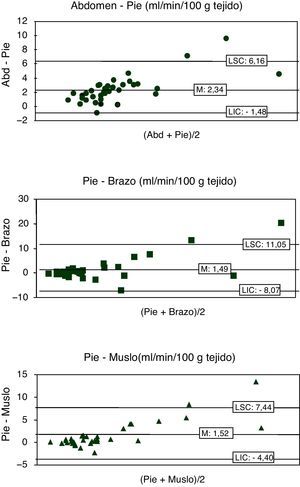
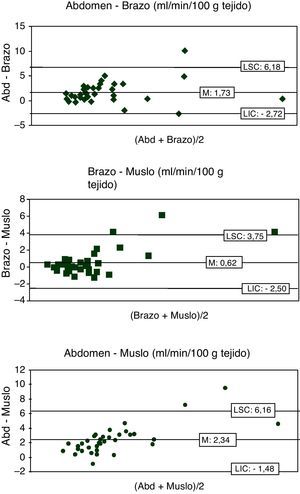
En la tabla 2 se muestran la correlación y la concordancia del flujo tisular entre las diferentes localizaciones. Existió una correlación moderada estadísticamente significativa entre las localizaciones centrales (abdomen, muslo y brazo). No existió correlación entre el flujo tisular de la planta del pie con el del resto de las localizaciones.
Correlación y concordancia del flujo tisular entre las diferentes localizaciones
| Correlación intraclase | Concordancia | ||||
| r | P | Media | Límite superior | Límite inferior | |
| Abdomen-pie | 0,225 | 0,232 | –1,09 | 6,43 | –8,61 |
| Pie-brazo | 0,259 | 0,192 | 1,49 | 11,05 | –8,07 |
| Pie-muslo | 0,364 | 0,069 | 1,52 | 7,44 | –4,40 |
| Abdomen-brazo | 0,574 | 0,001 | 1,73 | 6,18 | –2,72 |
| Abdomen-muslo | 0,423 | 0,002 | 2,34 | 6,16 | –1,48 |
| Brazo-muslo | 0,703 | 0,000 | 0,62 | 3,75 | –2,50 |
r: correlación.
Tampoco se encontró una buena concordancia entre las medidas en las 4 localizaciones, existiendo unos límites amplios de concordancia (tabla 2).
Las figuras 1 y 2 muestran las gráficas de concordancia de Bland-Altman. Existieron unos márgenes de concordancia muy elevados entre las diferentes medidas de flujo.
La tabla 3 muestra la correlación entre el flujo tisular en las diferentes localizaciones y los parámetros hemodinámicos y de tratamiento. Se encontró una correlación moderada estadísticamente significativa entre el flujo tisular en la planta del pie y la temperatura, e inversamente proporcional con la edad, el peso y el índice inotrópico.
Correlación del flujo tisular con los parámetros hemodinámicos y de tratamiento
| Correlación de Spearman | Planta pie | Abdomen | Brazo | Pierna |
| Peso (kg) | ||||
| r | –0,355 | –0,268 | –0,061 | –0,176 |
| p | 0,039 | 0,113 | 0,726 | 0,299 |
| Edad (meses) | ||||
| r | –0,343 | –0,198 | –0,113 | –0,126 |
| p | 0,044 | 0,246 | 0,519 | 0,450 |
| Temperatura periférica (°C) | ||||
| r | 0,503 | 0,132 | 0,210 | 0,265 |
| p | 0,017 | 0,567 | 0,361 | 0,210 |
| Temperatura diferencial (central-periférica) | ||||
| r | –0,405 | –0,102 | –0,425 | –0,366 |
| p | 0,076 | 0,677 | 0,070 | 0,094 |
| Presión de perfusión (PAM-PVC) | ||||
| r | –0,006 | –0,103 | 0,033 | –0,123 |
| p | 0,973 | 0,575 | 0,861 | 0,490 |
| Índice inotrópico | ||||
| r | –0,443 | 0,140 | 0,037 | –0,042 |
| p | 0,008 | 0,415 | 0,835 | 0,803 |
| Lactato | ||||
| r | –0,127 | 0,429 | 0,184 | –0,100 |
| p | 0,503 | 0,014 | 0,331 | 0,584 |
PAM: presión arterial media, PVC: presión venosa central; r: coeficiente de correlación.
El flujo tisular en las localizaciones centrales no se correlacionó con ninguna de las medidas hemodinámicas, excepto el flujo tisular en el abdomen con el lactato.
DiscusiónLos parámetros hemodinámicos habituales (frecuencia cardiaca, presión arterial, presión venosa central, gasto cardiaco) solo ofrecen una valoración global del estado hemodinámico del paciente y no permiten estimar el estado de la perfusión de los órganos y tejidos19. En la práctica clínica, la perfusión tisular se estima por parámetros indirectos, como el estado de consciencia, la diuresis y el relleno capilar, y por la medición del lactato y de la relación lactato/piruvato, que permiten detectar estados ya establecidos de hipoperfusión tisular sistémica20.
La disminución de la perfusión tisular periférica y esplácnica es uno de los primeros signos que aparecen en el shock y uno de los últimos en recuperarse1,2, por ello su detección precoz puede ser de gran importancia. La disponibilidad de un método no invasivo, cuantitativo, fácil de utilizar y sensible a los cambios de perfusión podría facilitar la detección precoz del shock y servir para controlar el efecto del tratamiento.
La medición del flujo tisular cutáneo mediante láser Doppler podría cumplir estos requisitos.
Este es el primer estudio que ha analizado el flujo tisular cutáneo en diferentes localizaciones en niños críticamente enfermos. Nuestros resultados muestran que existe una moderada correlación sin buena concordancia, entre las diferentes localizaciones centrales (abdomen, muslo y brazo), pero que no existe correlación entre ellas con la medición periférica en la planta del pie. Este hecho puede deberse a la existencia de una diferente perfusión en las distintas localizaciones anatómicas.
La existencia de una correlación entre el flujo tisular de la planta del pie y la temperatura, es decir, a mayor temperatura aumenta el flujo tisular cutáneo periférico y la correlación inversa con la temperatura diferencial, casi significativa, es lógica ya que el aumento de temperatura produce vasodilatación y, por tanto, mayor perfusión tisular, y un mayor gradiente de temperatura se correlaciona con un menor flujo tisular.
La correlación inversa con el índice inotrópico puede explicarse porque el aumento del soporte inotrópico provoca vasoconstricción y, por tanto, disminución del flujo tisular periférico. El que no se encuentre esta correlación con las localizaciones centrales puede explicarse por el hecho de que la mayor vasoconstricción se da en zonas acras, preservando la perfusión de órganos vitales, localizados en zonas centrales.
Estos hallazgos sugieren que la medición del flujo tisular en la planta del pie podría servir para valorar de forma objetiva la perfusión periférica, y puede ser sensible a cambios de temperatura y de fármacos vasoactivos.
Sin embargo, este solo es un estudio preliminar y son necesarios trabajos que valoren la utilidad de la medición del flujo tisular periférico en situaciones de hipoperfusión y shock y sus cambios con el tratamiento, así como la correlación con el tiempo de relleno capilar.
El láser-Doppler se ha usado en adultos para medir el flujo tisular de la microcirculación en circunstancias con hiperemia reactiva, como sepsis, diabetes mellitus, hipertensión o arteroesclerosis21. Sin embargo, la mayor limitación de la medición del flujo tisular con láser-Doppler es que no tiene en cuenta la heterogeneidad del flujo sanguíneo, con lo que la medida de la velocidad de la sangre es una media de la velocidad de los diferentes vasos sanguíneos y capilares. Actualmente, no existe ningún método de láser-Doppler que mida valores absolutos, sino que todos ellos están en relación con una cantidad de tejido (p. ej., ml/min/100g tejido), expresándose la medición en unidades de perfusión, lo que es una medida arbitraria3.
Por otra parte, la correlación inversa existente entre la medición en la planta del pie con la edad y el peso podría ser debida a que en los niños más mayores el espesor de los tejidos es mayor, y aunque este método estima que 100g de tejido equivale a 1 mm3 del mismo, esto puede cambiar con el espesor del tejido y con la localización de la medición. Por ello, sería necesario establecer valores de normalidad de acuerdo con la edad.
Nuestro estudio tiene como limitación que ha sido realizado en pacientes ingresados en cuidados intensivos pediátricos, que pueden tener afectación de la perfusión por ser niños en estado crítico, aunque no presenten alteraciones macrohemodinámicas. Además, la mayoría eran cardiópatas y recibían un tratamiento inotrópico. Por otra parte, no existe un grupo control que haya evaluado cuál es la perfusión tisular normal en niños.
Concluimos que en niños críticamente enfermos que no están en situación de shock existe una correlación moderada pero con mala concordancia del flujo tisular cutáneo entre las localizaciones centrales, pero no con la de la planta del pie. El flujo tisular en la planta del pie se correlaciona con el peso, la edad, la temperatura periférica y el índice inotrópico. Son necesarios estudios que analicen su utilidad para valorar la perfusión periférica en situaciones de shock.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al personal de enfermería del Servicio de Cuidados Intensivos Pediátricos del Hospital General Universitario Gregorio Marañón por su colaboración en la realización de este estudio.