El presente estudio revisa la epidemiología, las manifestaciones clínicas y el manejo de los casos de osteomielitis aguda (OA) ingresados en un hospital pediátrico de tercer nivel.
MetodologíaEstudio descriptivo de los pacientes menores de 15 años ingresados con el diagnóstico de OA entre 2000 y 2011, retrospectivo hasta 2006, y posteriormente prospectivo.
ResultadosSe identificaron 50 pacientes (52% varones) con una mediana de edad de 2 años. La sintomatología preponderante al ingreso fue dolor (94%), impotencia funcional (90%) y fiebre (72%). Las localizaciones más frecuentes fueron el fémur (32%), la tibia (28%) y el calcáneo (22%).
Se encontró leucocitosis>12.000/μl en el 56%, VSG elevada>20mm/h en un 26 y un 64% con PCR superior a 20mg/l. El 20% de los hemocultivos resultó positivo, siendo Streptococcus del grupo A el germen más frecuente (11%).
La gammagrafía ósea con 99Tc permitió el diagnóstico de confirmación en todos los casos.
El tratamiento antibiótico fue intravenoso (i.v.) durante una media de 10 días ±3 DE, continuándose por vía oral (v.o.) una media de 18 días ±6 DE. Tres pacientes requirieron drenaje quirúrgico. La evolución en todos los pacientes fue excelente, salvo 3 excepciones, que se resolvieron con el tiempo.
ConclusionesLa actual pauta corta de tratamiento i.v. disminuyó la estancia hospitalaria. Tras su instauración no se encontraron diferencias estadísticamente significativas en la duración de la clínica, ni en la PCR en el momento del alta en comparación con las pautas prolongadas previas a 2006.
The present study focuses on the epidemiology, clinical and laboratory data, and management of osteomyelitis in a pediatric third level hospital.
MethodologyAll cases of children under 15 years-old admitted with osteomyelitis between 2000 and 2011 were retrospectively reviewed until July 2006, then prospectively from then until 2011.
ResultsA total of 50 patients were identified (52% males) with median age at diagnosis of 2 years. Principal onset manifestations were pain (94%), functional impairment (90%) and fever (72%). The femur (32%), fibula (28%) and calcaneus (22%) were most affected bones.
Leucocytosis>12.000/μl was found in 56%, elevated ESR>20mm/h in 26%, and elevated CRP>20mg/L in 64%. Blood culture was positive in 20%, with group A streptococcus being the most frequently isolated bacteria (11%).
All diagnoses were confirmed by a 99Tc scintigraphy bone scan.
Antibiotic therapy was initially intravenously (mean time of administration: 10 days ± 3 SD), followed by oral medication (mean time of administration: 18 days ± 6 SD). Surgery was necessary in 3 patients. Evolution of all cases was excellent, despite 3 exceptions that resolved over time.
ConclusionsThe current short-term intravenous therapy led to shorter hospitalizations. There were no statistically significant differences between time from clinical onset or in CRP levels at discharge compared to long-term therapies prior to 2006.
La osteomielitis aguda (OA) es una enfermedad frecuente en la infancia con una incidencia anual en menores de 13 años entre 1/5.000 y 1/10.0001,2 y de gran relevancia, dadas sus potenciales secuelas. Afecta principalmente a menores de 5 años (50% de los casos), con un pico de incidencia a los 3 años3. La localización más común es la metáfisis de los huesos largos de los miembros inferiores4.
Los patógenos implicados más frecuentes son grampositivos, destacando Staphylococcus aureus, con un aumento progresivo en la descripción de casos secundarios a S. aureus resistente a oxacilina (SAOS), incluidos los productores de leucocidina de Panton-Valentine (PVL), de mayor gravedad2,5,6.
Las pautas terapéuticas habituales incluyen antibioterapia por vía intravenosa (i.v.) inicial durante entre 3 y 7 días, seguida de antibioticoterapia oral (v.o.) de 14 a 21 días más7. En un reducido número de casos se requiere además tratamiento quirúrgico. Un manejo precoz y adecuado minimiza las secuelas, principalmente asociadas a los casos con hemocultivo positivo, afectación epifisaria y edad de menos de un año al inicio del cuadro8. El porcentaje de secuelas tras OA y osteomielitis crónica puede alcanzar del 16 al 37%, transcurridos 10 años8,9.
Son escasos los estudios referentes a OA en niños en todo el mundo y mínimos en nuestro país. Con objeto de conocer las características clínicas y la evolución de los niños diagnosticados de OA se revisó la experiencia existente en un hospital pediátrico de tercer nivel.
MétodosEstudio descriptivo de los pacientes menores de 15 años ingresados en el Hospital Universitario de Getafe en Madrid, entre enero de 2000 y diciembre de 2011, con el diagnóstico de OA. Este hospital atiende a 209.639 habitantes, de los cuales 32.324 son menores de 14 años. Se definieron como OA aquellos casos con manifestaciones clínicas compatibles (dolor local, limitación funcional y/o signos de flogosis) y que además asociaban al menos uno de los siguientes requisitos: pruebas de imagen compatibles con OA y/o cultivo positivo4,10,11.
El estudio, de carácter retrospectivo hasta julio de 2006 (33 casos), pasó a ser una recogida prospectiva de datos (17 pacientes) cuando se introdujo el actual protocolo de manejo y seguimiento de OA. Según dicho protocolo los pacientes recibieron inicialmente antibiótico i.v. durante 7 días, seguido de antibioticoterapia v.o. 21 días más. En menores de 5 años se usó cefotaxima (150-200mg/kg/día, cada 6-8 h) y cloxacilina (150mg/kg/día, cada 6 h) i.v., completando la pauta con cefuroxima axetilo v.o. (60mg/kg/día, cada 12 h). Los mayores de 5 años recibieron cloxacilina i.v. (150mg/kg/día, cada 6 h), seguida de cefalexina v.o. (100-150mg/kg/día, cada 8 h) o cefadroxilo v.o. (60-90mg/kg/día, cada 8 h). Los mínimos controles previstos son a las 3 semanas del alta y posteriormente a los 3, 6, 9 y 12 meses.
Solo se incluyeron los casos de OA adquiridos en la comunidad. No se incluyeron los casos de osteomielitis vertebral y/o discitis, ni se revisaron las artritis sépticas de forma aislada.
Las variables recogidas en el estudio fueron: sexo, edad, días de demora entre el inicio de los síntomas y el diagnóstico, manifestaciones clínicas, antecedente traumático o herida, presencia y duración de la fiebre y huesos afectados, hemograma y bioquímica sanguíneas (PCR, VSG y procalcitonina, entre otros), resultado de los cultivos microbiológicos, pruebas de imagen realizadas y momento en la evolución del cuadro en que se realizaron, tratamiento antibiótico (tipo, combinaciones, vía de administración, duración), días de estancia hospitalaria, necesidad de tratamiento quirúrgico, complicaciones y seguimiento hasta su última revisión en consulta.
Los datos se expresaron en medias con sus desviaciones estándar (DE), medianas y rango. Se compararon variables mediantes diferentes pruebas paramétricas y no paramétricas y se realizaron análisis de correlación y regresión mediante el programa SPSS. El nivel de significación estadística fue de p<0,01 y todos sus valores se obtuvieron en test de 2 colas.
ResultadosDe un total de 55 pacientes revisados, 50 cumplieron los criterios de OA, de los cuales 26 eran varones (52%), con una mediana de edad de 24 meses (rango: 6-151 meses). El 72% presentó edad ≤ 3 años en el momento del diagnóstico, siendo menores de 5 años el 82% de la muestra.
Los casos excluidos fueron una OA tras herida de metralla y 4 casos en los que, aunque inicialmente se sospechó una OA, el diagnóstico final fue artritis idiopática juvenil, artritis reactiva, celulitis y fractura.
Manifestaciones clínicasSe observó predominio de afectación de los huesos de miembros inferiores: 45 pacientes (90%), seguido de afectación de los huesos del miembro superior en 4 niños (8%) y un caso de OA costal con piomiositis (2%). Las diferentes localizaciones se concretan en la tabla 1.
Localizaciones más frecuentes de osteomielitis aguda
| Huesos afectadosa | Número de pacientes |
| Fémur | 16 |
| Tibia | 14 |
| Calcáneo | 11 |
| Astrágalo | 9 |
| Pelvis | 5 |
| Radio | 3 |
| Cúbito | 3 |
| Costilla | 1 |
| Peroné | 1 |
| Escafoides | 1 |
| Metatarsiano | 1 |
Se encontró afectación de huesos contiguos en 11 niños (22%) y un caso de OA multifocal en huesos de miembros diferentes en un varón de 12 años en el que se aisló SAOS en el hemocultivo. Fueron diagnosticados de osteoartritis 5 niños (10%), 3 de ellos menores de 18 meses y con afectación en todos los casos de metáfisis intracapsulares de cadera, rodilla y codo, respectivamente.
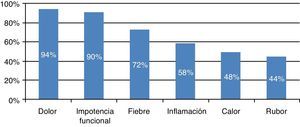
En 7 pacientes (14%) se detalló un traumatismo previo en la historia y en 5 (10%) antecedente de herida cutánea en el miembro afectado. Un 14% de los niños desarrolló una infección de los tejidos blandos circundantes al hueso afectado: 4 casos de piomiositis sin herida superficial y 3 de celulitis con herida cutánea. Las manifestaciones clínicas preponderantes al diagnóstico pueden verse en la figura 1.
La mediana de la duración de la fiebre antes de iniciarse el tratamiento antibiótico por vía i.v. fue de 3 días (rango: 0,5-7 días). La mediana del tiempo de demora entre el inicio clínico y el diagnóstico fue de 5 días (rango: 1-30). La estancia hospitalaria media fue de 11 días±4,7 DE.
Laboratorio y microbiologíaEn la tabla 2 se presentan algunos de los resultados analíticos más relevantes. En 40 pacientes (80%) se encontró elevación de algún reactante de fase aguda (PCR, procalcitonina o VSG) en el momento de su ingreso. No se demostró asociación estadísticamente significativa entre dicha elevación y el tiempo de evolución de las manifestaciones clínicas antes de iniciar el tratamiento (test de Mann-Whitney de 2 colas, p=0,43). La mediana de la PCR al alta fue de 2,5mg/l (rango: 0,2-16).
Resultados analíticos al ingreso
| N.° de determinaciones/total pacientes (%) | Media±DE | Mediana | Rango | |
| Leucocitos (ml) | 50/50 (100) | 13.619±4.792 | 12.400 | 4.440-28.900 |
| Leucocitosis>12.000/μl) | 28/50 (56) | |||
| PCR | 50/50 (100) | 54±60 | 33 | 0-245 |
| PCR>20 mg/l | 32/50 (64) | |||
| PCR>50 mg/l | 17/50 (34) | |||
| VSG | 13/50 (26) | 61±24 | 60 | 23-103 |
| VSG>20 mm/h | 13/50 (26) | |||
| Procalcitonina | 7/50 (14) | a | a | a |
| Procalcitonina>0,5 ng/ml | 2/50 (4) |
Se obtuvieron 13 cultivos positivos (26%): 10 hemocultivos, un cultivo de líquido articular y 2 cultivos de tejidos blandos adyacentes. El germen aislado con mayor frecuencia fue Streptococcus del grupo A (SGA). Las tablas 3 y 4 amplían datos sobre dichos cultivos. No se encontró ningún caso por SAOS, Haemophilus influenzae ni Kingella kingae (K. kingae).
Tipos de cultivos realizados
| Realizados/total muestra (%) | Positivos/total muestra (%) | Positivos/total cultivos específicos recogidos (%) | Bacteria aislada | OA multifocal con cultivo positivo/N.ototal OA multifocales | Osteoartritis con cultivo positivo/N.o total de osteoartritis | |
| Hemocultivo | 46/50 (92) | 10/50 (20) | 10/46 (22) | 5 SGA4S. aureus 1enterococo | 2/12 | 0/5 |
| Cultivo de LA | 5/50 (10) | 1/50 (2) | 1/5 (20) | SGA | 0/12 | 1/5 |
| Cultivo de tejidos blandos | 3/50 (6) | 2/50 (4) | 2/3 (67) | SGA | 0/12 | 0/5 |
LA: líquido articular; OA: osteomielitis aguda; S. aureus: Staphyloccocus aureus; SGA: Streptoccocus del grupo A.
Distribución de los cultivos por grupos de edad
| Número | Hemocultivos positivos/total hemocultivos positivos (%) | Bacterias aisladas hemocultivo | Hemocultivos negativos/hemocu ltivos recogidos (%) | Cultivos LA y tejidos blandos positivos/Total cultivos LA y tejidos blandos realizados | Bacterias aisladas en LA y cultivo tejidos blandos | |
| 0-6 meses | 0 | - | - | - | - | - |
| 6 meses-3 años | 36 | 5/10 (50) | 4SGA 1 enterococcus | 28/33 (85%) | 2/6 | 2SGA |
| 3 años-5 años | 5 | 1/10 (1) | 1SGA | 4/5 (80%) | 0/1 | - |
| > 5 años | 9 | 4/10 (40) | 4S. aureus | 4/8 (50%) | 1/1 | 1SGA |
| Total | 50 | 10/10 | 10 cultivos | 36/46 | 3/8 | 3cultivos |
LA: líquido articular; S. aureus: Staphyloccocus aureus; SGA: Streptoccocus del grupo A.
La radiografía simple, realizada a 41 pacientes con una mediana de 4 días una vez iniciada la sintomatología (rango: 1-29 días) mostró hallazgos patológicos en 11 de ellos (27%). Los casos con alteraciones óseas radiológicas presentaron clínica de ≥ 7 días de evolución. En 2 pacientes encontramos aumento de partes blandas sin afectación ósea radiológica en la placa simple hecha en las primeras 48 h de sintomatología.
La ecografía constató enfermedad osteoarticular en 9 niños de los 20 a los que se les indicó (45%), realizándose con una mediana de 4 días (rango: 1-14) desde el inicio de la sintomatología. Permitió diagnosticar piomiositis en 4 pacientes, uno de ellos con un absceso subperióstico, durante los primeros días de clínica.
La gammagrafía ósea con 99Tc, realizada en todos los pacientes una media de 7,7 días±6 DE tras el inicio de la clínica, permitió el diagnóstico de confirmación en todos ellos y además mostró afectación de huesos contiguos en 11 niños (22%) y un caso de OA multifocal en huesos de miembros diferentes.
En 2 casos dudosos se recurrió a la resonancia magnética (RM) durante el ingreso, permitiendo descartar la presencia de abscesos y diferenciar una OA de lo que, inicialmente, se pensó que era una fractura. Durante el seguimiento se hizo RM en aquellos casos con alteraciones radiológicas en otras pruebas de imagen y/o con evolución clínica tórpida. Concretamente se realizó a 2 pacientes asintomáticos pero con alteraciones gammagráficas persistentes en controles de rutina a los 4 y 7 meses, respectivamente, y a un tercer paciente con sintomatología inicial tórpida que precisó prolongar el tratamiento antibiótico. Estos 3 casos corresponden a pacientes ingresados antes de la aplicación del protocolo de 2006 y tuvieron un control normal en la revisión de los 12 meses.
TratamientoEl tratamiento se inició con antibioticoterapia i.v. empírica en función de la edad del paciente como se detalló en el apartado «Métodos». No se ha registrado ningún abandono del tratamiento antibiótico, a pesar de su duración y elevada dosificación.
El tratamiento i.v. se mantuvo una media de 10 días±3 DE, seguido de tratamiento v.o. durante un tiempo medio de 18 días±6 DE. Se requirió intervención quirúrgica en 3 pacientes dado que presentaron afectación articular de la cadera y/o piomiositis. Se realizó artrocentesis en los 5 pacientes con artritis asociada. No surgieron complicaciones derivadas de dichos actos quirúrgicos.
EvoluciónLa fiebre cedió en menos de 48 h una vez iniciado el tratamiento i.v. en el 92% de los pacientes. En 4 casos la fiebre persistió más de 48 h, 2 de ellos con celulitis asociada y 3 con cultivos positivos para SGA. La duración media de la fiebre tras la instauración del tratamiento antibiótico i.v. fue de 30 h±34 DE.
La tabla 5 muestra la comparación entre 2 grupos de pacientes: los incluidos en el estudio antes de la instauración del protocolo de 2006 (grupo A) y los casos posteriormente incorporados (grupo B). Cabe destacar que el grupo B, aún con una menor duración del tratamiento i.v. (diferencia estadísticamente significativa respecto al grupo A), no presentó una mayor duración de los síntomas tras iniciar el tratamiento antibiótico, ni de la fiebre, ni mayor PCR al alta.
Comparación de datos del grupo de pacientes incorporados antes de la instauración del protocolo de 2006 (grupo A) con el grupo de pacientes incorporados con posterioridad (grupo B)
| Grupo AMedia±DE | Grupo BMedia±DE | U de Mann-Whitney(test de 2 colas)p | |
| Edad (meses) | 41±42,7 | 35±40 | p=0,848 |
| Días de estancia hospitalaria | 12,4±4,9 | 9,3±3,2 | p=0,01 |
| Días de tratamiento antibiótico i.v. | 10,8±3,4 | 7,5±1,1 | p=0,000 |
| Días de tratamiento antibiótico v.o. | 17,7±7 | 20,1±4,2 | p=0,052 |
| PCR al alta | 4,2±4,7 | 3,5±3,2 | p=0,884 |
| Horas de fiebre tras iniciar el tratamiento antibiótico | 15,6±22,5 | 17±38 | p=0,959 |
| Días de persistencia de la sintomatología tras iniciar tratamiento antibiótico | 7,8±6,1 | 6,5±2,4 | p=0,822 |
En negrita los valores de p que alcanzan significación estadística.
El seguimiento ha sido variable, con una media de 63 meses±28 DE, sin que ningún niño presente secuelas en la revisión de los 12 meses.
DiscusiónLa OA requiere un alto grado de sospecha dado lo inespecífico de su sintomatología y la dificultad en la anamnesis y exploración del grupo etario al que afecta con mayor frecuencia3. Aspecto este especialmente relevante en nuestra muestra: la mayoría de pacientes son menores de 5 años con una mediana de edad al diagnóstico de 2 años frente a otros estudios con medianas de edad de 3 y 4 e, incluso, 9 años3,11,12.
Los resultados en cuanto a los huesos implicados fueron los esperables: predominio del fémur y la tibia, implicados en aproximadamente el 50% de los casos como en la literatura revisada4,5,10. Se diagnosticaron 5 pacientes con OA pélvica (10%), cifra similar a la de otras series (6-8%)5 y un caso de afectación costal, localización excepcional, como la esternal o la clavicular, que justifican menos del 2-3% en otras series4.
Entre los 8 y los 18 meses de vida, la vascularización epifisaria se independiza de la metafisaria, siendo infrecuentes los casos de osteoartritis en mayores de 18 meses, a excepción de las de localización intracapsular3,4,13,14. Los hallazgos en nuestra muestra se ajustan a esto: el 60% de los pacientes con osteoartritis eran menores de 18 meses y el 100% afectaba a articulaciones intracapsulares.
El dolor, la impotencia funcional y la fiebre fueron las manifestaciones clínicas principales al diagnóstico, como ocurre en otras series publicadas3,4,13. El tiempo de demora del diagnóstico es similar al de otros estudios2.
La radiografía simple muestra cambios óseos a partir de 7 días de evolución (osteopenia apreciable con pérdidas de mineralización ósea ≥ 30%)3,13. Esto explica el escaso número de radiografías patológicas descrito en esta y otras series (20-30%)3. No obstante, en las primeras 48 h pueden detectarse alteraciones en los tejidos blandos circundantes3, como ocurrió en 2 de nuestros pacientes.
La ecografía puede revelar cambios compatibles con OA en las primeras 48 h, por lo que numerosos autores la recomiendan al inicio15. Es muy útil para confirmar infección de los tejidos circundantes y la presencia de abscesos subperiósticos y para guiar su drenaje quirúrgico, así como la toma de muestras biológicas, minimizando las complicaciones. Algunos autores plantean las ecografías seriadas y el uso del Doppler color (detecta aumento del flujo vascular dentro o alrededor del periostio alterado) para el seguimiento de estos cuadros15,16.
La gammagrafía ósea con 99Tc puede detectar alteraciones óseas en las primeras 24-48 h de evolución, permite descubrir los casos multifocales y presenta una alta sensibilidad a la hora de detectar OA de forma precoz, siendo esta sensibilidad mayor y previa a la de otras técnicas (69 al 100%)13,17,18. Esto concuerda con los hallazgos de este estudio: todos los casos presentaron una gammagrafía positiva, incluso en aquellos en que se realizó en las primeras 48 h. Es una prueba poco específica que no diferencia OA de neoplasias o traumatismos, aunque combinada con la elevación de reactantes de fase aguda, suele permitir el diagnóstico3,13,14.
Por último, y siguiendo el protocolo implantado en 2006, se recurrió a la RM en los casos de probable OA pélvica, en los de evolución tórpida y en aquellos con sospecha de absceso. Es más específica que la gammagrafía (E>80%) pero menos sensible y no permite distinguir infección de infarto en niños con drepanocitosis, ni infección de lesión inflamatoria postraumática17,19. Aun así, resulta de enorme utilidad, sobre todo en hospitales que no dispongan de gammagrafía ósea y en casos bien localizados, por la calidad y detalle de las imágenes así conseguidas.
Entre los datos de laboratorio, la PCR y la VSG son los que se alteran con mayor frecuencia y, por lo tanto, constituyen los indicadores más fiables de infección osteoarticular. En la revisión de Bonhoeffer et al.11 encontramos PCR elevada en el 82% (algo menor en nuestro trabajo) y aumento de la VSG en el 100% (coincidente con lo obtenido en nuestra serie). En otra revisión más reciente y amplia de Pääkkönen et al.20, la elevación de la PCR al ingreso afecta al 95% de los pacientes y hay aumento de la VSG en el 94%, encontrando aún mejor sensibilidad en el uso combinado de ambas (sensibilidad del 98%). La leucocitosis, presente en el 56% de nuestros pacientes, no llega al 40% en otras series, siendo un pobre marcador de OA12. La procalcitonina (Pct) comienza a postularse como una herramienta fundamental para diferenciar los cuadros osteoarticulares infecciosos de los de etiología inflamatoria o traumática. La Pct permanece baja en los brotes de actividad inflamatoria y ascensos superiores a 0,5 ng/ml se correlacionan con la existencia de infección bacteriana (con adecuada especificidad y un buen valor predictivo positivo). Según el trabajo de Butbul-Aviel et al.21, la Pct ≥ 0,5 ng/ml presenta una especificidad del 100% y una sensibilidad del 58,3% para la OA.
En nuestra muestra existe un mayor número de cultivos positivos para SGA que para S. aureus, principal microorganismo causal en otras series22. El 100% de nuestros casos positivos para SGA corresponde a niños menores de 5 años, grupo etario en el que la literatura médica designa a esta bacteria como principal responsable11,12, y que constituye el 81% de los casos recogidos en nuestro estudio. Por el contrario, todos los mayores de 5 años con hemocultivos positivos lo son para S. aureus, acorde con lo observado en otras muestras11,12. A pesar de que todos los hemocultivos se procesaron durante un tiempo prolongado, no se obtuvo ninguna positividad para K. kingae. Es posible que no se identificara algún caso, pues es un patógeno de difícil crecimiento. Técnicas más sensibles como la PCR podrían haber contribuido a una mayor identificación23–25.
Nadie cuestiona la recogida de hemocultivo en todos los casos o de líquido articular (LA) en las osteoartritis. Pero no hay consenso respecto a la toma de tejido óseo y/o de partes blandas para cultivo. El problema radica en lo cruento de las técnicas de recogida de estas muestras biológicas, que quizás podrían reservarse a los casos más evolucionados al iniciarse el estudio y a los de progresión tórpida.
La evolución clínica de todos los pacientes fue excelente, con las 3 excepciones referidas anteriormente. La media de seguimiento, menor a la de otras series, podría explicar la relativa ausencia de complicaciones a medio-largo plazo respecto a la observada en otros estudios (10-37%)8. Otra limitación del estudio es su naturaleza retrospectiva en la recogida de datos de 2000 a 2006.
En cuanto al tratamiento, existe un amplio espectro de antibióticos empleados de manera empírica para cubrir inicialmente los principales patógenos causales de OA: cloxacilina, amoxicilina-clavulánico, cefalosporinas, etc.26,27. Siguiendo nuestro protocolo de 2006 se han administrado fundamentalmente cefalosporinas y cloxacilina, con excelentes resultados. Para su elección se consideró la edad, los antecedentes personales, los patógenos habituales y las infecciones concomitantes2,28. Se usaron dosis máximas de antibiótico para asegurar su llegada en concentraciones elevadas al hueso10. Destacamos la óptima respuesta y adherencia al tratamiento antibiótico, aun aplicando regímenes i.v. cortos y dosis orales elevadas, que tradicionalmente se asocian a mala tolerancia en niños7,29,30, supuesto que no se ha observado en nuestra serie.
Al comparar los grupos antes calificados como A y B (previos y posteriores a la implantación del protocolo) se observó que el grupo B, al que se aplican pautas cortas de tratamiento antibiótico i.v., no presentó diferencias estadísticamente significativas con respecto al grupo A que señalen un mayor riesgo de complicaciones.
Conclusiones derivadas del estudio:
Las nuevas terapias de transición rápida a la vía oral no suponen un mayor riesgo de complicaciones, al menos a corto plazo, con respecto a las antiguas de antibioticoterapia i.v. prolongada: no han tenido asociada una mayor duración de la sintomatología (dolor, impotencia funcional, fiebre, etc.) y no han supuesto un incremento de la PCR al alta. Además reportan el beneficio de una menor estancia hospitalaria. Se requieren nuevos estudios, principalmente en nuestro país, para conocer las consecuencias a más largo plazo de estas terapias cortas, qué antibióticos son los de primera elección y cuánto tiempo deben administrarse y cuáles son los marcadores más útiles para monitorizar la respuesta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.