Evaluar la eficacia y la seguridad de la vacuna adyuvada MF59 en la gripe pandémica en población infantil.
MétodosSe ha elaborado una revisión sistemática de la literatura médica (2005-2012). Para ello se realizó una búsqueda bibliográfica en fuentes de datos electrónicas como MedLine o Embase y búsqueda manual en revistas especializadas, utilizando descriptores MeSH y términos de búsqueda libre. Los criterios de inclusión fueron ensayos clínicos que incluyeran a niños vacunados frente a la gripe A/H1N1 con la vacuna adyuvada MF59 y se comparaba frente a otras dosis vacunales con o sin adyuvante MF59, registrando resultados de seguridad e inmunogenicidad. La calidad de los ensayos clínicos se evaluó utilizando los criterios del cuestionario CASPe.
ResultadosSe seleccionaron 4 ensayos clínicos de calidad moderada. Los efectos adversos locales y sistémicos fueron de carácter leve o moderado, sin diferencias entre los grupos vacunados. Los porcentajes de seroconversión y seroprotección alcanzados fueron superiores con las vacunas que utilizaron el adyuvante MF59. Los títulos de anticuerpos alcanzados también fueron mayores en las vacunas adyuvadas.
ConclusionesLa vacuna pandémica antigripal adyuvada con MF59 presenta un buen perfil de eficacia y seguridad. Los efectos adversos que puede ocasionar son comunes y se presentan de manera similar a los que acontecen al utilizar vacunas no adyuvadas.
To assess the efficacy and safety of MF59-adjuvanted pandemic influenza A/H1N1 vaccine in children.
MethodsA systematic review of the literature was performed after searching the MedLine and Embase electronic databases, and manual search in specialties journals, with MeSH terms and and free terms. Inclusion criteria were clinical trials with children vaccinated with MF59-adjuvanted influenza A/H1N1 vaccine, compared with other vaccines doses with/without MF59-adjuvanted. The immunogenicity and safety of the vaccine was recorded. The quality of the studies included was assessed by CASPe checklist.
ResultsFour clinical trials with moderate quality were selected. The local and systemic adverse effects were rare and mild, with no differences between groups. Seroconversion and seroprotection levels were higher with MF59-adjuvanted vaccines. Antibody titres were also higher with the adjuvant vaccines.
ConclusionsThe adjuvant vaccine has a good efficacy and safety profile. The adverse effects that may occur are common and appear similarly in both vaccination groups.
El virus de la gripe es una causa importante de infecciones respiratorias agudas en todo el mundo y está asociado a una morbilidad, riesgo de hospitalización y mortalidad anual significativa en niños1-3. Varias características de la biología del virus influenza permiten que nuevas cepas emerjan en la población humana, causando pandemias como la de 1918. En abril del 2009 se detectaron los primeros casos de gripe pandémica A/H1N1 en México y EE. UU., extendiéndose la enfermedad rápidamente a nivel mundial, de manera que el 11 de junio del 2009 la Organización Mundial de la Salud elevó el nivel de alerta de pandemia hasta la fase 61,2.
La gripe pandémica A/H1N1 del 2009 afectó predominantemente a niños y adolescentes, como sucede con la estacional1. La mayoría de los casos publicados de gripe A/H1N1, incluyendo casos severos, son individuos menores de 65 años (rango de edad 5-24 años), con series publicadas de casi la mitad de casos en niños menores de 18 años2.
A su vez, los datos disponibles señalan que la transmisión del virus de la gripe A/H1N1 en 2009ha sido más elevada en niños en edad escolar y en adultos jóvenes, al igual que sucede con la gripe estacional1,4.
La vacunación de los niños frente al virus de la gripe conlleva importantes beneficios para la salud, directamente a ellos e indirectamente a las personas de otras edades, ayudando al control de la difusión de la enfermedad, y son, por tanto, considerados un grupo prioritario para la vacunación contra la gripe pandémica. Diversos modelos sugieren que la inmunización en masa de los niños es esencial para el óptimo control de la enfermedad3,5.
No obstante, varios estudios revelan que la respuesta inmunitaria conferida por las vacunas convencionales no adyuvadas, como la vacuna trivalente inactivada frente a la gripe, no parece inducir eficazmente anticuerpos protectores en niños pequeños, consiguiendo solamente una eficacia modearada3,6,7. Sin embargo, la respuesta inmunitaria en niños pequeños puede ser mejorada con el uso de adyuvantes de emulsión de aceite en agua, como es el MF593.
El uso de MF59 en humanos fue aprobado en 1997. Estudios clínicos previos habían demostrado que la vacuna frente a la gripe estacional adyuvada con MF59 induce una mayor producción de anticuerpos, que las vacunas no adyuvadas, especialmente en aquellos sujetos con un título bajo de anticuerpos previo a la vacunación, como son poblaciones con mayor vulnerabilidad (ancianos, pacientes con afección crónica de base y niños pequeños)3,8. La alta inmunogenicidad de las vacunas adyuvadas con MF59 adquiere gran relevancia frente a la gripe en niños prematuros (mayor riesgo de complicaciones). Hasta la fecha no se ha encontrando en la literatura estudios comparativos de vacunas adyuvadas con MF59 frente a no adyuvadas en este grupo de pacientes9.
El uso de vacunas frente a la gripe, adyuvadas con MF59, tiene establecido un buen perfil de seguridad, apoyado por datos de seguridad clínica y poscomercialización en menores de 13 años, con más de 158 millones de dosis de vacuna adyuvada con MF593,8,10, mostrando los estudios que comparan vacunas frente a la gripe no adyuvadas con las que contienen MF59 un aumento mínimo de reactogenicidad local y sistémica de estas últimas10,11.
El objetivo fundamental de este trabajo ha sido evaluar la eficacia y la seguridad de la vacuna adyuvada MF59 en la gripe pandémica en población infantil.
Material y métodosSe ha desarrollado una revisión sistemática (2005-2012) para la evaluación de la eficacia y la seguridad de la vacuna antigripal pandémica A/H1N1 adyuvada MF59 en población infantil.
Bases de datosSe realizó una búsqueda inicial exploratoria de documentos, para la localización de revisiones sistemáticas, utilizando los descriptores «pandemic influenza A/H1N1» y «adjuvanted vaccine». Tras la búsqueda inicial, se elaboró una estrategia de búsqueda para desarrollar la búsqueda sistemática definitiva en las bases de datos MedLine, Embase, Cochrane Library, Center for Review Dissemination, Lilacs, ECRI y el registro de ensayos norteamericano ClinicalTrials.gov. También se realizó una búsqueda manual en revistas especializadas de Pediatría, Enfermedades Infecciosas y Vacunas.
Estrategia de búsquedaLa estrategia de búsqueda se confeccionó utilizando los descriptores «influenza A virus. H1N1 subtype», «influenza vaccines», «infant», «child», «efficacy» y «safety», y los términos de búsqueda libre «pandemic influenza», «pandemic H1N1», «pandemic vaccine», «adjuvant vaccine», «influenza A-H1N1», «Rexibel», «Fluvirin», «Focetria» y «MF59». No se realizó ninguna restricción de idioma. El periodo de búsqueda fue de enero del 2005 a junio del 2012.
Criterios de inclusión de estudiosDiseñoEnsayos clínicos aleatorizados.
PoblaciónEstudios que incluyeran población infantil menor de 18 años. Se excluyeron estudios con población adulta y estudios con animales de experimentación.
IntervenciónEstudios en el que se realizaba la vacunación frente a la gripe pandémica A/H1N1 con vacuna adyuvada MF59. Se excluyeron artículos que evaluaban vacunas adyuvadas en gripe estacional, prepandémica, combinación con otras vacunas, resultados in vitro y estudios que no mostrasen resultados de eficacia y seguridad.
ComparaciónEstudios que utilizaban la vacuna de gripe pandémica, adyuvada o no, y también estudios que comparasen la vacunación con diferentes formulaciones (dosis de carga antigénica y adyuvante).
Medidas de resultadoLos resultados a determinar en los estudios eran datos de eficacia (inmunogenicidad, seroconversión, seroprotección, títulos de anticuerpos) y seguridad (reacciones locales y sistémicas, muertes). Los criterios de seroconversión y seroprotección de las vacunas se definieron en los estudios según las pautas establecidas por el Center for Biologics Evaluation and Research Criteria12.
Selección de estudios y calidad metodológicaLas referencias localizadas eran analizadas por 2 investigadores de forma individual, mediante lectura de título y resumen, y si cumplían los criterios de inclusión, se leía el artículo a texto completo, valorando de nuevo su inclusión de manera independiente. En caso de discordancia, se consultó a un tercer investigador. La calidad de los estudios se evaluó mediante el cuestionario CASPe13 adaptado para ensayos clínicos.
Análisis estadísticoLa comprobación de los resultados descritos en los estudios de valores absolutos y porcentajes, así como la elaboración de tablas y los rangos de resultados se realizó mediante la utilización del programa estadístico SPSS (v18.0). Debido a la heterogeneidad de los estudios, los resultados de eficacia y seguridad no se pudieron sintetizar cuantitativamente mediante la elaboración de metaanálisis.
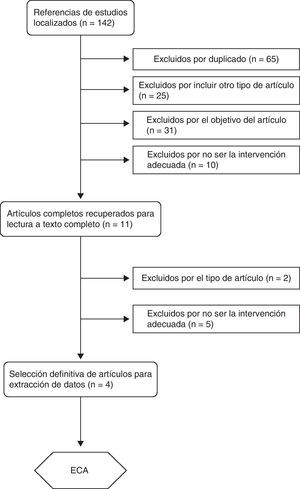
ResultadosLa búsqueda sistemática, encaminada a localizar artículos originales, proporcionó un total de 142 referencias. Tras eliminar duplicados (65) y lectura de título y abstract, se seleccionaron 11 artículos que cumplían los criterios de inclusión para lectura a texto completo. Al aplicar nuevamente los criterios de inclusión, se seleccionaron finalmente 4 ensayos clínicos aleatorizados para elaborar la revisión sistemática (fig. 1). Los motivos de exclusión de 7 estudios tras lecturas a texto completo fueron por no ser ensayos clínicos14,15, utilizar otro adyuvante16,17, intervención no adecuada18,19 o incluir mismos datos de otro estudio20.
Calidad de los estudiosLa calidad de los 4 estudios incluidos10,11,21,22 ha sido moderada (tabla 1). Todos los trabajos describieron el contexto, las fechas de reclutamiento y los criterios de elegibilidad de los pacientes. La aleatorización se realizó en todos los ensayos, pero solo uno21 explicó el método empleado. El enmascaramiento de la intervención se realizó en 2 estudios10,21 y fue simple ciego. Los grupos fueron comparables al comienzo y se trataron de forma similar a lo largo del estudio. El seguimiento de los pacientes y las pérdidas se explicaron en solo 210,21 de los ensayos. Dos estudios10,21 presentaron en los resultados el intervalo de confianza como los parámetros de significación estadística.
Calidad metodológica de los estudios incluidos según el listado de comprobación CASPe
| Escala CASPe | Validez de la intervención | Resultados | ||||||
| Autor, año | Definición clara pregunta | Aleatorización asignación pacientes | Seguimiento completo pacientes | Enmascaramiento | Grupos similares al comienzo | Tratamiento igual de los grupos | Magnitud intervención | Precisión estimación efecto |
| Nassim et al.21, 2012 | Sí | Sí | Sí | Simple | Sí | Sí | Sí | Sí |
| Block et al.10, 2012 | Sí | Sí | Sí | Simple | Sí | Sí | Sí | Sí |
| Arguedas et al.11, 2011 | Sí | Sí | nd | No | Sí | Sí | Sí | Sí |
| Yasuda et al.22, 2010 | Sí | Sí | nd | No | Sí | Sí | Sí | Sí |
nd: no descrito.
La tabla 2 describe las principales características de los estudios seleccionados en la revisión. Los 4 ensayos clínicos analizados incluyeron a un total de 2.526 niños, con edades comprendidas entre 6 meses y los 19 años. De ellos, 1.408 recibieron una dosis de la vacuna H1N1 adyuvada con MF59 y 1.118 recibieron la misma cepa vacunal sin adyuvante. Dos de los ensayos se realizaron en Estados Unidos, uno en Japón y otro en Costa Rica. Los 4 trabajos se realizaron entre agosto del 2009 y noviembre del 2010 (reclutamiento). La intervención consistió en todos los estudios en la vacunación con la vacuna H1N1 con dosis distintas (3,75; 7,5; 15, y 30μg) y con adyuvante MF59 al 50 y al 100%. Las cepas de gripe A/H1N1 utilizadas en la composición de la vacuna en todos los estudios fue la California/7/2009. En todos los trabajos, la intervención se comparó frente a la misma vacuna a distinta dosis sin adyuvante. Todos los estudios registraron resultados de inmunogenicidad y de efectos adversos locales y/o sistémicos en todos los grupos de sujetos.
Principales características de los cuatro estudios analizados
| Estudio, año | Población | País estudio | Cepas utilizadas | Tipos de vacunas | Resultados determinados |
| Edad media (rango) | Periodo de reclutamiento | Nombre (laboratorio) | |||
| Nassim et al.21, 2012 | 1.357 niños5,5 años (5,2-5,9 años) | Estados UnidosSep 09-nov 10 | A/H1N1 California/7/2009 | Vacuna H1N1 sin o con adyuvante MF59 a 8 diferentes dosisRexibel® (Novartis Vaccines) | SeroconversiónSeroprotecciónGMREfectos adversos |
| Block et al.10, 2012 | 654 niños21,3 meses(6-36 meses) | Estados Unidos, MéxicoOct 09-dic 10 | A/H1N1 California/7/2009 | Vacuna H1N1 sin o con adyuvante MF59 a 4 diferentes dosisRexibel® (Novartis Vaccines) | SeroconversiónSeroprotecciónGMREfectos adversos |
| Arguedas et al.11, 2011 | 392 niños9,3 años(3-17 años) | Costa Rica18-30 Ago 2009 | A/H1N1 California/7/2009 | Vacuna H1N1 sin o con adyuvante MF59 a 3 diferentes dosisFluvirin® (Novartis Vaccines) | SeroconversiónGMRGMTEfectos adversos |
| Yasuda et al.22, 2010 | 123 niños8,3 años(6 meses-19 años) | JapónOct-dic 2009 | A/H1N1 California/7/2009 | Vacuna H1N1 con MF59 a 2 diferentes dosisA/H1N1v virus (Colegio Médico NY) | SeroconversiónGMRGMTEfectos adversos |
En la tabla 3 se exponen los efectos adversos locales informados de los 4 estudios. Las reacciones locales fueron leves. El ensayo de Nassim et al.21 registraba el total de efectos adversos, oscilando entre el 31 y el 47% para las vacunas no adyuvadas frente al 39-67% para las vacunas adyuvadas con MF59.
Porcentajes de efectos adversos locales registrados en los diferentes grupos de vacunación
| Autor | Reacción | Vacunas adyuvadas | Vacunas no adyuvadas | ||
| Nassim et al.21 | CualquieraEritemaHinchazónInduración | 39-67%––– | 31-47%––– | Total (sin diferenciar)94-99%91-97%90-99% | |
| Block et al.10 | EquimosisEritemaHinchazónInduraciónDolor | 3,75 H1N1-50% MF590%1%3%5%30% | 7,5 H1N1-50%MF590%1%1%8%33% | 7,5 H1N10%0%5%4%26% | 15 H1N10%1%3%5%26% |
| Arguedas et al.11 | Edad 3-8 años:EritemaInduraciónHinchazónDolorEdad 9-17 años:EritemaInduraciónHinchazónDolor | 7,5 H1N1-100%MF592%0%5%38%2%2%2%60% | 15 H1N10%4%5%30%1%7%5%36% | 30 H1N10%2%6%31%0%2%5%44% | |
| Yasuda et al.22 | Edad 6-35 meses:EquimosisEritemaInduración HinchazónSensibilidadEdad 3-19 años:EquimosisEritemaInduración HinchazónDolor | 3,75 H1N1-50% MF5920%30%20%10%0%6%32%18%28%64% | 7,5 H1N1-100%MF599%27%0%0%18%8%41%24%35%82% | ||
En 3 estudios10,11,22 se detallaron los efectos adversos locales, siendo el dolor el síntoma registrado con más frecuencia en ambos grupos de vacunas y en cualquiera de las presentaciones, oscilando entre el 26 y el 44% para las vacunas no adyuvadas y el 30 y el 82% paras las formulaciones que utilizaban adyuvante. Otros síntomas que aparecieron con frecuencia fueron induración (2-5% no adyuvada frente al 0-20% adyuvada) e hinchazón (3-5% frente a 3-28%). La frecuencia de aparición de equimosis y eritema fue baja.
En los estudios que compararon distintos grupos de edad11,22, el incremento de reactogenicidad local con la vacuna adyuvada fue más evidente en los grupos de mayor edad en cada estudio.
La tabla 4 muestra los datos de los efectos adversos sistémicos. Nassim et al.21 notificó el total de reacciones sistémicas, que presentaba un rango 15-27% para las formulaciones que utilizaron vacuna no adyuvada frente al 20-39% para las vacunas adyuvadas con MF59.
Efectos adversos sistémicos (%) notificados en los diferentes grupos de vacunación
| Autor | Reacción | Vacunas adyuvadas | Vacunas no adyuvadas | ||
| Nassim et al.21 | CualquieraDolor cabezaFatigaMialgiaFiebre | 20-39%–––– | 15-27%–––– | Total (sin diferenciar)5-22%4-17%2-16%4-10% | |
| Block et al.10 | SomnolenciaDiarreaVómitoIrritabilidadAlteración apetitoLloro persistenteFiebre | 3,75 H1N1-50% MF5922%19%8%24%13%21%3% | 7,5 H1N1-50%MF5923%22%7%28%12%21%5% | 7,5 H1N117%16%6%23%9%22%3% | 15 H1N116%15%5%25%10%20%4% |
| Arguedas et al.11 | Edad 3-8 años:Dolor cabezaFatigaMialgiaArtralgiaEscalofríosNáuseasVómitosDiarreaEdad 9-17 años:Dolor cabezaFatigaMialgiaArtralgiaEscalofríosNauseasVómitosDiarrea | 7,5 H1N1-100%MF5913%11%7%0%5%9%0%0%32%17%21%4%2%6%0%4% | 15 H1N114%10%10%2%1%8%1%0%34%15%18%2%2%8%1%0% | 30 H1N117%9%11%4%4%7%4%2%14%19%19%0%2%9%0%0% | |
| Yasuda et al.22 | Edad 6-35 meses:SomnolenciaDiarreaVómitoIrritabilidadAlteración apetitoTemblorLloro persistenteFiebreEdad 3-19 añosEscalofríosMalestar generalMialgiaArtralgiaDolor de cabezaSudoraciónFatigaNáuseasFiebre | 3,75 H1N1-50% MF5930%0%10%10%20%0%10%10%4%14%8%2%22%2%16%2%8% | 7,5 H1N1-100%MF599%9%9%0%0%0%0%18%8%16%18%8%22%2%22%8%10% | ||
El dolor de cabeza fue el efecto sistémico más prevalente en ambos grupos de vacunas y en cualquiera de las presentaciones (13-22% con vacuna adyuvada frente al 14-34% con la vacuna no adyuvada). Otra reacción frecuente fue la somnolencia, con porcentajes del 30% con la vacuna adyuvada al 16% con la no adyuvada y la dosis antigénica mayor. En menor proporción se registraron vómitos (0-10% de la vacuna adyuvada frente al 1-5% con la no adyuvada) y escalofríos (1% con la vacuna no adyuvada con una presentación de 15 en niños de 3 a 8 años, frente al 8% con la vacuna adyuvada de dosis de 7,5 en niños de 3 a 19 años).
Los efectos adversos graves fueron escasos, registrándose una convulsión febril en el ensayo de Nassim et al.21, en el trabajo de Block et al.10 3 (ninguno de ellos fue relacionado con la vacuna), en el estudio de Arguedas et al. un caso de apendicitis (no se relacionó con la administración de la vacuna) y en el ensayo de Yasuda et al.22 5 (4 casos de gripes y una fractura de húmero, ninguno relacionado con la vacuna). No se registraron fallecimientos en ninguno de los estudios.
Resultados de eficacia de los estudios incluidosSeroconversiónLa mayoría de los estudios exponen los resultados para 3, 4 y 6 semanas tras la administración de la vacuna (tabla 5). Las formulaciones administradas sin adyuvante (7,5, 15 y 30μg de H1N1) presentaron porcentajes de seroconversión a las 3 semanas que oscilaron entre el 32 y el 46% para 7,5μg, el 44 y el 88% para dosis de 15μg, y el 60 y el 94% para dosis de 30μg. Estos porcentajes subieron a las 4 semanas al 78, el 92 y el 94%, respectivamente, y descendieron ligeramente a las 6 semanas.
Resultados de porcentajes de seroconversión según las diferentes formulaciones vacunales utilizadas
| Autor | Grupos | Semanas determinación | ||
| 3 | 4 | 6 | ||
| Nassim et al.21 | 3,75 H1N1-50% MF597,5 H1N17,5 H1N1-50%MF597,5 H1N1-100%MF5915 H1N115 H1N1-50%MF5915 H1N1-100%MF5930 H1N1 | 82% (74-87)46% (38-54)78% (70-84)88% (82-93)58% (50-66)82% (74-87)92% (86-95)60% (52-68) | 99% (95-100)78% (70-84)99% (95-100)99% (95-100)87% (81-92)100% (98-100)100% (97-100)94% (89-97) | 98% (94-100)77% (70-83)97% (93-99)97% (94-99)84% (77-89)99% (95-100)99% (97-100)88% (82-93) |
| Block et al.10 | 3,75 H1N1-50% MF597,5 H1N17,5 H1N1-50%MF5915 H1N1 | 74% (65-81)32% (24-41)80% (72-87)44% (35-53) | –––– | 98% (93-100)68% (59-76)98% (94-100)76% (68-93) |
| Arguedas et al.11 | 3 a 8 años 1: 7,5 H1N1-100%MF592: 15 H1N13: 30 H1N19 a 17 años 1: 7,5 H1N1-100%MF592: 15 H1N13: 30 H1N1 | 91% (79-88)69% (58-79)75% (60-86)87% (73-95)88% (79-95)94% (84-99) | 98% (88-100)92% (83-97)94% (83-99)89% (76-96)91% (82-96)94% (84-99) | 96% (85-99)84% (74-91)92% (80-98)84% (71-94)91% (82-94)92% (81-98) |
| Yasuda et al.22 | 3,75 H1N1-50% MF597,5 H1N1-100%MF59 | 56% (42-69)78% (65-88) | –– | 100% (94-100)100% (94-100) |
Las formulaciones administradas con adyuvante MF59 a diferentes porcentajes (50% y 100%) mostraron los siguientes resultados: 3 estudios10,21,22 emplearon la formulación 3,75μg H1N1-50%MF59, obteniendo una seroconversión a las 3 semanas que osciló entre el 56 y el 82%, aumentando a las 4 semanas al 99%21. Dos estudios10,21 utilizaron la dosis 7,5μg H1N1-50%MF59, obteniendo porcentajes a las 3 semanas del 78-80%, aumentando a las 4 semanas al 99%21. En 3 ensayos11,21,22 usaron también la formulación 7,5μg H1N1-100%MF59, obteniendo porcentajes en 3 semanas del 78-91%. Los porcentajes se elevaron en la cuarta semana al 89-99%. Un solo trabajo21 utilizó dosis de 15μg H1N1 adyuvada al 50 y 100%. A las 3 semanas los resultados fueron del 82 y el 92%, respectivamente, ascendiendo a la cuarta semana en ambos casos al 100%.
SeroprotecciónLos resultados de seroprotección se notificaron en 3 estudios10,21,22 a las 3 semanas (tabla 6). Las formulaciones administradas sin adyuvante (7,5, 15 y 30μg de H1N1) presentaron porcentajes del 37-40, el 50-60 y el 66%, respectivamente. Las formulaciones administradas con adyuvante MF59 mostraron porcentajes para 3,75μg H1N1-50%MF59 del 56-84%, para 7,5μg H1N1-50%MF59 del 81-86% y para 7,5μg H1N1-100%MF59 del 78-91%. Los resultados que se registraron a las 6 semanas10,22 notificaron una seroprotección del 100% para las vacunas adyuvadas.
Resultados de porcentaje de seroprotección según las diferentes formulaciones vacunales utilizadas
| Autor | Grupos | Semanas determinación | |
| 3 | 6 | ||
| Nassim et al.21 | 3,75 H1N1-50% MF597,5 H1N17,5 H1N1-50%MF597,5 H1N1-100%MF5915 H1N115 H1N1-50%MF5915 H1N1-100%MF5930 H1N1 | 84%40%81%91%60%82%94%66% | –––––––– |
| Block et al.10 | 3,75 H1N1-50% MF597,5 H1N17,5 H1N1-50%MF5915 H1N1 | 79 (71-86)%37 (29-46)%86 (79-91)%50 (41-59)% | 100 (97-100)%70 (61-78)%100 (92-100)%81 (74-88)% |
| Yasuda et al.22 | 3,75 H1N1-50% MF597,5 H1N1-100%MF59 | 56 (42-69)%78 (65-88)% | 100 (94-100)%100 (94-100)% |
Las formulaciones administradas sin adyuvante (7,5, 15 y 30μg de H1N1) registraron rangos de títulos a las 3 semanas de 2,8-3,7 para 7,5μg, 3,4-51 para 15μg y 6,7-66 para 30μg. Los rangos ascendieron a las 6 semanas a 11-16, 14-46 y 24-59, respectivamente. Las formulaciones administradas con adyuvante MF59 mostraron rangos de títulos para 3,75μg H1N1-50%MF59 de 6,4-13, para 7,5μg H1N1-50%MF59 de 10 y para 7,5μg H1N1-100%MF59 de 13-42. A las 6 semanas los rangos de títulos fueron de 62-68, 55-67 y 78-130, respectivamente (tabla 7).
Resultados de proporción geométrica de títulos según las diferentes formulaciones vacunales utilizadas
| Autor | Grupos | Semanas determinación | ||
| 3 | 4 | 6 | ||
| Nassim et al.21 | 3,75 H1N1-50% MF597,5 H1N17,5 H1N1-50%MF597,5 H1N1-100%MF5915 H1N115 H1N1-50%MF5915 H1N1-100%MF5930 H1N1 | 13 (9,6-17)3,7 (2,8-4,9)10 (7,7-13)20 (15-26)5,4 (4,1-7,1)14 (11-19)23 (17-30)6,75 (5,1-8,9) | 89 (69-115)19 (15-25)79 (61-101)120 (93-154)24 (19-31)102 (79-132)159 (123-205)32 (25-42) | 66 (52-84)16 (12-20)55 (44-70)78 (62-99)19 (15-24)70 (55-88)112 (88-141)24 (19-31) |
| Block et al.10 | 3,75 H1N1-50% MF597,5 H1N17,5 H1N1-50%MF5915 H1N1 | 8,0 (5,9-11)2,8 (2,1-3,8)10 (7,4-13)3,4 (2,6-4,6) | –––– | 62 (45-85)11 (8-15)67 (49-92)14 (10-19) |
| Arguedas et al.11 | 3 a 8años 1: 7,5 H1N1-100%MF592: 15 H1N13: 30 H1N19 a 17 años 1: 7,5 H1N1-100%MF592: 15 H1N13: 30 H1N1 | 31 (19-50)12 (8,4-18)13 (8,4-22)42 (24-74)51 (33-79)66 (39-111) | –––––– | 130 (74-192)22 (15-32)38 (24-60)44 (25-77)46 (30-72)59 (35-100) |
| Yasuda et al.22 | 3,75 H1N1-50% MF597,5 H1N1-100%MF59 | 6,4 (4,1-10)13 (,7-21) | –– | 68 (52-88)96 (75-123) |
Aunque la mayoría de los niños infectados por el virus de la gripe pandémica A/H1N1 presentan cuadros clínicos leves (fiebre, tos, rinorrea, dolor de garganta y síntomas gastrointestinales, siendo la presencia de estos últimos más frecuentes que en adultos), se han notificado casos de enfermedad severa, ya que las complicaciones de la enfermedad pueden ser graves, desde fracaso respiratorio hasta complicaciones neurológicas, shock e incluso la muerte2.
Con la finalidad de actualizar el conocimiento para evitar estas complicaciones que la enfermedad pueda ocasionar en futuras pandemias de gripe, esta revisión sistemática ha sintetizado la información existente de varios ensayos clínicos aleatorizados sobre la eficacia y la seguridad de la vacuna adyuvada-MF59 en niños frente a la gripe pandémica estacional.
Los datos registrados en los estudios presentan a la vacuna pandémica adyuvada con MF59 como segura, siendo el riesgo de reacciones locales y sistémicas similares o levemente superiores a las de las vacunas antigripales pandémicas no adyuvadas. La vacuna tiene un buen perfil de seguridad, ocasionando algunas reacciones locales como dolor local, induración de la zona y calor, y algunas reacciones sistémicas, poco frecuentes, como escalofríos, fiebre y mialgia. Todas ellas fueron registradas como de carácter leve-moderado y de resolución espontánea.
En relación con la inmunogenicidad, los niveles de seroconversión y seroprotección alcanzados fueron aceptables con las vacunas no adyuvadas a las 3 semanas de estudio y se elevaron o mantuvieron constante las 4 o 6 semanas. Con las vacunas adyuvadas con MF59, los niveles fueron superiores a la no adyuvada en todas las formulaciones y alcanzaron niveles superiores al 90% a las 4 o 6 semanas, lo que manifiesta que el adyuvante ejerce un papel fundamental para alcanzar niveles adecuados de protección, sin la necesidad de aumentar la dosis antigénica de cepa vacunal.
Los ensayos clínicos incluidos en este trabajo han sido clasificados como de calidad moderada, ya que están limitados por una serie de factores y presentan algunos problemas metodológicos tanto de validez interna como externa. Algunas de estas limitaciones han sido la selección de pacientes en los estudios, pues no siempre los niños tenían las mismas características ni rangos de edades, la falta de cegamiento en los estudios y no explicación de pérdidas acontecidas durante la investigación en varios ensayos. En la interpretación de resultados se debe tener en cuenta la posible heterogeneidad provocada por las diferentes dosis de vacunas y adyuvantes utilizadas, ya que según el estudio no siempre se han usado las mismas cargas antigénicas de cepas vacunales, ni porcentajes de adyuvante utilizado, y las medidas de resultado se han registrado a diferentes intervalos de tiempo.
Como se ha descrito en otro trabajo previo23, la vacuna adyuvada induce más efectos adversos que la vacuna no adyuvada, pero estas reacciones son normalmente de carácter leve o moderado, transitorias y no suelen requerir de ninguna intervención médica. Nuestros resultados coinciden con otros estudios previos que han evaluado vacunas adyuvadas con MF59 en la gripe estacional y/o pandémica, otros adyuvantes o intervenciones, pacientes adultos y niños, de manera más generalizada7,8,23,24. Un reciente metanálisis de Manzoli et al.25 analiza las vacunas antigripales estacionales y pandémicas en todas las edades, pero nuestro trabajo es la única revisión sistemática que evalúa ensayos clínicos aleatorizados que utilizan el adyuvante MF59 para la gripe pandémica en población infantil.
La elaboración de este trabajo de revisión ha presentado una serie de limitaciones. En primer lugar, se ha visto influenciada por el número de estudios y la heterogeneidad de estos, que abordan la pregunta de investigación planteada al principio de diferente manera. Otra limitación de esta revisión es el potencial sesgo de publicación, ya que se excluyeron trabajos aún no publicados, literatura gris e informes de la industria. Este sesgo se ha tratado de evitar al extender la búsqueda en varias bases de datos y realizarla sin restricción de idiomas. Con el fin de evitar un posible sesgo en la aplicación de los criterios de selección, estos se definieron a priori. Así, se intentaron reducir las posibles fuentes de heterogeneidad mediante la aplicación estricta de los criterios de inclusión de pacientes, seleccionando únicamente estudios con niños y que la vacunación fuera con la vacuna A/H1N1 adyuvada-MF59 para la gripe pandémica, excluyendo gripe prepandémica y gripe estacional.
La aplicación en la práctica clínica de la vacunación con esta vacuna adyuvada-MF59, según los resultados discutidos, estaría justificada, ya que ha demostrado tener un buen perfil de seguridad y, como se ha descrito en otros estudios, es altamente inmunógena siendo este un hecho fundamental por las características inmunológicas específicas de la población pediátrica9.
Por último, se evidencia la necesidad de realizar futuros ensayos clínicos para evaluar a niños que, por sus condiciones inmunológicas deficitarias (prematuros, inmunodeprimidos), podrían beneficiarse sustancialmente de la mayor inmunogenicidad de las vacunas antigripales pandémicas adyuvadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.