La citrulina es un aminoácido producido exclusivamente por los enterocitos. Se estudió su valor como biomarcador de masa enterocitaria funcionante en pacientes con fracaso intestinal por síndrome de intestino corto (SIC) y su relación con la tolerancia digestiva.
Material y métodosSe determinó la concentración plasmática de citrulina por cromatografía líquida de alta resolución (normal>15μmol/L) en 57 pacientes (edad 0,,5-18 años) con fracaso intestinal en distintas situaciones evolutivas. Fueron excluidos pacientes deshidratados, con insuficiencia renal u otras situaciones que pudieran alterar los resultados. Se clasificaron en grupos: i: SIC extremo dependientes de nutrición parenteral (NP); ii: SIC en alimentación mixta enteral-parenteral; iii: SIC adaptados y autónomos sin NP; iv: trasplantados y autónomos sin NP.
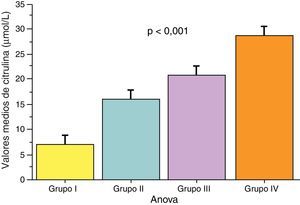
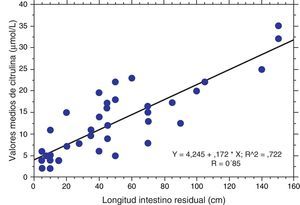
ResultadosLos valores medios ±DE de citrulina plasmática fueron: grupo i (n=15): 7,1±4,1; grupo ii (n=11): 15,8±8,9; grupo iii (n=13): 20,6±7,5; grupo iv (n=25): 28,8±10,1. Los valores resultaron inferiores en el grupo i comparados con los grupos ii-iii-iv (p<0,001) y en el grupo ii comparados con los grupos iii-iv (p<0,001). Se observó una fuerte correlación entre la citrulinemia y la longitud del intestino delgado remanente (r=0,85; p<0,001). En el grupo iv la citrulina descendió >50% coincidiendo con rechazo moderado-severo en 3 pacientes y con enteritis viral en un paciente.
Conclusiones1. La citrulina plasmática puede ser un biomarcador sensible y específico del intestino funcional residual. 2. Se relaciona con la tolerancia a la alimentación enteral. 3. Debe confirmarse su valor pronóstico en el proceso de adaptación intestinal y como marcador de rechazo en pacientes trasplantados.
Citrulline is a non-essential amino acid produced solely in the enterocyte. The aim of this study was to analyse the role of serum citrulline as a biomarker of enterocyte load in children with intestinal failure due to short bowel syndrome (SBS) and its relationship to enteral adaptation.
Material and methodsPlasma citrulline concentration was determined by chromatography (normal value>15μmol/L) in 57 patients (age 0.5-18 years) admitted to our Intestinal Rehabilitation Unit with intestinal failure. Those who were dehydrated, with renal insufficiency, or other conditions able to modify the results were excluded. Patients were divided into 4 groups: group i: SBS totally dependent on parenteral nutrition (PN); group ii: SBS under mixed enteral-parenteral nutrition; group iii: IF weaned from PN after a rehabilitation period; group iv: small bowel transplanted patients weaned from PN and taking a normal diet.
ResultsThe mean±SD plasma citrulline values were: group i (n=15): 7.1±4.1; group ii (n=11): 15.8±8.9; group iii (n=13): 20.6±7.5; group iv (n=25): 28.8±10.1. Values were significantly lower in group i in comparison with groups ii-iii-iv (P<.001), and in group ii in comparison with groups iii-iv (P<.001). A low citrulline was associated with remnant small bowel length (P<.001, r=0.85). In group iv citrulline levels decreased >50% in 3 patients who developed moderate-severe rejection, and in one patient who developed viral enteritis.
Conclusions1. Plasma citrulline could be a sensitive and specific biomarker of the residual functional enterocyte load. 2. It is related to enteral feeding tolerance. 3. Its prognostic value in the process of intestinal adaptation and as a rejection marker in small bowel transplanted patients needs to be confirmed.
El fracaso intestinal (FI) se define como la reducción de la masa intestinal funcional por debajo del mínimo necesario para mantener las necesidades fisiológicas de absorción de fluidos y nutrientes, precisando nutrición parenteral (NP) para la supervivencia1. La causa más frecuente de FI permanente en niños y adultos es el síndrome de intestino corto (SIC)2,3. La adaptación del intestino residual es el proceso que trata de restablecer la absorción intestinal total de micro y macronutrientes a aquella previa a la resección intestinal y que determina si el FI va a ser permanente o transitorio4. El tiempo máximo de adaptación intestinal estimado en adultos es de 2 años, pero en niños puede durar hasta más de 3 años2,5.
Al igual que en el fracaso renal o hepático, en los que existen marcadores de la función como la creatinina o las transaminasas, en el caso del intestino se ha buscado algún biomarcador en suero de la masa enterocitaria funcionante que pueda facilitar el diagnóstico y el pronóstico en los pacientes con FI6,7. Se han propuesto diferentes biomarcadores relacionados con el metabolismo enterocitario, siendo la citrulina plasmática uno de los más recientes, de fácil determinación y con alta reproductibilidad8.
La citrulina es un aminoácido producido exclusivamente por los enterocitos, que no se incorpora a las proteínas9. Se sintetiza a partir de la glutamina, se libera desde el enterocito hacia la circulación y se metaboliza después en arginina gracias al riñón10. Sus niveles plasmáticos son independientes del estado nutricional o de la hepatopatía11, y en situaciones de inflamación se produce un leve descenso no significativo8. Por otro lado, sí es importante considerar que en la insuficiencia renal con aclaramiento de creatinina inferior a 50ml/min aumentan los niveles de forma significativa12. Se han realizado varios estudios con el objetivo de determinar si la citrulina plasmática podría diferenciar entre pacientes con SIC y FI transitorio con posibilidades de alcanzar la autonomía digestiva y el destete de la NP, y pacientes con SIC y FI permanente, que probablemente precisen trasplante intestinal13–15, pero existen algunas controversias al respecto16–18.
Por otro lado, pese a los avances producidos en el trasplante intestinal a lo largo de las últimas décadas, el rechazo agudo sigue siendo la complicación más común y la causa más frecuente de pérdida del injerto19. Su diagnóstico suele ser demasiado tardío, ya que las herramientas diagnósticas disponibles hasta el momento son la combinación de la evolución clínica con el estudio endoscópico y la histología de las biopsias, método invasivo y con potenciales complicaciones graves20. Se ha propuesto la determinación de citrulina plasmática como prueba de cribado para detectar precozmente la disfunción del injerto, ya que en esta situación se produce un descenso significativo de su valor20–24.
Pacientes y métodosPacientesDesde octubre de 2010 hasta marzo de 2012 se ha determinado de forma rutinaria la concentración plasmática de citrulina en los pacientes con FI secundario a SIC y en los trasplantados intestinales pertenecientes a la Unidad de Rehabilitación Intestinal del Hospital Infantil La Paz. Se hicieron determinaciones seriadas en distintas situaciones evolutivas, clasificando los pacientes en 4 grupos:
- I:
SIC en dependencia absoluta de NP.
- II:
SIC en alimentación mixta enteral-parenteral en el periodo de adaptación intestinal.
- III:
SIC con FI transitorio que han alcanzado la adaptación intestinal y la autonomía digestiva (alimentación exclusiva por vía digestiva).
- IV:
Portadores de trasplante intestinal más de 3 meses y autónomos.
Se excluyeron del estudio a los pacientes en situaciones que pudieran alterar los resultados como insuficiencia renal moderada-grave o deshidratación. La composición de la nutrición parenteral y enteral fue similar en todos los pacientes, sin empleo de suplementos o fórmulas enriquecidas de glutamina. La inmunosupresión de los pacientes trasplantados se ha realizado atendiendo al protocolo de la Unidad.
Determinación de la citrulina plasmáticaSe utilizó una muestra de sangre que se obtuvo aprovechando el estudio analítico de rutina en las visitas programadas para el seguimiento cada 3 meses o durante los ingresos hospitalarios por complicaciones o disfunción del injerto en trasplantados. Se realizó la cuantificación de citrulina plasmática tras 6h de ayuno enteral mediante la técnica de cromatografía líquida de alta resolución de intercambio iónico, que es el método de referencia25. Los valores normales validados en esta Unidad para pacientes pediátricos son entre 15 y 40μmol/L.
Estimación de la longitud del intestino residualEn los grupos i, ii y iii se basó en los hallazgos encontrados durante el acto quirúrgico, completando el estudio con pruebas radiológicas baritadas.
Análisis estadísticoPara el análisis estadístico de los resultados se empleó el programa Statview. Los valores cuantitativos se expresaron en forma de media±desviación estándar o mediana y rango. Las concentraciones plasmáticas de citrulina se compararon entre los distintos grupos mediante el análisis de la varianza para muestras independientes. Con el fin de encontrar una relación lineal entre los parámetros, se empleó la regresión lineal para calcular el coeficiente de correlación de Pearson. Los resultados se mostraron mediante gráficos de dispersión. El nivel de significación estadística se definió en p<0,05.
ResultadosMasa intestinal funcional y niveles de citrulinaCincuenta y siete pacientes fueron tratados por FI: 32 varones y 25 mujeres. Quince pertenecían al grupo i, 11 al grupo ii, 13 al grupo iii y 25 al grupo iv. Ocho se incluyeron en 2 grupos diferentes, ya que la medición de la citrulina se realizó en momentos evolutivos distintos. Cuatro consiguieron la autonomía digestiva y pasaron del grupo ii al iii, y 4 recibieron trasplante, 3 del grupo i y uno del grupo ii, pasando al grupo iv y obteniendo muestras de citrulina antes y después del trasplante.
La causa de SIC fue: enterocolitis necrotizante en 11, vólvulo en 10, isquemia intestinal tras cirugía abdominal en 7, gastrosquisis en 6, atresia intestinal aislada en 4 y enterectomía tras un trasplante intestinal previo en 4. En el grupo de trasplantados se incluyeron otras causas de FI como seudoobstrucción intestinal en 7 pacientes, enfermedad de Hirschsprung extensa en 4, displasia intestinal en 3 y tumor desmoide en uno. La instauración del FI se produjo durante el periodo neonatal en el 37%. La mediana de edad en la primera determinación fue de 36 meses (4 meses-19 años); la mediana de edad al final del seguimiento de 49 meses (8 meses-22 años). Se realizaron un total de 146 determinaciones de citrulina plasmática: 33 del grupo i, 40 del grupo ii, 26 del grupo iii y 47 del grupo iv. Se descartaron 8 determinaciones: 4 en pacientes en insuficiencia renal, 2 en trasplantados en el periodo de reperfusión del injerto y 2 por fallo de la técnica. Cada paciente se sometió a una media de 3 determinaciones (rango 1-7). Los valores medios de citrulina en plasma para cada grupo fueron: 7,1±4,1; 15,8±8,9; 20,6±7,5 y 28,8±10,1μmol/L, respectivamente (fig. 1).
Grupo I (n=15): es el grupo de menor edad con una mediana de edad en la primera determinación de 8 meses (rango 4-104). Once pacientes se consideraron anentéricos, 7 tras resecciones masivas y 4 tras enterectomía postrasplante por rechazo. La mediana de citrulina en estos pacientes fue aun menor que en el grupo i global (6μmol/L). De ellos, 3 fallecieron en lista de trasplante, 6 están en lista actualmente y otros 2 han sido ya trasplantados con éxito, pasando al grupo iv. De los 4 niños con intestino residual (mediana de citrulina 9μmol/L), 3 están en lista de trasplante y uno ha recibido un trasplante multivisceral con éxito.
Grupo II (n=11): la mediana de edad en la primera determinación fue de 3,1 años (rango 7 meses-13 años). Dos pacientes presentaron cifras normales de citrulina (≥15μmol/L) al inicio del estudio, mientras que evolutivamente fueron 6. A lo largo del seguimiento 4 pacientes consiguieron la autonomía digestiva pasando al grupo iii y un paciente con una hepatopatía avanzada recibió un trasplante multivisceral. Los 6 restantes permanecen estables con nutrición parenteral ciclada domiciliaria.
Grupo III (n=13): la mediana de edad en la primera determinación fue de 20 meses (rango 4 meses-5,5 años). Todos los pacientes consiguieron autonomía digestiva gracias a un proceso de rehabilitación intestinal multidisciplinar, siendo la citrulina normal en todos ellos al final del estudio.
Grupo IV (n=25): recibieron un trasplante de intestino aislado 6 pacientes, hepatointestinal 8 y multivisceral 11. Veinte trasplantes fueron primarios y 5 retrasplantes. Fue el grupo de mayor edad, con una mediana en la primera determinación de 7,2 años (rango 5 meses -19 años). Durante este estudio una paciente falleció por una histoplasmosis y 2 pacientes perdieron el injerto por rechazo agudo severo, precisando trasplantectomía y pasando nuevamente a la lista de trasplante. En 4 pacientes se realizaron determinaciones antes y después de evidenciarse insuficiencia renal moderada-severa secundaria a la medicación inmunosupresora y en todos ellos prácticamente se duplicaban los niveles de citrulina (de 25 a 44, de 30 a 90, de 17 a 125 y de 14 a 30, respectivamente). En los 4 pacientes en los que se obtuvo una determinación antes del trasplante se objetivó un aumento significativo a partir de los 3 meses postrasplante (de 4 a 25, de 6 a 21, de 5 a 41 y de 10 a 32, respectivamente). La citrulina disminuyó >50% coincidiendo con rechazo moderado-severo en 3 pacientes y enteritis por rotavirus en uno.
Longitud intestinal y niveles de citrulinaEn el grupo i predominaron los pacientes con SIC secundario a resección intestinal masiva. La máxima longitud intestinal fue de 50cm en un paciente, aunque llegó a la Unidad en situación de dependencia absoluta de NP. En el grupo ii la longitud intestinal osciló entre 35 y 90cm. En 2 pacientes se realizó una enteroplastia seriada a lo largo del seguimiento, elongando de 85 a 165 y de 15 a 97cm el intestino residual respectivamente, pero no se disponen de determinaciones antes y después de la intervención. En el grupo iii, la longitud fue más variada, osciló entre 30 y 150cm de intestino. En el grupo iv consideramos la longitud intestinal de todos los pacientes trasplantados como normal, ya que ninguno precisó resección quirúrgica intra ni postrasplante. La correlación entre los niveles de citrulina y la longitud intestinal residual de los pacientes de los grupos i, ii y iii se muestra en la figura 2.
Análisis estadísticoLos valores resultaron significativamente inferiores en el grupo i comparados con los grupos ii-iii-iv (p<0,001), en el grupo ii comparados con los grupos iii-iv (p<0,001) y en el grupo iii comparado con el iv (p<0,001) (fig. 1). Se observó una fuerte correlación entre el nivel de citrulina plasmática y la longitud del intestino delgado residual (r=0,85; p<0,001) (fig. 2).
DiscusiónEl SIC es la causa principal de NP prolongada y FI permanente en niños2,3. La longitud intestinal es el principal factor predictivo para conseguir la autonomía digestiva en adultos26, pero en niños la correlación es mucho menor, por presentar mayor potencial de adaptación. Esto lo demuestra que niños que desarrollan SIC como complicación de su prematuridad con resecciones largas consiguen la autonomía digestiva27,28.
El estudio del área de absorción intestinal y de su capacidad continúa siendo un reto para las unidades de rehabilitación que tratan a niños con FI. El desarrollo de una prueba pronóstica o biomarcador que pueda relacionar la cantidad y la función intestinal y que pueda predecir el destete de la NP sería de gran ayuda. Con este objetivo se han estudiado el test de la D-xilosa29, el test de absorción de 3-O-metilglucosa30, el ratio de digestión de macronutrientes31,32 o la actividad de la diamina oxidasa tras heparina33, pero han resultado ser muy laboriosos con poco éxito en la práctica clínica8. Otros más recientes como el test de FABP-134 o la calprotectina fecal8 han demostrado utilidad solo en la medición del daño intestinal por isquemia o inflamación respectivamente.
En el año 2000, Crenn et al.publicaron el primer estudio que evaluaba adultos con SIC correlacionando su situación clínica con el nivel de citrulina plasmática, concluyendo que este es menor en pacientes con FI permanente que con FI transitorio, y que se correlaciona con la longitud de intestino remanente y con el porcentaje total de energía aportada mediante NP13. Posteriormente se han publicado nuevos estudios tanto en niños como en adultos con FI secundario a SIC realizando mediciones de citrulina plasmática y con resultados dispares respecto a su utilidad. La mayoría han demostrado que existe una estrecha correlación entre la citrulinemia y la longitud intestinal residual13,15–18,35, incluso con el diámetro y área de superficie estimada de intestino remanente13,16. También se ha observado que tras procedimientos quirúrgicos de elongación del intestino en niños, se incrementaba el nivel de citrulina plasmática en un 90% de los casos al año de la enteroplastia36. En nuestra serie, observamos un descenso significativo en los niveles de citrulina en aquellos pacientes con SIC, comparado con los que tenían longitud normal, y una fuerte correlación entre los niveles de citrulina plasmática y la longitud del intestino residual.
La utilidad de la citrulinemia para diferenciar entre FI permanente y transitorio se ha intentado demostrar con estudios que correlacionaban citrulina plasmática y el porcentaje de aporte energético total necesario mediante NP13–15 o el porcentaje de nutrición enteral tolerada11,18. Inicialmente se realizaron determinaciones aisladas dentro del tiempo estimado de adaptación tras establecerse el SIC, buscando niveles de corte que fueran un buen marcador pronóstico para valorar la posibilidad de conseguir la adaptación intestinal (20μmol/L en adultos13, 15μmol/L en niños18). En la muestra del estudio presentado, considerando un nivel de corte de 13μmol/L, observamos que el 84,6% de los pacientes del grupo i y ii tienen cifras iniciales menores (todos los del grupo i y 7 de 11 del grupo ii), mientras que el 92,3% de los pacientes del grupo iii tienen cifras iguales o superiores. Los estudios más recientes se basan en que la determinación secuencial podría ser más útil para confirmar si se está produciendo el proceso de adaptación intestinal. El estudio pediátrico de Bailly-Botuha et al. del 2009 indica que la asociación de una longitud de intestino residual menor de 50cm y un nivel de citrulina menor de 11μmol/L que no aumenta en el tiempo predice un FI permanente15, resultado que concuerda con los hallazgos encontrados en nuestra muestra de estudio por el momento.
En cuanto al trasplante intestinal, también se busca un biomarcador de disfunción aguda del injerto para evitar o minimizar las biopsias intestinales en el estudio del rechazo agudo y para conseguir un diagnóstico precoz. Al igual que en el SIC se han propuesto varios biomarcadores, siendo la citrulina plasmática uno de los más prometedores37. Los primeros estudios preliminares en 2002 por los grupos de Miami y Nueva York objetivaron un descenso de los niveles de citrulina en los episodios de rechazo, aun más marcado conforme aumentaba la severidad de este21,22. En 2004 se estudió el valor normal en pacientes trasplantados en su primer año, siendo mínimo en las primeras 2 semanas (periodo de isquemia-reperfusión del injerto) y aumentando progresivamente después hasta mantenerse estable a partir de los 90 días en valores similares a sujetos sanos. Los últimos estudios al respecto indican que el descenso significativo de citrulina plasmática medida de forma seriada tras el periodo de reperfusión del injerto solo se produce en situación de daño de la mucosa intestinal por rechazo agudo moderado o severo, no si es leve, y no se puede diferenciar por el momento de otras causas de enteritis como las secundarias a infecciones virales20. La diferenciación entre rechazo agudo y enteritis viral, 2 de las complicaciones más frecuentes y graves tras el trasplante intestinal, son el objetivo en el estudio de biomarcadores de disfunción del injerto puesto que el abordaje terapéutico es totalmente opuesto. Puede ser precisa la combinación de la determinación de citrulina con otros biomarcadores en estudio como la calprotectina fecal38 o la determinación de granzyme B y perforina en linfocitos39,40 para poder aumentar la especificidad del estudio hacia un rechazo agudo como causa de la disfunción intestinal.
Este trabajo es una confirmación más de que la concentración de citrulina sérica parece ser un marcador sensible y específico de la masa enterocitaria residual, y que se relaciona con la tolerancia a la alimentación por vía enteral en niños con SIC, pero los resultados son preliminares y debe confirmarse su valor pronóstico en el proceso de adaptación intestinal. Es una prueba sencilla, fácilmente realizable mediante simples análisis de sangre, repetible y relativamente barata.
El estudio presentado tiene limitaciones, siendo la más importante que es un estudio transversal, con una muestra de pacientes reducida hasta el momento, en la que se ha realizado la medición de citrulina plasmática en diferentes fases evolutivas del FI. Son necesarios estudios más a largo plazo de muestras más amplias y homogéneas en diferentes estadios evolutivos para poder extender su valor diagnóstico a la práctica clínica, con un valor pronóstico más fiable. En el trasplante intestinal la identificación de uno o una combinación de biomarcadores con valor predictivo de disfunción intestinal y su relación con el rechazo del injerto sigue siendo una prioridad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todo el equipo que forma parte de la Unidad de Rehabilitación Intestinal del Hospital Infantil La Paz, incluyendo gastroenterólogos pediátricos, cirujanos pediátricos, enfermeras, auxiliares y psicóloga infantil. A los profesionales que trabajan en la Unidad de Neuroquímica del Servicio de Bioquímica del centro.