Introducción
El estado epiléptico convulsivo es una emergencia neurológica relativamente frecuente en la edad pediátrica 1-3 que a pesar de su tratamiento agresivo se asocia todavía a una elevada mortalidad y a una morbilidad considerable, especialmente cuando se hace resistente 4,5. Puede diagnosticarse asociado a fiebre, a epilepsia o a enfermedades agudas o crónicas del sistema nervioso central (SNC).
Se ha observado que algunos factores como la edad, la etiología, la duración de la crisis, la resistencia al tratamiento o la presencia de algunos patrones electroencefalográficos específicos son predictivos de mal pronóstico 6-9.
Con el objetivo de investigar los factores asociados a la mortalidad y a una mala evolución clínica en la fase aguda de la enfermedad, hemos realizado un estudio de cohortes retrospectivo donde analizamos la etiología, las características y la evolución clínica del estado epiléptico convulsivo en un grupo de pacientes ingresados en nuestra unidad de cuidados intensivos pediátricos (UCIP).
Pacientes y métodos
Nuestra UCIP pertenece a un hospital universitario de tercer nivel y es la unidad de referencia para el tratamiento de los pacientes pediátricos graves de un área poblacional de 246.512 habitantes menores de 14 años (Instituto Nacional de Estadística, 2004). En ella ingresan mediante traslado pacientes procedentes de siete hospitales de nivel asistencial inferior.
Hemos seleccionado todos los niños de edad comprendida entre un mes y 14 años que ingresaron en nuestra UCIP por presentar estado epiléptico convulsivo entre los meses de enero de 2001 y diciembre de 2004. Para los fines de este estudio se analizó cada episodio de estado epiléptico como un caso independiente.
Se definió el estado epiléptico convulsivo como una convulsión aislada tónica o tonicoclónica de duración superior a 30 min o como la presencia de convulsiones recurrentes dentro de un período de 30 min de duración sin recuperación del nivel de conciencia 10.
Se excluyeron del análisis los pacientes diagnosticados de estado epiléptico no convulsivo y los que presentaron la crisis después de su ingreso en la UCIP.
Se revisaron las historias clínicas de los pacientes seleccionados para obtener información referida a los siguientes datos: edad, sexo, ingreso por traslado primario, duración de la estancia en la UCIP, antecedentes de enfermedad neurológica y/o de epilepsia, etiología y duración del estado epiléptico, características de las crisis convulsivas y datos relacionados con su evaluación diagnóstica como punción lumbar, tomografía computarizada (TC) craneal y electroencefalograma (EEG) en las primeras 24 h desde su ingreso en la UCIP. También se recogió de la historia clínica información relativa al estado funcional previo de los pacientes, al tratamiento anticomicial previo y al recibido durante su estancia hospitalaria, así como a la necesidad y duración del soporte ventilatorio artificial.
De acuerdo con las indicaciones de la Liga Internacional contra la epilepsia 11 las convulsiones motoras se clasificaron como parciales, parciales secundariamente generalizadas, generalizadas, mioclonías y atónicas. Por su etiología, el estado epiléptico se clasificó del modo siguiente 1,12: idiopático cuando las convulsiones no se relacionaron con disfunción del SNC ni con algún trastorno metabólico; estado epiléptico febril si las crisis estaban provocadas solamente por hipertermia igual o superior a 38,5 °C; estado epiléptico sintomático agudo si se produjo durante la fase aguda de una enfermedad relacionada con disfunción metabólica o del SNC; estado epiléptico sintomático remoto es el que se diagnosticó, sin relación demostrable con ninguna causa aguda, en pacientes portadores de lesiones antiguas del SNC que se asocian a un riesgo convulsivo conocido; estado epiléptico asociado a encefalopatía progresiva, el que se produjo durante el curso de una enfermedad progresiva (metabólica o neurocutánea) del SNC. El estado epiléptico convulsivo se consideró resistente cuando se prolongó durante al menos 60 min después de haber recibido dosis apropiadas de una benzodiazepina y de un antiepiléptico de segunda línea (usualmente fenitoína) 7.
El diagnóstico de meningitis bacteriana y de meningoencefalitis se realizó utilizando los criterios bioquímicos y microbiológicos admitidos habitualmente 13.
En su evaluación inicial, durante las primeras 24 h todos los pacientes fueron estudiados mediante una TC craneal que fue interpretada por un radiólogo y al menos, un EEG que fue interpretado por un neurofisiólogo. Los resultados de la TC se clasificaron como: normal, alteraciones difusas, anomalías focales o anomalías multifocales 13. En los EEG se consideraron cuatro posibles resultados: normal, ritmo anormal (enlentecimiento focal o generalizado, amplitud atenuada), paroxismos (focales, multifocales, ondas punta) o EEG plano 4.
El protocolo de tratamiento en nuestra UCIP ante un estado epiléptico convulsivo consiste en instaurar medidas generales de soporte hemodinámico y respiratorio junto con la administración escalonada de: a) diazepam intravenoso en dosis de 0,2 mg/kg o clonazepam intravenoso en dosis de 50 μg/kg (dosis máxima 1 mg) seguido, si la medicación anterior no consigue controlar la crisis, por: b) inyección intravenosa lenta de fenitoína a 15-20 mg/kg y, si ésta fracasa, c) midazolam intravenoso a dosis de 150 μg/kg o tiopental sódico en perfusión continua intravenosa a la dosis suficiente para inducir en el EEG un patrón de onda supresión. Cuando el tratamiento del estado epiléptico convulsivo de un paciente se había iniciado en el servicio de urgencias o en otro hospital, se siguió desde el escalón de tratamiento aplicado antes de su ingreso en la UCIP y hasta el control del episodio.
La evaluación de las secuelas neurológicas se realizó comparando el estado neurológico basal (previo a su ingreso) de los pacientes con los resultados de la exploración neurológica reflejada en la historia clínica en el momento de su alta de la UCIP. De acuerdo con la clasificación de Jennett y Bond 14 se utilizó el Glasgow Outcome Score (GOS) y se clasificaron las secuelas neurológicas en cinco estadios funcionales:
1.Ausencia de secuelas (situación neurológica normal).
2.Secuelas leves (deterioro neurológico que no interfiere con el nivel de autonomía previsto para su edad).
3.Secuelas moderadas (deterioro del nivel de autosuficiencia previsible).
4.Estado vegetativo (imposibilidad de llevar a cabo por sí mismo las actividades básicas de la vida cotidiana).
5.Fallecimiento.
Para los fines de este estudio, se definió la mala evolución neurológica de un paciente como su fallecimiento durante su estancia en la UCIP o el empeoramiento de su estado neurológico basal presentando al menos secuelas moderadas (estadio funcional GOS ≥ 3) en el momento del alta de la UCIP.
Debido al carácter observacional del estudio y dado que en todo momento se mantuvo la confidencialidad de los datos de las historias clínicas, se descartó la necesidad de la solicitud del consentimiento informado.
Método estadístico
La estadística descriptiva se realizó mediante expresión de las medianas y los percentiles 25 y 75 para las variables cuantitativas y porcentajes para las variables cualitativas. El análisis univariante de las variables predictivas de mala evolución se llevó a cabo mediante el test de la ji cuadrado (x 2) (o el test exacto de Fisher) considerándose significativos valores de p < 0,05. Para cuantificar la magnitud de la asociación entre las variables predictoras y la mala evolución se utilizó el riesgo relativo (RR) con sus intervalos de confianza del 95 % (IC 95 %). Posteriormente se realizó un análisis multivariante con un modelo de regresión logística no condicional con aquellas variables que resultaron significativas como predictoras de mala evolución en el análisis univariante.
Resultados
Los resultados relativos a las características demográficas, etiología y a la evaluación inicial de los pacientes incluidos en el estudio figuran en la tabla 1.
Durante el período de tiempo analizado (48 meses) se produjeron 43 ingresos consecutivos por estado epiléptico convulsivo en 37 pacientes. Un paciente ingresó dos veces y otro paciente cuatro veces. Se excluyeron del estudio 2 pacientes que ingresaron por estado epiléptico debido a la imposibilidad de recoger sus datos adecuadamente. La población objeto de nuestro análisis fue de 41 casos.
La incidencia más elevada de estado epiléptico se produjo en los menores de 2 años de edad que representaron el 43,9 % del total. El 53,7 % de los casos ingresaron procedentes de otro hospital.
El estado epiléptico sintomático representó el porcentaje más elevado de nuestros casos. Al subdividir este grupo según el grado de antigüedad del proceso origen de las convulsiones, el estado epiléptico sintomático remoto fue la causa más frecuente. Este grupo de pacientes estaba formado por 5 casos con malformaciones congénitas, 4 con encefalopatías estáticas incluyendo dos con encefalopatía anóxica, 2 casos de traumatismo craneoencefálico remoto y 2 casos de meningoencefalitis antiguas. Con estado epiléptico sintomático agudo ingresaron 6 pacientes (14,6 %) siendo secundario a traumatismo craneoencefálico (2 casos), encefalitis (2 casos), meningitis bacteriana (1 caso) y tumor cerebral (1 caso).
Los pacientes diagnosticados de alguna enfermedad neurológica antes de la presentación del estado epiléptico constituyen un grupo numeroso (representó el 51,2 % de nuestros pacientes) y heterogéneo. Está constituido por todos los que presentaron epilepsia sintomática remota y los portadores de encefalopatía progresiva.
Las convulsiones que caracterizaron al estado epiléptico fueron generalizadas en la mayoría de nuestros pacientes.
El registro EEG realizado durante las primeras 24 h de su ingreso en UCIP se consideró patológico en 35 casos (85,4 %). En el resto de pacientes fue normal debido a que se realizó en el período interictal.
El 61 % de los pacientes presentaron alguna anomalía en la TC craneal.
En 18 pacientes (43,9 %) el estado epiléptico se consideró refractario. Estos casos respondieron a la perfusión intravenosa de medicación de tercera línea: midazolam o tiopental en dosis suficientes como para controlar el estado epiléptico.
En 28 pacientes (68,3 %) fue necesario establecer soporte ventilatorio artificial mediante ventilación mecánica controlada. Este grupo incluye a los 18 pacientes portadores de estado epiléptico refractario y a otros 10 que necesitaron el soporte debido al efecto depresor respiratorio de dosis repetidas de benzodiazepinas antes de su ingreso en la UCIP.
La evolución clínica de los pacientes incluidos en el estudio se describe en las tablas 1 y 2.
Durante la estancia en la UCIP se registró una mortalidad del 14,6 % (6 pacientes), cuatro de los cuales correspondían al grupo sintomático remoto y dos al sintomático agudo. La situación neurológica previa al ingreso de estos pacientes era normal en 2 casos; los otros cuatro presentaban algún grado de incapacidad funcional, repartiéndose entre leve y grave al 50 %.
Se detectaron nuevas secuelas (empeoramiento de la situación neurológica basal) en 3 pacientes, que fueron graves (GOS 3) en 2 pacientes y uno fue dado de alta en estado vegetativo (GOS 4).
Añadiendo a los 6 pacientes que fallecieron durante su estancia en UCIP, los 3 casos que presentaron un agravamiento de su situación funcional en el momento del alta, el porcentaje de mala evolución representa el 22 %.
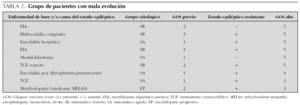
Los factores asociados con mal pronóstico en nuestros pacientes se muestran en la tabla 3.
En el análisis univariante, la presencia de un estado epiléptico refractario y la pertenencia al grupo etiológico sintomático se asociaron de forma estadísticamente significativa a una mala evolución neurológica (38,9 % frente a 8,7 % con p < 0,05 y 42,1 % frente a 4,5 % con p < 0,01, respectivamente). En el grupo de pacientes con alteraciones en la TC craneal un 36 % presentó una mala evolución, lo que no se sucedió en ninguno de los que tenían una TC craneal normal (p = 0,08).
Se realizó un análisis multivariante con las variables que alcanzaron nivel de significación estadística en el análisis univariante (grupo sintomático y presencia de estado epiléptico refractario), manteniéndose la asociación con mala evolución neurológica de forma estadísticamente significativa en ambos casos.
Discusión
Nuestros resultados demuestran que el estado epiléptico en niños tiene un mal pronóstico alcanzando un porcentaje de mala evolución del 22 %. La mortalidad del estado epiléptico en los pacientes de este estudio fue del 14,6 %, el porcentaje que se sitúa por encima del nivel publicado por series pediátricas recientes que cifran la mortalidad entre el 1 y el 11 % 8,12,13.
Entre los niños que sobrevivieron al estado epiléptico solamente el 8,6 % mostró algún grado de deterioro de su situación funcional previa. Aunque al referirnos a la morbilidad estamos mencionando los déficit de tipo cognitivo o motor que resultan detectables en el examen clínico, es posible, especialmente en los lactantes, que cambios neurológicos sutiles que en el futuro se manifestarán como dificultades en el aprendizaje o en la reducción del nivel de autonomía personal pasen desapercibidos en una primera exploración.
Destaca en nuestra serie el número elevado de pacientes que fallecieron comparado con el reducido número de los que sobrevivieron con alguna secuela grave. Es evidente que la mortalidad representa una proporción sustancial en nuestro porcentaje de mala evolución que podría ser atribuible a la enfermedad de base o a las características del propio estado epiléptico.
Algunos autores han encontrado en pacientes adultos con estado epiléptico una asociación estadística entre el mal pronóstico y la etiología del estado epiléptico y su duración 4,7,12,15. También en niños con estado epiléptico se ha relacionado una mayor mortalidad y un deterioro neurológico superior con factores como la edad menor de un año, la epilepsia sintomática, algunos patrones EEG, el estado epiléptico refractario y la duración prolongada de las crisis 2,6-8. En un metaanálisis que incluye 111 episodios de estado epiléptico 15 la mortalidad se relacionó con la enfermedad origen del trastorno convulsivo y en esos casos la epilepsia sintomática aguda se relaciona con un pronóstico peor que otras causas de epilepsia.
A diferencia de otros estudios no hemos encontrado evidencia estadística que demuestre la influencia de la edad, la epilepsia parcial, la existencia de anomalías en las pruebas de neuroimagen y la duración del estado epiléptico con un mal pronóstico. Aunque es preciso reconocer que, debido al carácter retrospectivo de este estudio y al alto porcentaje de pacientes que ingresaron procedentes de traslado desde otros centros, algunas convulsiones clasificadas en los hospitales de procedencia como primariamente generalizadas pudieran tratarse en su origen de crisis parciales con generalización secundaria que no se hubieran identificado como tales. Con respecto al valor pronóstico de las pruebas de neuroimagen, el nivel de significación cercano a 0,05 hace probable que una serie más numerosa de pacientes hubiera permitido afirmar que la existencia de una TC craneal anormal en la evaluación inicial de los pacientes pueda identificar a los de peor pronóstico. En el análisis multivariante de nuestros resultados, identificamos a la epilepsia sintomática y al desarrollo de un estado epiléptico resistente como predictores independientes de mala evolución. Este dato sugiere que la morbilidad del estado epiléptico está relacionada tanto con la enfermedad de base que es origen del estado epiléptico como con la resistencia de la actividad convulsiva a los fármacos anticomiciales.
Si se analiza el pronóstico de los pacientes en relación con la causa que desencadenó el estado epiléptico llama la atención que el 100 % de los que fallecieron y el 88,9 % de los que presentaron una mala evolución pertenecían al grupo sintomático. Es conocido el mal pronóstico de la epilepsia sintomática 8,15, un tipo de convulsiones que cuando evoluciona hasta el estado epiléptico resistente se acompaña de una elevada mortalidad 15 y que en nuestra serie se observó en un elevado porcentaje de pacientes. Coincidiendo con el buen pronóstico que se atribuye al estado epiléptico de origen febril o idiopático 12,16-18, ninguno de los pacientes de estos grupos presentó una mala evolución, indicando una mayor influencia de la enfermedad de base en la evolución clínica de nuestros casos.
Estudios previos en niños y adultos 19-22 han demostrado que la refractariedad es uno de los factores que se asocian con un mal pronóstico del estado epiléptico siendo en los niños su porcentaje de mortalidad hasta del 43,5 % con aparición de secuelas en el 61,5 % de los supervivientes 5. El 43,9 % de nuestros pacientes evolucionó hacia un estado epiléptico resistente.
Algunos estudios clínicos 13,16,23,24 dan soporte a la idea de que estado epiléptico es por sí mismo un factor que induce lesión cerebral. Esos datos sugieren que las convulsiones prolongadas son una causa directa de lesiones neurológicas y que la duración de las convulsiones sería un buen marcador pronóstico. De acuerdo con esos resultados, en nuestra serie hemos encontrado que la existencia de estado epiléptico resistente ha sido una variable con valor pronóstico.
Nuestra serie se caracteriza por una elevada proporción de pacientes con estado epiléptico sintomático (46,3 %), de portadores de anomalías estructurales en la TC craneal (61 %) y de pacientes con estado epiléptico resistente (43,9 %). Por otra parte, existe un porcentaje reducido (34,2 %) de casos con las formas más benignas de estado epiléptico convulsivo (febril e idiopático). Creemos que todos estos factores reflejan el alto nivel de gravedad de nuestros pacientes y contribuyen a explicar la elevada mortalidad de nuestra serie.
En nuestra experiencia, el estado epiléptico de tipo idiopático y el de origen febril presentan una respuesta rápida al tratamiento y su pronóstico es favorable. Por el contrario, nuestros datos indican que cuando el estado epiléptico convulsivo es de tipo sintomático agudo o remoto, o si se manifiesta como resistente a la medicación habitual, se acompaña de una mortalidad elevada que el tratamiento intensivo con numerosos fármacos no ha conseguido disminuir, aunque haya reducido la incidencia de secuelas.
Agradecimiento
Agradecemos al Dr. José Sánchez Payá del Servicio de Medicina Preventiva del Hospital General Universitario de Alicante, su colaboración en el análisis estadístico de nuestros resultados.