La insuficiencia ovárica prematura (POI) conlleva importante morbilidad, causando infertilidad, disfunción sexual, disminución de la densidad ósea, riesgo cardiovascular, alteraciones emocionales y mortalidad precoz.
ObjetivoConocer la incidencia y el manejo actual de la POI en supervivientes a un tumor sólido en la infancia y/o adolescencia en nuestro medio.
Material y métodosEstudio observacional multicéntrico. Mujeres entre 12 y 18 años con diagnóstico de tumor sólido y criterios clínicos y/o analíticos de POI. El riesgo se estima según los criterios «The Pediatric Initiative Network of the Oncofertility Consortium».
ResultadosIncidencia de 1,5 (30 casos de POI). Edad media 14±2,09. Los tumores sólidos que más se asociaron a la POI fueron: sarcoma de Ewing, tumores cerebrales y germinales. El 83% de los casos no realizó preservación previa al tratamiento. Un 63% no referían menarquia al diagnóstico de la POI. El 97% cumplían criterios de alto riesgo de toxicidad gonadal, a pesar de ello el 47% no realizó ninguna vigilancia previa al diagnóstico. La mediana de tiempo tras el diagnóstico y la aparición del evento es de 43,5 y 29,5 meses tras finalizar tratamiento. Las curvas de Kaplan-Meier, muestran que al 30% de los casos, aparecen en los 2 años tras el diagnóstico y las mujeres con estadio puberal 1 desarrollan insuficiencia más tardíamente que aquellas con estadio 5.
ConclusionesEl seguimiento de mujeres en riesgo de la POI, es susceptible de mejora. Las herramientas actuales facilitan conocer el riesgo al planificar los tratamientos del tumor y realizar vigilancia, educación, diagnóstico precoz, preservación e instauración de tratamiento sustitutivo. Todo ello, supondría importantes mejoras en salud.
Primary ovarian insufficiency (POI) carries significant morbidity, causing infertility, sexual disfunction, decreased bone density, cardiovascular risk, emotional distress and early mortality.
ObjectiveTo know the incidence and current management of POI in childhood/adolescent solid tumour survivors.
Material and methodsWe conducted a multicentre observational study. It included female patients aged 12 to 18 years with a diagnosis of solid tumour and meeting clinical or biochemical criteria for POI. The risk was estimated based on the criteria of the Pediatric Initiative Network of the Oncofertility Consortium.
ResultsWe found an incidence of 1.5 (30 cases of POI): The median age at the time of the event was 14 years (standard deviation, 2.09). The solid tumours associated most frequently with POI were Ewing sarcoma and brain and germ cell tumours. Eighty-three percent of patients did not undergo fertility preservation. Sixty-three percent reported not having undergone menarche at the time of ovarian failure. Ninety-seven percent were at high risk of gonadal toxicity, yet 47% were not monitored before the diagnosis. The median time elapsed to the occurrence of the event was 43.5 months after diagnosis and 29.5 months after completing treatment. The Kaplan-Meier curves showed that approximately 30% of POI cases developed within 2 years of diagnosis and that women at Tanner stage 1 developed insufficiency later than women at Tanner stage 5.
ConclusionsThere is room for improvement in the followup of women at risk of POI in Spain. The tools currently available facilitate risk assessment at the time of treatment planning and allow the implementation of monitoring, education, early diagnosis, fertility preservation, and replacement therapy as needed. All of this would achieve significant improvement in health outcomes.
La supervivencia del cáncer en la edad pediátrica y la adolescencia ha aumentado en los últimos años superando el 80%1. Sin embargo, las secuelas del cáncer y los tratamientos recibidos merman la calidad de vida de los supervivientes en la etapa adulta2. La insuficiencia ovárica prematura (POI), es una de estas secuelas. El termino POI ha sido propuesto por la Sociedad Europea de Reproducción Humana y Embriología (ESHRE), para su uso en la investigación y en la práctica clínica. Se caracteriza por una disfunción de los ovarios, hipoestrogenismo y pérdida de la reserva de folículos en las gónadas, que conlleva importante morbilidad, causando infertilidad, disfunción sexual, disminución de la densidad ósea, riesgo cardiovascular y alteraciones emocionales y, finalmente, aumento de mortalidad precoz3,4.
La prevalencia en la población general de la POI está en torno al 1,8%. Siendo mayor en pacientes con cáncer o enfermedades que requieren quimioterapia y/o radioterapia. En el momento actual algunas publicaciones muestran que la incidencia de la POI es 3,5 veces mayor en niñas y adolescentes supervivientes a un cáncer que en sus pares4. El riesgo tras la radioterapia va a depender del campo de radiación, la dosis y la edad de la paciente. En cuanto a los agentes quimioterápicos, los alquilantes son los más relacionado con la POI en todas las edades5,6.
La monitorización estrecha de la función ovárica en niñas, mujeres que recibieron tratamientos gonadotóxicos es importante, ya que ofrece la posibilidad de preservar fertilidad, sobre todo en aquellos casos que no pudo realizarse antes del inicio de los tratamientos. Igualmente, permite iniciar la terapia hormonal sustitutiva de forma precoz, optimizando la salud y la calidad de vida de las mujeres7.
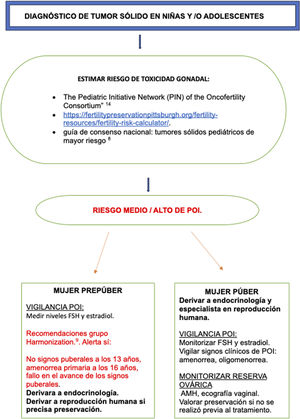
En el caso de niñas prepúberes, el diagnóstico de POI es más complejo. Una guía de consenso nacional describe los tumores sólidos pediátricos de mayor riesgo8. Asimismo, el grupo de efectos secundarios «Harmonization», publica guías basadas en la evidencia sobre grupos de riesgo de infertilidad y monitorización de supervivientes9. Los niveles de FSH y estradiol son las herramientas recomendadas en mujeres prepúberes con retraso en el inicio puberal: no signos puberales a los 13 años, amenorrea primaria a los 16 años, fallo en el avance de los signos puberales.
The Children's Oncology Group (COG), el grupo Pancare y otras instituciones disponen de guías elaboradas por expertos para la vigilancia y actuación frente a los efectos secundarios de los supervivientes10–12. Es fundamental informar y concienciar a los supervivientes sobre los posibles efectos secundarios que podrían aparecer a lo largo de su vida adulta. En este sentido, las niñas y los adolescentes con alto riesgo de POI y sus familias deberían conocer, identificar los signos de alarma y consulta. Desafortunadamente múltiples publicaciones muestran que la información y la actuación frente a las secuelas del cáncer sigue siendo insuficiente13.
ObjetivoConocer la incidencia y el manejo actual de la POI en supervivientes a un tumor sólido en la infancia y/o adolescencia en nuestro medio con el fin de implementar mejoras en la vigilancia, detección precoz, abordaje e información.
Material y métodosEstudio observacional multicéntrico, realizado por el grupo de trabajo de adolescentes con cáncer de la Sociedad Española de Hematología y Oncología Pediátricas (SEHOP).
El estudio ha sido aprobado por el Comité de ética de referencia del Hospital General Universitario Gregorio Marañón con código GARFOP2021 cumpliendo los requisitos establecidos en la legislación vigente, Real Decreto 1090/2015 y Decreto 39/94 de la Comunidad de Madrid para que la decisión del citado CEIM sea válida.
PacientesCriterios de inclusiónSe incluyeron mujeres entre 12 y 18 años en el momento del estudio con diagnóstico de tumor sólido y riesgo moderado/alto de desarrollar POI.
Criterios exclusiónSe excluyeron pacientes con diagnóstico de hemopatías malignas o aquellas sometidas a trasplante alogénico de médula ósea.
Participaron 5 centros a nivel nacional que tratan pacientes pediátricas y/o adolescentes con cáncer. Se seleccionaron 210 historias de mujeres con tumores sólidos en la infancia o adolescencia y riesgo medio/alto de POI entre enero de 2010 y diciembre de 2022, que hubiesen cumplido al menos dos años de seguimiento tras el fin de la terapia.
Recogida de datosSe revisaron las 210 historias clínicas, recogiendo datos exclusivamente de las niñas y/o adolescentes con cáncer, que cumplían criterios diagnósticos de POI. Se recogieron datos relevantes: edad al diagnóstico, tipo de tumor, fin de tratamiento, fecha de evento, preservación fertilidad previa a tratamiento o al fallo ovárico, grupo de riesgo, menarquia, seguimiento en endocrinología, seguimiento en ginecología, terapia hormonal sustitutiva y criterios de POI.
Los grupos de riesgo se definieron de acuerdo con los siguientes criterios establecidos por expertos «The Pediatric Initiative Network (PIN) of the Oncofertility Consortium»14.
Posteriormente, se estimó el riesgo de los casos de POI a través de esta herramienta: https://fertilitypreservationpittsburgh.org/fertility-resources/fertility-risk-calculator/.
La POI se define, siguiendo las recomendaciones de la ESHRE, como síntomas clínicos de menopausia, amenorrea u oligomenorrea durante al menos 4 meses y niveles de FSH>25UI/l repetidos en un intervalo de 4 semanas o un nivel de FSH>40UI/l Los niveles de FSH son la prueba con mayor valor en el diagnóstico de POI. El valor de la hormona antimülleriana (AMH) debe ser interpretada en el conjunto de los valores de FSH y estrógenos15.
Métodos estadísticosLos datos fueron recogidos de forma anonimizada siguiendo las normas de las buenas prácticas clínicas en una base de datos para su posterior análisis usando IBM (SPSS®) versión 26. (IBM Corp, Armonk, NY, EE. UU.). Las variables categóricas se expresan como frecuencias y porcentajes y las variables continuas como media±desviación estándar. Se estableció como límite de la significación estadística el valor de p 0,05. Las curvas de Kaplan-Meier se utilizaron para analizar el tiempo en que aparece la complicación tras el diagnóstico y analizar diferentes factores.
ResultadosDe las 210 pacientes con criterios de riesgo moderado alto, se excluyeron 170 pacientes por no desarrollar POI en el periodo de recogida de datos. Se incluyeron 30 pacientes en el estudio, lo que supuso una incidencia muestral del 1,5.
La media de edad al diagnóstico del tumor fue de 10±3,88 años y la media de edad en el momento del evento era de 14±2,09. En cuanto a los tumores sólidos el sarcoma de Ewing, los tumores de sistema nervioso central y los tumores germinales, supusieron el 70% de los casos de POI en nuestro estudio. El 83% de los casos no habían realizado preservación de ovocitos o corteza previamente al inicio de tratamiento y/o desarrollo de la POI. El 63% (19) no habían presentado menarquia en el momento del fallo ovárico. El desarrollo puberal mediante la escala de Tanner a la exploración fue mayoritariamente uno (13) y 5 (14) representando el 90% del total.
En el momento del diagnóstico de la POI, el desarrollo puberal era completo en 14 mujeres y el resto eran prepúberes, con estadios Tanner 1 mayoritariamente.
La ecografía vaginal se realizó solo en 10 mujeres (33%) siendo patológica con menos de 10 folículos en el 90%. La ecografía abdomino- pélvica, se realizó en 23 casos de los cuales fue normal en 11 (37%) y patológica en 12 (40%) con ovarios de pequeño tamaño y ausencia de folículos.
Los valores hormonales mostraron que la FSH, estaba por encima de 40UI/l en una determinación en el 78% de la muestra y el 21% restante, tenía 2 determinaciones por encima de 25UI/l. El valor de estradiol era menor de 28ng/l en el 90% de los casos. La LH estaba aumentada en 25 determinaciones, el 83% de los estudios. La determinación de hormona antimülleriana, no se consideró criterio diagnóstico. Se realizó en 7 pacientes (23%) mostrando valores disminuidos en todas ellas.
Los síntomas de menopausia se describieron en 16 (53%) y la oligo amenorrea de al menos 4 meses de evolución en 23 (77%).
Respecto a los factores de riesgo de POI, (8) 20% habían recibido dosis medias de alquilantes y (16) 53% dosis altas. Trece (43%) quimioterapia a altas dosis con trasplante autólogo de médula ósea como tratamiento de consolidación de un tumor sólido. El 40% recibieron platinos en su terapia. Radioterapia abdominal se administró a dosis >10Gy en 8 (27%). Radioterapia craneal >40Gy en 6 (20%) de los casos recogidos. Ooforectomía en 5 casos (17%).
Sumando los diferentes riesgos descritos en las pacientes incluidas en el estudio, de acuerdo con los criterios establecidos en el apartado de material y métodos, y aplicando la calculadora de riesgos, el 97% tenían un riesgo alto de fallo ovárico prematuro y, el resto riesgo medio alto.
En cuanto a la vigilancia de efectos secundarios recomendada en esta población de riesgo, observamos que el seguimiento por endocrinología no se realizó en 14 paciente (47%), 5 (17%), había realizado entre una y 5 visitas de seguimiento discontinuas y 11 (37%) estaban en seguimiento de vigilancia de efectos secundarios por parte de endocrinología y o ginecología.
El diagnóstico de POI lo realizó un especialista de oncología pediátrica en el 33% de las pacientes y en otros muchos lo remite a ginecología y/o endocrinología. Endocrinología realizó el diagnóstico en el 47% y ginecología en el 20% de los casos. En el momento del análisis 26 mujeres (87%) estaban en tratamiento con terapia hormonal sustitutiva.
La mediana de meses tras el diagnóstico y la aparición del evento fue de 43,5 y 29,5 meses tras el fin de tratamiento.
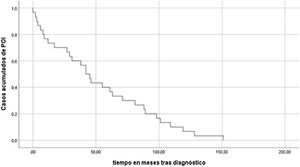
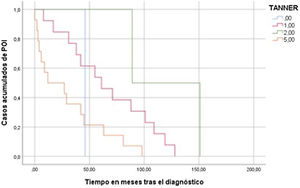
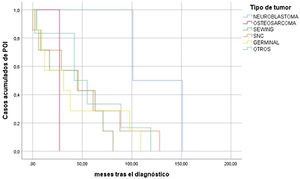
Las curvas de Kaplan-Meier (fig. 1), mostraron que aproximadamente el 30% de los casos de POI, aparecían en los dos años siguientes al diagnóstico del tumor y algunos casos de forma tardía varios años después del diagnóstico. Este mismo análisis incluyendo como factor la escala Tanner mostró diferencias significativas en cuanto al desarrollo de POI entre las mujeres prepúberes (Tanner 1) y púberas (Tanner 5). (fig. 2). Sin embargo, no se encontraron diferencias cuando se realizó el análisis por tipo de tumor (fig. 3).
El número de supervivientes a un cáncer en la infancia/adolescencia está en aumento16, este hecho supone un énfasis sobre el manejo de los efectos secundarios a largo plazo. La toxicidad de los tratamientos sobre las gónadas se ha identificado como una de las preocupaciones mayores para padres, adultos jóvenes y supervivientes a un cáncer en la edad pediátrica17. Igualmente, se describe como causa de peor calidad de vida en supervivientes18.
El riesgo de POI en la población general afecta aproximadamente al 1% de las mujeres19. Este riesgo aumenta en supervivientes a un cáncer en la edad pediátrica y/o adolescencia, siendo la prevalencia en adolescentes con cáncer del 5,4%. frente a un 2,2% en adolescentes sin cáncer20,21. El riesgo de desarrollar POI antes de los 40 años en esta población, es variable. Ha sido evaluado en diferentes estudios con resultados de incidencia acumulada entre 8-10,9%22,23. En nuestro estudio, la incidencia acumulada fue del 1,5%. Es importante resaltar que la POI puede aparecer en la edad pediátrica tras los tratamientos del cáncer y la vigilancia debe instaurarse de forma precoz, ya que el riesgo seguirá aumentando en las siguientes décadas de la vida, hasta la edad de mayor riesgo de POI, que se sitúa en torno a los 34 años23,24.
La mediana de meses tras el diagnóstico y la aparición del evento en nuestro trabajo es de 43,5 y 29,5 meses tras el fin de tratamiento. Las curvas de supervivencia (Kaplan-Meier) muestran que 30% de los casos de POI aparecen en los 2 años tras el diagnóstico del tumor y algunos casos aparecen de forma tardía varios años después del diagnóstico.
Igualmente, se encuentra una diferencia significativa estadísticamente en los tiempos de aparición de POI, mucho más prematuro en adolescentes púberes al diagnóstico del tumor, frente a prepúberes. En la literatura médica existe evidencia sobre menor posibilidad de desarrollar POI cuando el tratamiento se realiza en mujeres a edades más tempranas relacionado con un número mayor de folículos primordiales25. Este hecho podría explicar también el retraso de la aparición de fallo ovárico en pacientes más jóvenes, aunque no podríamos afirmarlo con los datos actuales.
Es importante reseñar que, aunque menstruación y ovocitos están estrechamente relacionados, es posible presentar menstruación con ciclos anovulatorios en relación con alteraciones en el eje hipotálamo-hipófisis-ovario. La presencia de menstruaciones tras los tratamientos no es un indicador de la reserva ovárica adecuada y puede llevar a engaño en algunos casos24. Por tanto, no excluye de un seguimiento adecuado en los casos en riesgo. En nuestro trabajo el 36% de los casos presentaron menarquia previa a la POI y mantuvieron menstruaciones el 23%.
Los factores de riesgo de nuestro estudio se evaluaron en función de la clasificación del «Pediatric interest network of the oncofertility Consortium»14.
Actualmente existen múltiples herramientas para unificar los grupos de riesgo de forma universal y facilitar a los clínicos el cálculo de riesgo de las pacientes. Green et al.21 desarrollan la CED ecuación para facilitar el cálculo de riesgo de forma universal (https://fertilitypreservationpittsburgh.org/fertility-resources/fertility-risk-calculator/). Clark et al. crean una herramienta «on line» para estimar el riesgo de no recuperar la función ovárica tras las terapias26. El conocimiento y uso de estas herramientas por parte de los especialistas supone la posibilidad de identificar aquellas niñas/adolescentes en riesgo una vez diagnosticadas y diseñado su plan de tratamiento. Cuando aplicamos de forma retrospectiva las mismas en nuestro estudio, el 97% de las supervivientes presentaban riesgo alto de POI.
En este trabajo la POI, se diagnóstica en 19 niñas sin desarrollo puberal ni menarquia, de las cuales el 47% no realizaba seguimiento endocrino, ni vigilancia hormonal, por la falta de sospecha. La instauración del uso de las herramientas y guías descritas de forma sistemática supondría una importante ayuda en el diagnóstico precoz, con las ventajas asociadas que ello conlleva.
Los resultados de nuestro trabajo son acordes con estas herramientas, con niveles de FSH y estradiol alterados en todos los casos y falta de signos puberales en el 63% (19).
La AMH no se recomienda como criterio diagnóstico de la POI, ya que un valor bajo puede derivarse de la toxicidad y también de la enfermedad en general. Un valor bajo en adolescentes jóvenes no excluye la posibilidad de embarazo. Asimismo, la interpretación de AMH en pediatría es complicado dado que su valor aumenta a lo largo de la infancia hasta la vida adulta, descendiendo en la menopausia. En general salvo en el estudio de Van der Kooi et al.27 no existen diferencias en los niveles de AMH tras los tratamientos, entre prepúberes y púberes. Tampoco se encuentran diferencias en la mayoría de los estudios, en los niveles de adultas supervivientes a un cáncer en la infancia/o adolescencia, frente a la población general28.
La combinación de FSH aumentada y AMH indetectable o baja se relaciona con la POI. Este hallazgo se confirma en nuestro estudio en los casos en que se realiza determinación de AMH (23%) su valor estaba disminuido y el valor de FSH aumentado.
En el seguimiento de las mujeres supervivientes a un cáncer, el valor de la AMH para detectar baja reserva ovárica y extremar la vigilancia, se describe de utilidad29. Otro método para monitorizar la reserva ovárica en mujeres adultas es la ecografía transvaginal. Al igual que la AMH no se aconseja su uso como criterio de definición POI. Su uso en niñas y adolescentes es limitado. En este estudio se realiza solo en 10 (33%) siendo patológica con menos de 10 folículos en el 90%.
A pesar de los avances en oncofertilidad como el desarrollo de guías y herramientas para detectar los pacientes en riesgo descritas previamente30, nuestro estudio revela que solo 11 (37%) pacientes, estaban realizando un seguimiento adecuado de riesgo de la POI a pesar de ser pacientes de alto riesgo. Asimismo, la tasa de preservación de fertilidad previa al tratamiento y/o al desarrollo de la POI fue baja 17%. Las herramientas y recomendaciones de seguimiento de mujeres en riesgo de desarrollar POI, se resumen en la figura 4.
Actualmente hay evidencia preliminar sobre el uso de antraciclinas y aumento de riesgo de la POI31, y se desconoce el efecto sobre las gónadas de nuevas terapias como anticuerpos monoclonales, bevacizumab, inhibidores de tirosina kinasa entre otros32. Estos factores de riesgo no han sido evaluados en el presente estudio y podrían ser objeto de investigaciones futuras.
ConclusionesLa aplicación de las herramientas disponibles actualmente para estimar el riesgo de la POI, posibilita educar a los pacientes y/o sus familias acerca de sus posibles efectos secundarios, y facilita elaborar un plan de vigilancia y derivación a los especialistas adecuados para su seguimiento. Este campo, es susceptible de mejora en nuestro medio y supondría grandes beneficios en salud. Entre ellos, la posibilidad de preservar fertilidad previa al desarrollo de la POI en aquellas supervivientes en las que no se consideró o no fue posible previamente al inicio del tratamiento33. Instaurar terapia sustitutiva de forma precoz, que han demostrado disminuir la morbilidad secundaria a enfermedades cardiovasculares, afectación de la densidad ósea y distrés emocional. La implicación de especialistas en endocrinología y ginecología es fundamental.
FinanciaciónNo existe beca o entidad financiadora del trabajo que declarar.
Conflicto de interesesNo existe conflicto de intereses entre los autores.