La ecografía se ha utilizado para cuantificar y calificar la morfología muscular de niños críticamente enfermos, detectando posibles cambios en el grosor muscular. El objetivo del estudio fue evaluar la fiabilidad de la medición por ecografía del grosor muscular en niños críticamente enfermos, y comparar la evaluación de un examinador experto con la de examinadores con poca experiencia.
Material y métodosEstudio observacional transversal en la unidad de cuidados intensivos pediátricos de un hospital universitario de tercer nivel en Brasil. Se incluyeron pacientes entre un mes y 12 años, que recibieron ventilación mecánica invasiva durante un mínimo de 24h. Se obtuvieron imágenes ecográficas del bíceps braquial/braquial y cuádriceps femoral en evaluaciones realizadas por un ecografista experimentado y ecografistas inexpertos. La concordancia intra- e interevaluador se estableció mediante el coeficiente de correlación intraclase (CCI) y el análisis gráfico de Bland-Altman.
ResultadosSe midió el grosor muscular en 10 niños con una edad media de 15,5 meses. El grosor medio de los músculos evaluados fue de 1,14 ±0,27cm para el bíceps braquial/braquial y de 1,85±0,61cm para el cuádriceps femoral. La fiabilidad intraevaluador e interevaluador fue muy buena (CCI>0,81) para todos los ecografistas. Las diferencias fueron pequeñas, sin detectarse en el análisis de los gráficos de Bland-Altman, y todas las mediciones estuvieron dentro de los límites de concordancia, excepto una medición de bíceps y cuádriceps.
ConclusiónLa ecografía se puede utilizar en niños en estado crítico para evaluar con precisión los cambios en el grosor muscular, incluso por diferentes evaluadores. Se necesitan más estudios para establecer un enfoque estandarizado en el uso de esta herramienta para la monitorización de la pérdida muscular con el fin de incorporar su uso en la práctica clínica.
Ultrasound has been used to quantify and qualify muscle morphology in critically ill children and can detect changes in muscle thickness. The aim of this study was to assess the reliability of ultrasound measurement of muscle thickness in critically ill children and to compare the assessments made by an expert with those made by inexperienced sonographers.
Material and methodsCross-sectional observational study conducted in the paediatric intensive care unit of a tertiary care university hospital in Brazil. The sample included patients aged 1 month to 12 years who received invasive mechanical ventilation for at least 24hours. Ultrasound images of the biceps brachii/brachialis and quadriceps femoris were obtained by one experienced sonographer and several inexperienced sonographers. We assessed intrarater and inter-rater reliability by means of the intraclass correlation coefficient (ICC) and Bland-Altman plot analysis.
ResultsMuscle thickness was measured in 10 children with a mean age of 15.5 months. The mean thickness of the assessed muscles was 1.14cm for the biceps brachii/brachialis (standard deviation [SD]: 0.27) and 1.85cm for the quadriceps femoris (SD: 0.61). The intrarater and inter-rater reliability were good for all sonographers (ICC>0.81). The differences were small, there was no significant bias in the Bland-Altman plots and all measurements were within the limits of agreement, except for 1 measurement of biceps and quadriceps.
ConclusionSonography can be used in critically ill children to accurately assess changes in muscle thickness, even by different evaluators. More studies are needed to establish a standardised approach to the use of ultrasound for monitoring muscle loss in order to incorporate it in clinical practice.
La hospitalización en unidades de cuidados intensivos (UCI) se asocia a diversas complicaciones, entre las que se encuentra la debilidad muscular, que a su vez se asocian comúnmente con un aumento de la morbimortalidad, tanto en adultos como en niños1,2. La debilidad adquirida en la UCI (DAUCI) se diagnostica tras la enfermedad crítica, y es una entidad importante a diferenciar de otras enfermedades neuromusculares que pueden causar fallo respiratorio e ingreso en la UCI3,4. Además, la DAUCI es simétrica, difusa y generalizada, afectando a las 4 extremidades, y se asocia a atrofia muscular, hipotonía e hiporreflexia3,5.
Al contrario que en adultos, la DAUCI está poco estudiada todavía en la edad pediátrica6, dándose una amplia variabilidad en la incidencia en esta población, en parte debida a la falta de conocimiento sobre esta entidad y los retos que plantea detectar la debilidad muscular en niños críticamente enfermos7. No obstante, se sabe ya que la DAUCI se asocia a una estancia hospitalaria más prolongada, lo que afecta a la evolución de la enfermedad y la recuperación funcional4.
La ecografía es una técnica no invasiva que puede utilizarse para identificar cambios en la estructura y morfología muscular. Se puede realizar a pie de cama y es fácil de aplicar, barata y se encuentra disponible en la mayoría de los hospitales8. Se ha propuesto como posible instrumento de evaluación en pacientes críticos porque permite la detección precoz de la pérdida de masa muscular, que está asociada a cambios histológicos y declive funcional9. Se trata, por tanto, de una herramienta útil que puede evitar el uso de métodos complejos para el estudio de los cambios musculares, p. ej., pruebas electrofisiológicas, tales como la electromiografía (EMG) y los estudios de conducción nerviosa, que son más complicadas, más costosas y no están disponibles en muchas UCI10.
Estudios previos en la población pediátrica han demostrado que esta herramienta puede detectar posibles cambios de grosor muscular en niños críticamente enfermos, a pesar de lo cual solo recientemente ha empezado a utilizarse como método de evaluación10,11. En consecuencia, quedan por aclarar varias cuestiones, como los músculos ideales para la medición, la técnica, duración, ecogenicidad y fiabilidad para el uso en la práctica clínica de la ecografía muscular en niños críticamente enfermos. En vista de todo ello, el objetivo de nuestro estudio fue evaluar la fiabilidad de la medición mediante ecografía del grosor muscular del bíceps braquial/braquial y el cuádriceps femoral en niños críticamente enfermos y comparar la fiabilidad de un examinador experto con examinadores recién entrenados.
Materiales y métodosDiseño de estudioEstudio transversal observacional.
PoblaciónLos participantes se seleccionaron entre agosto y noviembre de 2021 en la unidad de cuidados intensivos pediátricos (UCIP) de un hospital terciario universitario ubicado en el sur de Brasil. Se incluyeron pacientes de ambos sexos y con edades comprendidas entre un mes y 12 años (sin cumplir). Se incluyó a pacientes de ambos sexos de un mes a 12 años sin cumplir, con un padre o tutor legal, y que habían recibido ventilación mecánica durante un mínimo de 24h. Se excluyó a pacientes ventilador dependientes antes del ingreso en la UCIP; a los reingresados en la UCIP en menos de 24h tras el alta; a aquellos con trauma en alguna de las extremidades a evaluar o con cualquier otra alteración anatómica que impidiese una evaluación muscular adecuada, y aquellos con diagnóstico de enfermedad neuromuscular, parálisis cerebral, accidente cerebrovascular o cualquier otra enfermedad neurológica y/o genética que cursase con debilidad muscular y/o alteración del tono muscular. Los datos clínicos y demográficos se obtuvieron accediendo a la historia clínica electrónica, incluyendo los siguientes: sexo, edad (meses), diagnóstico, motivo de ingreso, peso y talla.
El estudio fue aprobado por el Comité Ético de Investigación (2021-0119). Tras su aprobación, se inició la selección de la muestra, obteniendo el consentimiento informado firmado de los padres o tutores legales de los participantes, en conformidad con la Resolución 466/12 que regula la investigación en seres humanos.
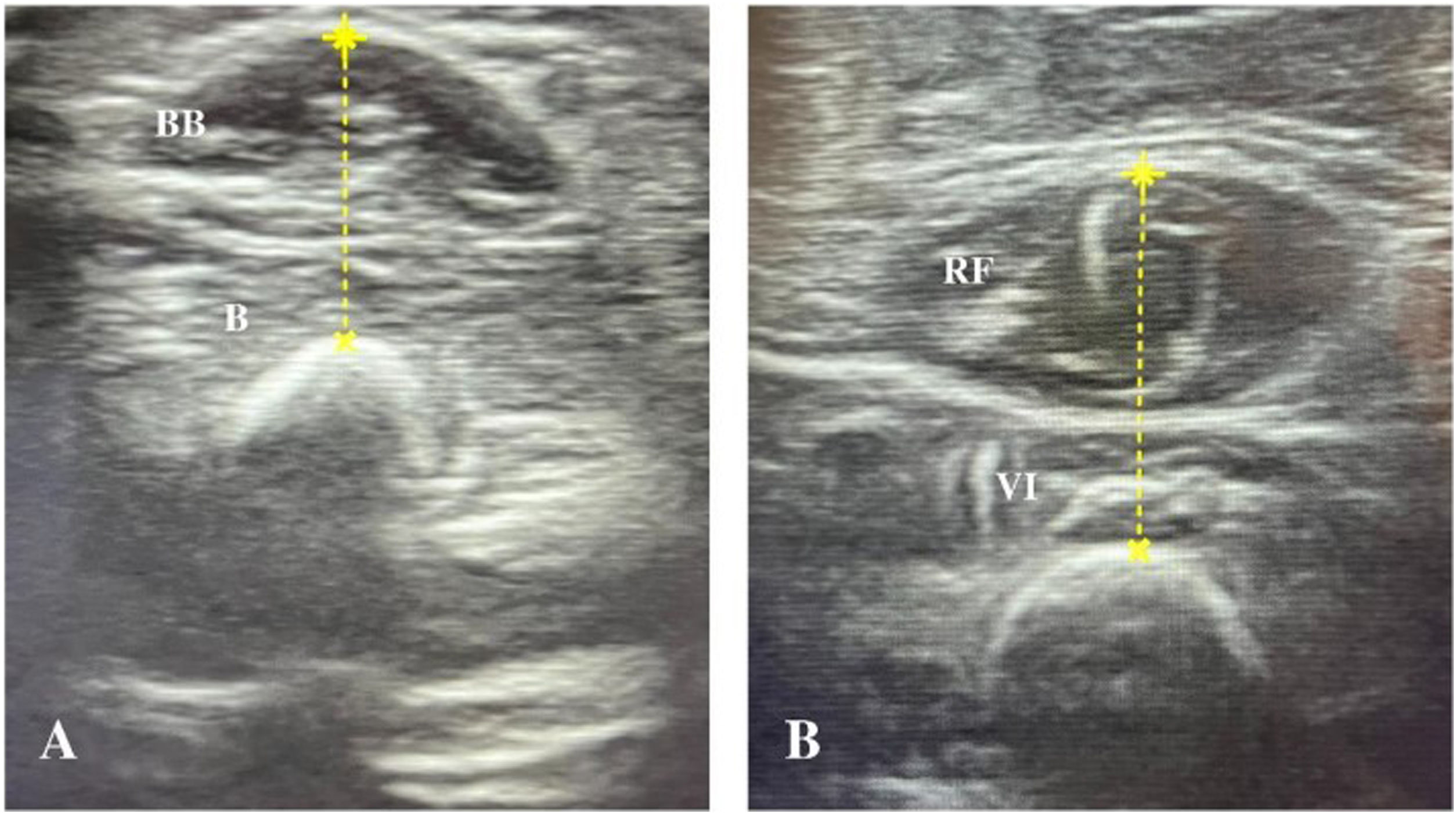
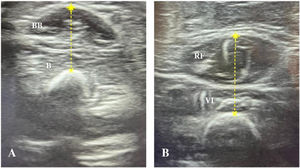
Protocolo de ecografía muscularLos estudios ecográficos se llevaron a cabo con un ecógrafo portátil InnoSight (Koninklijke Philips N.V., Países Bajos) con una sonda lineal de 4-12MHz, manteniendo los mismos parámetros técnicos, como la compensación ganancia de tiempo, el foco y la profundidad, en todas las evaluaciones. Las mediciones se realizaron en las primeras 24h tras la intubación, siguiendo el protocolo descrito por Ng et al.12, evaluándose 2 grupos musculares en cada niño (bíceps braquial/braquial y cuádriceps femoral) (fig. 1) en el lado derecho. En casos en que la extremidad derecha inferior o superior no estaba disponible debido a alguna estructura subyacente (p. ej., acceso venoso periférico, fijador externo), se evaluó el lado opuesto. Los músculos se evaluaron con el paciente en decúbito supino con los brazos y piernas estirados y los músculos relajados. La extremidad superior se encontraba en supinación y la inferior colocada con la rodilla en extensión y el tobillo en posición neutra. Se obtuvieron cortes transversales de los músculos en posiciones anatómicas en base la distancia de los puntos de referencia óseos: a) bíceps braquial/braquial: 2/3 desde el acromion al pliegue antecubital y b) cuádriceps femoral: 1/2 desde la espina ilíaca anterosuperior al borde superior de la rótula. El punto de colocación del transductor se marcó en la piel con un rotulador permanente. Durante la exploración, el transductor se colocó perpendicular a la piel con una cantidad generosa de gel conductor, ejerciéndose una presión mínima para no comprimir la musculatura.
Cuatro examinadores tomaron las medidas, uno de ellos experto (radiólogo con experiencia en ecografía) y 3 recién entrenados (inexpertos 1, 2 y 3). El examinador experto era un radiólogo certificado con dos años de experiencia en radiología musculoesquelética. Los examinadores inexpertos eran fisioterapeutas sin experiencia previa en imagen muscular o medición de grosor muscular y con exposición limitada a la ecografía. La formación consistió en unas prácticas iniciales a pie de cama para los 3 examinadores inexpertos, organizada exprofeso para el estudio, de 3 horas de duración y centrada específicamente en las 2 regiones de interés. En esta formación inicial, cada examinador inexperto efectuó varias medidas. El examinador experto estuvo disponible para proveer formación adicional y aclaraciones según fuera necesario durante el período de estudio y evaluó la competencia de los otros examinadores durante la formación a pie de cama.
Cada examinador realizó 3 mediciones consecutivas mediante ecografía en un solo plano en el punto anatómico marcado. Durante la formación, el punto de colocación del transductor lo marcó un solo examinador para conseguir una fiabilidad interobservador mayor. La marca inicial la realizó el primer examinador, ya fuera inexperto o experimentado. Todas las imágenes se obtuvieron cuando el paciente estaba relajado al máximo, independientemente del nivel de conciencia, y se permitió que se moviera o recolocara de ser necesario.
Análisis intraobservadorPara cada músculo, se obtuvieron 3 medidas consecutivas del grosor muscular de una vez. Las medidas mayores y menores de las 3 tomadas se utilizaron para analizar la variabilidad intraobservador.
Análisis interobservadorLos examinadores tomaron las medidas del bíceps braquial y el cuádriceps el mismo día, preferiblemente en el mismo turno. Se calculó la media de las 3 medidas para cada examinador, y se analizaron las diferencias entre los 3 examinadores en formación y el experto.
Análisis estadísticoEl análisis estadístico se realizó con el paquete estadístico SPSS® Statistics, versión 28.0 (IBM Corporation, Armonk, NY, EE. UU.), considerándose estadísticamente significativos los p-valores inferiores a 0.05. Las variables categóricas se expresaron como frecuencias absolutas y porcentajes, y las continuas como media y desviación estándar (DE) o mediana y rango intercuartílico según la distribución de los datos. Se utilizó la prueba de Kolmogorov-Smirnov o de Shapiro-Wilk para verificar la normalidad de los datos.
La fiabilidad de evaluó por medio del coeficiente de correlación intraclase (CCI) con un modelo de efectos mixtos de 2 factores y mediante análisis de Bland-Altman. El CCI se utilizó para determinar el nivel de concordancia: muy bajo <0,21, bajo 0,21-0,40; moderado 0,41-0,6; bueno 0,61-0,80; muy bueno 0,81-1,00. Los límites de concordancia se calcularon como la diferencia media ±1,96×DE entre las medidas, como se ha descrito previamente12,13. Los gráficos se analizaron para obtener una representación visual de la concordancia de las medidas entre los examinadores y para investigar posibles sesgos sistemáticos.
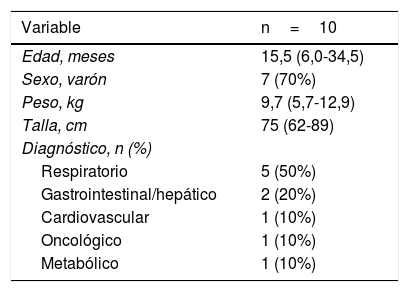
ResultadosDurante el periodo de formación, se realizaron mediciones del grosor muscular en 13 niños. Tras terminar la recogida de datos, el experto y los 3 examinadores inexpertos revisaron las imágenes obtenidas y el experto identificó 3 mediciones (cada una en pacientes distintos) que consideró inadecuadas (presión excesiva con el transductor o colocación incorrecta para el músculo evaluado). Se decidió por consenso excluir las mediciones inadecuadas del análisis, quedando así 10 pacientes en la muestra. Los datos clínicos y demográficos se presentan en la tabla 1. El motivo principal de ingreso en la UCIP fue el fallo respiratorio agudo (50%), y el grosor medio de los músculos evaluados fue de 1,14cm (DE: 0,27) en el caso del bíceps braquial/braquial y de 1,85cm (DE: 0,61) en el caso del cuádriceps femoral.
Características demográficas y clínicas de los niños clínicamente enfermos al ingreso en la UCIP
| Variable | n=10 |
|---|---|
| Edad, meses | 15,5 (6,0-34,5) |
| Sexo, varón | 7 (70%) |
| Peso, kg | 9,7 (5,7-12,9) |
| Talla, cm | 75 (62-89) |
| Diagnóstico, n (%) | |
| Respiratorio | 5 (50%) |
| Gastrointestinal/hepático | 2 (20%) |
| Cardiovascular | 1 (10%) |
| Oncológico | 1 (10%) |
| Metabólico | 1 (10%) |
Resultados expresados como mediana (rango intercuartílico) o n (%).
UCIP: unidad de cuidados intensivos pediátricos.
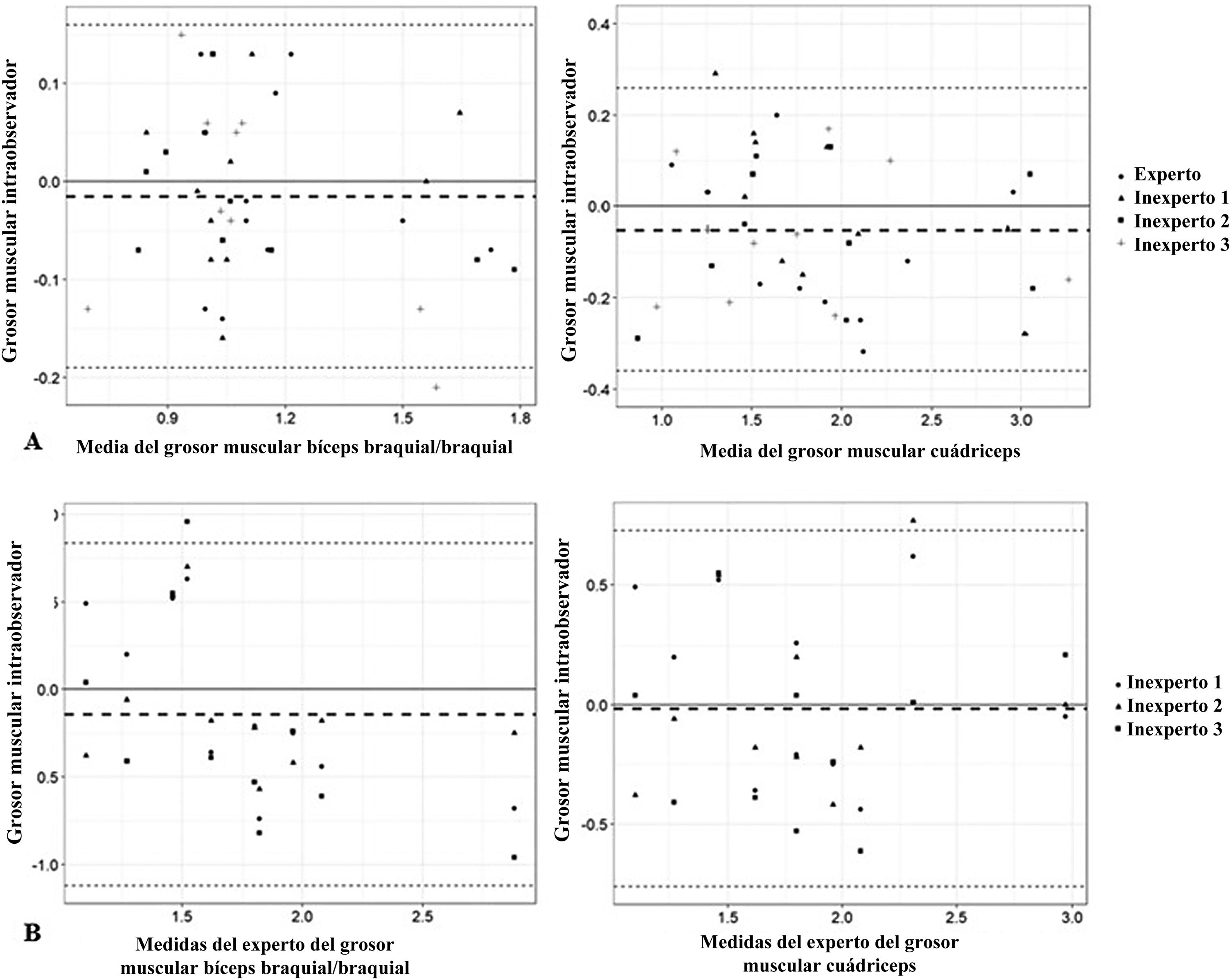
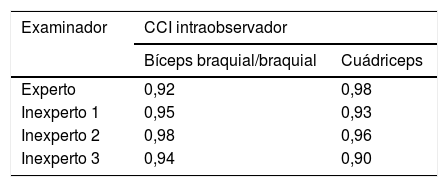
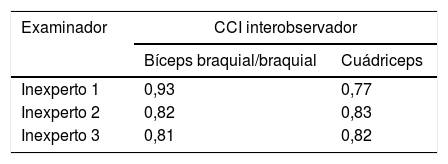
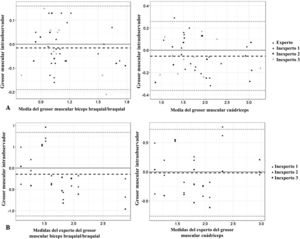
La fiabilidad intraobservador fue muy buena (CCI>0,81) tanto en el examinador experto como en los inexpertos (tabla 2). El CCI fue similar en todos los examinadores, y fue superior en la medición de los músculos de la extremidad inferior en la evaluación por el experto y en la medición de los músculos de la extremidad superior en las evaluaciones de los examinadores inexpertos. Las diferencias intraobservador en el examinador experto y los inexpertos fueron pequeñas, sin detección de sesgos en los gráficos de Bland-Altman (fig. 2A). Todas las medidas obtenidas se encontraban dentro de los límites de concordancia (−0,19 a 0,16cm para el bíceps braquial y −0,36 a 0,26cm para el cuádriceps), salvo una medida del cuádriceps por uno de los examinadores. La media de las diferencias fue de −0,01cm para los músculos de la extremidad superior y −0,05cm para los de la extremidad inferior.
Gráficos de Bland-Altman para los examinadores inexpertos y el experto. A) Análisis Bland-Altman intraobservador de las diferencias entre las mediciones repetidas (cm) y la media del grosor muscular (cm). B) Análisis Bland-Altman interobservador de las diferencias entre las medidas repetidas (cm) y las medidas del experto del grosor muscular (cm).
La fiabilidad interobservador (tabla 3) fue algo menor que la intraobservador, pero también fue muy buena (CCI>0,81), salvo para uno de los examinadores inexpertos en la medición del cuádriceps. Las diferencias entre los examinadores fueron pequeñas y no mostraron sesgos en el análisis de los gráficos de Bland-Altman (fig. 2B). Todas las medidas obtenidas se encontraban dentro de los límites de concordancia (−1,12 a 0,83cm para el bíceps y −0,76 a 0,72cm para el cuádriceps), salvo una medida del bíceps braquial/braquial y una del cuádriceps en un examinador. La media de las diferencias fue de −0,14cm para los músculos de la extremidad superior y −0,01cm para los de la extremidad inferior.
DiscusiónActualmente, la ecografía muscular en el punto de atención se considera una herramienta no invasiva que se puede emplear para identificar alteraciones musculares en niños con riesgo de desarrollar atrofia muscular en el entorno de cuidados intensivos. En el presente estudio observamos que, previo entrenamiento, examinadores inexpertos pueden realizar evaluaciones musculares mediante ecografía incluso en entornos de alta complejidad, como la UCI pediátrica.
La evaluación ecográfica del grosor muscular fue reproducida con precisión tanto por examinadores individuales como por distintos examinadores, obteniéndose una fiabilidad tanto intraobservador como interobservador con CCI considerados muy buenos, de manera similar a estudios previos en niños12,14,15 y adultos críticamente enfermos16. No obstante, cabe mencionar que los coeficientes de correlación interobservador fueron más bajos, si bien seguían siendo muy buenos, al contrario de lo observado por Ng et al.12.
Previamente a la formación en ecografía, los examinadores que la recibieron no tenían experiencia en técnicas de imagen muscular o medición del grosor muscular. Por ello, el examinador experto supervisó y evaluó las mediciones realizadas por los examinadores entrenados, señalando cualquier irregularidad y realizando las correcciones pertinentes (p. ej., en la posición y presión del transductor sobre la piel), minimizando así la potencial variabilidad en las mediciones. La medición del grosor de músculos pequeño, p. ej., en los menores de un año (50% de la muestra), supuso un reto. Cualquier pequeña variación podría enmascarar un cambio relativo en el grosor muscular y disminuir la fiabilidad de las medidas.
Estudios previos en niños críticamente enfermos han demostrado que la fiabilidad de las medidas ecográficas del grosor muscular del cuádriceps femoral depende del número de imágenes obtenidas14,17. En nuestro estudio, se aplicó la técnica descrita por Ng et al.10, obteniéndose 3 cortes transversales de cada grupo muscular evaluado, en lugar de uno solo. De este modo, se pudieron repetir las mediciones con diferencias del 7% o inferiores entre los examinadores en los 2 músculos, produciendo resultados más precisos y consistentes. Además, nuestro método difiere del de estudios previos en los que solo se evaluó el cuádriceps17–19, ya que también evaluamos el bíceps braquial/braquial para aumentar la fiabilidad.
Actualmente el cuádriceps es el grupo muscular estudiado con mayor frecuencia en este tipo de evaluación10, con medición del área de la sección transversal y/o el grosor muscular, siendo este último el método más reportado en la literatura20. Estudios en adultos han demostrado que la ecografía es una herramienta capaz de detectar cambios cuantitativos y cualitativos en los músculos21,22, con una fiabilidad intra- e interobservador excelentes; no obstante, aún no existe un protocolo operacional estandarizado para esta medición, lo que limita la difusión de la técnica22,23. Además, en niños críticamente enfermos, la evidencia que apoya el uso de la ecografía para la detección de pérdida muscular es escasa. Hasta la fecha, este método no se considera fiable en estos pacientes10,14.
De manera similar a los estudios de Valla et al.17 y Ng et al.12, nuestro estudio requería que el punto de colocación del transductor se marcara una sola vez en el músculo evaluado. De borrarse las marcas, se utilizaba la medida entre los puntos de referencia óseos para las siguientes medidas. A pesar de ello, conseguimos alcanzar una fiabilidad buena midiendo la distancia entre los puntos de referencia óseos, aunque no se registraron los valores para que sirvieran de referencia posteriormente. En estudios futuros, sugerimos registrar estos valores para lograr una fiabilidad mayor.
Nuestro trabajo presenta algunas limitaciones. En primer lugar, algunos de nuestros pacientes no estaban sedados completamente o se movieron durante la evaluación. El aumento en el tono muscular que acompaña a un movimiento o un cambio en el nivel de conciencia del paciente puede alterar la medida del grosor, aunque se entrenó a los examinadores a que realizaran las mediciones durante períodos de relajación en pacientes despiertos y en movimiento. Creemos que esta podría ser la causa de las medidas que se encontraban fuera de los límites de concordancia en el análisis interobservador. En segundo lugar, algunas imágenes mostraron alteraciones en la ecogenicidad muscular. Estos cambios, debidos a trastornos agudos o crónicos, pueden afectar negativamente a la visualización de la imagen ecográfica y a la precisión de la evaluación del grosor muscular. Proponemos que estudios futuros evalúen e investiguen cambios en la ecogenicidad, como los cambios en tejido adiposo o fibroso, en asociación a medidas de grosor muscular, ofreciendo un análisis cualitativo y cuantitativo de las imágenes obtenidas. Por último, nuestro estudio fue realizado en un único centro e involucró a un número reducido de participantes, lo que podría limitar su generalización. Además, se excluyó a niños diagnosticados de enfermedades neuromusculares o trastornos neurológicos asociados a debilidad muscular o hipotonía, por lo que nuestros hallazgos podrían no ser aplicables a dicha población.
ConclusiónLa exploración ecográfica puede ser una herramienta valiosa para evaluar el grosor muscular con precisión en niños críticamente enfermos. En nuestro estudio encontramos una fiabilidad alta en la medición del bíceps braquial/músculo braquial y el cuádriceps femoral, y una fiabilidad interobservador alta entre examinadores recién entrenados y con experiencia. La ecografía musculoesquelética también se podría utilizar para monitorizar la pérdida muscular, por lo que se necesitan métodos de evaluación precisos para detectar cambios pequeños en el grosor muscular a lo largo de la estancia en la UCI, especialmente en niños pequeños.
Son necesarios estudios adicionales para establecer un abordaje estandarizado para la monitorización mediante ecografía de los cambios musculares en niños críticamente enfermos para incorporar su uso en la práctica clínica en unidades de cuidados intensivos pediátricos.
Aprobación éticaEl estudio fue aprobado por el Comité Ético de Investigación (2021-0119).
FinanciaciónEl estudio no recibió fondos específicos de agencias financiadoras públicas, privadas o sin ánimo de lucro.
Conflicto de interesesLos autores no tienen ningún conflicto de intereses que declarar.