Introducción
Los glucocorticoides inhalados (GCI) constituyen actualmente el tratamiento de primera línea en el asma. Debido a ello, el asma se ha convertido en una enfermedad menos grave, mejor controlada, disminuyendo la utilización de los glucocorticoides sistémicos, con la reducción de los efectos colaterales de los mismos.
Es bien conocido el efecto supresor de los glucocorticoides orales sobre el eje hipotálamo-hipofisario-adrenal, retrasando el crecimiento y afectando al metabolismo óseo. Por vía inhalatoria estos efectos se reducen considerablemente, aunque su seguridad es todavía cuestionada1.
El crecimiento en los seres humanos no es un proceso continuo, sino escalonado, con variaciones estacionales, que está influido por diferentes factores en cada etapa de la vida. En el paciente asmático, además está influenciado por otros condicionantes, como la gravedad de la enfermedad, aspectos sociales y psicológicos, estado de nutrición, edad, pubertad, factores genéticos, exposición al tabaco y tratamientos. Todo ello hace que sea difícil la interpretación de los resultados obtenidos en los estudios sobre la influencia de los GCI2.
En la evaluación del metabolismo óseo, contamos con marcadores de formación ósea, como son la fosfatasa alcalina, la osteocalcina, el nivel sérico del propéptido carboxiterminal del procolágeno tipo I (PICP), etc.; marcadores de resorción, tales como los niveles séricos del telopéptido carboxiterminal del colágeno tipo I (ICTP), de la fosfatasa ácida tartrato resistente (FART), de desoxipiridinolina/creatinina (DPYRCR), entre otros, y con la medida de la densidad mineral ósea (DMO).
El mayor uso de los GCI en la última década, ha despertado un gran interés, por lo que se han sucedido múltiples estudios sobre su influencia en el crecimiento, en la DMO y en los marcadores óseos, tanto en adultos3-6 como en niños 7-10. Los resultados no son concluyentes. Así, en algunas series de adultos asmáticos que recibían GCI se ha encontrado disminución de la DMO11-14, sin embargo, en otras series no se ha hallado esa asociación4,15. Así mismo, la talla de adultos asmáticos tratados con GCI durante la infancia, por largos períodos de tiempo (3-9 años), no difirió de la de adultos que no recibieron tratamiento corticoideo5,6.
No existe tampoco unanimidad con respecto a los resultados de los marcadores óseos en pacientes tratados con GCI, encontrándose en algunos estudios en adultos disminución de los parámetros de formación ósea16-20, mientras en otros no3.
En la edad pediátrica la experiencia es más limitada y a su vez no concluyente, así encontramos estudios donde no se observa disminución de la DMO en niños asmáticos tratados con GCI, incluso durante varios años10,21-23, mientras en otros estudios sí se ha apreciado una disminución9,24.
Con respecto a los marcadores óseos, algunos estudios encuentran disminución de los marcadores de formación ósea en la infancia tras tratamiento con GCI7,21 mientras no se hallan cambios en ellos ni en los marcadores de resorción ósea en otros9,25.
Ante este estado de cosas, resulta de interés valorar la influencia del empleo de GCI sobre la DMO y otros parámetros de formación y resorción ósea, en niños asmáticos. Ese es el objetivo del presente estudio.
Pacientes y métodos
Se estudiaron un total de 151 niños, entre 1 y 17 años (edad mediana de 9 años), siendo el 59 % varones y el 41 % mujeres. Esta muestra se divide en 3 grupos: asmáticos bajo tratamiento con GCI de forma mantenida al menos durante 6 meses (grupo 1); asmáticos que sólo recibieron GCI de forma ocasional en las crisis durante ese período, como grupo control (grupo 2), y niños sanos, sin patología crónica, como segundo grupo control (grupo 3).
La selección de los sujetos del estudio se realizó entre los pacientes del Departamento de Pediatría, Unidad de Neumología Pediátrica del Hospital Universitario Nuestra Señora de la Candelaria y de los Centros de Salud de Finca España y Laguna-S. Benito, en Tenerife, Islas Canarias, con una estrategia de selección según orden de asistencia a las consultas y previo consentimiento informado de los padres.
A todos los pacientes se les determinó la DMO en la columna lumbar, con un densitómetro Hologic QDR-4500SL DEXA. Los resultados fueron expresados como z-score (DMO medida DMO media de la población de la misma edad y sexo, dividido entre su desviación típica) de la densidad mineral ósea (z-DMO). Se consideraron normales los valores de z-DMO mayor de 1, osteopenia los valores de z-DMO inferiores a 1 y osteoporosis si z-DMO era inferior a 2,5.
Además de la DMO se estudiaron diversos parámetros auxológicos: peso y talla; bioquímicos de formación ósea: calcio, fósforo, fosfatasa alcalina, hormona paratiroidea y osteocalcina, y de resorción ósea: calciuria, FATR y DPYRCR.
En los asmáticos con tratamiento se registró el tipo de GCI empleado, la dosis diaria y la dosis acumulada durante los 6 meses previos.
La muestra se describió empleando los estadígrafos adecuados a la naturaleza de la escala de medición y distribución de cada variable. Las variables se compararon entre los grupos empleando la prueba de la chi cuadrado de Pearson para las cualitativas, la de Kruskal-Wallis y post hoc de Mann-Whitney para las numéricas con distribución no normal, y análisis de la varianza (ANOVA) con post hoc de Bonferroni y t de Student entre 2 grupos para las de escala normales. Las correlaciones se estimaron mediante los coeficientes de Pearson o Spearman según naturaleza y distribución de las variables involucradas. Se realiza un análisis de regresión logística binaria múltiple para la osteopenia como variable dependiente y la condición de asmático con y sin GCI respecto al niño sano como independiente, ajustando los modelos por dosis diaria o acumulada de GCI, el género y la edad como factores de riesgo probable. Se realiza un análisis de regresión lineal múltiple para z-DMO como variable dependiente, y la condición de sano, asmático sin GCI o asmático con GCI, como variable explicatoria, ajustando los modelos por la dosis diaria o acumulada de esos fármacos, género del niño y su edad. Todas las pruebas se realizaron a un nivel de significación de 0,05 o con estimaciones en intervalos de confianza del 95 % (IC 95 %).
Resultados
El grupo 1 o de asmáticos con empleo mantenido de GCI quedó constituido por 71 sujetos. El grupo 2 o de asmáticos sin tratamiento con GCI lo formaron 44 individuos. El grupo 3 de niños sanos quedó conformado por 36 sujetos. No se detectaron diferencias significativas en cuanto a edad y sexo entre los 3 grupos.
En el grupo 1, 8 niños estaban tratados con fluticasona propionato (FP) y 61 con budesonida (BUD), siendo la dosis media diaria de BUD de 800 μg (400-1.600) y la dosis acumulada durante los 6 meses de 384 mg (17-1.440), la dosis diaria de FP de 300 μg (200-800) y la acumulada de 60 mg (7-288).
El 40 % de la muestra total presentó osteopenia y en 3 niños se apreció osteoporosis, perteneciendo dos al grupo 1 y uno al grupo 2. Los 60 niños con osteopenia de la muestra total se distribuyeron en: 63 % en el grupo 1, 27 % en el grupo 2 y 10 % en el grupo 3 (p = 0,001). Al comparar esta frecuencia de osteopenia entre los grupos se detectó que no alcanzaba la significación entre asmáticos con y sin tratamiento, ni entre asmáticos sin tratamiento y sanos, pero sí entre asmáticos con tratamiento y sanos (p < 0,001).
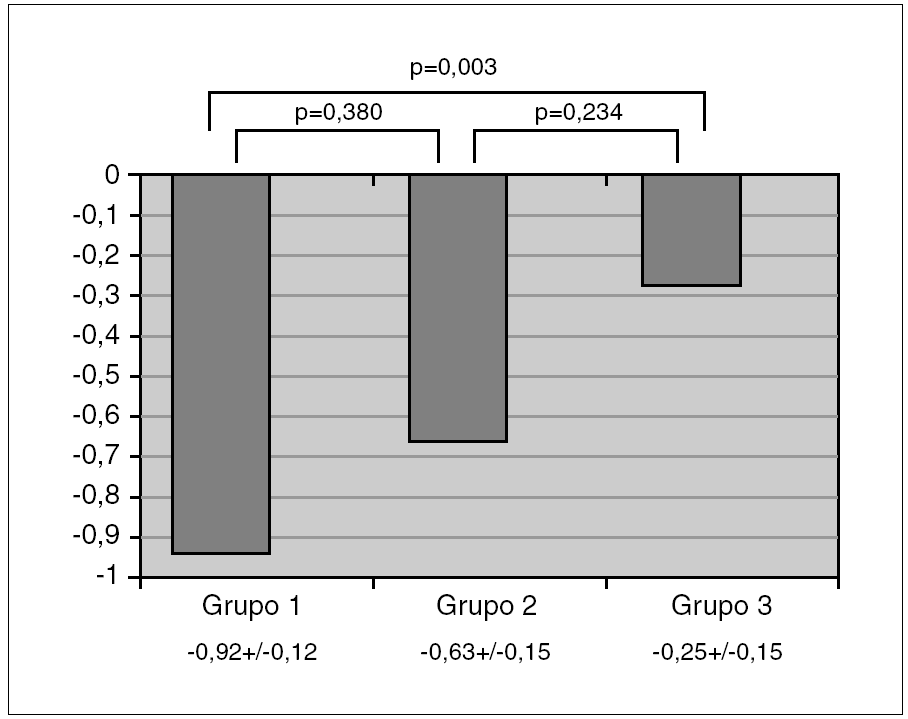
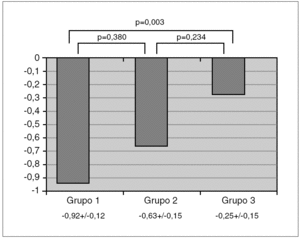
El ANOVA mostró una diferencia con significación estadística (p < 0,05) en z-DMO entre los 3 grupos. Las comparaciones post hoc demostraron que esta significación se alcanzaba a expensas de la diferencia entre asmáticos con tratamiento y sanos, con un exceso de 0,19-1,15 z-DMO (IC 95 %) de los sanos sobre los asmáticos con tratamiento; mientras la diferencia entre asmáticos con y sin tratamiento, y entre asmáticos sin tratamiento y sanos, no alcanzó la significación. La variación de z-DMO en cada grupo y los resultados de las comparaciones entre ellos se representan en la figura 1.
Figura 1. Valores de la densidad mineral ósea (z-DMO) en los grupos de asmáticos en tratamiento con glucocorticoides inhalados (grupo 1), asmáticos sin tratamiento (grupo 2) y niños sanos (grupo 3).
En el grupo 1 no se observaron diferencias significativas de z-DMO en relación con el tipo de glucocorticoide, la dosis diaria y la dosis acumulada. Así mismo, los valores z-DMO no se asociaron con el sexo ni con el índice de masa corporal (IMC) en ningún caso.
Los resultados de los análisis de regresión logística multivariante empleando la condición de osteopenia como resultado y al grupo como probable factor de riesgo a ella, ajustando los modelos por edad, género, dosis diaria y acumulada de GCI, se muestran en la primera sección de la tabla 1. Como se observa, los asmáticos del grupo 1 tienen un riesgo relativo de padecer osteopenia incrementado en casi tres veces respecto a los niños sanos del grupo 3, mientras no se observa ningún aumento de riesgo a padecer osteopenia entre los niños asmáticos sin tratamiento del grupo 2 respecto a los sanos del grupo 3.
Los resultados del análisis de regresión lineal multivariante empleando el valor de z-DMO como resultado y como factor que lo explicaría al grupo, y ajustando los modelos por edad, género, dosis diaria y acumulada de GCI, se presentan en la segunda sección de la tabla 1. Estos resultados apuntan a una reducción media de densidad ósea en 0,50 z-DMO si un niño pasara de ser sano, a ser asmático sin tratamiento de GCI y posteriormente con ese tratamiento.
No se obtuvo diferencias significativas en los parámetros bioquímicos, los marcadores de formación ósea (fosfatasa alcalina, osteocalcina), ni los de resorción ósea (FATR, DPYRCR) entre los 3 grupos.
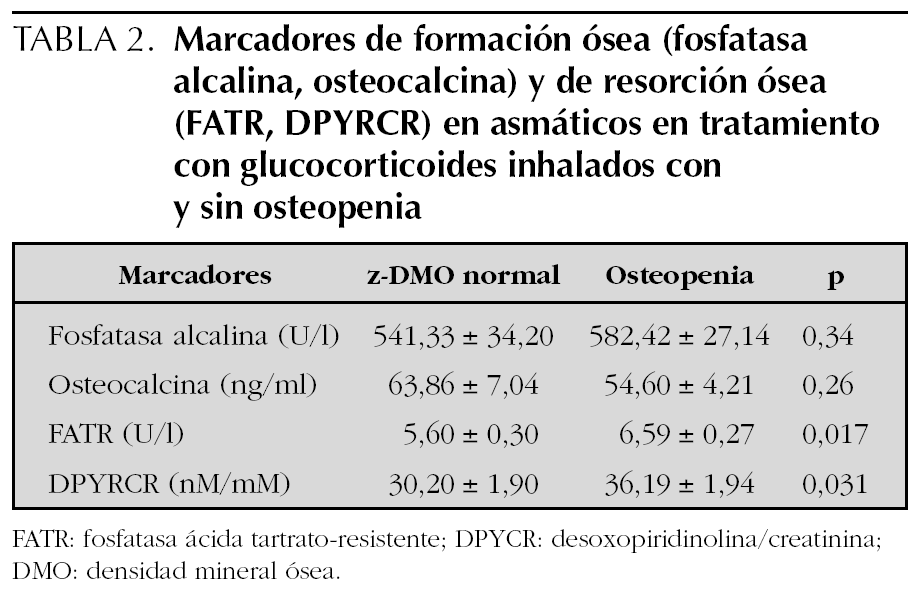
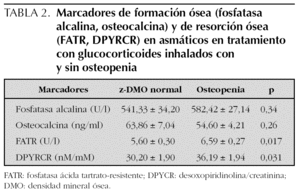
No se encontró diferencias en los marcadores de formación ósea entre los asmáticos con tratamiento y osteopenia y los asmáticos con tratamiento sin osteopenia, sin embargo los parámetros de resorción ósea se encontraron aumentados significativamente en el grupo con osteopenia. Este aumento de la resorción ósea no se relacionó con la dosis diaria ni con la dosis acumulada de GCI. Las medidas de resumen de todas estas variables en el grupo 1 y los resultados de su comparación se presentan en la tabla 2.
Discusión
El metabolismo óseo es un proceso dinámico basado en el equilibrio entre la formación ósea o actividad osteoblástica y la resorción ósea o actividad osteoclástica. Durante el crecimiento, la velocidad de formación de hueso es superior a la de resorción y el equilibrio de calcio es positivo. A partir de la cuarta o quinta décadas de la vida, la resorción de hueso predomina sobre la formación, lo que resulta en una pérdida progresiva de masa ósea26.
La administración de glucocorticoides puede afectar a la biología del hueso, tanto disminuyendo la formación ósea como aumentando la resorción, provocando así una disminución de la masa ósea.
Otros factores que influyen negativamente en el metabolismo óseo son: dieta baja en calcio, hábito de fumar, alcoholismo, deficiencia de estrógenos y escasa actividad física, factores que pueden alterar los resultados de los estudios sobre el metabolismo óseo en pacientes tratados con glucocorticoides27.
Los efectos de los glucocorticoides sobre el hueso pueden ser estudiados midiendo los marcadores de formación ósea, los marcadores de resorción ósea y la medida de la DMO.
Coincidimos con otros autores10,21 en que para evaluar los efectos de los GCI en el asma, el grupo control debería estar formado por niños asmáticos sin tratamiento y no por niños sanos, ya que los niños con asma crónica a menudo presentan unos patrones de crecimiento diferentes a los que tienen los niños sanos.
En nuestro estudio, además de valorar pacientes asmáticos con y sin tratamiento con GCI, incluimos también un grupo de niños no asmáticos. Harris et al28 realizaron un estudio similar al nuestro, comparando z-DMO de 76 niños asmáticos tras 6 meses de tratamiento con glucocorticoides inhalados (BUD, FP o dipropionato de beclometasona: BDP), con asmáticos sin tratamiento, no obteniendo diferencias cuando la dosis era baja o moderada, pero si la dosis de glucocorticoides era mayor de 800 μg/día, z-DMO disminuía con relación al grupo sin tratamiento.
En nuestro estudio no se encontraron diferencias de z-DMO en ambos grupos de asmáticos, con y sin tratamiento con GCI. A su vez, el valor de z-DMO no se relacionó con el tipo, la dosis diaria, ni la dosis acumulada de GCI. Resultados similares son reflejados en la literatura especializada29,30.
Agertoft el al10 realizaron un estudio longitudinal de seguimiento a 157 niños asmáticos tratados con BUD, con una dosis media de 504 μg/día y tratamiento prolongado durante 3 a 6 años, comparándolos con 111 niños asmáticos sin tratamiento de GCI, y no detectaron diferencias de z-DMO entre ambos grupos. Tampoco hallaron relación de z-DMO con la duración del tratamiento, la dosis diaria y la dosis acumulada de BUD.
Sin embargo, no todos los estudios ofrecen los mismos resultados. Así, Baxter-Jones et al31 hallaron diferencias de z-DMO en niños asmáticos tras 6 meses de tratamiento con GCI, en relación con los asmáticos sin tratamiento.
Al comparar los niños asmáticos en tratamiento con GCI con los niños sanos, se encontró en nuestro estudio una disminución de z-DMO en el grupo de asmáticos en tratamiento en relación con los niños sanos, pero no se observó entre los asmáticos sin tratamiento y los niños sanos.
Una limitación de nuestro trabajo fue el hecho de que no se recogió en la totalidad de los pacientes si habían recibido en algún momento corticoides sistémicos, por lo que no se pudo analizar esta posible influencia en los resultados obtenidos.
Boot et al9 identificaron una disminución de z-DMO en los asmáticos tras 3-8 años de tratamiento con GCI en comparación con niños sanos. En este estudio no se incluyó un grupo control de asmáticos sin tratamiento. Resultados similares entre asmáticos con tratamiento de GCI y niños sanos son referidos por otros estudios32,33. Sin embargo, en un estudio reciente de niños asmáticos que se trataron durante un año con 400 μg de BUD o 250 μg de FP no se encontraron diferencias de z-DMO con niños sanos34.
Con respecto a los marcadores óseos, en nuestro estudio no se encontró diferencias entre los grupos, de los marcadores de formación ósea (fosfatasa alcalina, osteocalcina) ni de los de resorción (FATR, DPYRCR).
Sorva et al7 encontraron una disminución de la osteocalcina en un estudio longitudinal de niños asmáticos tratados con 800 μg/día de BUD en comparación con los tratados con cromoglicato sódico, sin embargo no disminuían dichos valores con 400 μg/día de BUD. Los valores de PICP disminuían tanto con 800 μg/día como con 400 μg/día, tras los 5 meses de tratamiento.
Por el contrario, Chay et al25 no hallaron diferencias en los valores de osteocalcina tras 6 meses de tratamiento con BDP en un grupo de niños asmáticos al compararlos con asmáticos sin tratamiento.
Resulta interesante el estudio transversal de König et al21, en el que los niveles de osteocalcina en niños asmáticos no tratados con GCI fueron inferiores a los valores en niños sanos, sugiriendo un papel de la propia enfermedad sobre el metabolismo óseo. Otros autores9,30 no obtuvieron diferencias en los marcadores de formación ósea entre asmáticos sin tratamiento y niños sanos, ni entre asmáticos con y sin tratamiento de GCI.
Sin embargo, recientemente Akil et al35 encontraron disminución de la osteocalcina en 22 niños asmáticos en tratamiento con BUD, a una dosis de 400-600 μg/día, durante un período de sólo 3 meses, en comparación con 23 controles sanos.
Con respecto a los marcadores de resorción ósea, aunque no existe unanimidad en la literatura especializada, no parece existir diferencias entre niños asmáticos con y sin tratamiento con GCI25,30.
En nuestro estudio los niños asmáticos en tratamiento con GCI que presentaban osteopenia, tenían aumentados los marcadores de resorción ósea en relación con los asmáticos con tratamiento sin osteopenia. No podemos atribuir este hecho al uso de los GCI, ya que todos estaban con dicho tratamiento. Por otro lado, el aumento de la resorción ósea no se relacionó con la dosis diaria ni acumulada de GCI. Estos resultados junto con los obtenidos con z-DMO, que mostró diferencias entre asmáticos con tratamiento y niños sanos, pero no entre asmáticos con y sin tratamiento, hace pensar que no son sólo los GCI los responsables de la osteopenia en los asmáticos con tratamiento. Sugerimos la posibilidad de la existencia de algún factor de la propia enfermedad que pudiera incrementar la resorción ósea, tal vez la producción aumentada de citocinas con capacidad resortiva36,37, responsables también de la osteopenia. Se precisan nuevos estudios en esta línea, que ayuden a esclarecer esta sospecha.
Con relación a la influencia del tratamiento con GCI sobre la talla definitiva, en estudios realizados en adultos no se han obtenido diferencias en la talla de asmáticos tratados durante la infancia con GCI y los que no recibieron dicho tratamiento, ni con la talla de adultos sanos5,6. Así mismo, en una reciente revisión de la Librería Cochrane38 no encontraron evidencia del efecto de los GCI a dosis convencionales administradas por 2 o 3 años sobre la DMO, en adultos asmáticos o con enfermedad pulmonar obstructiva crónica moderada.
Respecto a la infancia, en el mayor estudio realizado hasta el momento8, con 1.041 niños asmáticos, tratados con BUD a 400 μg/día, nedocromil o placebo, durante 4-6 años, se detectó una disminución transitoria de la talla al final del primer año en el grupo con BUD, pero al final del tratamiento la velocidad de crecimiento fue similar en los 3 grupos. Resultados similares obtuvieron Altintas et al34 en un reciente estudio.
Por otro lado, el tratamiento con GCI en niños y adolescentes39, así como en adultos38 no parece aumentar el riesgo de fracturas, en comparación con los que no han recibido dicho tratamiento.
Concluimos, a partir de los resultados de nuestro estudio, que probablemente si hay efecto de los GCI en los valores de z-DMO de niños asmáticos. En estos niños la osteopenia además podría deberse a la existencia de algún factor de la propia enfermedad que aumente la resorción ósea. Por otro lado, el tipo de glucocorticoide inhalado, la dosis diaria y la dosis acumulada no parecen guardar relación con los valores de z-DMO. Sin embargo, se recomienda no superar los 400 μg/día de BUD o los 200 μg/día de FP, dosis que se consideran seguras en tratamientos prolongados. Por último, basándonos en nuestros resultados, los marcadores de formación y de resorción ósea no parecen afectarse por la inhalación de glucocorticoides. No obstante todo ello, para minimizar el riesgo de posibles efectos secundarios de los GCI, deben utilizarse los que tienen menor biodisponibilidad sistémica y a la dosis mínima necesaria para controlar la enfermedad. Igualmente, el crecimiento debería ser monitorizado en todos los niños tratados con GCI.
Se deben continuar realizando estudios longitudinales de seguimiento a largo plazo que confirmen o descarten nuestros resultados.
Correspondencia: Dra. C. Galván Fernández.
Centros de Salud Laguna-S. Benito y Finca España.
Urbanización Las Estrellas, 23. 38010 Santa Cruz de Tenerife. España.
Correo electrónico: cgalvanf@comtf.es
Recibido en octubre de 2006.
Aceptado para su publicación en marzo de 2007.