La obesidad en la edad pediátrica es cada vez más prevalente. La población hispana inmigrante tiene un alto riesgo de obesidad y de diabetes tipo 2.
ObjetivoAnalizar la influencia étnica en la prevalencia del síndrome metabólico (SM) y sus componentes en una población pediátrica obesa.
Pacientes y métodosEstudio retrospectivo de 616 niños y adolescentes obesos ([IMC>2 DE (Hernández 1998-2004)]: 142 hispanos y 474 caucásicos. Se comparan la prevalencia de SM y sus componentes (criterios modificados Cook 2003): obesidad y ≥2 de los siguientes: colesterol HDL<40mg/dl, triglicéridos >110mg/dl, presión arterial sistólica y/o diastólica >p90 (Task Force 2004) y alteración del metabolismo hidrocarbonado (ADA 2011). Se evalúa también: historia familiar de SM, HbA1c, insulinorresistencia (HOMA), función hepática y evolución del IMC al año de tratamiento con cambios en el estilo de vida.
ResultadosEl 30,5% de los hispanos presentan SM frente al 15,5% de los caucásicos (OR=2,4 [IC del 95%, 1,5-3,8]), p<0,005]) y OR de 2,5 al ajustar por sexo, IMC-DE y pubertad. Los hispanos presentan mayor insulinorresistencia (58,6% vs 42,86%, p<0,005) y peor evolución del IMC al año de seguimiento. No hubo diferencias en el resto de datos analizados. Encontramos una peor adherencia a las medidas de cambio de alimentación y ejercicio físico en el grupo hispano.
ConclusionesLa prevalencia de SM es superior en la población pediátrica hispana obesa que en la caucásica. La peor adherencia al tratamiento de los niños y adolescentes obesos hispanos hace que este grupo de pacientes tenga un riesgo potencialmente mayor de enfermedades cardiovasculares en la vida adulta.
Obesity in children is becoming more prevalent. Obesity and type 2 diabetes is higher in the Latin American immigrant population.
ObjectiveTo analyze the influence of ethnicity on the prevalence of metabolic syndrome (MS) and its components in an obese pediatric population.
Patients and methodsA retrospective study of 616 obese children and adolescents (BMI ≥2 SD [Hernández 88-04]), was conducted on 142 Latin American children and 474 Caucasians, which compared the prevalence of metabolic syndrome and its components according to modified Cook criteria (2003): obesity+2 or more of the following components: HDL-cholesterol <40mg/dl, triglycerides >110mg/dl, systolic and/or diastolic blood pressure >p90 (Task Force 2004), and impaired glucose metabolism (ADA 2011). Hepatic function, family history of MS, HbA1c, insulin resistance (HOMA) and BMI evolution at one year of treatment with changes in lifestyle (diet and exercise) were also assessed.
ResultsAlmost one-third (30.5%) of Latin American children had MS compared to 15.5% of Caucasians (OR=2.4 [CI 95%: 1.5-3.8]), P<.005] and OR=2.5 adjusting for sex, SD-BMI and puberty. Latin American children also had a higher insulin resistance (58.6% vs 42.8%, P<.005) and a worse outcome after one year of treatment.
ConclusionThere is a higher prevalence of MS in our Latin American obese pediatric population with poor adherence to the measures of change in lifestyle, making these patients a group with potentially increased risks of cardiovascular disease in adulthood
En la última década se ha producido un aumento ostensible en la prevalencia de obesidad en todas las edades. Este hecho tiene especial importancia en la infancia ya que se relaciona con una persistencia de la misma en la adolescencia y en la edad adulta1. Este incremento ha sido más acusado en los niños de origen hispano en comparación con los caucásicos2.
La obesidad y sus consecuencias metabólicas, como la dislipemia, la alteración del metabolismo hidrocarbonado y la hipertensión arterial, entre otros, forman parte de lo que se conoce como síndrome metabólico (SM)3, que se relaciona con un aumento del riesgo de desarrollar diabetes tipo 2 y enfermedad cardiovascular.
La tasa de sobrepeso en la población española de 4 a 24 años se ha incrementado aproximadamente un 10% en los últimos 20 años4. En la actualidad, se estima que en la edad pediátrica el 20% de los varones y el 15% de las niñas y adolescentes presentan sobrepeso y el 5% obesidad según los criterios internacionales definidos por Cole4–6.
La población inmigrante de origen hispano constituye un grupo con mayor riesgo de obesidad7,8. Según la Encuesta Nacional de Inmigrantes realizada por el Instituto Nacional de Estadística, en el año 2007, residían en España 4,5 millones de inmigrantes, de los cuales 1,8 eran de origen hispano9.
Existen discrepancias sobre la definición de síndrome metabólico (SM) en la edad pediátrica. Mientras que la International Diabetes Federation, en el año 2007, apunta que no se debe hablar de SM antes de los 10 años, otros autores, entre ellos Cook3, definen criterios de SM que se deben utilizar en la infancia.
No existen estudios en España que analicen la influencia étnica en la prevalencia de obesidad infantil o de SM. El estudio NHANES7, realizado en Estados Unidos (National Health and Nutrition Survey 2007-2008), demuestra una mayor prevalencia/incidencia de obesidad en niños hispanos en todos los rangos etarios7.
El objetivo de nuestro estudio es analizar el impacto de la influencia étnica en la prevalencia de SM y sus componentes en una población pediátrica obesa hispana y caucásica.
Pacientes y métodosEstudio retrospectivo de 616 niños y adolescentes remitidos a nuestra Unidad de Endocrinología Pediátrica para valoración de la obesidad entre los años 2000 y 2010. Edad media de 11±2,8 años (55% mujeres y 54% impúberes). De ellos, 142 eran de origen hispano (55% mujeres) y 474 de origen caucásico (52% mujeres). Los criterios de inclusión fueron: a) existencia de obesidad, definida por un IMC ≥2 desviaciones estándar (DE) para edad y sexo según las tablas españolas de Hernández10, que no fuese secundaria a patología orgánica conocida; b) origen hispano o caucásico, y c) ausencia de patología endocrinológica conocida.
La anamnesis incluyó datos sobre antecedentes familiares de primer grado de obesidad, diabetes mellitus (DM) o gestacional, dislipemia, hipertensión arterial (HTA) y/o enfermedades cardiovasculares. Se realizó en cada paciente una encuesta dietética y una valoración del ejercicio físico que realizaba.
En la exploración física la valoración de la obesidad se realizó a través del IMC en DE según tablas de Hernández et al. Se evaluó la presencia de acantosis nigricans y el estadio puberal (estadios de Tanner). La presión arterial (PA) se midió con el monitor Critikon dinamap 8100 tras haber permanecido el paciente al menos 5 min en reposo; se realizaron 3 mediciones, se escogió para el análisis el valor más bajo y se evaluó según los percentiles de la International Task Force11.
La valoración del metabolismo lipídico se hizo mediante la determinación en suero de los niveles de la lipoproteína de alta densidad del colesterol (HDLc) y los triglicéridos, que se midieron por métodos enzimáticos con el sistema AEROSET/ARCHITECT c8000 (Abbott). Los niveles en ayunas de HDLc y triglicéridos fueron expresados en mg/dl (media ± DE).
El metabolismo hidrocarbonato se valoró mediante sobrecarga oral de glucosa (SOG) (1,75g/kg, máximo 75g) tras 12h de ayuno y 3 días con una ingesta mínima de hidratos de carbono del 50% de las calorías totales diarias. Se determinó la glucemia (mg/dl) e insulinemia (μU/ml) a lo largo de 2h. La glucemia se midió a través del método de la glucosa oxidasa con el analizador AEROSET c8000 (Abbott) y la insulinemia, por inmunoensayo con el analizador Inmunolite 2000 (Siemens), mediante el cual se obvia la posible reactividad cruzada con la proinsulina. Se consideró hiperinsulinemia cuando en la SOG los niveles de insulina basal fueron superiores a 10,5μU/ml en prepúberes y 15μU/ml en púberes y/o un pico máximo de insulina de más de 150μU/ml y/o un valor de 75μU/ml a los 120min12. La insulinorresistencia (IR) se valoró mediante el uso del modelo homeostático de IR (HOMA-IR: glucosa en ayunas (mmol/l)×insulinemia en ayunas [μU/ml)/22,5]), considerando presencia de IR en niños prepúberes y púberes valores de HOMA-IR>2,4 y 3, respectivamente12. También se determinó la hemoglobina glucosilada (HbA1c, expresada en %). La HbA1c se midió con la técnica estandarizada para DCCT/NGSP e IFCC mediante HPLC de Menarini (vn 5,3±0,4%)
El SM fue definido según criterios Cook 20033 modificados, cuando se cumplían al menos 3 de los siguientes criterios: a) obesidad (IMC≥2 DE) (criterio obligatorio); b) HDLc<40mg/dl; c) triglicéridos >110mg/dl; d) PA sistólica y/o diastólica>p90; e) alteración del metabolismo hidrocarbonato (AMH) según los criterios de la American Diabetes Association 201113. Las AMH comprenden: alteración de la glucemia en ayunas (AGA): glucemia en ayunas ≥100mg/dl y <126mg/dl; alteración de la tolerancia a la glucosa (ATG): niveles de glucemia entre 140 y 199mg/dl a los 120min tras SOG y diabetes (DM): glucemia≥126mg/dl en ayunas o≥200mg/dl a los 120min tras SOG. Consideramos también la presencia de alteración indeterminada de la glucemia (AIG) ante niveles de glucemia ≥200mg/dl a los 30, 60 y/o 90min tras SOG, sin otras alteraciones presentes, y la determinación de niveles de glucemia ≥155mg/dl a los 60 min como marcador de riesgo posterior de AMH14.
Además, se valoró la función hepática mediante la determinación de los niveles séricos de glutámico oxalacético transaminasa (GOT), glutámico pirúvico transaminasa (GPT) y gamma glutamil transpeptidasa (GGT), expresados en unidades/litro (U/l). La GOT se determinó mediante método NADH (p-5p) midiendo la oxidación de NADH en NAD, la GPT mediante método FCC midiendo el índice de reducción y la GGT mediante método G-glutamil-carboxi-nitroanilida; en todas ellas se utilizó el equipo ARCHITECT ci 16000 (Abbott). Se consideró que existía alteración hepática si los niveles de GOT, GPT y/o GGT eran superiores a 50, 40 y 30 U/l, respectivamente. Se evaluó la existencia de esteatosis hepática primaria no alcohólica mediante ecografía abdominal, en ausencia de hepatitis infecciosa o autoinmune, enfermedad de Wilson, déficit de alfa-1-antitripsina y excluido el consumo de alcohol.
A todos los pacientes se les dieron normas dietéticas para seguir una alimentación equilibrada, normocalórica (hidratos de carbono 50-55%, grasas 25-30% y proteínas 15%-20%) y se les aconsejó la realización de ejercicio físico adecuado a su edad de forma diaria y regular. Las revisiones clínicas se programaron cada 2-3 meses y se analizó la variación del IMC al año de seguimiento. Definimos mejoría del IMC cuando este disminuyó más de 0,5 DE respecto al inicial. Se excluyó del análisis a los pacientes que acudieron a menos de 3 revisiones durante el seguimiento o faltaron a la revisión anual.
El estudio fue aprobado por el comité ético del hospital y todos los padres o tutores y pacientes menores mayores de 12 años firmaron el consentimiento para participar en el estudio una vez fueron informados del mismo.
El análisis estadístico de los datos se realizó con el programa SSPS, versión 15.0. Los datos se expresan como medias±DE según la fórmula (z=x – x¿/DE) o como porcentajes. Para la comparación entre grupos se utilizaron pruebas paramétricas: t de Student para las variables cuantitativas y chi cuadrado para las cualitativas. Para aquellos datos que no se ajustaban a la distribución normal se emplearon pruebas no paramétricas: la U de Mann-Whitney. Los resultados del análisis de SM fueron ajustados por IMC, pubertad y sexo, para evaluar la influencia de estos parámetros en las diferencias encontradas, Se realizó un análisis multivariente utilizando SM como variable dependiente y HbA1c, GOT, GPT, GGT, esteatosis hepática, ácido úrico e historia familiar de SM como variables dependientes. Se consideró significación estadística para un valor de p<0,05.
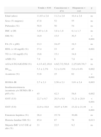
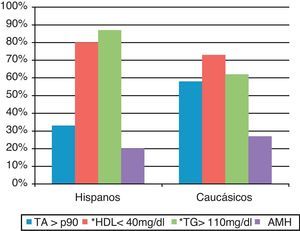
ResultadosEn nuestra población estudiada el 23% era hispana y el 77% caucásica, sin diferencias entre ambos grupos en edad, distribución de sexos ni estadio puberal. Tampoco existían diferencias significativas en el IMC entre ambos grupos. Las características de la muestra quedan reflejadas en la tabla 1. Encontramos una mayor prevalencia de SM en la población hispana frente a la caucásica (OR=2,4 [IC del 95%, 1,5-3,8]; p<0,005]. La OR de 2,5 obtenida tras ajustar por sexo, IMC-DE y pubertad asegura que ninguno de estos factores actúa como factor de confusión. Esta diferente prevalencia de SM entre hispanos y caucásicos es más llamativa en el grupo puberal (40,7% vs 19,7%; p<0,005), aunque se evidencia también en el grupo impúber (21,7% vs 11,2%; p<0,05). La presencia de los distintos componentes del SM quedan reflejados en la tabla 1 y la figura 1. Evaluando cada componente del SM por separado, ajustados por edad, IMC y pubertad, entre ambos grupos encontramos diferencias significativas en la prevalencia de HDLc<40mg/dl (23% de los caucásicos vs 45% de los hispanos; p<0,001) e hipertrigliceridemia>110mg/dl (15% de los caucásicos vs 35% de los hispanos, p<0,001); sin embargo, no encontramos diferencias significativas en la elevación de la PA (25% caucásicos vs 19% hispanos) ni en la presencia de AMH (presente globalmente en el 7,9% de los pacientes). La presencia de diabetes fue muy baja: en 3 caucásicos y en un hispano; esta se controló con pérdida de peso y ejercicio, necesitando la administración de metformina solo un paciente. La HbA1c fue significativamente mayor en el grupo de hispanos que en el de caucásicos (5,8±0,5 vs 5,2±0,5; p=0,002).
Características clínico-analíticas en población pediátrica obesa globales y por grupos étnicos
| Totaln=616 | Caucásicosn=474 | Hispanosn=142 | p | |
| Edad (años) | 11,03±2,8 | 11,2±2,8 | 10,4±2,8 | ns |
| Sexo (% mujeres) | 47,8 | 52 | 55 | ns |
| Puberales (%) | 50,9 | 50 | 54 | ns |
| IMC ± DE | 3,85±1,8 | 3,8±1,8 | 4,1±1,7 | ns |
| SM (%) | 18,9 | 15,5 | 30,5 | <0,001 |
| PA (% > p90) | 23,3 | 24,47 | 19,3 | ns |
| HDL (< 40mg/dl) (%) | 27,4 | 23 | 45 | 0,001 |
| TG (> 110mg/dl) (%) | 19,6 | 15,1 | 34,8 | |
| AMH (%) | 7,9 | 8 | 7,8 | ns |
| AGA/ATG/AIG/DM (%) | 4,1/3,4/2,1/0,6 | 4,6/2,7/2,5/0,6 | 2,2/5,8/0,7/0,7 | ns |
| HbA1c | 5,3±2,3% | 5,2±0,4% | 5,8±0.4% | 0,002 |
| Acantosis (%) | 33,6 | 25 | 62 | <0,001 |
| HOMA-IR | 2,7±2,1 | 2,56±2,1 | 3,01±2,4 | 0,003 |
| Insulinorresistencia (acantosis y/o HOMA-IR > p95) (%) | 45 | 42,3 | 58,6 | 0,002 |
| GOT (U/l) | 22,7±9,7 | 20,5±9,8 | 31,21±28,9 | <0,001 |
| GGT (U/l) | 22,9±16,8 | 16,07±5,94 | 23,22±21,44 | <0,001 |
| Esteatosis hepática (%) | 26,4 | 25,74 | 30,66 | ns |
| Historia familiar SM (%) | 85,4 | 87 | 78 | 0,013 |
| Mejoría IMC ≥ 0,5 DE al año (%) | 21 | 22,5 | 9,2 | ns |
SM: síndrome metabólico; PA: presión arterial; HDL: lipoproteína de alta densidad; TG: triglicéridos; AGA: alteración de la glucemia en ayunas; ATG: alteración de la tolerancia a la glucosa; AIG: alteración indeterminada de la glucemia; DM: diabetes mellitus; HOMA-IR: homeostatic model assessment-insulin resistance; SOG: sobrecarga oral de glucosa; GOT: glutámico oxalacético transaminasa; GGT: gamma glutamiltranspeptidasa; ns: no significativo.
La presencia de IR fue superior en los hispanos (HOMA-IR 3,01±2,4 vs 2,56±2,1; p<0,005) y también su expresión clínica como acantosis nigricans (62% vs 25%; p<0,005). La elevación de GOT y esteatosis hepática fueron significativamente superiores en los pacientes con IR (GOT [U/l]: 27±22 vs 20±9, p=0,001; esteatosis hepática: 50% vs 32%; p<0,001). En los pacientes con IR, el riesgo de esteatosis hepática fue 2,4 veces superior que en los pacientes sin IR (IC del 95%, 1,7-3,5; p<0,001) y el riesgo de hipertransaminasemia 4,5 veces superior (IC del 95%, 2,2-9,3; p<0,001). No encontramos diferencias significativas entre hispanos y caucásicos en esta asociación.
En el análisis multivariante de regresión logística con la variable SM como variable dependiente, el índice HOMA-IR, la GPT y la hiperuricemia fueron factores predictores de SM de forma significativa en el total de los pacientes, con p=0,006, p=0,006 y p=0,043, respectivamente, independientemente de las variables de confusión edad, sexo e IMC.
Se encontró historia familiar de DM, dislipemia, HTA o enfermedad cardiovascular en un 78% de los hispanos vs 87% de los caucásicos (p<0,05).
Respecto de la evolución clínica, evidenciamos mejoría del IMC al año de seguimiento en el 9,2% de los hispanos frente al 22,5% de los caucásicos (p=0,09). Completaron el seguimiento el 45% de los hispanos y el 76% de los caucásicos (p<0,001).
DiscusiónEn los países desarrollados, la enfermedad cardiovascular es la primera causa de muerte, por lo que en las últimas décadas ha aumentado el interés sobre la detección precoz de los factores de riesgo cardiovascular (FRCV)15. Recientemente, se ha demostrado que la obesidad en la edad pediátrica tiene repercusión sobre los FRCV y que estos se expresan cada vez en edades más tempranas15.
Hasta ahora no existían datos en nuestro país sobre la influencia de la procedencia étnica en la repercusión de la obesidad sobre los FRCV que componen el SM. Nuestro estudio pone de manifiesto que los pacientes pediátricos obesos de procedencia hispana tienen el doble de riesgo de presentar SM ante el mismo grado de obesidad que la población caucásica española obesa, lo que sugiere que la población hispana debe tener mayor riesgo genético para estos FRCV. Estudios realizados en otros países16 corroboran nuestros hallazgos, aunque los resultados no son totalmente comparables porque se utilizan diferentes definiciones de obesidad y SM.
En la valoración de los componentes del SM hemos encontrado que las alteraciones lipídicas tienden a ser más frecuentes en los pacientes hispanos mientras que las alteraciones de la PA lo son en los caucásicos, aunque sin significación estadística. Estas diferencias no las hemos encontrado en las alteraciones hidrocarbonadas. Estos aspectos no han sido especificados en otros estudios.
La presencia de una glucemia >155mg/dl a los 60min tras la SOG ha sido identificada como altamente predictiva de DM tipo 214,17. En nuestro estudio no se encontraron diferencias significativas en la presencia de esta alteración entre ambos grupos, pero hay que destacar el elevado porcentaje del total de pacientes que la presentan (8,3%). No se encontró relación entre su presencia y el grado de obesidad o los antecedentes familiares de DM. El seguimiento de estos pacientes nos ayudará a valorar su valor predictivo sobre el riesgo posterior de diabetes u otra alteración hidrocarbonada.
Aunque la valoración de la IR es difícil en la edad pediátrica, la mayoría de los autores12,18,19 consideran que la determinación del HOMA-IR puede ser utilizada como marcador de dicha alteración. En nuestro estudio, el valor de HOMA-IR fue significativamente superior en el grupo de hispanos en comparación con la población caucásica, con una buena correlación con la presencia de acantosis nigricans, indicador clínico conocido de IR.
Estudios previos han relacionado la persistencia de obesidad y SM en adolescentes hispanos con el empeoramiento progresivo de la sensibilidad a la insulina, la función de la célula beta pancreática, el incremento progresivo del riesgo de DM tipo 220 y el adelgazamiento de la íntima carotídea21.
El hallazgo en nuestra población de un mayor porcentaje de alteración hepática (hipertransaminasemia y/o esteatosis hepática) en hispanos fue ya evidenciado por Graham et al.22 en adolescentes hispanos obesos. También hemos encontrado una asociación entre hipertransaminasemia y SM, aspecto ya referido en otros estudios18,22–24. La existencia de esteatosis hepática en niños y adolescentes hispanos ha sido relacionada con la presencia de la variante polimórfica rs738409 de la proteína lipasa PNPLA325.
En el seguimiento de los pacientes, hemos constatado una peor adherencia al tratamiento, con una menor asistencia a las consultas programadas en la población hispana, con una peor evolución del IMC al año de seguimiento. El porcentaje de pacientes perdidos fue significativamente mayor entre los hispanos. Esto podría estar en relación con un menor nivel socioeconómico de esta población, aunque en el presente estudio no hemos valorado estos datos.
Entre las causas que pudieran explicar las diferencias étnicas, tanto en la presencia de obesidad como del SM asociado, se barajan tanto factores ambientales como genéticos. En comparación con niños caucásicos, se ha demostrado una mayor prevalencia de factores de riesgo relacionados con el desarrollo de obesidad en niños hispanos26, como son: la ingesta de bebidas azucaradas y comida rápida, el sedentarismo, la presencia de televisión en el dormitorio, la depresión materna, la obesidad materna al inicio del embarazo, una mayor ganancia ponderal durante el mismo con mayor proporción de diabetes gestacional, un aumento rápido del peso en los primeros meses de vida, una menor lactancia materna y la introducción temprana de alimentos sólidos. También se ha descrito que los niños hispanos duermen menos horas durante la primera infancia, con una relación demostrada inversamente proporcional entre horas de sueño entre los 6 meses y los 2 años, y obesidad a los 3 años de vida26. Respecto de los factores genéticos, hay que resaltar la hipótesis de Neel27 del «genotipo ahorrador», que a lo largo de generaciones ha seleccionado determinados polimorfismos en genes que codifican proteínas que influyen en el metabolismo lipídico e hidrocarbonado; estos polimorfismos, en condiciones de escasez, supusieron una ventaja genética para la supervivencia al favorecer el aprovechamiento de los alimentos a través de la resistencia insulínica y el depósito de grasa, pero al mejorar las condiciones ambientales, dicho genotipo ahorrador se convierte en un factor negativo, siendo más evidente en determinadas poblaciones, entre las que se encuentra la población hispana25,28,29.
En nuestro estudio, la historia familiar de SM en los pacientes afectados fue superior entre los caucásicos. Este dato, aunque en principio pueda parecer paradójico, podría explicarse en parte porque algunos de los componentes del SM puedan estar infradiagnosticados en los familiares de nuestra población hispana por el menor nivel sanitario de sus países de origen y porque las generaciones anteriores antes de emigrar no estaban expuestas a la sobrealimentación ni al sedentarismo.
En conclusión, encontramos un aumento de la prevalencia de SM en nuestra población pediátrica obesa de origen hispano en comparación con nuestra población de origen caucásico. Ello, junto a las mayores dificultades de seguimiento y la peor adherencia al tratamiento, hace que este grupo de pacientes constituya una población con un mayor riesgo potencial de enfermedades cardiovasculares en la edad adulta, lo que conllevaría una mayor morbimortalidad futura.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.