A pesar de ser una enfermedad rara, el cáncer es la primera causa de mortalidad por enfermedad durante la edad pediátrica en los países desarrollados. En este momento, la irrupción de nuevos tratamientos como la inmunoterapia constituye un nuevo paradigma clínico y regulatorio. Uno de estos tipos de inmunoterapia es la inmunoterapia celular. En particular, los medicamentos de terapia avanzada con receptores antigénicos quiméricos en los linfocitos T (CAR-T), y en concreto las células CAR-T19, han supuesto un nuevo escenario en el abordaje de los tumores hematológicos, como la leucemia aguda linfoblástica y los linfomas de células tipo B. La aprobación por las autoridades regulatorias de tisagenlecleucel y axicabtagene ciloleucel, ha impulsado la puesta en marcha del Plan Nacional de Terapias Avanzadas-Medicamentos CAR-T en España, evidenciándose no solo la conveniencia de identificar los centros más adecuados para su administración, sino la necesidad de que estos sufran una profunda transformación para que su actividad asistencial se extienda en algunos casos a la capacidad de fabricación propia de este tipo de terapias. Los hospitales especializados en hematooncología pediátrica tienen por tanto el reto de evolucionar hacia un modelo asistencial que integre la inmunoterapia celular, dotándose de capacidad propia para gestionar todos los aspectos relativos al uso, fabricación y administración de estos nuevos tratamientos.
Despite being a rare disease, cancer is the first cause of mortality due to disease during the paediatric age in the developed countries. The current, great increase in new treatments, such as immunotherapy, constitutes a new clinical and regulatory paradigm. Cellular immunotherapy is one of these types of immunotherapy. In particular, the advanced therapy drugs with chimeric antigen receptors in the T-lymphocytes (CAR-T), and particularly the CAR-T19 cells, has opened up a new scenario in the approach to haematology tumours like acute lymphoblastic leukaemia and the B-Cell lymphomas. The approval of tisagenlecleucel and axicabtagene ciloleucel by the regulatory authorities has led to the setting up of the National Plan for Advanced Therapies-CAR-T drugs in Spain. There is evidence of, not only the advantage of identifying the centres most suitable for their administration, but also the need for these to undergo a profound change in order that their healthcare activity is extended, in some cases, to the ability for the in-house manufacture of these types of therapies. The hospitals specialised in paediatric haematology-oncology thus have the challenge of progressing towards a healthcare model that integrates cellular immunotherapy, having the appropriate capacity to manage all aspects relative to their use, manufacture, and administration of these new treatments.
Hasta la mitad del siglo pasado, la leucemia, el cáncer más frecuente en la edad pediátrica, era una enfermedad incurable. En el año 1948, Sidney Farber fue el primero en demostrar cómo un fármaco inhibidor de la ruta del folato, la aminopterina, podía generar remisiones transitorias de esta enfermedad1. Posteriormente, Donald Pinkel incorporó el concepto terapéutico de combinación de quimioterápicos, «la quimioterapia total», con los que sinérgicamente inducían remisiones prolongadas1. Sucesivas optimizaciones sobre esta estrategia inicial han permitido hacer de la leucemia aguda infantil una enfermedad curable en la inmensa mayoría de los casos2-4. Sin embargo, aún en nuestros días en los países desarrollados, la primera causa de mortalidad por enfermedad en niños y adolescentes sigue siendo el cáncer.
El desarrollo y el impacto de la inmunoterapia en el tratamiento del cáncer en la última década son el fruto de lustros de investigación5-11. A diferencia de los tratamientos convencionales, la inmunoterapia pretende aprovechar, manipular e incrementar la capacidad de defensa que tiene el organismo para atacar y eliminar a las células tumorales. En la actualidad, la inmunoterapia antitumoral constituye el principal sector en desarrollo de ensayos clínicos a nivel global. Con el término inmunoterapia antitumoral se engloba un amplio abanico de posibilidades terapéuticas, que incluyen los anticuerpos monoclonales, los fármacos inhibidores de los puntos de control inmunitario, las vacunas, los virus oncolíticos, las citoquinas, inmunoterapias celulares adyuvantes y la inmunoterapia adoptiva con células T y células Natural Killer(NK) (tabla 1). Sin embargo, el reciente y renacido impulso de la inmunoterapia y su máximo interés clínico y social en estos momentos lo han suscitado las estrategias de inmunoterapia adoptiva con células T, basadas en modificaciones del receptor de los linfocitos T (TCR) y el desarrollo de receptores antigénicos quiméricos (CAR), con más de 700 ensayos clínicos activos en todo el mundo, tanto para el tratamiento de neoplasias hematológicas, como para, en menor medida, tumores sólidos.
Tipos de inmunoterapia contra el cáncer
| Tipos de inmunoterapia contra el cáncer | ||||||
|---|---|---|---|---|---|---|
| Inmunoterapia activa (amplificadores de la respuesta inmunitaria) | Inmunoterapia pasiva (iniciadores de una nueva respuesta inmunitaria) | |||||
| Inhibidores de los puntos de control inmunitario | Agonistas de los puntos de control inmunitario | Vacunas antitumorales/activadores de la inmunidad innata | Anticuerpos monoclonales (simples, conjugados y biespecíficos) | Virus oncolíficos | Terapia adoptiva de células T | |
| Objetivo | Aumentan la susceptibilidad de las células tumorales al ataque del sistema inmunitario | Estimulan el sistema inmunitario para atacar al tumor | Dirigidos específicamente contra las células tumorales | Destrucción directa de las células tumorales y desencadenan una respuesta inmunitaria importante | Mejora la capacidad natural de las células T contra el cáncer | |
| Mecanismo de acción | Bloquean los mecanismos que inhiben la respuesta inmunitaria (CTLA-4, PD- 1/PDL-1) | Estimulan las células presentadoras de antígeno y las células T | Modulan la respuesta innata (monocitos/macrófagos) | Localizan los antígenos en la superficie celular para cuyo reconocimiento han sido diseñados:Activan diversos mecanismo inmunitariosDirigen el fármaco contra las células tumorales | Lisan directamente las células tumorales y también activan células del sistema inmunitario | Se mejora la capacidad natural antitumoral de las células T mediante su modificación ex vivo y posterior infusión al paciente. |
| Nombre e indicación para laque tienen aprobación | Inhibidores de CTLA-4Ipilimumab:melanoma en pacientes >12 años y adultos (EMA y FDA)Inhibidores PD-1/PD-L1Nivolumab: cáncer colorrectal en pacientes > 12 años (FDA) y en melanoma, cáncer pulmón, riñón, linfoma Hodgkin, cabeza y cuello, vejiga en adultos (EMA y FDA)Pembrolizumab:linfoma Hodgkinlinfoma de células B grandes primario mediastínico r/r, tumores con alta IMS o dMMR no de SNC pediátricoEn todas las indicaciones población pediátrica y adultos (FDA) y solo adultos (EMA)Avelumab: carcinoma de células de Merkel mediastínico en pacientes pediátricos > 12 años y adultos (FDA) y solo adultos (EMA) | Mifamurtida: osteosarcoma pediátrico (EMA) | Dinutuximab beta: neuroblastoma población pediátrica > 12 meses (EMA)Blinatumomab: LLA-B pediátrico y adultos (EMA y FDA)Gemtuzumab ozogamicina: LMA pacientes > 15 años (EMA) y pediátrico y adultos (FDA) | Tisagenlecleucel: LLA-B r/r postrasplante o en segunda o posterior recaída en pacientes pediátricos y adultos jóvenes de < 25 años de edad (EMA y FDA). LBDCG r/r tras dos o más líneas de tratamiento sistémico en adultos (EMA y FDA) | ||
| Ensayos clínicos o en estudio (más relevantes) | Inhibidores PD-1/PD-L1 Otras indicaciones en población pediátrica: melanoma, glioblastoma con dMMRD, diversos tumores raros, linfoma anaplásico Alk+, desorden linfoproliferativo cerebral | En fases iniciales de investigación | Rituximab: enfermedades autoinmunespoblación pediátricaHu3F8: neuroblastoma población pediátricaHu14.18K322A: neuroblastomapoblación pediátrica | Reolysin:osteosarcoma y sarcomas de tejidos blandos: sarcoma de Ewingg, histiocitoma fibroso maligno, fibrosarcoma, leiomiosarcoma (población pediátrica y adultos)HSV G207: tumores cerebrales pediátricos | CART-CD22, CARTCD19, CART dual CD19/22: leucemia población pediátricaCART-CD22: linfoma población pediátricaCART-HER2, CARTEGFR: tumores del SNC r/rTIL modificados genéticamente: melanoma metastásico población pediátricaCélulas NKAES:tumores sólidos (sarcomas) y hematológicos (leucemias, linfoma) en población pediátrica | |
CAR: receptor de antígeno quimérico; dMMR: deficiencias en el sistema reparador MMR (mismatch repair); EMA: European Agency Medicines; FDA: Food and Drugs Administration; IMS: inestabilidad microsatelital; LCGBD: linfoma de células grandes B difuso; LLA: leucemia linfoblástica aguda; LMA: leucemia mieloide aguda; NKAE: células NK (Natural Killer) activadas y expandidas; SNC: sistema nervioso central; TIL: linfocitos infiltrantes de tumor.
Las unidades y servicios de Hematooncología Pediátrica de nuestro país están demostrando un claro interés por la inmunoterapia12,13. Este interés se justifica en el esfuerzo que muchas instituciones han realizado y están realizando al dotarse de equipos humanos multidisciplinares, con la adaptación y/o puesta en marcha de las infraestructuras necesarias para acoger estos programas terapéuticos innovadores (bien como centros administradores, o simultáneamente productores y administradores), o con la participación activa en proyectos a nivel preclínico y ensayos clínicos en torno a estos nuevos tratamientos. Una consulta realizada en junio de 2018 dentro del grupo de Inmunoterapia de la Sociedad Española de Hematología y Oncología Pediátricas, reflejó el interés de hasta trece centros por las inmunoterapias CAR, las células NK, los linfocitos T infiltrantes de tumor, los virus oncolíticos y los anticuerpos monoclonales, tanto en tumores sólidos (sarcomas y tumores del sistema nervioso central) y fundamentalmente en leucemias. Más aún, nueve centros refieren presentar una infraestructura propia, o a través de colaboraciones, de instalaciones autorizadas para la administración de terapias celulares, así como para la fabricación de medicamentos de terapia avanzada (MTA), y hasta un total de cuatro centros disponen de acreditación Joint Accreditation Committee International Society for Cellular Therapy Europe & European Group for Blood and Marrow Transplantation (JACIE) y otros cuatro están en proceso de solicitud de la misma.
Inmunoterapia con células CAR-TLa inmunoterapia CAR surge de la combinación de los avances en terapia humoral específica contra el tumor14 y de la manipulación genética de los linfocitos T (células CAR-T)15,16.Una célula CAR-T está compuesta de los dominios de reconocimiento antigénico obtenidos de las regiones variables de las cadenas pesada y ligera de un anticuerpo monoclonal específico, unidas entre sí para formar un anticuerpo de cadena simple (scFv). Este scFv está acoplado a un dominio de señalización derivado del dominio intracelular de la cadena CD3ζ del complejo del receptor de la célula T-CD3 (TCR-CD3). El Dr. Zelig Eshhar bautizó esta aproximación en sus orígenes como «T-body»17. Los primeros CAR-T así compuestos se denominan «de primera generación».
Actualmente la técnica ha evolucionado para incorporar a la estructura de señalización diferentes dominios procedentes de moléculas coestimuladoras, como CD28, OX40 o 41BB, dando lugar a los CAR-T de segunda y tercera generación. Alternativamente a los scFV, también pueden utilizarse receptores como NKG2D, CD16 o Erb-B18,19. A priori, pueden diseñarse CAR-T dirigidos contra cualquier antígeno extracelular, pero los dirigidos contra el antígeno CD19 (CART-19), que se expresa en linfomas y leucemias linfoblásticas agudas (LLA) de tipo B, representan el mayor éxito clínico por el momento, con la entrada en el mercado estadounidense en otoño del año 2017 y en el europeo en verano del 2018 de dos terapias comerciales autólogas, Kymriah® (tisagenlecleucel) de Novartis y Yescarta® (axicabtagene ciloleucel) de Gilead/KitePharma20-22.
En España, y en paralelo al desarrollo comercial, se están desarrollando CART-19 en instituciones académicas. Los primeros centros públicos en impulsar esta estrategia fueron los Hospitales Clinic y Sant Joan de Déu en Barcelona para pacientes pediátricos con LLA-B y adultos con neoplasias linfoides B CD19+23. Actualmente conviven en nuestro país los CAR-T comerciales y los académicos en el marco de ensayos clínicos.
Desde el punto de vista regulatorio, las células CAR-T son MTA en cuanto a su desarrollo y fabricación. El desarrollo de medicamentos o productos en investigación comprende varias fases para demostrar los requisitos fundamentales de calidad, seguridad y eficacia del producto24-27. Los estudios preclínicos in vitro e in vivo constituyen la prueba de concepto para dar paso a los ensayos clínicos. La confirmación de la eficacia en ensayos fase III conduce a la solicitud de autorización de comercialización a nivel europeo. Hasta hace unos años, los MTA han tenido un éxito comercial limitado, pero en la actualidad la industria ha aceptado estos desafíos y está desarrollando este tipo de tratamientos. No obstante, la academia sigue siendo la principal fuerza impulsora del desarrollo tecnológico de este tipo de terapias, lo que se refleja en el aumento creciente en el número de alianzas de colaboraciones academia-industria.
Terapia con células CAR-T en una unidad hospitalariaLa inmunoterapia CAR-T presenta una elevada morbilidad, en especial en aquellos pacientes con elevada carga tumoral. Complicaciones como el síndrome de liberación de citoquinas, alteraciones neurológicas, citopenias prolongadas o aplasias de linfocitos B, requieren para su manejo equipos multidisciplinares con experiencia en estas complicaciones, algunas propias de la terapia CAR-T y otras habituales en el contexto del trasplante de progenitores hematopoyéticos alogénico.
El abordaje de los tratamientos basados en inmunoterapia con células CAR-T, requiere un equipo multidisciplinar de diferentes profesionales para abarcar todas las fases del proceso hasta su administración al paciente y cuidados postadministración: estudio del caso clínico y admisión para el tratamiento, recolección del material de partida, envío al fabricante externo de la terapia o producción propia, preparación del paciente con quimioterapia de linfodepleción, infusión de las células CAR-T y seguimiento y tratamiento de las complicaciones tras su infusión en fases tempranas y tardías y aspectos regulatorios28-30. Por estos motivos, el equipo que proporcione cobertura a todo el proceso debe estar integrado por diferentes especialistas y estrechamente coordinado: hematólogos, oncólogos, intensivistas, pediatras, neurólogos, inmunólogos, biólogos, genetistas, farmacólogos, farmacéuticos hospitalarios, expertos en regulación, enfermería, especialidades de soporte y expertos en diferentes sistemas de calidad. Desde noviembre de 2018, nuestro sistema nacional de salud (SNS) ha establecido un Plan Nacional, y las diferentes Consejerías un Plan Regional, para los MTA y la administración de CAR-T. El objetivo ha sido organizar de forma planificada, equitativa, segura y eficiente la utilización de estos medicamentos en unas condiciones que garanticen los estándares de calidad, seguridad y eficacia. Este plan se ha desarrollado en colaboración con las comunidades autónomas, sociedades científicas y asociaciones de pacientes, e incorpora la visión estratégica de impulsar la investigación pública, así como la traslación de esta a la práctica clínica y la fabricación propia de los CAR académicos. El 4 de marzo de 2019 se aprobaron los criterios y estándares para la designación de centros para la utilización de medicamentos CAR-T en el SNS.
En abril de 2019, el Ministerio de Sanidad presentó la lista de los centros españoles autorizados para administrar terapias CAR-T. Se han designado ocho centros para el tratamiento de pacientes adultos con linfoma difuso de células grandes B (LDCGB) recidivante o refractario o con LLA-B refractaria. En el caso de los pacientes pediátricos se han designado tres centros para el tratamiento de la LLA-B refractaria. Así mismo, se han designado tres centros más para ofrecer las nuevas terapias CAR-T en caso de que haya sobrecarga asistencial, dos para adultos y uno pediátrico.
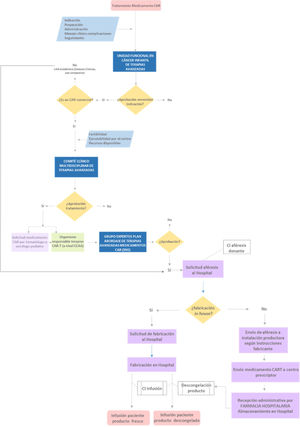
Los centros autorizados para la utilización de los medicamentos CAR-T dispondrán de unidades multidisciplinares para el abordaje integral de la utilización del medicamento y del manejo clínico del paciente. Estas unidades integrarán al responsable del programa CAR-T y tanto a los clínicos que intervengan en el proceso asistencial como a otros profesionales. Un ejemplo del diagrama de flujo del proceso ante la necesidad de valoración de un tratamiento CAR-T se expone en la figura 1.
Los requisitos regulatorios en cuanto a la fabricación de células CAR-T, al ser MTA, tienen un impacto directo en las infraestructuras y el personal involucrado directa e indirectamente en su fabricación31,32. Esta situación supone un desafío particularmente importante en el ámbito académico-hospitalario, pues se requieren instalaciones good manufacturing practice (GMP, tradicionalmente salas blancas)19,33,34. La normativa GMP se ha aplicado clásicamente a la fabricación de medicamentos «convencionales», por lo que su aplicación a las terapias avanzadas y manipulación de células y tejidos requiere una adaptación considerable35. Además, el introducir la gestión de una planta de fabricación farmacéutica para la producción de medicamentos en un entorno hospitalario puede generar muchas dificultades prácticas. Tanto es así, que recientemente el Comité de Terapias Avanzadas de la Agencia Europea del Medicamento (European Medicines Agency [EMA]) ha establecido unas directrices específicas para estos medicamentos36. Por tanto, la fabricación de terapias avanzadas en general, y de medicamentos CAR-T en particular, precisa de la integración en los hospitales de profesionales especializados en diferentes áreas y, por tanto, una transformación del modelo asistencial.
Administración de células CAR-TUna vez que se establece la indicación y se aprueba, el paciente se programa para una linfoaféresis. Para las terapias autólogas disponibles actualmente (tisagenleuclecel, axicabtagen ciloleucel y el CART-19 académico), es necesaria una cifra mínima de linfocitos T que además tengan capacidad de expansión, por lo que resulta crítico identificar el momento óptimo para la obtención de las células, para preservar la cantidad y calidad de esta población leucocitaria. La criopreservación de la linfoaféresis se establece para tisagenleuclecel y no para axicabtagen ciloleucel. En el caso de los dos productos comerciales, al tratarse de fabricaciones externalizadas, el material de partida extraído en el hospital es enviado a la planta de fabricación del medicamento CAR-T y, una vez fabricado, se envía de nuevo al centro prescriptor. El circuito debe cumplir en todo momento con la legislación aplicable a cada fase del proceso para garantizar la calidad, seguridad y trazabilidad del mismo, por lo que se requiere personal especializado en la realización de aféresis, terapias celulares y coordinadores de enfermería para la clínica y toda la logística. El Servicio de Farmacia Hospitalaria es fundamental en la cadena de custodia y todo el circuito de solicitud y recepción del medicamento fabricado, y en la farmacovigilancia posterior. El promedio de tiempo para la fabricación de CAR-T comerciales, a partir de la aféresis, envío a la compañía y recepción del producto fabricado es variable, estimándose en 17-60 días. En los días previos a la infusión del CAR-T, se procede a la preparación del paciente, evaluándose el estado de su enfermedad y su estado clínico. Posteriormente, se procederá a un esquema de tratamiento de linfodepleción, que facilite la expansión posterior del CAR-T. Durante la infusión del producto, así como en el período postinfusión, es fundamental la vigilancia ante la posible aparición de efectos adversos (toxicidad neurológica, síndrome de liberación de citoquinas, etc.), por lo que, entre las especialidades médicas que integran el equipo multidisciplinar, deben participar activamente neurología infantil y cuidados intensivos pediátricos. Diferentes sociedades científicas como la American Society of Gene and Cell Therapy, the Foundation for the Accreditation of Cell Therapy eInternational Society for CellularTherapy, están desarrollando guías para armonizar el manejo de la terapia CAR-T, así como para el tratamiento de sus potenciales toxicidades.
Impacto social y económico de la terapia CART-19En España, el Ministerio de Sanidad, Consumo y Bienestar Social anunció en diciembre de 2018 la financiación de la primera terapia celular CAR-T (CART-19 tisagenleuclecel) por el SNS para el tratamiento de LLA-B refractaria y del LDCGB, y recientemente se ha anunciado el primer paciente pediátrico con LLA-B curado con esta terapia en el Hospital Sant Joan de Déu. En julio de 2019 el Ministerio ha aprobado el precio y la financiación de la segunda terapia industrial CAR-T (CART-19 axicabtagene ciloleucel) para el tratamiento de pacientes adultos con dos tipos de linfoma no Hodgkin: LDCGB y linfoma primario mediastínico de células B grandes. En nuestro país, la financiación de ambos tratamientos (tisangeleuclecel y axicabtagen ciloleucel) está sometida a acuerdos de riesgo compartido en dos pagos. Es importante destacar que además del coste del medicamento, hay que tener en cuenta los costes de la hospitalización, tratamiento de soporte y fármacos específicos para las complicaciones como los inhibidores de la interleucina-6 37.
Limitaciones y futuro de los CAR-TLas terapias CAR-T se han trasladado rápidamente al ámbito clínico dada la necesidad de atender a pacientes con enfermedad refractaria y con múltiples recaídas. En el caso concreto de la LLA-B las tasas de respuesta son históricamente superiores a las encontradas en la leucemia linfocítica crónica y linfomas de alto grado. Las razones para esta respuesta diferencial, en el caso del CART-19 en LLA-B, linfoma y leucemia linfocítica crónica, pueden ser múltiples e intrínsecas a la célula tumoral. Sin embargo, cada vez hay más evidencias que sugieren que la calidad del linfocito T autólogo que se usa como célula inmune efectora para su transducción con el CAR contribuye enormemente a la respuesta a la terapia. Desafortunadamente, la «funcionalidad» de los linfocitos T se ha estudiado frecuentemente en muestras clínicas al diagnóstico, mientras que apenas hay estudios que evalúen de forma prospectiva la calidad de los linfocitos T en la recaída o en estadios más avanzados de la enfermedad. Por tanto, resulta necesaria la realización de estudios funcionales de las células T en estadios de la enfermedad próximos a la potencial inclusión del paciente en ensayos con células CAR-T. Dichos estudios deberían ser longitudinales y comparar la naturaleza y función de los linfocitos T al momento del diagnóstico con donantes sanos de la misma edad, así como las diferencias entre los linfocitos T entre diagnóstico y recaídas pareadas. Estos estudios deben ofrecer información acerca de: a) la cantidad de linfocitos T disponibles para su uso en inmunoterapia adoptiva; b) la distribución de las poblaciones linfocitarias con especial énfasis en células Tγδ y células T de memoria; c) la capacidad proliferativa, de activación y proinflamatoria en respuesta al antígeno, y d) la expresión de receptores de puntos de control inmunitario que acostumbran a aumentar significativamente en fases avanzadas de la enfermedad, facilitando por ello el escape inmunológico y el agotamiento de los linfocitos T38,39. El desarrollo de CAR-T alogénicos universales a partir de pool de donantes disponible como medicamentos criopreservados constituyen un desafío para el futuro cercano. Para poder conseguir este objetivo se deben desarrollar sistemas de edición genética más seguros, que además de garantizar transducciones eficaces, permitan utilizar linfocitos T no restringidos a determinados antígenos leucocitarios humanos (HLA).
Por otra parte, la principal limitación de la terapia CAR-T en estos momentos, además de las complicaciones derivadas del tratamiento, es el coste y la complejidad de su fabricación. La posibilidad de utilizar CAR-T académicos constituye un desafío y a la vez una gran oportunidad. Por último, se tienen que desarrollar nuevas fuentes de células efectoras como por ejemplo células NK (CAR-NK) derivadas de sangre de cordón umbilical o la población de linfocitos T de memoria que permita vencer todas las limitaciones a día de hoy de la terapia CAR-T.
ConclusiónEstamos ante un momento trascendente en el manejo del paciente pediátrico con cáncer, en el que la inmunoterapia se está incorporando a los tratamientos convencionales con un impacto importante. Hasta la fecha, la terapia CART-19ha sido la inmunoterapia más exitosa y ya se encuentra aprobada para niños y adultos jóvenes de hasta 25 años con LLA-B refractaria o en segunda recaída. Por el momento, dos compañías tienen aprobado el uso de la terapia CAR-T aunque solo una de ellas tiene indicación para edad pediátrica y tendrá que establecerse y consolidarse un modelo logístico bajo los estándares farmacéuticos para su fabricación y distribución a nivel global a un gran número de pacientes, cuya idoneidad se comprobará con la experiencia. Por otra parte, todo lo relativo a los tratamientos puente, previos a la administración de la terapia CAR-T, y manejo posterior de complicaciones clínicas, requerirá una curva de aprendizaje de tal manera que cada centro establecerá también estándares propios sobre el uso de este tipo de productos. El modelo de fabricación propia por parte de cada centro en sistemas cerrados y simplificando la construcción de ambientes estrictamente controlados en cumplimiento con los estándares de calidad y seguridad de instalaciones de fabricación de medicamentos, permitirá, por un lado una optimización de los procesos y sus costes, proporcionando mayor seguridad para el paciente y redundando en una calidad asistencial de excelencia y competitiva al diseminarse las estrategias con la descentralización, y por otro, impulsar la actividad docente e investigadora en el área de la Hematooncología Pediátrica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Fundación CRIS contra el cáncer.
Isabel Mirones. Unidad de Investigación Traslacional y Terapias Avanzadas, Servicio de Hemato-Oncología Pediátrica, Hospital Universitario La Paz, Madrid.
Luisa Sisinni. Servicio de Hemato-Oncología Pediátrica, Hospital Universitario La Paz, Madrid.
Marina García-Morín. Departamento de Pediatría, Hospital General Universitario Gregorio Marañón, Madrid.
Javier Anguita. Servicio de Hematología, Hospital General Universitario Gregorio Marañón, Instituto de Investigación Sanitaria Gregorio Marañón (IiSGM), Madrid.
Manuel Ramírez, Miguel Ángel Díaz y Marta González. Unidad de Terapias Avanzadas, Servicio de Hemato-Oncología Pediátrica, Hospital Universitario Niño Jesús, Madrid.
Lucas Moreno y Laura Alonso. Servicio de Hemato-Oncolología Pediátrica, Hospital Universitario Valld’Hebron, Barcelona.
Susana Rives. Servicio de Hemato-Oncolología Pediátrica, Hospital Sant Joan de Déu, Barcelona.
Marta M. Alonso y Ana Patiño-García. Instituto de Investigación Sanitaria de Navarra (IDISNA), Pamplona, España; Programa de Tumores Sólidos y Biomarcadores, Fundación para la Investigación Médica Aplicada, Pamplona, España; Departamento de Pediatría, Clínica Universidad de Navarra, Pamplona, España.
Pilar Palomo. Unidad de Trasplante de Hematopoyético, Servicio de Hematología y Hemoterapia, Hospital Central de Asturias, Oviedo.
Jaime Verdú-Amorós. Unidad de Hemato-Oncolología Pediátrica, Hospital Clínico Universitario, Valencia.
Isabel Martínez. Unidad de Hemato-Oncolología Pediátrica, HM Hospitales, Madrid.
Garbiñe Lizeaga. Servicio de Farmacia, Hospital Universitario Donostia, San Sebastián, Guipúzcoa, España.
Pilar Guerra-García. Unidad de Hemato-Oncología Pediátrica, Hospital Universitario 12 de Octubre, Madrid.
José Luis Fuster, José M. Moraleda, Andrés Sánchez-Salinas y Miguel Blanquer. Sección de Hemato-Oncología Pediátrica, Unidad de TPH y Terapia Celular, Servicio de Hematología, Hospital Clínico Universitario Virgen de la Arrixaca, Murcia, España; Instituto Murciano de Investigación Biosanitaria (IMIB), Universidad de Murcia, Murcia, España.
Javier García-Castro. Unidad de Biotecnología Celular, Instituto de Salud Carlos III, Majadahonda, Madrid.
María Luisa Toribio e Hisse M. van Santen. Programa Interacciones con el Ambiente, Unidad Desarrollo y Función del Sistema Inmunitario, Centro de Biología Molecular Severo Ochoa, CSIC-UAM, Madrid.
Pablo Menéndez. Instituto de Investigación contra la leucemia Josep Carreras, Facultad de Medicina, Universidad de Barcelona, Barcelona; Instituto Catalán de Recerca i Estudis Avancats (ICREA) Research Professor; Centro de investigación en Res de Cancer (CIBERONC), ISCIII, Barcelona.
Antonio Pérez-Martínez. Unidad de Investigación Traslacional en Hemato-Oncología Pediátrica, Trasplante de Progenitores Hematopoyéticos y Terapia Celular, Hospital Universitario La Paz, Madrid, España; Servicio de Hemato-Oncología Pediátrica, Hospital Universitario La Paz, Madrid, España.