La incidencia de la enfermedad inflamatoria intestinal pediátrica ha aumentado en las últimas décadas. El objetivo del presente estudio fue evaluar el papel de la monitorización proactiva y en serie de los niveles de fármacos anti-TNF (factor de necrosis tumoral) para mantener la remisión clínica y la curación mucosa durante el seguimiento de pacientes pediátricos con enfermedad de Crohn (EC).
MétodoEstudio prospectivo que incluye a todos los pacientes diagnosticados de EC y tratados con adalimumab o infliximab entre mayo de 2015 y noviembre de 2020, en los que se ha realizado una monitorización seriada y proactiva de los niveles de anti-TNF.
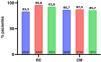
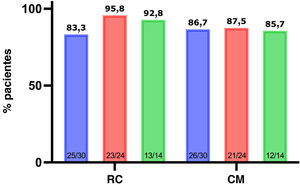
ResultadosSe incluyeron treinta pacientes, 21 varones (70%). La edad en el momento del diagnóstico fue de 11,3±2,0 años, la edad en el momento de iniciar el anti-TNF fue de 12,6±1,9 años con un tiempo medio de seguimiento de 27,1±9,1 meses. Se consideró remisión clínica si weighted Pediatric Crohn's Disease Activity Index (wPCDAI)<12,5 puntos y curación mucosa si el índice Mucosal Inflammation Non-invasive Index (MINI)<8. Durante el seguimiento, el paciente estuvo en remisión clínica en el 87,1% de las visitas, el 11,4% presentó enfermedad leve, el 1,5% enfermedad moderada y se asumió curación mucosa en el 83% de las visitas. Las tasas de remisión clínica y mucosa tras 1, 2 y 3 años de seguimiento fueron del 83,3%, 95,8%, 92,8% y 86,7%, 87,5% y 85,7%, respectivamente.
ConclusionesLa monitorización proactiva y seriada de los niveles séricos de anti-TNF podría permitir al paciente mantener la remisión clínica y la curación mucosa durante el seguimiento, optimizando individualmente la dosis requerida y minimizando la pérdida secundaria de respuesta.
The incidence of paediatric inflammatory bowel disease has increased in recent decades. The aim of the present study was to evaluate the role of proactive and serial monitoring of tumour necrosis factor (TNF) inhibitor levels to maintain clinical remission and mucosal healing in the followup of paediatric patients with Crohn disease (CD).
MethodProspective study that included all patients diagnosed with CD and treated with adalimumab or infliximab between May 2015 and November 2020 who underwent serial and proactive monitoring of TNF inhibitor levels.
ResultsThe study included 30 patients, 21 male (70%). The mean age at diagnosis was 11.3 years (SD, 2.0), the mean age at initiation of TNF inhibitors was 12.6 years (SD, 1.9) with a mean duration of follow-up of 27.1±9.1 months. Clinical remission was defined as a weighted Pediatric Crohn's Disease Activity Index (wPCDAI) of less than 12.5 and mucosal healing as a Mucosal Inflammation Non-invasive Index (MINI) of less than 8. During the follow-up, patients were in clinical remission in 87.1% of the visits, presented with mild disease in 11.4% and with moderate disease in 1.5%, and mucosal healing was assumed in 83% of the visits. The rates of clinical remission and mucosal healing at 1, 2, and 3 years of follow-up were 83.3%, 95.8%, 92.8%, and 86.7%, 87.5% and 85.7%, respectively.
ConclusionsProactive and serial monitoring of serum TNF inhibitor levels may make it possible for patients to maintain clinical remission and mucosal healing in the maintenance phase, with individualised optimization of the required dosage and minimization of secondary loss of response.
La enfermedad de Crohn (CD) es una enfermedad inflamatoria intestinal (EII) crónica que puede afectar de forma segmentaria y transmural a cualquier parte del tracto digestivo. Es un tipo de enfermedad inflamatoria intestinal, un término general que también engloba la colitis ulcerosa (CU) y la enfermedad inflamatoria intestinal no clasificada (EII-nc). La incidencia de la EII ha aumentado en las últimas décadas, tanto en España1,2 como a nivel mundial3. En los últimos años se han desarrollado diferentes estrategias, comprendidas en 3 líneas principales: diagnóstico, objetivos evolutivos y manejo terapéutico, con el fin último de modificar el curso de la enfermedad4.
El desarrollo de los fármacos contra el factor de necrosis tumoral (anti-TNF) ha supuesto un avance significativo en el tratamiento de estos pacientes, modificando su pronóstico a corto, medio y largo plazo,5 especialmente si se prescriben en el momento óptimo. En pacientes pediátricos, la identificación de factores asociados a un mal pronóstico podría indicar la necesidad del inicio precoz del tratamiento con anti-TNF para mejorar los resultados6. Las últimas guías de la European Crohn's and Colitis Organisation (ECCO) y la European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) recogen este aspecto7. Los objetivos del tratamiento van más allá de la remisión libre de corticoides. La curación mucosa (CM) y la curación transmural (CT), la remisión profunda (CM+CT), la prevención del daño intestinal y la discapacidad resultante y la mejora de la calidad de vida relacionada con la salud son objetivos particularmente importantes, como lo es la remisión clínica. Para alcanzar estos objetivos, es necesario un seguimiento estrecho de los pacientes con evaluaciones clínicas frecuentes4.
La monitorización de fármacos (MF) supone la medición periódica de los niveles séricos de fármacos y anticuerpos antifármacos. Puede ser reactiva si se lleva a cabo en respuesta a eventos que ya han ocurrido (recurrencia clínica, reacción infusional, efectos adversos, etc.), proactiva, si su objeto es alcanzar dianas preestablecidas, o predictiva, si se realiza para anticiparse a eventos futuros. El uso de las dosis indicadas en los estudios pivotales (REACH8 e IMAgINE19) daría lugar a resultados similares en la remisión, por lo que deberían explorarse otras estrategias para mejorar los resultados. Hay cierta controversia en cuanto a la eficacia, eficiencia10,11 y efectividad de la monitorización proactiva de niveles séricos de anti-TNF en los diversos escenarios que pueden presentarse durante el tratamiento con estos fármacos12. Durante el tratamiento de inducción, los niveles séricos de anti-TNF pueden utilizarse para establecer el riesgo de pérdida de respuesta secundaria precoz debido a la presencia de anticuerpos contra el anti-TNF13. El desarrollo de anticuerpos antifármaco (AAF) y los retrasos en la toma de decisiones sobre el tratamiento pueden afectar la futura evolución de la enfermedad. En este sentido, la monitorización proactiva de la concentración de anti-TNF podría permitir la detección precoz de AAF y la aplicación de estrategias dirigidas a prevenir la pérdida de respuesta secundaria12,14.
La MF proactiva reduce la necesidad de tratamiento combinado14, restringiendo su uso al manejo de situaciones temporales de mayor seriedad con aclaramiento aumentado del fármaco. Dado que los kits de ELISA disponibles en la actualidad no pueden medir niveles de fármacos y de anticuerpos simultáneamente, la monitorización proactiva de los niveles séricos de anti-TNF puede evidenciar una disminución progresiva de niveles sin haber cambiado la dosis o el intervalo entre dosis, lo que, de no haber un aclaramiento aumentado, podría reflejar el desarrollo de AAF15.
Los índices de actividad clínica solo tienen una correlación moderada con el grado de inflamación de la mucosa intestinal, por lo que no son instrumentos adecuados, por sí solos, para guiar la toma de decisiones en el manejo del paciente16. En este sentido, el Mucosal Inflammation Non-invasive Index (MINI) es un instrumento no invasivo que permite evaluar la inflamación de la mucosa en niños con EC, identificando a aquellos con curación mucosa con una alta sensibilidad (84%) y especificidad (87%)17, por lo que podría ser un indicador útil en la monitorización de fármacos. A continuación, se presentan los resultados a largo plazo de la monitorización de niveles de anti-TNF en pacientes con EC.
MétodosSe llevó a cabo un estudio descriptivo observacional prospectivo entre mayo de 2015 y noviembre de 2020. Se incluyó a todos los pacientes con diagnóstico de EC tratados con anti-TNF, con monitorización proactiva mediante determinaciones seriadas de concentraciones séricas de adalimumab (ADL) (Humira, AbbVie Deutschland GmbH& Co. KG) e infliximab (IFX) (Remicade, Janssen Biologics BV) durante la fase de mantenimiento. La EC se diagnosticó según los criterios de Oporto18, y el fenotipo de la EC se estableció atendiendo a la Clasificación de París19. Se excluyó a pacientes con CU, EII-nc o enfermedad perianal grave que requiriese intervención quirúrgica.
El peso (kg) y la talla (cm) se midieron en cada visita con el paciente descalzo y en ropa interior. Se calcularon los z-scores de peso, talla e índice de masa corporal (IMC) usando tablas de crecimiento españolas como referencia (https://www.seghnp.org/nutricional/)20.
También se calculó el índice ponderado de actividad de la EC pediátrica (weighted Pediatric Crohn's Disease Activity Index [wPCDAI])16 y el MINI17. La remisión clínica se definió como un wPCDAI inferior a 12,5, y la curación mucosa como un MINI inferior a 8. Se estudiaron las dosis de mantenimiento utilizadas en los estudios pivotales (REACH e IMaGINe1): 5mg/kg cada 8 semanas para el IFX8 y 40mg cada 2 semanas para el ADL9. El término pérdida de respuesta secundaria hace referencia a pacientes que responden al tratamiento de inducción, pero dejan de responder durante el tratamiento de mantenimiento21. Los mecanismos subyacentes a esta pérdida de respuesta pueden ser farmacocinéticos (concentraciones subterapéuticas de fármaco en ausencia de AAF), farmacodinámicos (con concentraciones adecuadas de fármaco) o inmunogénicos (concentraciones subterapéuticas de fármaco en presencia de AAF)22.
La remisión clínica (wPCDAI<12,5) en el contexto de una concentración de proteína C reactiva (PCR) de 5mg/L o superior se consideró EC silente23,24. Las muestras de sangre y heces se recogieron el mismo día que se administró el fármaco, antes de su administración. También se realizó hemograma y determinaciones de PCR, albúmina, calprotectina fecal, velocidad de sedimentación globular (VSG) y concentraciones séricas de IFX and ADL (monitorización de fármacos proactiva).
La determinación de las concentraciones de IFX, ADL y AAF se llevó a cabo mediante kits ELISA (Promonitor, Grifols). Los rangos de medición para las pruebas Promonitor-IFX y Promonitor-ADL fueron de 0,035 a 14,4μg/mL y de 0,024 a 12μg/mL, respectivamente. Los rangos para las pruebas Promonitor-Anti-IFX y Promonitor-Anti-ADL fueron de 5 a 1440AU/mL y de 10 a 2000AU/mL, respectivamente. La calprotectina fecal se midió mediante el Calprest (Eurospital), un kit ELISA que utiliza anticuerpos policlonales con un rango de medición de 15,6 a 500μg/g.
Las pautas de tratamientos fueron prescritas a discreción del facultativo a cargo del paciente, sin establecerse concentraciones diana predeterminadas de anti-TNF para el ajuste de dosis, aunque se tuvieron en cuenta otros parámetros en la toma de decisiones clínicas (datos clínicos, resultados analíticos y valores de calprotectina fecal). En la fase de mantenimiento, la concentración de IFX en sangre se midió cada vez que el paciente acudió a recibir la infusión de IFX, mientras que la concentración de ADL se midió a intervalos de 12 semanas o menos si había razón para sospechar recurrencia.
La adherencia al tratamiento se evaluó en base a los datos de dispensación de la clínica ambulatoria del servicio de farmacia mediante el cálculo de la tasa de posesión de medicación (TPM): (número de dosis unitarias dispensadas–número de dosis unitarias devueltas) / número de dosis unitarias prescritas×100.
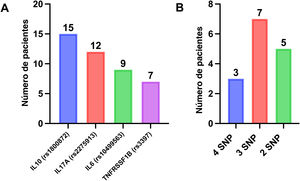
Polimorfismos de un solo nucleótidoAl igual que en estudios previos25–28, se investigó la presencia de polimorfismos de un solo nucleótido (SNP, del inglés single nucleotide polymorphism) en asociación a la respuesta a largo plazo al IFX y al ADL en la EC en 15 pacientes. El alelo TNFRSF1B C (rs3397); el genotipo IL10 CC (rs1800872); el alelo IL17A G (rs2275913) y el alelo C en IL6 (rs10499563) se han identificado como predictores de una respuesta a más largo plazo a los anti-TNF27.
Análisis estadísticoLas variables se expresaron como media y desviación estándar (DE) si los datos seguían una distribución normal, y en caso contrario como mediana y rango (RIC). La normalidad de la distribución se evaluó con la prueba de Kolmogorov-Smirnov. Los datos emparejados se compararon mediante la prueba t de Student y la prueba de los rangos con signo de Wilcoxon, y las proporciones mediante la prueba χ2. Para evaluar la correlación entre variables se utilizó el coeficiente de correlación de Spearman. Se generaron y analizaron curvas características operativas del receptor (ROC) para calcular los puntos de corte de la concentración de anti-TNF para definir la remisión clínica y la curación mucosa. Los valores de p<0,05 se consideraron significativos. El análisis estadístico se llevó a cabo con el software SPSS versión 25, y los gráficos se generaron con Prism 9 para macOS, versión 9.2.0 (283), 15 de julio, 2021.
ResultadosSe incluyó a 30 pacientes, 21 de ellos varones (70%), de los que 24 fueron tratados con ADL y 6 con IFX. La edad al diagnóstico fue de 11,3±2,0 años, y la edad media al momento de iniciar la terapia anti-TNF de 12,6±1,9 años. Las características clínicas y demográficas de los pacientes se presentan en la tabla 1.
Características basales de pacientes con enfermedad de Crohn tratados con terapia anti-TNF (N=30)
| Total (N=30) | ADA (n=24) | IFX (n=6) | p | |
|---|---|---|---|---|
| Sexo masculino, n (%) | 21 (70) | 17 (70,8) | 4 (66,6) | 0,028 |
| Edad al diagnóstico (años) | 11,3±2,0 | 11,1±2,1 | 11,8±1,3 | 0,561 |
| Tiempo transcurrido desde el debut al diagnóstico (m) | 4 (RIC 2,2-7) | 4,1 (RIC 2,2-6,9) | 3,3 (RIC 2,3-4,9) | 0,477 |
| Edad al inicio de anti-TNF | 12,6±1,9 | 12,7±1,9 | 12,4±1,8 | 0,743 |
| Tiempo desde el diagnóstico hasta la terapia anti-TNF (meses) | 9,9 (RIC 2,8-21,5) | 10.3 (RIC 4,4-24,1) | 3,7 (RIC 0,05-14,6) | 0,143 |
| Clasificación de París19al diagnóstico | n (%) | n (%) | n (%) | |
| A1b | 25 (83,3) | 20 (83,3) | 5 (83,3) | |
| A1a | 5 (16,7) | 4 (16,7) | 1 (16,7) | 0,731 |
| L3L4a | 13 (43,3) | 9 (37,5) | 4 (66,7) | 0,099 |
| L3L4b | 1 (3,3) | - | 1 (16,7) | |
| L1 | 8 (26,7) | 7 (29,1) | 1 (16,7) | |
| L3 | 4 (13,3) | 4 (16,7) | - | |
| L2 | 2 (6,6) | 2 (8,3) | - | |
| L1L4b | 1 (3,3) | 1 (4,1) | - | |
| L1L4a | 1 (3,3) | 1 (4,1) | - | |
| B1 | 27 (90) | 22 (91,6) | 5 (83,3) | 0,515 |
| B2 | 3 (10) | 2 (8,4) | 1 (16,7) | |
| Enfermedad perianal (p) | 11 (36,6) | 8 (33,3) | 3 (50) | 0,408 |
| Retraso del crecimiento (G1) | 5 (16,6) | 3 (12,5) | 2 (33,3) | 0,269 |
| Tratamiento anterior al anti-TNF | n (%) | n (%) | n (%) | |
| NEE | 28 (93,3) | 23 (95,8) | 5 (83,3) | 0,366 |
| AZA | 28 (93,3) | 22 (91,6) | 6 (100) | 0,634 |
| MTX | 4 (13,3) | 4 (16,6) | - | 0,499 |
| 6MP | 2 (6,7) | 1 (4,1) | 1 (16,6) | 0,366 |
| Corticoides | 12 (40) | 11 (45,8) | 1 (16,6) | 0,237 |
| Antropometría al inicio de anti-TNF | ||||
| Peso (kg) | 39,7 (RIC 33,6-47,6) | 41,2 (RIC 36,2-48,1) | 34,1 (RIC 28,3-40,2) | 0,078 |
| z-score de pesoa | −0,75 (RIC −1,4 a 0,08) | −0,42 (RIC −1,3 a 0,13) | −1,1 (RIC −1,9 a −0,02) | 0,259 |
| Talla (cm) | 148 (RIC 140,5-160,4) | 152,5 (RIC 141,7-163,7) | 141 (RIC 134,8-155,8) | 0,140 |
| z-score de tallaa | −0,39 (RIC −1,16 a 0,76) | −0,2 (RIC −1,06-0,78) | −0,52 (RIC −2,5 a −0,34) | 0,125 |
| IMC (kg/m2) | 17,8 (RIC 15,5-20,4) | 18,3 (RIC 15,8-20,5) | 16,1 (RIC 14,1-19,4) | 0,316 |
| z-score de IMCa | −0,7 (−1,1 a 0,53) | −0,38 (RIC −1,1 a 0,54) | −1,0 (−1,5 a −0,40) | 0,316 |
| wPCDAIbbasal | n (%) | n (%) | n (%) | 0,086 |
| Remisión | 8 (9,1) | 7 (29,1) | 1 (16,7) | |
| Leve | 10 (18,2) | 9 (37,5) | 1 (16,7) | |
| Moderado | 7 (31,8) | 5 (20,8) | 2 (33,3) | |
| Grave | 5 (40,9) | 3 (12,5) | 2 (33,3) | |
| Tratamiento concomitante al anti-TNF | n (%) | n (%) | n (%) | |
| AZA | 20 (66,7) | 17 (70,8) | 3 (50) | 0,306 |
| NEP | 19 (63,3) | 16 (66,7) | 3 (75) | 0,380 |
| Corticoides | 4 (13,3) | 3 (12,5) | 1 (16,7) | 0,612 |
| MTX | 1 (3,3) | 1 (4,1) | - | 0,793 |
| 6MP | 4 (13,3) | 1 (4,1) | 3 (50) | 0,169 |
| 5-ASA (oral) | 1 (3,3) | 1 (4,1) | - | 0,8 |
| MINI basal | 13 (RIC 9,5-14) | 11 (7-13) | 16 (10.5-17) | 0,243 |
| Resultados basales de laboratorio | Total (N=30) | ADA (n=24) | IFX (n=6) | |
| Calprotectina fecal (μg/g) | 623 (RIC 419-1410) | 623 (RIC 408-1290) | 752 (RIC 429-4206) | 0,437 |
| PCR (mg/L) | 20,3 (RIC 13-30,6) | 16,2 (RIC 12-28,5) | 38,4 (RIC 15,9-66,9) | 0,102 |
| VSG (mm/h) | 35 (RIC 17-45) | 35 (RIC 14-38) | 42 (RIC 20,2-86,2) | 0,121 |
| Albúmina (g/dL) | 3,6 (RIC 3,2-4,2) | 3,5 (RIC 3,2-4,3) | 3,7 (RIC 2,0-3,9) | 0,345 |
| Vitamina D (ng/mL) | 21,8 (RIC 18,0-28,9) | 18 (RIC 10-25) | 22 (RIC 9-27) | 0,865 |
| Hb (g/dL) | 11,9 (RIC 10,9-12,8) | 11,9 (RIC 10,3-12,8) | 11,3 (RIC 11,1-12,3) | 0,667 |
| Htc (%) | 36,6 (RIC 35,1-38,5) | 36,8 (RIC 34-38,7) | 36,2 (RIC 35,5-37,7) | 0,820 |
| LEUC (×109/L) | 7,4±2,2 | 7,4±2,4 | 7,4±1,7 | 0,743 |
| Plaquetas (×109/L) | 424±116 | 413±116 | 469±117 | 0,321 |
AZA: azatioprina; Hb: hemoglobina; Hct: hematocrito; LEUC: recuento de leucocitos; MINI: Mucosal Inflammation Non-Invasive Index (índice no invasivo de inflamación mucosa)17; MTX: metotrexato; NEE: nutrición enteral exclusiva; NEP: nutrición enteral parcial; PCR: proteína C reactiva; RIC: rango intercuartílico; VSG: velocidad de sedimentación globular; wPCDAI: Paediatric Crohn's Disease Activity Index (índice de actividad de la EC pediátrica) ponderado; 5-ASA: 5-ácido aminosalicílico; 6MP: 6-mercaptopurina.
Aunque inicialmente se ofreció tratamiento con ADL a los 30 pacientes, 6 lo rechazaron por miedo a las agujas. Los 6 pacientes tratados con IFX recibieron una dosis de inducción de 5mg/kg en los días 0, 2 y 6 de tratamiento y cada 8 semanas a partir de entonces. En el grupo tratado con ADL, 2 pacientes recibieron dosis de inducción de 80/40mg por pesar menos de 30kg, y el resto (22 pacientes) dosis de inducción de 160/80mg. La dosis mediana de ADL por kg de peso fue 3,9mg (RIC 3,3-4,3) en la primera dosis y 1,9mg (RIC 1,6-2,1) en la segunda. La dosis mediana por metro cuadrado fue de 118mg (RIC 103-130) en la primera dosis y de 59,1mg (RIC 51-65) en la segunda. La duración mediana del seguimiento fue de 27,1±9,1 meses (28,9±8,4 en pacientes tratados con IFX vs. 26,6±9,3 en los tratados con ADL; p=0,556). Durante el período de estudio, los pacientes realizaron un total de 218 visitas, 77 en el grupo tratado con IFX (12,8 visitas/paciente) y 141 en el grupo tratado con ADL (5,8 visitas/paciente). No hubo casos de pérdida de respuesta secundaria o interrupción de tratamiento por mala adherencia.
Pauta posológica de anti-TNF durante el seguimientoGlobalmente, 2 de los 6 pacientes tratados con IFX y 13 de los 24 tratados con ADL (33,3% vs. 54,1%; p=0,651) mantuvieron la dosis de 5mg/kg/8 semanas de IFX o la dosis de 40mg/2 semanas de ADL durante todo el seguimiento. En el grupo tratado con ADL, no hubo diferencias significativas en la duración del seguimiento entre los pacientes que requirieron ajustes de dosis y los que no los requirieron (24,5±8,5 meses vs. 30,9±9,3 meses; p=0,091). En el 48,6% de las visitas realizadas durante el período de estudio, la dosis y el intervalo entre dosis en la pauta prescrita a los pacientes fueron las empleadas en los estudios pivotales. Estratificando por fármaco, esto solo fue el caso en el 15,6% de los pacientes tratados con IFX, en comparación con el 66,7% de los tratados con ADL (p<0,0001). Las pautas de tratamiento se presentan en la tabla 2.
Dosis de infliximab y adalimumab y sus intervalos, y su frecuencia en episodiosa
| Pauta | n (%) |
|---|---|
| Infliximab | |
| 5mg/kg/8 sem | 12 (15,6%) |
| 7,5mg/kg/6 sem | 12 (15,6%) |
| 10mg/kg/4 sem | 12 (15,6%) |
| 7,5mg/kg/4 sem | 11 (14,3%) |
| 12mg/kg/4 sem | 9 (11,7%) |
| 10mg/kg/6 sem | 9 (11,7%) |
| 7,5mg/kg/8 sem | 5 (6,5%) |
| Otra | 7 (9%) |
| Total | 77 (100%) |
| Adalimumab | |
| 40mg/2 sem | 94 (66,7%) |
| 40mg/sem | 34 (24,1%) |
| 80mg/sem | 7 (4,9%) |
| 20mg/2 sem | 5 (3,6%) |
| Otra | 1 (0,7%) |
| Total | 141 (100%) |
sem: semana.
a Solo incluye pautas de tratamiento prescritas en 5 o más visitas.
Se evaluó el efecto del tratamiento concomitante con tiopurinas (azatioprina/6-mercaptopurina) o metotrexato en la necesidad de ajustar la dosis de anti-TNF o el intervalo entre dosis. En la muestra total, la dosis se ajustó a la empleada en estudios pivotales en el 45,5% de las visitas de pacientes que recibieron tratamiento combinado en comparación con el 53,5% de los pacientes manejados con monoterapia (p=0,138). En el grupo tratado con ADL, el tratamiento inmunomodulador concomitante (azatioprina/6-mercaptopurina o metotrexato) se asoció a un número mayor de visitas con la pauta de 40mg/2 semanas (85,1% vs. 61,2%; p=0,001), diferencia que no fue observada en el grupo tratado con IFX (12,5% vs. 2,2%; p=0,092).
Tiempo de respuesta del laboratorioEl tiempo de respuesta fue de 7 días (RIC 6-14 días) para los niveles de IFX, 9 días (RIC 4-18) para los niveles de ADL, y 4 días (RIC 2-8 días) para la calprotectina fecal. Los resultados de todas las demás pruebas de laboratorio estuvieron disponibles en menos de 48h.
Remisión clínica, enfermedad silente y pérdida de respuesta secundariaDurante el seguimiento, los pacientes se encontraban en remisión clínica en el 87,1% de las visitas, con enfermedad leve en el 11,4% y con enfermedad moderada en el 1,5%. En 22 de las 190 visitas en las que el paciente se encontraba en remisión clínica (11,5%) se objetivaron niveles de PCR≥5mg/L (EC silente). Se detectó pérdida de respuesta secundaria por mecanismo farmacocinético en el 7,3% de las visitas, sin diferencias según el anti-TNF utilizado (6,5% en el grupo tratado con IFX vs. 7,6% en el grupo tratado con ADL; p=0,513), y se consiguió recuperar la respuesta mediante el aumento de la dosis o el acortamiento del intervalo entre dosis. En todo el seguimiento no hubo casos de pérdida de respuesta secundaria debida a mecanismos inmunogénicos o farmacodinámicos o de interrupción del tratamiento. Ninguno de los pacientes requirió la adición de corticoides para alcanzar la remisión clínica.
Dos pacientes exhibieron un descenso progresivo de la concentración de anti-TNF en ausencia de aumentos en PCR o niveles de calprotectina fecal, lo que el médico a cargo, habiendo verificado la correcta administración del tratamiento, podría atribuir al desarrollo de AAF no cuantificables por la prueba de detección utilizada. En ambos casos, los niveles de anti-TNF volvieron a la normalidad tras la intensificación del tratamiento y se mantuvieron en el rango terapéutico sin necesidad de ajustes adicionales.
A los 12 meses de terapia anti-TNF, el 83,3% de los pacientes se encontraban en remisión libre de corticoides, a los 2 años, el 95,8%, y a los 3 años, el 92,8% (fig. 1).
También se observó mejoría en los valores de calprotectina fecal, albúmina, PCR, VSG, hemoglobina y vitamina D durante el seguimiento en comparación con los valores basales al inicio de la terapia anti-TNF (tabla 3).
Evolución hasta los 3 años de seguimiento
| Basal, n=30 | 1 año, n=30 | 2 años, n=24 | 3 años, n=14 | |
|---|---|---|---|---|
| Calprotectina fecal (μg/g) | 623 (419-1410) | 142 (32-254) | 131 (20-389) | 158 (37-458) |
| PCR (mg/L) | 20,3 (13-30,6) | 2,9 (2,9-5,6) | 2,9 (2,9-2,9) | 2,9 (2,9-16,8) |
| VSG (mm/h) | 35 (17-45) | 12 (4-16) | 10 (4-16) | 10 (3,5-22) |
| Albúmina (g/dL) | 3,6 (3,2-4,2) | 4,3 (3,5-4,5) | 4,2 (3,9-4,4) | 4,1 (3,7-4,3) |
| Vitamina D (ng/mL) | 21,8 (18,0-28,9) | 25,9 (23,1-32,4) | 28,6 (21,8-31,6) | 28,3 (17,4-34,1) |
| Hb (g/dL) | 11,9 (10.9-12,8) | 13,3 (12,2-13,9) | 13,8 (12,7-14,8) | 31,3 (12,4-14,7) |
| Htc (%) | 36,6 (35,1-38,5) | 39,5 (36,2-42,6) | 42,2 (39,4-43,7) | 40,1 (39,2-43,6) |
| LEUC (×109/L) | 7,4±2,2 | 6,4±1,6 | 6,9±1,5 | 6,5±0,8 |
| Plaquetas (×109/L) | 424±116 | 263±82 | 261±72 | 270±54 |
| Remisión clínica | 25 (83,3%) | 23 (95,8%) | 13 (92,8%) | |
| Curación mucosa | 26 (86,7%) | 21(87,5%) | 12 (85,7%) |
Remisión: wPCDAI <12,516; curación mucosa: MINI <8. Datos presentados como mediana (rango intercuartílico), media±desviación estándar o n (%).
Hb: hemoglobina; Hct: hematocrito; LEUC: recuento de leucocitos; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
En el total de pacientes, la puntuación mediana en el MINI durante el seguimiento fue de 4 (RIC −3 - 7), identificándose CM en el 83% de las visitas. Los resultados se muestran en la figura 1. La correlación entre las puntuaciones en el MINI y el wPCDAI fue débil: 0,298 (p<0,0001).
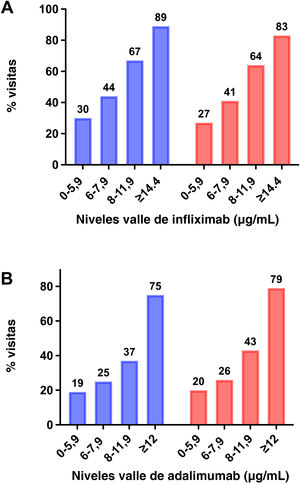
Concentraciones de fármaco para la remisión clínica y curación mucosaLa figura 2 muestra el porcentaje de visitas en las que los pacientes se encontraban en remisión clínica o mostraban CM según la concentración de anti-TNF.
En el caso del IFX, niveles séricos de 5,85μg/mL predecían la remisión clínica (área bajo la curva [AUC] 0,614 [0,405-0,823]; p=0,328) con una sensibilidad del 68,4% y una especificidad del 57,1%, y niveles de 7,30μg/mL predecían la CM (AUC 0,584 [0,377-0,791]; p=0,383), con una sensibilidad del 58,5% y una especificidad del 54,5%.
En el caso del ADL, niveles séricos de 9,4μg/mL predecían la remisión clínica (AUC, 0,626 [0,478 -0,774]; p=0,082) con una sensibilidad del 61,7% y una especificidad del 63,2%, y niveles de 9,7μg/mL predecían la CM (AUC, 0,464 [0,347-0,580]; p=0,562) con una sensibilidad del 59% y una especificidad del 37%.
Adherencia al tratamientoSe observó una adherencia media global del 90,5±6,8%. En el grupo tratado con ADL, la adherencia media fue del 92,2±5,9%, mientras que en el tratado con IFX fue del 85,7±8,1% (p=0,527).
Asociación de SNP con la respuesta a largo plazo a anti-TNFEn todos los pacientes en los que se realizó estudio farmacogenético (n=15) se detectaron al menos 2 SNP asociados a una respuesta a largo plazo a los anti-TNF (fig. 3).
DiscusiónLos resultados del estudio muestran que la monitorización proactiva de los niveles de anti-TNF combinados con otros parámetros inflamatorios es una práctica eficiente, ya que reduce el riesgo de recurrencia clínica y analítica y la pérdida de respuesta secundaria por mecanismos inmunogénicos o farmacocinéticos, además de permitir la identificación precoz de EC silente en pacientes pediátricos. La actualización de las guías ECCO-ESPGHAN recomiendan su realización, estableciendo niveles valle diana para la fase de mantenimiento con objeto de alcanzar la CM de 5μg/mL de IFX y 7,5μg/mL de ADL7. En nuestro estudio, no se aplicaron niveles mínimos predeterminados de anti-TNF.
El estudio PAILOT comparó la estrategia proactiva con el tratamiento reactivo con ADL en la población pediátrica, encontrando una mayor frecuencia de remisión libre de corticoides en los pacientes manejados con la estrategia proactiva (82% vs. 48%; p=0,002). Los autores establecieron un nivel diana mínimo de ADL de 5μg/mL14. Aunque esta actitud puede ser correcta, no se corresponde con la práctica clínica habitual real, en la que han de considerarse datos clínicos y analíticos además de las concentraciones de fármacos, como se hizo en nuestro estudio.
De manera similar a lo descrito por Ungar et al.29, en nuestro estudio observamos que un grupo de pacientes en remisión clínica y con CM tenían concentraciones inferiores a 5μg/mL, lo que apoya la estrategia de monitorización proactiva empleada en nuestro estudio, que no estaba basada en niveles diana preestablecidos. En otra serie retrospectiva de pacientes pediátricos, Lyles et al. encontraron que la monitorización proactiva fue más efectiva para alcanzar la remisión libre de corticoides a las 52 semanas de tratamiento que el enfoque reactivo. Los autores describieron que la monitorización proactiva se asociaba a continuar con el anti-TNF inicial por más tiempo (hazard ratio [HR] 0,78; intervalo de confianza del 95% [IC 95]: 0,51-1,18; p=0,24) y un riesgo muy inferior de cese del tratamiento por cualquier AAF detectable (HR, 0,47; IC 95%: 0,27-0,79; p=0,005)30.
En una revisión sistemática reciente de la investigación en el mundo real sobre la eficacia a largo plazo del tratamiento con IFX en pacientes pediátricos, la probabilidad de seguir en tratamiento con IFX fue del 83-97% al cabo de un año, 67-91% a los 2 años y 61-85% a los 3 años. Los datos relativos al ADL eran más escasos, mostrando probabilidades correspondientes del 50-85%, 50-79% y 79%, respectivamente31. En nuestra serie, no hubo casos de pérdida de respuesta o interrupción del tratamiento.
Otro aspecto evaluado fue el porcentaje del período de tratamiento en el que los pacientes siguieron con la dosis inicial recomendada por el fabricante, que resultó ser bastante mayor en los pacientes tratados con ADL. Uno de los hallazgos de Assa et al.14 fue precisamente que los pacientes bajo monitorización proactiva necesitaron intensificación del tratamiento más frecuentemente que aquellos bajo monitorización reactiva (87% vs. 60%). Un análisis más detallado mostró que de los 33 pacientes en los que se llevó a cabo la intensificación, en 18 lo fue exclusivamente por concentraciones inferiores a 5μg/mL, mientras que los 15 restantes, además de niveles del fármaco por debajo de 5μg/mL, también tenían un nivel de calprotectina fecal superior a 150μg/g, un nivel de PCR superior a 0,5mg/dL o un PCDAI de 10 o superior. A nuestro parecer, una proporción considerable de estos pacientes no hubieran requerido intensificación si se hubieran encontrado bajo monitorización proactiva fuera del marco de un ensayo clínico.
Numerosos estudios pediátricos han proporcionado puntos de corte para definir la curación mucosa, la remisión clínica y la curación histológica en distintos momentos del seguimiento de pacientes con EII22,32–34. En nuestro estudio, el análisis de los puntos de corte obtenidos mediante curvas ROC para definir la remisión clínica y la curación mucosa no encontró la sensibilidad o especificidad necesaria para su predicción, probablemente debido al tamaño muestral, aunque fueron muy similares a los obtenidos en el estudio realizado por Kim et al.33. Los datos sobre la adherencia reflejaron que esta fue alta, ya que la adherencia se definió como un TPM del 85% o superior35, lo que se alcanzó con el ADL y casi con el IFX, y podría asociarse a los resultados clínicos obtenidos.
Una de las principales limitaciones de nuestro estudio es, probablemente, el tamaño muestral. Otra sería la estimación de la CM por medio del índice MINI, el cual, a pesar de ofrecer una sensibilidad del 84% y una especificidad del 87% para la detección de la CM, depende en gran medida de la calprotectina fecal y puede sobreestimar el estado real de la mucosa intestinal. Tampoco se pudieron analizar los resultados histológicos a lo largo del tiempo. Dado que la CM se define como la curación endoscópica (según distintos índices de actividad), no se puede extrapolar completamente de los valores del MINI, por lo que nuestros resultados en lo concerniente a la CM han de interpretarse con cautela. Otra limitación fue la carencia de un grupo de control. Las de remisión clínica a uno, 2 y 3 años de seguimiento en nuestro estudio fueron consistentes con las descritas por Kim et al.33, pero las frecuencias de CM (Simple Endoscopic Score for Crohn Disease [SES-CD] vs. MINI) no, ya que fueron mucho mayores en los primeros 2 años. Por otro lado, el método empleado para cuantificar la adherencia terapéutica podría no reflejar correctamente las diferencias entre el ADL y IFX, también debido a la diferencia de tamaño entre los grupos tratados con cada fármaco.
Todos los pacientes investigados al respecto tenían al menos 2 de las variantes de ADN asociadas a una respuesta a largo plazo a la terapia anti-TNF descritas por Salvador et al.33. Tanto este aspecto farmacogenético como la medición proactiva de los niveles del fármaco probablemente contribuyeron a la evolución favorable observada en nuestra serie. Tiempos de respuesta rápidos en los laboratorios son esenciales para el enfoque proactivo, como fue el caso en nuestro estudio. Esto hizo posible que se recogieran muestras de los pacientes 2 semanas antes de la consulta y que los pacientes recibieran los resultados en el momento de la visita. En el caso del IFX, esta rapidez permitió a continuación contactar con la familia para hacer una cita para la nueva infusión. Además, la adherencia en nuestra cohorte fue alta, consistente con los datos publicados por otros autores36.
En conclusión, la monitorización proactiva y seriada de los niveles séricos de anti-TNF podría permitir al paciente mantener la remisión clínica y la curación mucosa durante el seguimiento en la mayoría de los casos, optimizando individualmente la dosis requerida y minimizando la pérdida secundaria de respuesta. La determinación de concentraciones de fármaco es otro posible método para el control de nuestros pacientes, aunque su correlación con la curación mucosa o la remisión clínica puede ser débil.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a Jordi Bozzo, director de publicaciones científicas de Grifols, por sus valiosas contribuciones que siguieron a la revisión exhaustiva del manuscrito una vez fue redactado por los autores.