El síndrome de Li-Fraumeni es una rara entidad de predisposición genética al cáncer, de herencia autosómica dominante y expresividad variable, relacionada con alteraciones germinales en el gen TP53. Dicha entidad predispone al desarrollo de una amplia variedad de tumores malignos. Los tumores más característicos son los sarcomas de tejido blando (rabdomiosarcoma y otros), osteosarcoma, cáncer de mama en mujeres premenopáusicas, leucemia hipodiploide, tumores cerebrales (carcinoma de plexos coroideos, glioblastoma y meduloblastoma) y carcinoma adrenocortical. Dichos tumores pueden presentarse a cualquier edad, incluida la pediátrica. La prevalencia no es bien conocida pues es sin duda una entidad infradiagnosticada. Dado que el seguimiento de familias no había demostrado aumentar la supervivencia a largo plazo, no existe hasta la fecha un programa de detección de pacientes.
La situación con respecto a dicho síndrome de predisposición está cambiando. De acuerdo con el trabajo publicado por Villani et al. en 20111, y actualizado en 20162, es posible ofrecer un seguimiento que potencialmente permita aumentar la supervivencia a largo plazo.
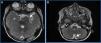
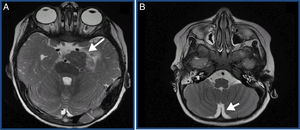
Se presenta el caso de un varón de 2 años que consulta de forma urgente en el hospital de zona por crisis convulsiva (crisis parcial compleja), estando previamente asintomático. Se inicia estudio con prueba de imagen y, ante la sospecha de lesión ocupante de espacio cerebral, fue remitido al centro de referencia. En las pruebas de imagen realizadas, se detectó afectación tumoral maligna y diseminada por las cubiertas meníngeas de todo el neuroeje, y una lesión principal a nivel intracerebral (tumor retroclinoideo izquierdo con diseminación meníngea difusa) (fig. 1).
A) Lesión principal. Sospecha de tumor primario. Tumoración sólida, de 30 mm (CC)×27 mm (AP)×20 mm (T), en la vertiente izquierda de la cisterna prepontina. B) Diseminación tumoral meníngea. Realce leptomeníngeo seudonular grosero que se extiende por valles y cisuras de Silvio, cisternas interpeduncular, cuadrigeminal, prequiasmática, receso pineal y receso anterior superficie anterior del bulbo.
El diagnóstico anatomopatológico de la biopsia realizada por craniectomía fue de meningioma maligno (alta densidad celular constituida por células de citoplasma claro con núcleos lateralizados, otras células citoplasma eosinófilo también con núcleos lateralizados, otras núcleos grandes hipercromáticos y pleomórficos). Las células se disponen en sábana alternando con vasos congestivos y focalmente con material eosinófilo tipo membrana basal entre la celularidad tumoral. No remolinos ni cuerpos de psamoma. No estroma condromixoide. Las células expresan por inmunohistoquímica intensamente CK AE1-AE 3 e INI 1. Focalmente expresan EMA, vimentina, sinaptofisina y muy focalmente PLAP. Negatividad para CD 117, OCT3/4 y alfafetoproteína. Negatividad para CD45, CD68, GFAP y desmina. La expresión intensa para citoqueratinas con positividad focal para EMA y vimentina apoya el diagnóstico de meningioma maligno y no apoya diagnóstico de carcinoma de plexos coroideos.
Se administró quimioterapia de acuerdo con protocolo SEHOP para para menores 3 años, pues la cirugía y la radioterapia no estaban indicadas por lo diseminado de la enfermedad y la corta edad del niño. Se manejaron las complicaciones que surgieron a lo largo de su seguimiento (hidrocefalia secundaria con válvula de derivación ventrículo-peritoneal, crisis convulsivas de difícil control, vómitos incoercibles, temblor de reposo, alteraciones del comportamiento) y se administró el tratamiento previsto. A pesar de ello, la enfermedad acabó progresando y el paciente falleció 6 meses después del inicio.
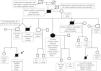
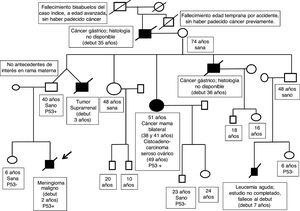
Al diagnóstico, se valoró la historia familiar, detectando múltiples casos de cáncer en la familia paterna (se adjunta árbol genealógico familiar [fig. 2]). Se remitió a la unidad de consejo genético en cáncer. El diagnóstico de Li-Fraumeni se confirmó genéticamente (mutación c.430C>T p.Q144* exón 5 (sin sentido) del gen TP53 del paciente)3. Dicho diagnóstico, no se había realizado con anterioridad en una familia con un árbol genealógico altamente indicativo. Posteriormente se ha podido estudiar a la familia y confirmar que el padre es portador de la misma variante, así como otros miembros de la rama paterna.
De acuerdo con el artículo publicado por Villani et al., es posible aumentar la supervivencia a largo plazo y de forma global de los portadores de alteraciones germinales en TP53. Esta publicación ha servido de fundamento para la comunicación del trabajo coordinado por la American Association for Cancer Research en torno al síndrome de Li-Fraumeni4 y que cuenta con colaboración internacional de expertos en la materia. Además, con dicho apoyo, se ha puesto en marcha el ensayo académico Li-Fraumeni-Syndrome-Cancer-Predisposition-Syndrome Registry 01, dirigido a elaborar un registro mundial de pacientes con síndrome de Li-Fraumeni, entre otros síndromes de predisposición.
La detección previa de nuestro paciente podría haber cambiado la historia natural de la enfermedad. Además, otros miembros de la familia se podrían haber beneficiado de un seguimiento apropiado5.
En este contexto, es importante que los pediatras tengamos presente dicho diagnóstico, al realizar la anamnesis inicial de un recién nacido sano. En caso de familias con múltiples antecedentes oncológicos, debe derivarse la familia a una unidad de consejo genético especializada6.
Dicho estudio familiar, comenzaría con un adulto afectado para acabar beneficiando a un recién nacido sano, potencialmente portador.