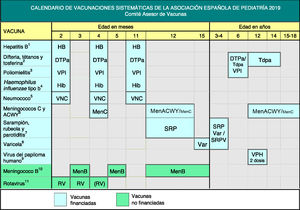
El Comité Asesor de Vacunas de la Asociación Española de Pediatría publica anualmente el calendario de vacunaciones que estima idóneo para los niños residentes en España, teniendo en cuenta la evidencia disponible.
En cuanto a las vacunas financiadas, se recomienda emplear el esquema 2+1 (2, 4 y 11 meses) con vacunas hexavalentes (DTPa-VPI-Hib-HB) y con antineumocócica conjugada 13-valente.
Se aconseja un refuerzo a los 6 años, preferentemente con DTPa, junto con una dosis de polio para aquellos que recibieron esquemas 2+1, así como vacunación con Tdpa en adolescentes y en cada embarazo, entre la semana 27 y la 32.
Se emplearán esquemas de 2 dosis para triple vírica (12 meses y 3-4 años) y varicela (15 meses y 3-4 años). La segunda dosis se podría aplicar como vacuna tetravírica.
Se recomienda vacunación sistemática universal frente al VPH, tanto a chicas como a chicos, preferentemente a los 12 años, debiéndose realizar un mayor esfuerzo para mejorar las coberturas. La nueva vacuna de 9 genotipos amplía la cobertura para ambos sexos.
Se recomienda que la vacuna antimeningocócica conjugada tetravalente (MenACWY) se introduzca en el calendario financiado a los 12 meses y a los 12-14 años, aconsejándose un rescate hasta los 19 años. Igualmente, se recomienda en los mayores de 6 semanas de edad con factores de riesgo o que viajen a países de elevada incidencia de estos serogrupos.
Respecto a las vacunas no financiadas, se recomienda la antimeningocócica B, con esquema 2+1, solicitando su entrada en el calendario. Es recomendable vacunar a todos los lactantes frente al rotavirus.
The Advisory Committee on Vaccines of the Spanish Association of Paediatrics annually publishes the immunisation schedule considered optimal for children resident in Spain, according to available evidence on current vaccines.
As regards funded immunisations, the 2+1 strategy (2, 4, 11 months) with hexavalent (DTPa-IPV-Hib-HB) and 13-valent pneumococcal vaccines are recommended.
Administration of the 6-year booster dose with DTPa is recommended, with a poliomyelitis dose for children who had received the 2+1 scheme, as well as Tdap vaccine for adolescents and pregnant women in every pregnancy between 27 and 32 weeks gestation.
The 2-dose scheme should be used for MMR (12 months and 3-4 years) and varicella (15 months and 3-4 years). MMRV vaccine could be applied as the second dose.
Vaccination against HPV is recommended in both genders, preferably at 12 years of age. A stronger effort should be made to improve vaccination coverage. The new 9-valent vaccine is now available, expanding the coverage for both genders.
Tetravalent meningococcal vaccine (MenACWY) is recommended at 12 months and 12-14 years, with a catch-up up at 19 years of age. It is also recommended in infants older than 6 weeks of age with risk factors, or travellers to countries with high incidence of ACWY meningococcal serogroups.
As regards non-funded immunisations, it is recommended meningococcal B vaccination, with a 2+1 schedule, and requests that it be included in the National Immunisation Program. Vaccination against rotavirus is recommended in all infants.
El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) actualiza anualmente sus recomendaciones teniendo en cuenta las evidencias disponibles (fig. 1). Sus objetivos son promover el cumplimiento de los programas de vacunación oficiales y proponer, a los profesionales sanitarios que atienden a niños y adolescentes, opciones para actualizar las posibles vacunaciones demoradas y ampliar la protección mediante las vacunas no incluidas en los calendarios oficiales. Todo ello en el marco del escenario epidemiológico concreto en el que nos movemos y con la seguridad como pieza clave. En la tabla 1 se expone un listado con las vacunas actuales.
Calendario de vacunaciones sistemáticas de la Asociación Española de Pediatría 2019.
(1) Vacuna antihepatitis B (HB). Tres dosis, en forma de vacuna hexavalente, a los 2, 4 y 11 meses de edad. Los hijos de madres HBsAg positivas recibirán, además, al nacimiento, una dosis de vacuna HB monocomponente, junto con 0,5ml de inmunoglobulina antihepatitis B (IGHB), todo dentro de las primeras 12h de vida. Los hijos de madres con serología desconocida deben recibir la dosis neonatal y se determinará inmediatamente la serología materna; si esta fuera positiva, deberán recibir IGHB cuanto antes, dentro de la primera semana de vida. La administración de 4 dosis de vacuna HB es aceptable en general y preceptiva en hijos de madres HBsAg positivas con peso al nacer menor de 2000 g vacunados de recién nacidos, pues la dosis neonatal en estos casos no se ha de contabilizar. A los niños y adolescentes no vacunados se les administrarán, a cualquier edad, 3 dosis de vacuna monocomponente o combinada con hepatitis A, según la pauta 0, 1 y 6 meses.
(2) Vacuna frente a la difteria, el tétanos y la tosferina acelular (DTPa/Tdpa). Cinco dosis: primovacunación con 2 dosis, a los 2 y 4 meses, de vacuna DTPa (hexavalente); refuerzo a los 11 meses (3.a dosis) con DTPa (hexavalente); a los 6 años (4.a dosis) con el preparado de carga estándar (DTPa-VPI), preferible al de baja carga antigénica de difteria y tosferina (Tdpa-VPI), y a los 12-14 años (5.a dosis) con Tdpa.
(3) Vacuna antipoliomielítica inactivada (VPI). Cuatro dosis: primovacunación con 2 dosis, a los 2 y 4 meses, y refuerzos a los 11 meses y a los 6 años.
(4) Vacuna conjugada frente a Haemophilus influenzae tipo b (Hib). Tres dosis: primovacunación a los 2 y 4 meses y refuerzo a los 11 meses.
(5) Vacuna conjugada frente al neumococo (VNC). Tres dosis: las 2 primeras a los 2 y 4 meses, con un refuerzo a partir de los 11 meses de edad. La vacuna recomendada en nuestro país por el CAV-AEP sigue siendo la VNC13.
(6) Vacuna conjugada frente al meningococo C (MenC) y vacuna frente a los meningococos ACWY (MenACWY). Una dosis de vacuna conjugada monovalente C a los 4 meses de edad. A los 12 meses y a los 12-14 años se recomienda una dosis de la vacuna MenACWY, aconsejándose un rescate progresivo hasta los 19 años de edad. También se sigue recomendando especialmente esta vacuna para niños y adolescentes que vayan a residir en países en los que la vacuna se indique a esta edad, como EE. UU., Canadá, RU, Austria, Grecia, Holanda, Italia o Suiza; para mayores de 6 semanas de vida, en caso de viaje a países con elevada incidencia de EMI por los serogrupos incluidos en la vacuna o con factores de riesgo de EMI: asplenia anatómica o funcional, déficit de factores del complemento, tratamiento con eculizumab, episodio previo de EMI por cualquier serogrupo y contactos de un caso índice de EMI por serogrupo A, W o Y en el contexto de un brote epidémico.
(7) Vacuna frente al sarampión, la rubeola y la parotiditis (SRP). Dos dosis de vacuna sarampión-rubeola-parotiditis (triple vírica). La 1.a a los 12 meses y la 2.a a los 3-4 años de edad. La 2.a dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, vacunación con 2 dosis de SRP con un intervalo de, al menos, un mes.
(8) Vacuna frente a la varicela (Var). Dos dosis: la 1.a a los 15 meses (también es aceptable a los 12 meses de edad) y la 2.a a los 3-4 años de edad. La 2.a dosis se podría aplicar en forma de vacuna tetravírica (SRPV). En pacientes susceptibles fuera de las edades anteriores, vacunación con 2 dosis con Var con un intervalo de, al menos, un mes.
(9) Vacuna frente al virus del papiloma humano (VPH). Vacunación sistemática universal frente al VPH, tanto a chicas como a chicos, preferentemente a los 12 años, para prevenir la enfermedad oncológica relacionada con este virus. Las 3 vacunas están autorizadas en varones, aunque con VPH2 es aún escasa la experiencia en ellos. Administrar 2 dosis a los 11-12 años. Pautas de vacunación según el preparado vacunal: para la vacuna tetravalente, pauta de 2 dosis (0 y 6 meses) para niñas entre 9 y 13 años y pauta de 3 dosis (0, 1 y 6 meses) en≥14 años; la bivalente y la nonavalente con pauta de 2 dosis (0 y 6 meses) para niñas entre 9 y 14 años y pauta de 3 dosis (0, 1-2 y 6 meses) para≥15 años. Es posible su coadministración con las vacunas MenC, las de hepatitis A y B, y la Tdpa. No hay datos de coadministración con la vacuna de la varicela, aunque no debería plantear problemas.
(10) Vacuna frente al meningococo B (MenB). Tres dosis: si se inicia a los 3 meses de edad, 2 dosis separadas por 2 meses y un refuerzo a partir de los 12 meses y con 6 meses de separación de la última de primoinmunización. Si se iniciara a los 2 meses serán precisas 4 dosis. Se recomienda una separación de 15 días con las otras vacunas inactivadas inyectables, hasta los 18 meses, para minimizar su posible reactogenicidad y evitar la coadministración con MenC conjugada con toxoide tetánico. No es necesaria la separación de 15 días con las vacunas de la varicela, triple vírica y del rotavirus.
(11) Vacuna frente al rotavirus (RV). 2 o 3 dosis de vacuna frente al rotavirus: a los 2 y 3 meses o 2 y 4 meses con la vacuna monovalente o a los 2, 3 y 4 meses o 2, 4 y 5-6 meses con la pentavalente. La pauta ha de iniciarse entre las 6 y las 12 semanas de vida; es muy importante para minimizar riesgos, y debe completarse antes de las 24 semanas en la monovalente y de las 32 en la pentavalente. El intervalo mínimo entre dosis es de 4 semanas. Ambas se pueden coadministrar con cualquier otra vacuna.
Acrónimos y presentaciones comerciales de las vacunas
| Acrónimo | Vacuna | Nombre comercial (laboratorio) |
|---|---|---|
| DTPa-VPI-Hib-HB | Hexavalente | Hexyon® (Sanofi Pasteur) |
| DTPa-VPI-Hib-HB | Hexavalente | Infanrix Hexa® (GSK) |
| DTPa-VPI-Hib-HB | Hexavalente | Vaxelis® (MSD) |
| DTPa-VPI | Difteria carga estándar, tétanos, tosferina carga estándar y polio inyectable | No comercializada aún en España |
| Tdpa-VPI | Difteria carga reducida, tétanos, tosferina carga reducida y polio inyectable | Boostrix-Polio® (GSK) |
| Tdpa | Difteria carga reducida, tétanos y tosferina carga reducida | Boostrix® (GSK) |
| Tdpa | Difteria carga reducida, tétanos y tosferina carga reducida | Triaxis® (Sanofi Pasteur) |
| VNC10 | Neumococo conjugado de 10 serotipos | Synflorix® (GSK) |
| VNC13 | Neumococo conjugado de 13 serotipos | Prevenar 13® (Pfizer) |
| MenC | Meningococo C conjugado con toxoide tetánico | NeisVac C® (Pfizer) |
| MenACWY | Meningococos A, C, W e Y conjugado con CRM197 | Menveo® (GSK) |
| MenACWY | Meningococos A, C, W e Y conjugado con toxoide tetánico | Nimenrix® (Pfizer) |
| SRP | Triple vírica (sarampión, rubeola y parotiditis) | MMR-VaxPro® (MSD) |
| SRP | Triple vírica (sarampión, rubeola y parotiditis) | Priorix® (GSK) |
| SRPV | Tetravírica (sarampión, rubeola, parotiditis y varicela) | Priorix-Tetra® (GSK) |
| SRPV | Tetravírica (sarampión, rubeola, parotiditis y varicela) | ProQuad® (MSD) |
| Var | Varicela | Varilrix® (GSK) |
| Var | Varicela | Varivax® (MSD) |
| VPH2 | Virus papiloma humano 2 genotipos | Cervarix® (GSK) |
| VPH4 | Virus papiloma humano 4 genotipos | Gardasil® (MSD) |
| VPH9 | Virus papiloma humano 9 genotipos | Gardasil 9® (MSD) |
| 4CMenB | Meningococo B | Bexsero® (GSK) |
| MenB-fHbp | Meningococo B | Trumenba® (Pfizer) |
| RV | Rotavirus monovalente | Rotarix® (GSK) |
| RV | Rotavirus pentavalente | RotaTeq® (MSD) |
Este año, una vez consolidado el esquema 2+1 con hexavalentes para la vacunación en el primer año de vida1, el principal cambio afecta a la vacunación con la vacuna MenACWY, que pasa a estar recomendada a los 12 meses y en adolescentes.
Se aconseja consultar el documento ampliado publicado en la web del CAV-AEP, donde se explican detalladamente los argumentos que sustentan estas recomendaciones. Además, las recomendaciones específicas para situaciones especiales y grupos de riesgo pueden consultarse en el Manual de Vacunas en línea de la AEP (https://vacunasaep.org/documentos/manual/manual-de-vacunas), actualizado en su mayor parte en 2018.
Los calendarios oficiales de las CC. AA., aunque bastante homogéneos, necesitarían avanzar en la unificación completa en las edades de administración de las distintas vacunas.
Proponemos, también, progresar en: 1) el diseño y desarrollo de nuevas estructuras de estudio y decisión de recomendaciones vacunales, en las que, además del liderazgo del CISNS, se sumen las aportaciones directas de las sociedades científicas y las familias; 2) que el SNS contemple fórmulas de cofinanciación (copago, como con otros fármacos) de las vacunas no incluidas en los calendarios; 3) así como analizar y trabajar la necesidad de instaurar un sistema de compensación de los raros, aunque posibles, daños ocasionados por las vacunas.
Para evitar la reemergencia de enfermedades inmunoprevenibles es necesario continuar realizando esfuerzos para mantener coberturas altas, abordar las brechas de las coberturas de vacunas en algunas edades y hacer un abordaje integral y colaborativo multiprofesional para convencer a los padres que dudan o rechazan la vacunación.
Vacunación frente a hepatitis BRecomendación 2019: se recomienda vacunar a los lactantes con 3 dosis de vacuna hexavalente: 2, 4 y 11 meses de edad. En niños mayores y adolescentes no vacunados se aplicarán 3 dosis de vacuna monocomponente, con pauta 0, 1 y 6 meses.
En España, la tasa de incidencia anual de hepatitis B se mantiene por debajo de 2 casos por 100.000 habitantes. En 2015 se notificaron 561 casos de hepatitis B, con una incidencia de 1,21 casos por 100.0002.
Desde 2018, en todas las CC. AA. se inicia la serie vacunal de hepatitis B a los 2 meses de edad y con preparado hexavalente.
La vacunación del recién nacido sigue siendo preceptiva en hijos de madres HBsAg positivas o con serología desconocida, independientemente del peso al nacimiento, siempre con vacuna monocomponente. En el primer caso, deberán recibir, además, inmunoglobulina antihepatitis B dentro de las primeras 12 horas de vida. En el segundo, puede demorarse, como máximo, una semana, en espera del resultado serológico materno. Cuando se aplica la vacunación neonatal, la pauta completa será de 4 dosis.
Vacunación frente a difteria, tétanos, tosferina, poliomielitis y Haemophilus influenzae tipo bRecomendación 2019: se recomienda el esquema 2+1 con hexavalentes a los 2, 4 y 11 meses. Los niños que hayan recibido esta pauta 2+1 deben recibir DTPa-VPI, preferiblemente, o Tdpa-VPI a los 6 años y Tdpa a los 12-14 años. Se recomienda vacunar con Tdpa a las embarazadas en cada embarazo entre las 27-32 semanas de gestación, lo más precozmente posible en este rango.
A pesar de la vacunación, la tosferina ha experimentado un incremento en su incidencia mundial. Los lactantes menores de 3 meses tienen un mayor riesgo y son el principal grupo a proteger3.
La vacunación con Tdpa en la embarazada, en cada embarazo, es segura, eficaz y la forma más efectiva y eficiente de prevenir la tosferina en lactantes4. La vacunación en el segundo trimestre del embarazo produce mayores niveles de anticuerpos en lactantes, incrementa las oportunidades de vacunación y permite proteger a los prematuros5. Países como Reino Unido (RU) recomiendan su administración a partir de la semana 206.
Se ha descrito una posible interferencia en la producción de anticuerpos frente a diversos antígenos vacunales en lactantes hijos de mujeres vacunadas de tosferina durante el embarazo7, que tiende a normalizarse tras la administración de la dosis de refuerzo y sin que hasta la fecha este hecho se acompañe de cambios epidemiológicos negativos8.
La pauta 2+1 es utilizada en numerosos países europeos, es suficientemente inmunógena y permite optimizar las dosis disponibles. Se admite adelantar la primera dosis a las 6 semanas de vida.
Los lactantes que sigan el esquema 2+1 con hexavalentes deberán recibir el refuerzo de 6 años preferiblemente con preparados DTPa junto con componente antipolio (DTPa-VPI).
Vacunación frente al neumococoRecomendación 2019: se recomienda vacunar frente al neumococo a todos los menores de 5 años, así como a todos los niños con enfermedades de riesgo de cualquier edad. Para la vacunación sistemática del lactante se recomienda el esquema 2+1 (2, 4 y 11-15 meses). Considerando la epidemiología de las infecciones neumocócicas en España, el CAV sigue recomendando la utilización de la vacuna neumocócica conjugada tridecavalente (VNC13).
Sigue acumulándose la evidencia sobre la reducción de la carga de enfermedad neumocócica invasora (ENI) y no invasora (neumonía y otitis media aguda); el efecto se debe no solo a la protección directa de los vacunados, sino también, y en mayor medida, a la protección indirecta de los no vacunados, niños y adultos. Mientras que la reducción de la ENI ha sido similar a la prevista por los estudios de eficacia, en la neumonía y la otitis media ha sido superior a la esperada.
El efecto final de cada vacuna depende, en gran medida, de la cobertura que proporcionan frente a los serotipos circulantes en un determinado sitio, además de su capacidad para inducir inmunidad de grupo frente a los distintos serotipos. El CAV estima que, para España, la VNC13 es la vacuna que mejor cobertura proporciona frente a los serotipos circulantes. Tras la introducción de la VNC13 en Madrid, se han producido reducciones del 68 y del 93% en la incidencia de ENI en menores de 15 años por cualquier serotipo y por los serotipos vacunales, respectivamente9. Considerando todas las edades, las reducciones han sido del 33 y el 75%10.
La emergencia de serotipos no vacunales tras el uso de VNC10 y VNC13 varía de unos países a otros11–15. En Madrid, no se ha producido ningún aumento de estos serotipos en los menores de 15 años9, pero considerando todas las edades, se ha detectado un incremento de algunos de ellos, como 8, 9N, 10A, 23B, 24F y 3310. En la mayoría de los países donde se ha utilizado la VNC10, también se ha producido un aumento de casos de ENI producida por los serotipos no contenidos en esta vacuna, particularmente el 19A13–15.
Vacunación frente a meningococos C y ACWYRecomendación 2019: se recomienda mantener la protección frente al meningococo C a los 4 meses de edad. Dada la incidencia ascendente de los serogrupos W e Y en España, el CAV-AEP recomienda proteger a los 12 meses de edad y a los adolescentes mediante la introducción en calendario sistemático de la vacuna MenACWY, aconsejándose un rescate progresivo hasta los 19 años. También, a los mayores de 6 semanas de vida con factores de riesgo de enfermedad meningocócica invasora (EMI) o que viajen a países de elevada incidencia.
La efectividad de la vacuna monovalente frente al MenC ha sido ampliamente demostrada. La tasa de EMI por serogrupo C en España se ha mantenido muy baja durante la temporada 2016-2017 (0,06 casos/100.000 habitantes).
A partir del año 2000, se ha producido un aumento notable en la incidencia de EMI por un serotipo (ST-11CC) especialmente virulento del serogrupo W en muchos países del mundo16. Esto ha llevado a la inclusión de la vacuna MenACWY en los calendarios de varios países, como RU, Austria, Grecia, Holanda e Italia, así como países americanos entre los que se encuentran EE. UU., Canadá, Chile y Argentina.
RU decidió sustituir, desde 2015, la dosis de MenC de los 12 años por una dosis de MenACWY a los 14 años, con rescate en edades superiores. A pesar de coberturas todavía inferiores al 90%17, se ha notificado una reducción importante del número esperado de casos por serogrupo W18.
En España empezó a detectarse desde 2015 un aumento progresivo de EMI por serogrupos W e Y. En la temporada 2016-2017, el número total de casos por W fue de 17 y de 16 por Y (tasa de incidencia 0,04/100.000). Sin embargo, los últimos datos notificados al Centro Nacional de Epidemiología hasta la semana 37 de 2018 muestran un claro incremento: 39 casos de EMI por W (tasa 0,10/100.000) y 31 por Y (tasa 0,08/100.000)19.
En septiembre de 2017 se autorizó la comercialización en farmacias en España de 2 vacunas MenACWY20. Considerando la situación epidemiológica actual de la EMI en España, el CAV-AEP recomienda la administración de MenACWY en la vacunación sistemática de todos los adolescentes y en los mayores de 6 semanas de edad con factores de riesgo o que viajen a países de elevada incidencia de estos serogrupos.
Ante esta situación, se recomienda la introducción de MenACWY en el calendario sistemático a los 12 meses de edad para protección individual y en adolescentes. En estos últimos con la intención de actuar sobre la población con mayor índice de colonización nasofaríngea por meningococo, aconsejándose un rescate progresivo hasta los 19 años, aunque este comité recomienda seguir recibiendo el preparado seleccionado por cada comunidad autónoma intentando obtener una cobertura óptima. Se mantiene la vacunación con MenC a los 4 meses de edad, hasta que MenACWY pueda ser administrada en una sola dosis a esta edad.
Vacunación frente a sarampión, rubeola y parotiditis (vacuna triple vírica: SRP)Recomendación 2019: se recomienda que la primera dosis de SRP se administre a los 12 meses de edad y la segunda a los 3-4 años. Esta última se podría aplicar en forma de vacuna tetravírica (SRPV).
La SRPV conlleva un mayor riesgo de convulsión febril sobre todo tras la primera dosis y en menores de 2 años de edad, por lo que se recomienda administrar los 2 preparados por separado por debajo de esa edad21.
La prevalencia del sarampión en la Región Europea de la OMS ha aumentado en los últimos meses22, en parte debido a la cobertura vacunal subóptima en algunos países. Persisten también los brotes de parotiditis. Mantener coberturas vacunales altas y una vigilancia epidemiológica de calidad es esencial para la eliminación de estas enfermedades.
Una dosis a los 12 meses induce tasas de seroconversión mayores del 95% para los 3 virus y se aproximan al 100% tras la segunda dosis. Esta última es imprescindible para lograr una adecuada inmunidad de grupo y corregir posibles fallos primarios de la primera.
Vacunación frente a la varicelaRecomendación 2019: se recomienda la vacunación frente a varicela con 2 dosis en todos los niños, a los 15 meses y a los 3-4 años de edad (la segunda dosis con vacuna SRPV). Se recomienda, además, vacunación de rescate, con 2 dosis, a todos los niños y adolescentes que no hayan padecido la enfermedad (o completar la pauta de 2 dosis cuando sea necesario).
Desde 2016, todas las CC. AA. incluyen la vacunación antivaricela con una pauta de 2 dosis (a los 15 meses y a los 3-4 años)1. Se dispone de 2 vacunas monocomponente y 2 tetravíricas, que muestran una elevada efectividad (92-97,3%) tanto en la población vacunada como en la no vacunada23, con un perfil de seguridad excelente24. En 2018, varias CC. AA. ya han introducido la SRPV en la segunda dosis, lo cual facilita el cumplimiento del calendario vacunal.
Tras más de 20 años de vacunación en EE. UU. se ha comprobado una reducción sostenida de la enfermedad sin desplazamiento de la edad de presentación25 ni cambios en la incidencia del herpes zóster26, factor determinante para el coste-efectividad de la vacunación infantil frente a varicela24.
Vacunación frente al virus del papiloma humanoRecomendación 2019: vacunación sistemática universal frente al virus del papiloma humano (VPH) tanto a chicas como a chicos, preferentemente a los 12 años, para prevenir la enfermedad oncológica relacionada con este virus. Esta medida ha demostrado una reducción significativa en la carga de enfermedad asociada al VPH en ambos sexos.
La edad óptima de vacunación es a los 12 años de edad, con 2 dosis, con el objetivo de alcanzar la máxima inmunogenicidad, el mayor beneficio potencial al administrarse antes de las primeras relaciones sexuales y aspirar a la mayor cobertura vacunal posible. La recomendación es también aplicable a edades posteriores, en caso de retraso en su administración, dados los beneficios que puede seguir aportando.
Esta vacunación, en chicas, sigue demostrando su gran eficacia y efectividad para la prevención de infección persistente por VPH, de verrugas genitales y de lesiones cervicales preneoplásicas, con hasta un 85% de prevención de lesiones de alto grado, incluso más de 10 años después de su administración27. Respecto a los varones, existe evidencia de que la eficacia vacunal es más elevada en aquellos sujetos que no han iniciado actividad sexual28. Es esperable que, en unos años, se documente la prevención del cáncer de cérvix y otros tipos de cánceres asociados al VPH.
Estas vacunas, tras más de 300 millones de dosis administradas en el mundo, han demostrado ser seguras, con un balance beneficio/riesgo muy favorable27. Se ha descartado la asociación de estas vacunas con el desarrollo de enfermedades autoinmunes y neurológicas27. Aun así, la cobertura media en España permanece mucho más baja que la del resto de las vacunas sistemáticas29. Es imprescindible que todos los profesionales sanitarios estén adecuadamente informados sobre su efectividad y seguridad y refuercen los mensajes positivos sobre esta vacunación.
La vacunación en varones ya está incluida en el calendario oficial de numerosos países, a los que recientemente se han sumado Alemania y RU30. Hay datos relevantes sobre el papel etiopatogénico del VPH en ciertos tipos de cáncer que afectan a ambos sexos, pero sobre todo con una mayor incidencia al varón, como el cáncer anal y el de cabeza y cuello30. Por todo ello, el CAV-AEP recomienda vacunar a los varones adolescentes, preferentemente desde los 12 años.
La vacuna frente al VPH de 9 tipos (6/11/16/18/31/33/45/52/58) está disponible en España desde 201720. Es eficaz y segura y aporta una ampliación de la cobertura global de enfermedad oncológica cervical por VPH del 70 al 90%, así como una prevención potencial del 85-95% de los cánceres vulvar, vaginal y anal relacionados con VPH31, posicionándose actualmente como la mejor opción disponible para ambos sexos, aunque este comité recomienda recibir el preparado de VPH seleccionado por cada comunidad autónoma para las chicas.
Vacuna frente al meningococo BRecomendación 2019: esta vacuna presenta un perfil de vacuna sistemática a administrar a lactantes a partir de los 3 meses de edad con una pauta 2+1. Para el resto de las edades pediátricas, incluyendo la adolescencia, el CAV-AEP aboga también por su uso, realizando una recomendación de tipo individual.
Actualmente existen 2 vacunas disponibles para la prevención de EMI por meningococo B: 4CMenB y MenB-fHbp. Ambas están compuestas por antígenos proteicos subcapsulares. Al tratarse la EMI por MenB de una enfermedad muy poco frecuente, los estudios de coste/beneficio convencionales con esta vacuna resultan desfavorables. Sin embargo, al ser la EMI una enfermedad devastadora y existiendo vacunas eficaces y seguras, el CAV-AEP sigue considerando la 4CMenB con perfil de vacuna sistemática para los niños menores de 5 años, especialmente en los menores de 2, el grupo de edad con mayor tasa de EMI.
En 2015, RU incluyó 4CMenB en su calendario oficial, con un esquema 2+1 (fuera de FT). Los resultados de los primeros 10 meses del programa mostraron una efectividad del 83% frente a cualquier cepa de MenB y del 94,6% frente a las cepas cubiertas por la vacuna, con una reducción del 50% de casos en la población diana32. En el segundo año desde el inicio del programa, la EMI global por MenB se ha reducido en un 11%. En la temporada 2016-2017 se notificaron 47 casos de EMI por MenB en menores de un año, frente a los 83 de la 2015-201633. Andorra, Irlanda, Italia y Lituania han incluido también 4CMenB en sus calendarios vacunales.
Se ha confirmado que las pautas 2+1 con 4CMenB son suficientemente inmunógenas34, por lo que la EMA autorizó en 2018 un cambio en su FT, admitiéndose desde los 3 meses de edad.
MenB-fHbp está autorizada desde 2018 en Europa a partir de 10 años de edad. El limitado número de casos de EMI por MenB en población adolescente española, así como el no haberse demostrado aún su impacto en la colonización nasofaríngea35 (motivo epidemiológico principal para vacunar a dicha edad), hacen que el CAV-AEP recomiende el uso de ambas vacunas en adolescentes a título individual para optimizar la protección personal contra EMI.
Vacunación frente al rotavirusRecomendación 2019: la vacunación frente al rotavirus (RV) es una medida de salud recomendable para todos los lactantes.
En la actualidad, más de 100 países han introducido en sus calendarios la vacunación frente al RV. Los beneficios sanitarios de esta medida han sido enormes, con un descenso importante de la morbimortalidad mundial por gastroenteritis por RV en lactantes y niños pequeños36.
En Europa los programas de vacunación frente al RV han dado lugar a reducciones de la carga de enfermedad del 60 al 90% tanto en visitas de atención primaria como en hospitalizaciones37.
Los beneficios de la vacunación afectan tanto a los lactantes vacunados como, de forma indirecta, al entorno no vacunado, lo que aumenta notablemente el impacto y la eficiencia38. Se debe prestar especial atención a los prematuros, que pueden superar la edad de la ventana de vacunación antes del alta hospitalaria39, y a los niños infectados por VIH, que tienen un mayor riesgo de desarrollar enfermedad grave por RV.
Los beneficios de la vacunación son muy superiores a los riesgos de invaginación intestinal, único efecto adverso serio relacionado, que es muy infrecuente (entre uno y 5 casos/100.000 niños vacunados)40.
Hay disponibles en las farmacias 2 vacunas antirrotavirus, una pentavalente y otra monovalente20.
Conflicto de interesesDMP ha colaborado en actividades docentes subvencionadas por Astra, Pfizer, GlaxoSmithKline, Sanofi Pasteur y MSD, como consultor en Advisory Board de GlaxoSmithKline y como investigador en ensayos clínicos de Novartis.
FJAG ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer, Sanofi Pasteur y MSD y como consultor en Advisory Board de GlaxoSmithKline, Novartis, Pfizer, Sanofi Pasteur y MSD.
JAA ha colaborado en actividades docentes subvencionadas por Astra, GlaxoSmithKline, Pfizer, Sanofi Pasteur y MSD, como consultor en Advisory Board de GlaxoSmithKline y Pfizer y como investigador en ensayos clínicos de GlaxoSmithKline.
MJCO ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer, Sanofi Pasteur y MSD, como investigadora en ensayos clínicos de GlaxoSmithKline y Pfizer, y como consultora en Advisory Board de GlaxoSmithKline, Novartis, Pfizer, Sanofi Pasteur y MSD.
MGS ha colaborado en actividades docentes subvencionadas por Astra, GlaxoSmithKline, Pfizer, Sanofi Pasteur y MSD, como consultora en Advisory Board de GlaxoSmithKline y Novartis, y como investigadora en ensayos clínicos de GlaxoSmithKline, Janssen, Sanofi Pasteur y MSD.
NGS ha colaborado en actividades docentes subvencionadas por Sanofi Pasteur y MSD y ha asistido a actividades docentes subvencionadas por Novartis y Pfizer.
AHM ha recibido ayuda económica para asistir a actividades docentes nacionales, y ha participado en actividades docentes subvencionadas por Pfizer.
MMH ha colaborado como investigadora en ensayos clínicos de GlaxoSmithKline, MSD y Novartis.
MMM ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer, Sanofi Pasteur y MSD, como investigador en ensayos clínicos de GlaxoSmithKline, Pfizer, Sanofi Pasteur y MSD y como consultor en Advisory Board de Novartis.
AMM ha recibido ayuda económica de Pfizer para asistir a actividades docentes nacionales e internacionales, aunque desde que es miembro del CAV-AEP no he aceptado patrocinio directo alguno de ningún laboratorio farmacéutico para ninguna actividad (ni docente ni discente).
JRC ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer, Sanofi Pasteur y MSD y como investigador en ensayos clínicos de GlaxoSmithKline y Pfizer.
A Javier Arístegui, Jose María Corretger y Luis Ortigosa, por su asesoría interna en la redacción y elaboración de estas recomendaciones.