El manejo del dolor y la sedación es una prioridad de los cuidados intensivos neonatales. Se diseñó un estudio con el objetivo de determinar la práctica clínica actual en relación con la sedación y la analgesia en unidades de cuidados intensivos neonatales en España e identificar factores asociados al uso de fármacos sedantes o analgésicos.
MétodoEstudio multicéntrico, observacional, longitudinal y prospectivo.
ResultadosParticiparon 30 unidades neonatales y se reclutó a 468 neonatos. De estos, 198 (42,3%) recibieron medicación sedante o analgésica. En total, se usaron durante el período de estudio 19 fármacos distintos, de los cuales el más utilizado fue el fentanilo. Solo fentanilo, midazolam, morfina y paracetamol se usaron al menos en un 20% de los neonatos que recibieron sedación y/o analgesia. Se usaron 14 pautas distintas de fármacos en perfusión, siendo las más frecuentes la infusión de fentanilo y la combinación de fentanilo y midazolam.
Las variables asociadas a recibir sedación y/o analgesia fueron el haber precisado ventilación invasiva (p=< 0,001; OR=23,79), un score de CRIB>3 (p=0,023; OR=2,26), la existencia en la unidad de guías de evaluación del dolor (p<0,001; OR=3,82) y de un líder de dolor (p=0,034; OR=2,35).
ConclusionesCasi la mitad de los neonatos ingresados en cuidados intensivos recibe medicación sedante y/o analgésica.
Existe una importante variabilidad entre las unidades neonatales españolas en relación con las pautas de sedación y analgesia. Nuestros resultados permiten conocer el «estado del arte» y pueden servir de base para la elaboración de guías de práctica clínica a nivel nacional.
Pain management and sedation is a priority in neonatal intensive care units. A study was designed with the aim of determining current clinical practice as regards sedation and analgesia in neonatal intensive care units in Spain, as well as to identify factors associated with the use of sedative and analgesic drugs.
MethodA multicenter, observational, longitudinal and prospective study.
ResultsThirty neonatal units participated and included 468 neonates. Of these, 198 (42,3%) received sedatives or analgesics. A total of 19 different drugs were used during the study period, and the most used was fentanyl. Only fentanyl, midazolam, morphine and paracetamol were used in at least 20% of the neonates who received sedatives and/or analgesics. In infusions, 14 different drug prescriptions were used, with the most frequent being fentanyl and the combination of fentanyl and midazolam.
The variables associated with receiving sedation and/or analgesia were, to have required invasive ventilation (P<.001; OR=23.79), a CRIB score >3 (P=.023; OR=2.26), the existence of pain evaluation guides in the unit (P<.001; OR=3.82), and a pain leader (P=.034; OR=2.35).
ConclusionsAlmost half of the neonates admitted to intensive care units receive sedatives or analgesics.
There is significant variation between Spanish neonatal units as regards sedation and analgesia prescribing. Our results provide evidence on the “state of the art”, and could serve as the basis of preparing clinical practice guidelines at a national level.
El alivio del dolor es un derecho humano básico a cualquier edad. En los recién nacidos, por un lado la inherente dificultad para la detección del dolor y, por otro, la falsa creencia de que los neonatos carecían de las vías fisiológicas necesarias para presentar dolor han llevado a un infratratamiento histórico en este grupo de edad1. Hoy se sabe que los recién nacidos ingresados en unidades de cuidados intensivos (UCI) se someten a múltiples procedimientos dolorosos durante su estancia2,3. Además, existen suficientes pruebas de que el dolor no tratado durante el período neonatal puede tener consecuencias perjudiciales a corto y a largo plazo4-8.
Actualmente, se dispone de una amplia variedad de recursos para el manejo de la sedación y/o analgesia (S/A), que incluyen medidas farmacológicas y no farmacológicas, pero en la práctica muchas pautas se llevan a cabo en función de consensos de expertos, protocolos locales o incluso preferencias personales. En un intento de determinar la práctica clínica habitual en cuanto al manejo del dolor en unidades neonatales, en los últimos años se han publicado encuestas en diferentes países: Francia9, Canadá10, Reino Unido11,12, Australia13,14, Italia15, Estados Unidos16, Alemania, Austria y Suiza17,18, y Suecia19. Hasta donde conocemos, en España no existen actualmente datos sobre cómo se maneja la S/A en recién nacidos que permitan un análisis crítico y que constituyan un primer paso para la elaboración de guías de práctica clínica.
En el marco del proyecto multicéntrico internacional Europain (www.europainsurvey.eu) se diseñó un estudio específico de la muestra española con el objetivo de determinar las prácticas clínicas actuales y reales en relación con el uso de fármacos sedantes y analgésicos en UCI neonatales en España y los factores asociados a su uso.
Material y métodos- –
Diseño: el estudio Europain-España es de tipo observacional, longitudinal y prospectivo.
- –
Selección de las unidades: se solicitó a la Sociedad Española de Neonatología en el año 2012 un listado de las UCI neonatales de la red sanitaria pública española. Se invitó a participar vía correo electrónico a 34 unidades que prestaban asistencia intensiva integral, que incluía todos los modos de ventilación mecánica invasiva. Dos unidades declinaron la invitación, no se obtuvo respuesta de una y otra abandonó el estudio una vez comenzado. Finalmente, participaron 30 unidades neonatales distribuidas por todo el país (anexo 1).
- –
Criterios de inclusión: en cada una de las unidades participantes se incluyó a todos los recién nacidos que ingresaron durante un mes (noviembre del 2012) hasta una edad corregida de 44 semanas y cuyos tutor/es legal/es firmaron el consentimiento informado para participar en el estudio.
- –
Recogida de datos: de cada neonato se recogieron datos demográficos, de los modos de asistencia respiratoria, uso de sedantes, analgésicos o relajantes musculares y manejo de la abstinencia de drogas. La duración de la recogida de datos para cada recién nacido incluido fue de 28 días o hasta su alta, traslado a otro hospital o defunción. Los coordinadores de las unidades proporcionaron además datos de los protocolos locales sobre S/A y de las estadísticas generales de la unidad. El control de calidad se realizó como una autoauditoría en cada hospital participante por una persona distinta de la que había introducido los datos.
- –
Aspectos éticos: se obtuvo la aprobación de la Agencia Española de Medicamentos y Productos Sanitarios y del comité de ética de investigación clínica de referencia, además de los comités locales que así lo requirieron. Se obtuvo el consentimiento informado de los padres y/o tutores legales de todos los neonatos incluidos.
- –
Análisis de datos: se realizó un análisis descriptivo de las características tanto de las unidades participantes como de los pacientes incluidos y su manejo, indicando estimaciones por intervalo de los hallazgos principales. Se analizaron las variables asociadas al uso de S/A, utilizando el test de la chi al cuadrado o el test exacto de Fisher y el test de Mann-Whitney, calculando los valores de odds ratio y su intervalo de confianza del 95%. Para determinar las variables asociadas de forma independiente al uso de S/A, se ajustó un modelo multivariante de regresión logística. Dado que cada unidad incluyó un número variable de neonatos, se recurrió para su ajuste a modelos de ecuaciones de estimación generalizada20,21. Este enfoque tiene en cuenta la dependencia que puede existir entre los datos de neonatos ingresados en una misma unidad y permite evitar los sesgos asociados a las técnicas clásicas cuando la hipótesis de independencia no se puede mantener. Se siguió una estrategia de modelización hacia delante, introduciendo en el modelo todas aquellas variables que en el análisis bivariado mostraron un valor de p<0,20. Para el análisis multivariante se clasificaron las unidades según número de ingresos anuales (mayor o menor de 250) y según el número de ingresos quirúrgicos anuales (mayor o menor de 25). Se clasificó igualmente a los pacientes según una puntuación de CRIB superior a 3 e inferior o igual a 3. El análisis estadístico se realizó con el programa SPSS 19.0 para Windows. Todas las pruebas se realizaron con un planteamiento bilateral. Se consideraron significativos valores de p<0,05.
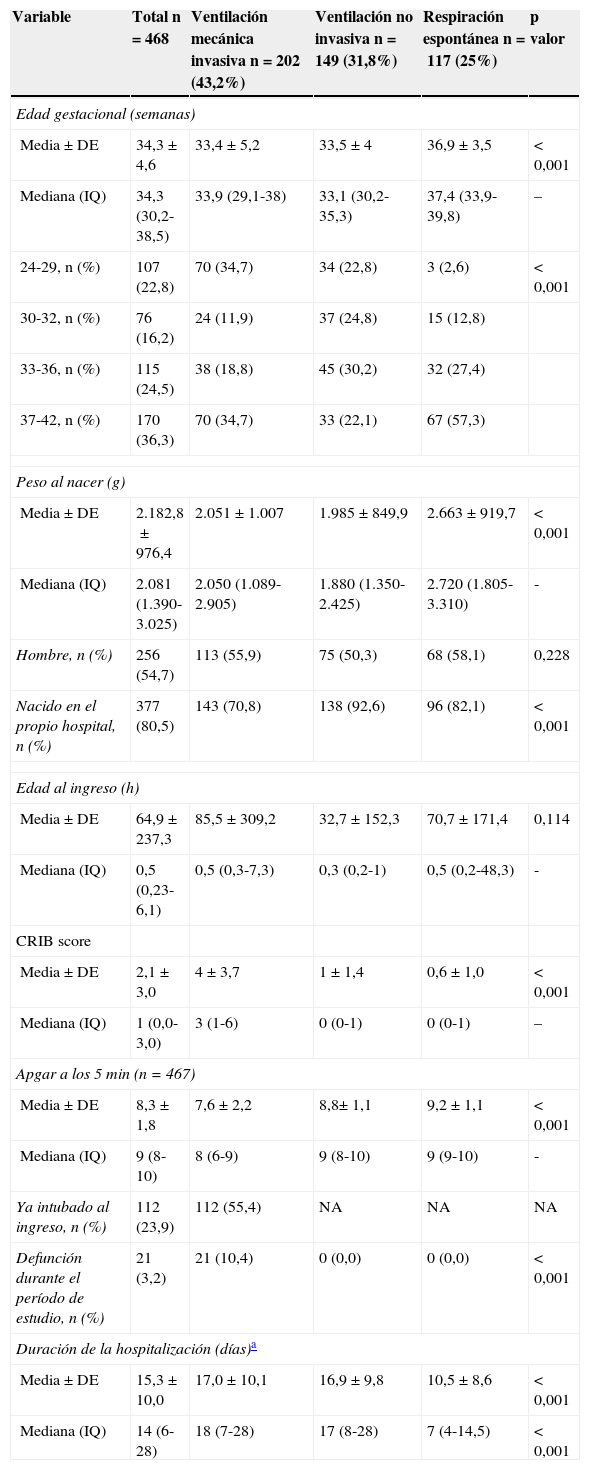
En la tabla 1 se describen las características de las 30 unidades participantes. Se incluyó a un total de 468 neonatos, cuyas características generales se muestran en la tabla 2. Del total, 202 neonatos (43,2%, IC del 95%, 38,5-47,7) recibieron ventilación mecánica invasiva (VM), durante un tiempo medio ± DE de 126,9 ± 173,5 h.
Características de las unidades participantes (n=30)
| Unidadesn=30 | |
|---|---|
| Existencia de guías locales de tratamiento del dolor en 2012, n (%) | 20 (66,6) |
| Existencia de guías locales de evaluación del dolor en 2012, n (%) | 13 (43,3) |
| Número de camas | |
| Media±DE | 13,1±7,0 |
| Mediana (rango) | 12 (2-33) |
| Número de ingresos/año | |
| Media±DE | 272,9±137,1 |
| Mediana (rango) | 251 (50-624) |
| Número de ingresos quirúrgicos/año | |
| Media±DE | 42,9±54,1 |
| Mediana (rango) | 25 (0-222) |
| Número de adjuntos | |
| Media±DE | 4,9±3,4 |
| Mediana (rango) | 4 (2-15) |
| Existencia de un líder de dolor médico, n (%) | 6 (20) |
| Existencia de un líder de dolor en enfermería, n (%) | 4 (13,3) |
| Existencia de un equipo del dolor en la unidad, n (%) | 13 (43,3) |
| Horario de visitas para los padres abierto 24 h, n (%) | 26 (86,6) |
DE: desviación estándar.
Características de los neonatos incluidos en el estudio, en la muestra total y sobre la base de la asistencia respiratoria máxima recibida durante el período de estudio
| Variable | Total n = 468 | Ventilación mecánica invasiva n=202 (43,2%) | Ventilación no invasiva n=149 (31,8%) | Respiración espontánea n=117 (25%) | p valor |
|---|---|---|---|---|---|
| Edad gestacional (semanas) | |||||
| Media±DE | 34,3±4,6 | 33,4±5,2 | 33,5±4 | 36,9±3,5 | < 0,001 |
| Mediana (IQ) | 34,3 (30,2-38,5) | 33,9 (29,1-38) | 33,1 (30,2-35,3) | 37,4 (33,9-39,8) | – |
| 24-29, n (%) | 107 (22,8) | 70 (34,7) | 34 (22,8) | 3 (2,6) | < 0,001 |
| 30-32, n (%) | 76 (16,2) | 24 (11,9) | 37 (24,8) | 15 (12,8) | |
| 33-36, n (%) | 115 (24,5) | 38 (18,8) | 45 (30,2) | 32 (27,4) | |
| 37-42, n (%) | 170 (36,3) | 70 (34,7) | 33 (22,1) | 67 (57,3) | |
| Peso al nacer (g) | |||||
| Media±DE | 2.182,8±976,4 | 2.051±1.007 | 1.985±849,9 | 2.663±919,7 | < 0,001 |
| Mediana (IQ) | 2.081 (1.390-3.025) | 2.050 (1.089-2.905) | 1.880 (1.350-2.425) | 2.720 (1.805-3.310) | - |
| Hombre, n (%) | 256 (54,7) | 113 (55,9) | 75 (50,3) | 68 (58,1) | 0,228 |
| Nacido en el propio hospital, n (%) | 377 (80,5) | 143 (70,8) | 138 (92,6) | 96 (82,1) | < 0,001 |
| Edad al ingreso (h) | |||||
| Media±DE | 64,9±237,3 | 85,5±309,2 | 32,7±152,3 | 70,7±171,4 | 0,114 |
| Mediana (IQ) | 0,5 (0,23-6,1) | 0,5 (0,3-7,3) | 0,3 (0,2-1) | 0,5 (0,2-48,3) | - |
| CRIB score | |||||
| Media±DE | 2,1±3,0 | 4±3,7 | 1±1,4 | 0,6±1,0 | < 0,001 |
| Mediana (IQ) | 1 (0,0-3,0) | 3 (1-6) | 0 (0-1) | 0 (0-1) | – |
| Apgar a los 5min (n=467) | |||||
| Media±DE | 8,3±1,8 | 7,6±2,2 | 8,8± 1,1 | 9,2±1,1 | < 0,001 |
| Mediana (IQ) | 9 (8-10) | 8 (6-9) | 9 (8-10) | 9 (9-10) | - |
| Ya intubado al ingreso, n (%) | 112 (23,9) | 112 (55,4) | NA | NA | NA |
| Defunción durante el período de estudio, n (%) | 21 (3,2) | 21 (10,4) | 0 (0,0) | 0 (0,0) | < 0,001 |
| Duración de la hospitalización (días)a | |||||
| Media±DE | 15,3±10,0 | 17,0±10,1 | 16,9±9,8 | 10,5±8,6 | < 0,001 |
| Mediana (IQ) | 14 (6-28) | 18 (7-28) | 17 (8-28) | 7 (4-14,5) | < 0,001 |
CRIB es una medida de la gravedad validada en neonatos pretérmino compuesto por 6 ítems recogidos en las primeras 12 h de vida, Su valor va de 0 a 23, en donde valores mayores indican mayor gravedad,
DE: desviación estándar; IQ: rango intercuartílico; NA: no aplicable.
Globalmente, 198 neonatos (42,3%, IC del 95%, 37,7-46,8) recibieron algún tipo de medicación sedante o analgésica. De estos, 16 (8%) la recibieron solo en perfusión, 85 (42,9%) solo en bolos y 97 (48,9%) en perfusión y en bolos.
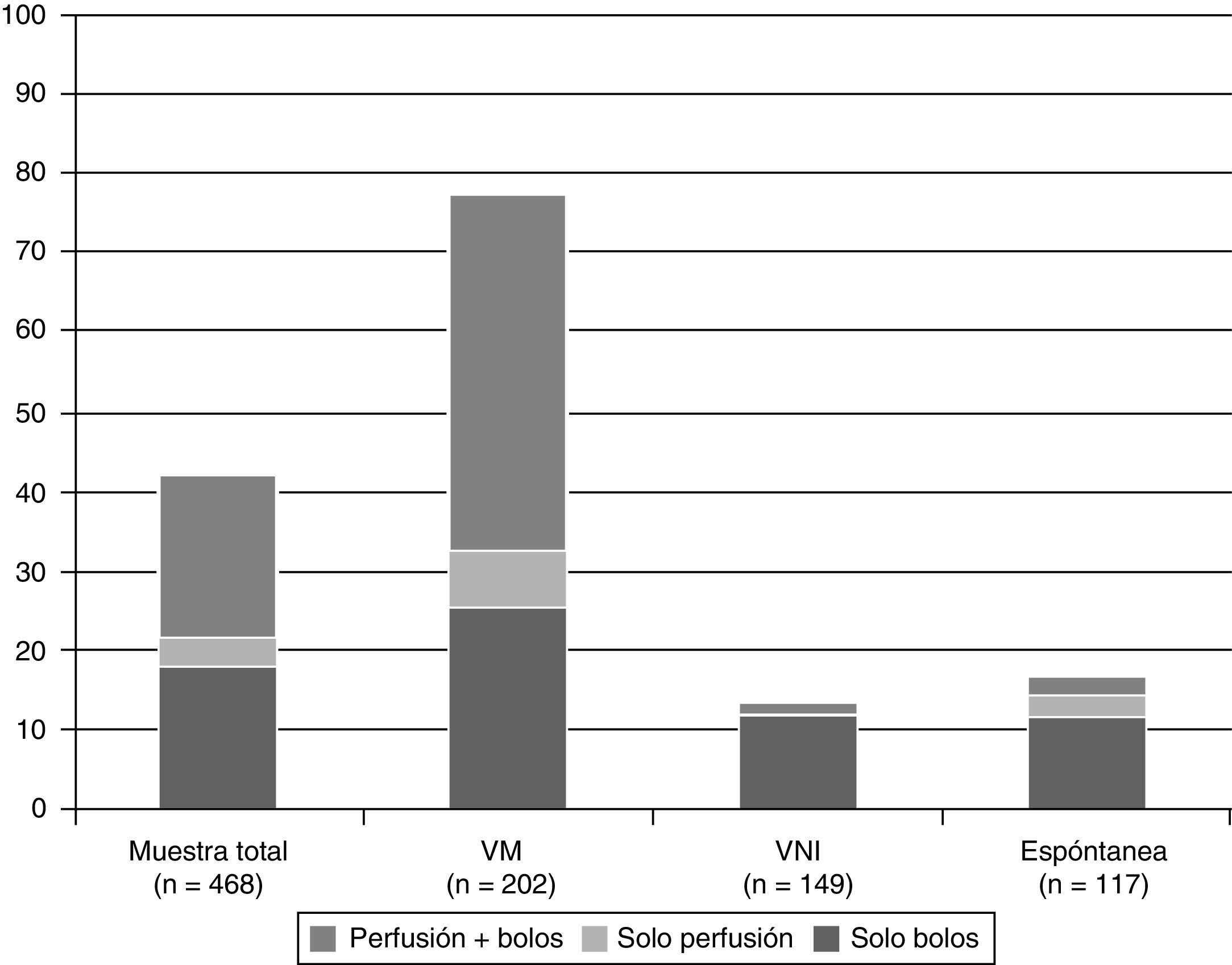
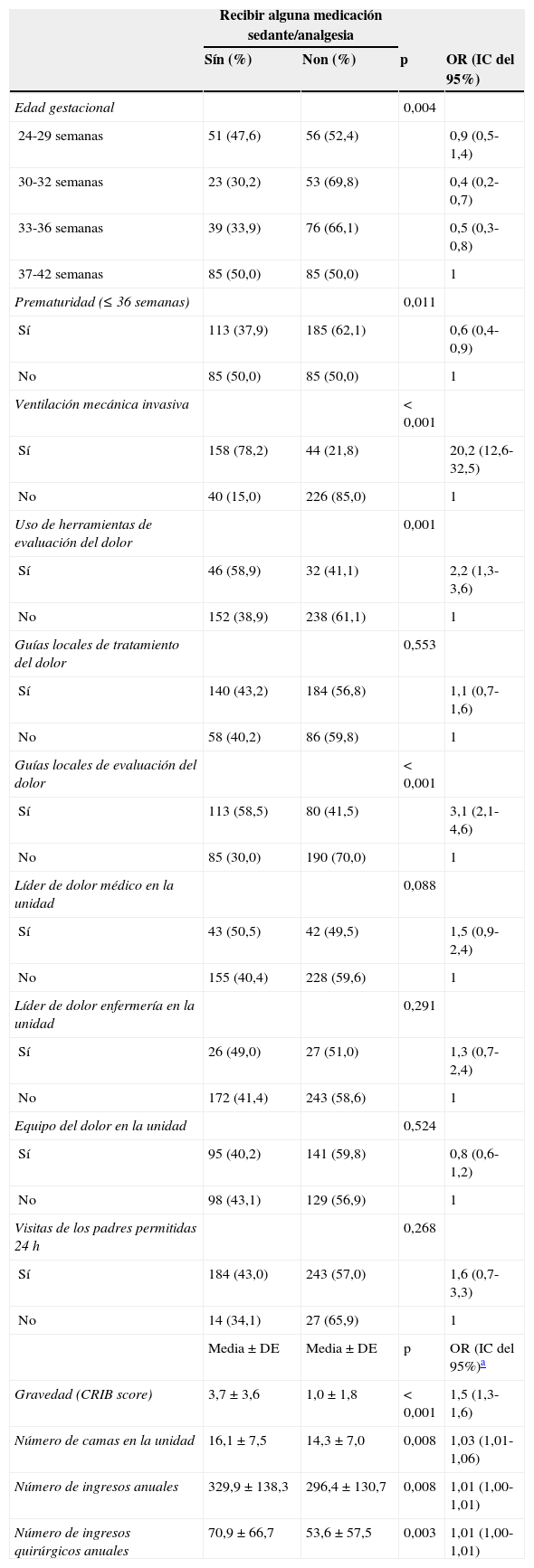
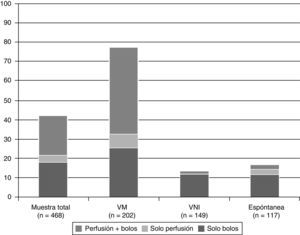
De los 202 neonatos que recibieron VM invasiva, 158 (78,2%, IC del 95%, 72,2-84,1) recibieron algún tipo de medicación sedante o analgésica. En la figura 1 se muestra la proporción de neonatos que recibieron algún tipo de medicación sedante o analgésica y su modo de administración según la asistencia respiratoria máxima recibida durante el período de estudio.
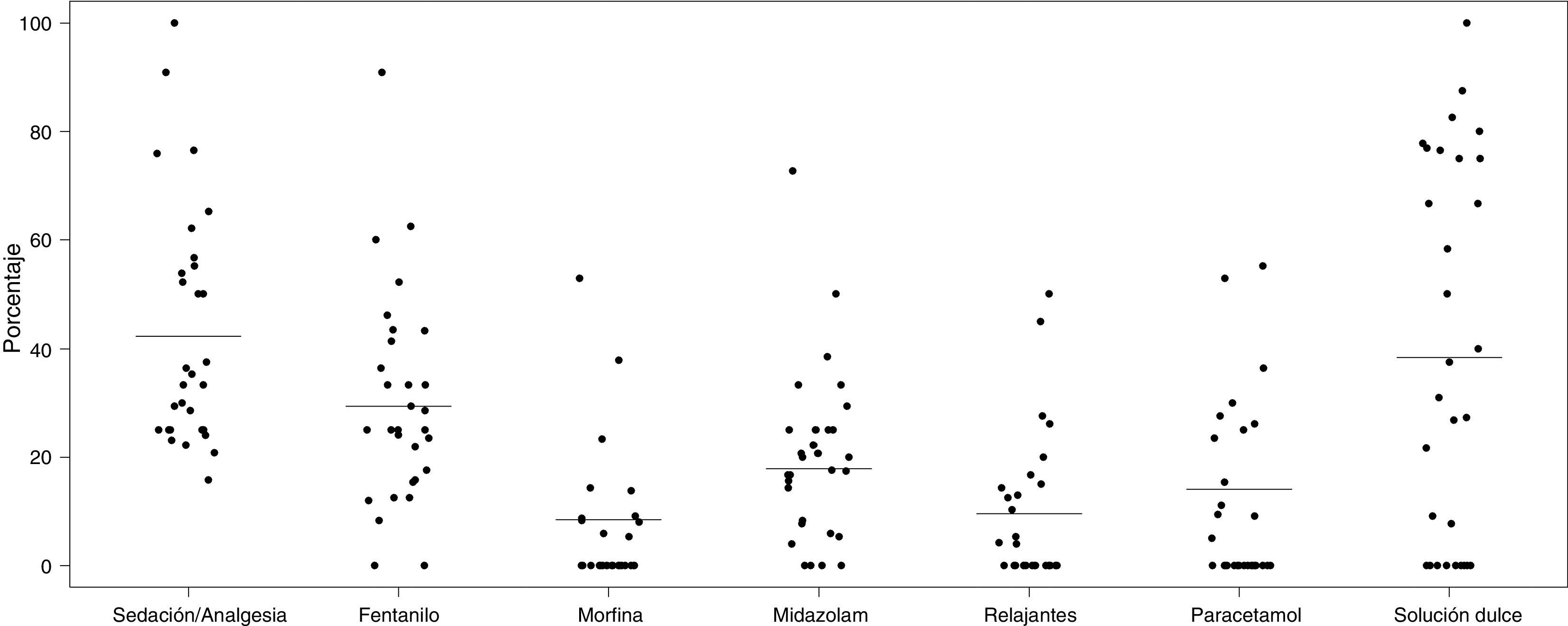
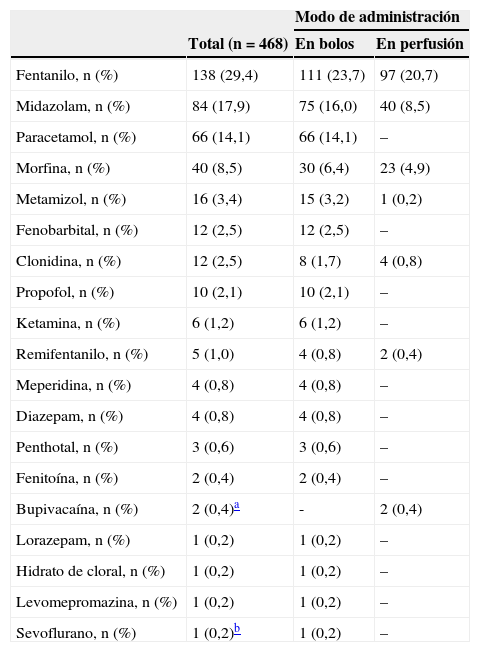
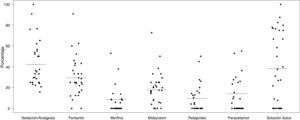
El fármaco más utilizado fue el fentanilo, tanto en perfusión como en bolos, usándose en 138/468 neonatos (29,4%). La tabla 3 muestra la utilización de los fármacos más habituales y su modo de administración (perfusión o bolos). En total, se usaron durante el período de estudio 19 fármacos distintos. Solo fentanilo, midazolam, morfina y paracetamol se usaron al menos en un 20% de los neonatos que recibieron S/A. La figura 2 recoge la proporción de pacientes que reciben cada fármaco en cada unidad participante y muestra gráficamente la variabilidad entre centros en el uso de estos fármacos.
Proporción de pacientes tratados con los diferentes fármacos sedantes o analgésicos durante el período de estudio y modo de administración. Se muestran los porcentajes del total de pacientes (n=468) que reciben cada fármaco
| Modo de administración | |||
|---|---|---|---|
| Total (n=468) | En bolos | En perfusión | |
| Fentanilo, n (%) | 138 (29,4) | 111 (23,7) | 97 (20,7) |
| Midazolam, n (%) | 84 (17,9) | 75 (16,0) | 40 (8,5) |
| Paracetamol, n (%) | 66 (14,1) | 66 (14,1) | – |
| Morfina, n (%) | 40 (8,5) | 30 (6,4) | 23 (4,9) |
| Metamizol, n (%) | 16 (3,4) | 15 (3,2) | 1 (0,2) |
| Fenobarbital, n (%) | 12 (2,5) | 12 (2,5) | – |
| Clonidina, n (%) | 12 (2,5) | 8 (1,7) | 4 (0,8) |
| Propofol, n (%) | 10 (2,1) | 10 (2,1) | – |
| Ketamina, n (%) | 6 (1,2) | 6 (1,2) | – |
| Remifentanilo, n (%) | 5 (1,0) | 4 (0,8) | 2 (0,4) |
| Meperidina, n (%) | 4 (0,8) | 4 (0,8) | – |
| Diazepam, n (%) | 4 (0,8) | 4 (0,8) | – |
| Penthotal, n (%) | 3 (0,6) | 3 (0,6) | – |
| Fenitoína, n (%) | 2 (0,4) | 2 (0,4) | – |
| Bupivacaína, n (%) | 2 (0,4)a | - | 2 (0,4) |
| Lorazepam, n (%) | 1 (0,2) | 1 (0,2) | – |
| Hidrato de cloral, n (%) | 1 (0,2) | 1 (0,2) | – |
| Levomepromazina, n (%) | 1 (0,2) | 1 (0,2) | – |
| Sevoflurano, n (%) | 1 (0,2)b | 1 (0,2) | – |
Representación gráfica del uso de los fármacos más habituales en cada una de las 30 unidades participantes. La línea horizontal señala el porcentaje de cada variable en la muestra total. Los puntos representan el porcentaje de pacientes que reciben cada fármaco en cada una de las unidades participantes.
En los 113 neonatos que recibieron algún fármaco sedante o analgésico en perfusión continua hubo 14 pautas distintas, siendo la más frecuente la infusión de fentanilo (46 neonatos, 40,7%) y la combinación de fentanilo y midazolam (26 neonatos, 23%).
De los 202 neonatos que recibieron VM invasiva, 45 (22,2%, IC del 95%, 16,2-28,2) recibieron algún tipo de relajante muscular. Diez neonatos lo recibieron en perfusión continua (9 vecuronio, uno cisatracurio) y 41 en bolos (33 vecuronio, 7 succinilcolina, uno cisatracurio).
Un total de 180 neonatos (38,4%, IC del 95%, 33,9-42,9) recibieron algún tipo de solución dulce oral, siendo la más frecuente la sacarosa (174 neonatos), seguida de la glucosa (6 neonatos).
Se diagnosticó un síndrome de abstinencia en 25 de los 165 neonatos que habían recibido algún opiáceo o benzodiacepina (15,2%). En 33 neonatos se usó una escala clínica para evaluar la abstinencia, siendo la más utilizada la escala de Finnegan (27 neonatos, 81,8%), seguida de la escala de Lipstiz (5 neonatos, 15,1%). Un total de 28 neonatos recibieron alguna medicación para tratar o prevenir específicamente los síntomas de la abstinencia. La medicación más usada fue la morfina (14 neonatos, 50%), seguida de la clonidina (9 neonatos, 32,1%) y la metadona (8 neonatos, 28,5%).
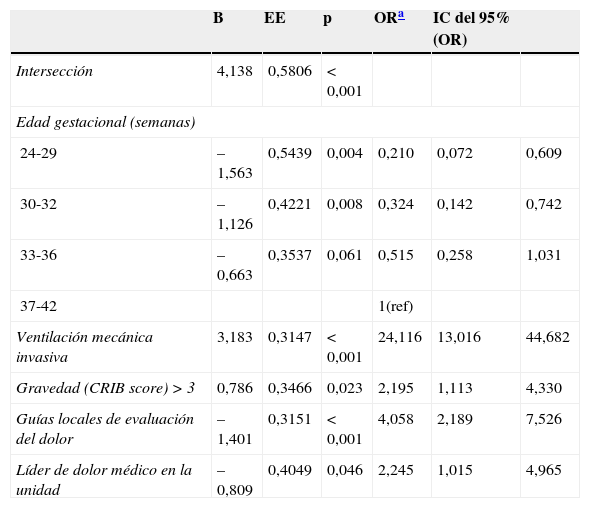
Factores asociados a recibir sedación y/o analgesiaFinalmente, se analizaron aquellas variables relativas a los neonatos o a las unidades asociadas al hecho de utilizar S/A (tabla 4). Tras el análisis multivariante, las variables asociadas fueron el haber recibido VM invasiva (p<0,001; OR=23,79), un score de CRIB>3 (p=0,023; OR=2,26), la existencia en la unidad de guías locales de evaluación del dolor (p<0,001; OR=3,82) y la existencia de un líder de dolor médico en la unidad (p=0,034; OR=2,35). Por el contrario, una edad gestacional inferior a 33 semanas se asoció de forma significativa a una menor probabilidad de recibir S/A. Ni el uso de herramientas de evaluación del dolor ni el tamaño de la unidad (según el número de ingresos o ingresos quirúrgicos anuales) se asociaron a la utilización de S/A (tabla 5).
Variables asociadas al hecho de recibir alguna medicación sedante o analgésica. Análisis univariado
| Recibir alguna medicación sedante/analgesia | ||||
|---|---|---|---|---|
| Sín (%) | Non (%) | p | OR (IC del 95%) | |
| Edad gestacional | 0,004 | |||
| 24-29 semanas | 51 (47,6) | 56 (52,4) | 0,9 (0,5-1,4) | |
| 30-32 semanas | 23 (30,2) | 53 (69,8) | 0,4 (0,2-0,7) | |
| 33-36 semanas | 39 (33,9) | 76 (66,1) | 0,5 (0,3-0,8) | |
| 37-42 semanas | 85 (50,0) | 85 (50,0) | 1 | |
| Prematuridad (≤ 36 semanas) | 0,011 | |||
| Sí | 113 (37,9) | 185 (62,1) | 0,6 (0,4-0,9) | |
| No | 85 (50,0) | 85 (50,0) | 1 | |
| Ventilación mecánica invasiva | < 0,001 | |||
| Sí | 158 (78,2) | 44 (21,8) | 20,2 (12,6-32,5) | |
| No | 40 (15,0) | 226 (85,0) | 1 | |
| Uso de herramientas de evaluación del dolor | 0,001 | |||
| Sí | 46 (58,9) | 32 (41,1) | 2,2 (1,3-3,6) | |
| No | 152 (38,9) | 238 (61,1) | 1 | |
| Guías locales de tratamiento del dolor | 0,553 | |||
| Sí | 140 (43,2) | 184 (56,8) | 1,1 (0,7-1,6) | |
| No | 58 (40,2) | 86 (59,8) | 1 | |
| Guías locales de evaluación del dolor | < 0,001 | |||
| Sí | 113 (58,5) | 80 (41,5) | 3,1 (2,1-4,6) | |
| No | 85 (30,0) | 190 (70,0) | 1 | |
| Líder de dolor médico en la unidad | 0,088 | |||
| Sí | 43 (50,5) | 42 (49,5) | 1,5 (0,9-2,4) | |
| No | 155 (40,4) | 228 (59,6) | 1 | |
| Líder de dolor enfermería en la unidad | 0,291 | |||
| Sí | 26 (49,0) | 27 (51,0) | 1,3 (0,7-2,4) | |
| No | 172 (41,4) | 243 (58,6) | 1 | |
| Equipo del dolor en la unidad | 0,524 | |||
| Sí | 95 (40,2) | 141 (59,8) | 0,8 (0,6-1,2) | |
| No | 98 (43,1) | 129 (56,9) | 1 | |
| Visitas de los padres permitidas 24 h | 0,268 | |||
| Sí | 184 (43,0) | 243 (57,0) | 1,6 (0,7-3,3) | |
| No | 14 (34,1) | 27 (65,9) | 1 | |
| Media±DE | Media±DE | p | OR (IC del 95%)a | |
| Gravedad (CRIB score) | 3,7±3,6 | 1,0±1,8 | < 0,001 | 1,5 (1,3-1,6) |
| Número de camas en la unidad | 16,1±7,5 | 14,3±7,0 | 0,008 | 1,03 (1,01-1,06) |
| Número de ingresos anuales | 329,9±138,3 | 296,4±130,7 | 0,008 | 1,01 (1,00-1,01) |
| Número de ingresos quirúrgicos anuales | 70,9±66,7 | 53,6±57,5 | 0,003 | 1,01 (1,00-1,01) |
CRIB es una medida de la gravedad validada en neonatos pretérmino compuesto por 6 ítems recogidos en las primeras 12 h de vida. Su valor va de 0 a 23, en donde valores mayores indican mayor gravedad.
DE: desviación estándar; OR: odds ratio.
Modelo multivariante de regresión logística mediante ecuaciones de estimación generalizada, de factores asociados al uso de sedación o analgesia en neonatos
| B | EE | p | ORa | IC del 95% (OR) | ||
|---|---|---|---|---|---|---|
| Intersección | 4,138 | 0,5806 | < 0,001 | |||
| Edad gestacional (semanas) | ||||||
| 24-29 | –1,563 | 0,5439 | 0,004 | 0,210 | 0,072 | 0,609 |
| 30-32 | –1,126 | 0,4221 | 0,008 | 0,324 | 0,142 | 0,742 |
| 33-36 | –0,663 | 0,3537 | 0,061 | 0,515 | 0,258 | 1,031 |
| 37-42 | 1(ref) | |||||
| Ventilación mecánica invasiva | 3,183 | 0,3147 | < 0,001 | 24,116 | 13,016 | 44,682 |
| Gravedad (CRIB score)>3 | 0,786 | 0,3466 | 0,023 | 2,195 | 1,113 | 4,330 |
| Guías locales de evaluación del dolor | –1,401 | 0,3151 | < 0,001 | 4,058 | 2,189 | 7,526 |
| Líder de dolor médico en la unidad | –0,809 | 0,4049 | 0,046 | 2,245 | 1,015 | 4,965 |
CRIB es una medida de la gravedad validada en neonatos pretérmino compuesto por 6 ítems recogidos en las primeras 12 h de vida. Su valor va de 0 a 23, en donde valores mayores indican mayor gravedad.
B: coeficiente de regresión; EE: error estándar; IC: intervalo de confianza; OR: odds ratio.
Hasta donde conocemos, este estudio es el primer estudio multicéntrico prospectivo sobre el manejo de la S/A en una muestra de neonatos ingresados en unidades neonatales españolas. En este estudio, un 42,3% de los neonatos recibieron algún tipo de medicación sedante o analgésica, una proporción que alcanzó el 78,2% en aquellos que recibieron VM invasiva. Sobre el total de neonatos, un 31,8% recibió un opiáceo y un 17,9% recibió midazolam. El opiáceo más utilizado fue el fentanilo, que se administró a un 29,4% del total de neonatos.
Casi la mitad de los neonatos recibieron algún tipo de fármaco sedante o analgésico en este estudio. A nivel internacional, en el año 2003, el 60,3% de una muestra de 151 neonatos holandeses recibió algún tipo de analgesia farmacológica3, pero este porcentaje se redujo significativamente, al 36,6%, en las mismas unidades 8 años después tras la intensificación de medidas no farmacológicas, la aplicación de los cuidados NIDCAP y el desarrollo de un protocolo de tratamiento basado en la valoración clínica del dolor22. En el grupo de neonatos con VM invasiva el porcentaje de S/A ascendió a un 78,2%. El fármaco más usado fue el fentanilo, seguido del midazolam, el paracetamol y la morfina, hallazgos similares a una encuesta previa italiana15. La VM es una técnica estresante y potencialmente dolorosa, además la inadaptación o «lucha» con el respirador puede dificultar una adecuada ventilación y tener efectos perjudiciales23. Se han publicado recomendaciones internacionales promoviendo el uso de opiáceos en neonatos ventilados7 y su uso ha sido evaluado en 2 estudios de buena calidad metodológica24,25, y en un metaanálisis26. Los resultados merecen una evaluación prudente. Se ha observado un modesto efecto de la morfina sobre las escalas de valoración del dolor durante los procedimientos dolorosos, y una ausencia de efecto sobre la prevención de lesiones neurológicas o muerte24,25. Además, la utilización de morfina se ha asociado a un mayor tiempo para alcanzar la alimentación enteral completa en neonatos prematuros. Sin embargo, hay que resaltar el hecho que los opiáceos sintéticos como el fentanilo no han sido evaluados en esos aspectos y sobre todo que la utilización de analgésicos para aliviar el dolor y el sufrimiento de los neonatos constituye en sí una razón suficiente para su utilización incluso en ausencia de efecto sobre algún resultado clínico.
En España existen varios opiáceos disponibles, pero en las unidades neonatales su uso prácticamente se restringe al fentanilo y a la morfina, sin poder recomendarse en este momento un opiáceo con respecto a otro. Una explicación al elevado uso de fentanilo en las unidades españolas es que este fármaco puede tener algunas ventajas teóricas (potente, efecto rápido, corta duración) con un efecto analgésico similar a morfina27, si bien existen muy pocos estudios aleatorizados al respecto y todos con un reducido número de pacientes28,29.
En cuanto a los fármacos con acción fundamentalmente sedante, las benzodiacepinas son los fármacos más utilizados. El midazolam se usa muy frecuentemente (42,4% de los neonatos que recibieron algún tipo de S/A) a pesar de la ausencia de beneficios demostrados, de la preocupación sobre su influencia en el neurodesarrollo tanto en experimentación animal30 como a nivel clínico6, y de recientes revisiones desaconsejando su uso rutinario31.
Como en otros estudios previos, nuestros resultados indican una gran variabilidad en las pautas de S/A entre las 30 unidades participantes2. Los 19 fármacos distintos utilizados, las 14 combinaciones distintas de fármacos en perfusión y la dispersión de los porcentajes de utilización de los distintos fármacos expresadas en la figura 2 son reflejo de la carencia de pautas de consenso comunes a las unidades españolas. Esta gran variabilidad ha podido ser detectada gracias a una recogida de datos en la cabecera del paciente; es muy probable que el uso de estas medicaciones no pudiese ser detectado en estudios tipo encuesta. De forma similar, Jenkins et al., en un estudio prospectivo de 338 pacientes pediátricos (incluyendo 39 neonatos) de 20 unidades en Reino Unido, reportan 24 fármacos sedantes o analgésicos distintos32. Es fácil concluir que estas diferencias entre unidades dificultan la comparación de resultados y el estudio de la S/A en nuestro país.
Soluciones dulces oralesEl uso de soluciones dulces orales durante procedimientos potencialmente dolorosos ha sido ampliamente recomendado33,34. Sin embargo, en nuestro estudio solo el 38,4% de los neonatos recibieron alguna solución dulce oral (sacarosa o glucosa). Es posible que el registro de la administración de soluciones dulces orales fuese más laxo que para los fármacos, aunque el carácter prospectivo del estudio debería haber minimizado este posible error. Otra posibilidad es que todavía existan reticencias a su uso debido al desconocimiento de su mecanismo de acción exacto. Es importante destacar el hecho de que 12 unidades utilizan soluciones dulces en más de la mitad de sus pacientes y en cambio hubo 9 unidades que no las utilizaron en ninguno de los pacientes incluidos en el estudio. Esta variabilidad, aunque también se observó con otros fármacos, es especialmente llamativa en el caso de las soluciones dulces orales.
Guías locales de tratamiento y valoración del dolorA pesar de las recomendaciones internacionales al respecto de la conveniencia de establecer protocolos de manejo del dolor35, un tercio de las unidades declararon no tener un protocolo por escrito, porcentaje muy similar al observado en el estudio de Mencía et al. en 36 UCI pediátricas españolas en el año 2011, en el cual un 64% de las unidades declaraban tener un protocolo escrito de sedonalgesia36. A nivel internacional, la proporción de unidades neonatales con protocolos por escrito varían desde un 15%13 hasta un 88%19. El porcentaje de nuestra muestra se sitúa en valores similares a otros países de nuestro entorno9,11,14,15,17.
Factores asociados a recibir sedación y/o analgesiaEl análisis multivariante mostró que las variables asociadas a un mayor uso de S/A fueron la edad a término, la VM, la gravedad al ingreso definida sobre la base de la puntuación de CRIB, la existencia de guías locales de evaluación del dolor y la existencia de un líder médico del dolor. El factor más asociado al uso de S/A fue la VM.
En estudios previos, se han descrito diferencias en el manejo del dolor asociadas al tamaño de las unidades17,19, al nivel asistencial11,12 y a su carácter quirúrgico11. En nuestra muestra, el número de ingresos anuales (mayor o menor de 250) y el número de ingresos quirúrgicos anuales (mayor o menor de 25) no se asociaron al hecho de recibir S/A. Existen pocos datos sobre la influencia de las guías locales en el manejo del dolor en unidades neonatales. Algunos estudios previos indican diferencias significativas entre las unidades que disponen de protocolos por escrito y las que no17,37. En nuestra muestra, solo la existencia de guías locales de valoración del dolor se asoció de forma independiente a un mayor uso de S/A, si bien la propia aplicación de las herramientas de valoración del dolor no se asoció de forma significativa.
LimitacionesUna preocupación habitual es la de la generabilidad de los resultados, que aquí tiene potencial importancia. En nuestro estudio han participado la gran mayoría de las unidades neonatales invitadas, con representación de unidades de todo el país e inclusión de un número elevado de pacientes consecutivos no seleccionados, por lo que creemos que constituyen un reflejo fiel de la situación real de la S/A en España. No se puede descartar que el hecho de participar en el estudio, por saberse observado, modifique las prácticas (efecto Hawthorne). Este aspecto se intentó minimizar con un tiempo relativamente largo de inclusión (un mes) y de seguimiento (28 días), que garantiza la rotación del personal.
Aunque el desarrollo inicial de la escala CRIB se llevó a cabo en neonatos de menos de 32 semanas38, se eligió utilizarla en este estudio como medidora de la gravedad principalmente por su sencillez y su amplia difusión39, pero también porque la prematuridad fue el principal diagnóstico al ingreso y por su uso previo en estudios de naturaleza similar al presente2.
No se evaluaron las dosis de los fármacos utilizados ni se evaluaron las medidas no farmacológicas para el manejo del dolor. La decisión de no recoger estos datos fue para facilitar la recogida de información y hacer viable el estudio, aspecto en el que tuvo éxito, pero limita la posibilidad de discusión de aspectos de indudable interés.
ConclusionesNuestros resultados permiten conocer las pautas reales de S/A utilizadas en España y demuestran una importante variabilidad entre las distintas unidades. Este «estado del arte» puede servir de base para la elaboración de guías de práctica clínica a nivel nacional40.
A pesar de que el manejo de la S/A es un campo en continuo cambio y que aún existen muchas áreas en las que son necesarios más estudios, la creación de grupos de trabajo y la elaboración de guías o protocolos consensuados entre las distintas unidades puede disminuir la variabilidad en la práctica clínica y permitir una más fácil evaluación de las pautas de S/A en España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Helena Viana, Paloma Lopez Ortego (Hospital Infantil Universitario La Paz, Madrid). Pilar Saenz Gonzalez, Raquel Escrig (Hospital Universitari i Politecnic La Fe, Valencia). Eva Bargalló Ailagas, Concepcio Carles (Hospital Universitari Josep Trueta, Girona). Laura San Feliciano, Ana Belén Mateo (Hospital Universitario de Salamanca). Inés Esteban Diéz, Rosa González Crespo (Hospital San Pedro de Logroño). Ersilia González Carrasco, Isabel de la Nogal Tagarro (Hospital Universitario Severo Ochoa, Leganés). María Dolores Elorza Fernández, Nerea Benito Guerra (Hospital Universitario de Donostia). Salud Luna Lagares, Pedro Jiménez Parrilla (Hospital Virgen Macarena, Sevilla). Francesc Botet, Anna Ciurana, Rebeca Tarjuelo (Hospital Clinic de Barcelona). María José García Borau, Nuria Ibáñez (Hospital de la Santa Creu i Sant Pau, Barcelona). Gloria Diáñez Vega (Hospital Universitario Puerta del Mar, Cádiz). María Arriaga Redondo (Hospital General Universitario Gregorio Marañón, Madrid). Gloria Herranz, Virginia de la Fuente Iglesias (Hospital Clínico San Carlos, Madrid). Amaya Pérez Ocón, Sagrario Santiago Aguinaga (Complejo Hospitalario de Navarra). Belén Martín Parra, Antonia Valero Cardona (Hospital General de Castellón). María Dolores Sánchez-Redondo, Antonio Arroyos Plana (Hospital Virgen de la Salud, Toledo). Zenaida Galve Pradel, Nuria Clavero Montañés (Hospital Universitario Miguel Servet, Zaragoza). María Jesús Ripalda Crespo, Raquel Nogales Juárez (Hospital Universitario Príncipe de Asturias, Alcalá de Henares). Aintzane Euba Lopez, Sonia Fernández de Retana (Hospital Universitario de Álava). Mar Reyné Vergeli, Raquel Vidal (Hospital Sant Joan de Déu, Barcelona). Jose Luis Fernandez-Trisac, María Taboada (Complexo Hospitalario Universitario de A Coruña). Aurora Montoro Expósito, Fátima Camba Longueira (Hospital Vall d¿Hebron, Barcelona). Gonzalo Solís Sánchez (Hospital Universitario Central de Asturias, Oviedo). María Purificación Ventura Faci, Marivi Mallen (Hospital Clínico Universitario Lozano Blesa, Zaragoza). Pilar Crespo Suárez, Elvira de Sola (Complexo Hospitalario de Pontevedra). Caridad Tapia Collados (Hospital General de Alicante). Isabel de las Cuevas, Beatriz Martín (Hospital Universitario Marqués de Valdecilla, Santander). María Luz Couce Pico, Alejandro Pérez Muñuzuri, Salomé Quintáns (Complexo Hospitalario Universitario de Santiago). Ana Melgar Bonis, Eugenia Bodas (Hospital Universitario 12 de Octubre, Madrid). Ana Concheiro Guisan, Begoña Pérez Costas (Complexo Hospitalario Universitario de Vigo).