El metotrexato (MTX) es el fármaco sistémico más utilizado en el tratamiento de pacientes con artritis idiopática juvenil. Su efectividad viene limitada por el desarrollo de efectos adversos (EA).
Pacientes y métodosEstudio observacional descriptivo retrospectivo de la frecuencia y tipo de EA asociados a MTX en pacientes con artritis idiopática juvenil seguidos en un hospital terciario en el periodo 2008-2016.
ResultadosSe estudió a 107 pacientes, 71/107 mujeres (66,3%) con edad al diagnóstico de 6,4 años (RIC 3,1-12,4) durante una mediana de seguimiento de 45,7 meses (RIC 28,8-92,4). El 44,9% (48 pacientes) tenía oligoartritis y el 24,3% (n=26) poliartritis factor-reumatoide negativo. El 48,6% (52/107) desarrolló EA, siendo los más frecuentes los síntomas gastrointestinales y los trastornos conductuales (35,6% cada uno). La edad mayor de 6 años al inicio del tratamiento aumentaba el riesgo de desarrollar EA, tanto en el estudio univariable (OR=3,5; IC95% 1,5-7,3) como en el multivariable (aumento del riesgo del 12% por año). La dosis, vía de administración o forma clínica no presentaban relación con el desarrollo de EA. Veinte niños precisaron cambio de dosis o vía de administración, resolviéndose el EA en 11 (55%). MTX se suspendió en 37/107 pacientes (34,6%) por EA, principalmente por hipertransaminasemia (n=14; 37,8%), síntomas gastrointestinales (n=9; 24,3%) y trastornos conductuales (n=6; 16,3%).
ConclusionesMTX es el tratamiento de elección de niños con artritis idiopática juvenil pero produce EA en prácticamente el 50% de los pacientes. Aunque estos EA no son graves, obligan a interrumpir el tratamiento en el 35%.
Methotrexate (MTX) is the drug of choice for juvenile idiopathic arthritis. Its clinical efficacy is limited due to the development of adverse effects (AEs).
Patients and methodsA retrospective observational study was conducted on the AEs associated with MTX therapy in children diagnosed with juvenile idiopathic arthritis followed-up in a tertiary hospital between 2008 and 2016.
ResultsThe study included a total of 107 patients, of whom 71 (66.3%) were girls (66.3%). The median age at diagnosis was 6.4 years (IQR 3.1-12.4), with a median follow-up of 45.7 months (IQR 28.8-92.4). There were 48 patients (44.9%) with oligoarthritis, and 26 children (24.3%) with rheumatoid-factor negative polyarthritis. Of these, 52/107 (48.6%) developed AEs, with the most frequent being gastrointestinal symptoms (35.6%) and behavioural problems (35.6%). An age older than 6 years at the beginning of therapy increased the risk of developing AEs, both in the univariate (OR=3.5; 95% CI: 1.5-7.3) and multivariate (12% increase per year) analyses. The doses used, administration route, or International League of Associations for Rheumatology (ILAR) classification, were not associated with the development of AEs. Twenty children required a dosage or route of administration modification, which resolved the AE in 11 (55%) cases. MTX was interrupted due to the development of AEs in 37/107 patients (34.6%), mainly due to increased plasma transaminases (n=14, 37.8%), gastrointestinal symptoms (n=9, 24.3%) and behavioural problems (n=6, 16.3%).
ConclusionsMTX is the therapy of choice for patients with juvenile idiopathic arthritis, but 50% of the children develop some form of AE. Although the AEs are not severe, they lead to interruption of therapy in 35% of the children.
La artritis idiopática juvenil (AIJ) tiene una prevalencia de 40-150/100.000 niños constituyendo la enfermedad reumatológica crónica más frecuente en pediatría. La AIJ es heterogénea y comprende 7 formas clínicas1 de acuerdo a los criterios de clasificación de la International League Against Rheumatism (ILAR). Esta clasificación se basa en las características clínicas y analíticas de la enfermedad. Cuando el síntoma dominante es la artritis periférica se clasifica en función del número de articulaciones afectadas en «oligoarticular» (hasta 4) o «poliarticular» (5 o más); esta última puede ser factor reumatoide positivo o negativo. La cuarta categoría, la forma «sistémica», viene determinada por la presencia de síntomas sistémicos (fiebre, exantema, serositis, adenopatías generalizadas u organomegalias), independientemente del número de articulaciones afectadas. La categoría «artritis relacionada con entesitis» se caracteriza por la afectación articular axial y/o la inflamación de las entesis. La sexta categoría es la «artritis psoriásica», denominándose «artritis indiferenciada» aquella que no puede ser incluida en ninguna de las anteriores. La enfermedad puede producir discapacidad a largo plazo2.
El metotrexato (MTX) es el fármaco antirreumático modificador de la enfermedad de elección para la mayoría de las formas clínicas de la enfermedad3,4 y tiene un buen perfil de seguridad5. En monoterapia induce la remisión de la enfermedad en el 60-70% de pacientes, mientras que combinado con fármacos antirreumáticos modificadores de la enfermedad biológicos disminuye su inmunogenicidad3,6.
Los efectos adversos (EA) más frecuentes de MTX no son graves, aunque pueden determinar la adherencia al tratamiento7 y su interrupción.
El objetivo del estudio es determinar la frecuencia y tipo de EA de MTX en pacientes con AIJ, los factores de riesgo relacionados con su aparición y las diferentes intervenciones realizadas.
Pacientes y métodosSe realizó un estudio observacional, descriptivo, de cohorte retrospectiva, que incluyó a todos los pacientes de 0 a 16 años diagnosticados de AIJ seguidos en la consulta de Reumatología Pediátrica de un hospital terciario tratados con MTX entre 2008 y 2016.
La información clínico-analítica se obtuvo de las historias electrónicas del hospital, incluyendo el sexo, edad al diagnóstico, forma clínica de AIJ según la clasificación ILAR1 y la presencia o no de EA. Todos los pacientes recibieron una dosis de 5mg a la semana de ácido fólico.
Los EA se clasificaron como gastrointestinales (dolor abdominal, náuseas/vómitos, anorexia), hepáticos (hipertransaminasemia), mucocutáneos (aftas orales, alopecia), hematológicos (citopenias), conductuales (conducta de anticipación con aparición de dolor abdominal, síntomas digestivos o nerviosismo significativo previos a su administración), infecciosos y otros.
Dada la frecuencia e inespecificidad de los síntomas digestivos, solo se consideraron aquellos asociados a la administración de MTX que no eran transitorios o cuya frecuencia y/o intensidad interferían con el tratamiento.
Se definió hipertransaminasemia como elevación de GPT/ALT y de GOT/AST superior al doble del límite superior del valor de referencia de nuestro centro (45UI/ml). A todos los pacientes se les realizó hemograma y función hepática al mes del inicio del tratamiento y cada 3-4 meses posteriormente. Cuando existía hipertransaminasemia se interrumpía el tratamiento; al mes se repetía la determinación de transaminasas, reintroduciendo MTX si estas eran normales o suspendiéndolo definitivamente si persistían elevadas.
Se recogió la fecha, vía y dosis de MTX al inicio del tratamiento y en el momento de aparición de EA, la necesidad o no de cambio de dosis o de vía de administración de MTX a causa de estos, y si hubo o no resolución posterior. También se registró si hubo que suspender MTX, el motivo de la interrupción y el fármaco elegido para su sustitución (biológico o no biológico). Por último, en los pacientes a quienes se reintrodujo MTX tras la resolución del EA se recogió la fecha, dosis, vía de administración y reaparición o no de EA. En todos se evaluó la presencia de artritis o uveítis activa al finalizar el estudio y los últimos valores de proteína C reactiva y velocidad de sedimentación globular registrados. La remisión de la enfermedad se evaluó de acuerdo a los criterios de Wallace et al8.
Las variables cuantitativas se describieron usando medias o medianas como medidas de tendencia central y desviación estándar o rango intercuartílico (RIC) como medidas de dispersión, en función de que la distribución fuera paramétrica o no paramétrica respectivamente. Para el análisis de las variables cualitativas se utilizó la distribución de frecuencias.
La asociación entre variables categóricas se estudió utilizando el test de χ2 de Pearson. La comparación de medias/medianas se realizó mediante las pruebas de Mann-Whitney o Kruskal-Wallis, dependiendo del tipo de distribución. El análisis multivariable se llevó a cabo mediante regresión logística. Se consideró significativo un valor de p<0,05.
La relación temporal entre la utilización de MTX y el desarrollo de EA se estudió mediante un análisis de supervivencia utilizando el método de Kaplan-Meier, siendo el evento de interés la suspensión de MTX y expresando el tiempo en meses.
La base de datos se creó en Microsoft Access 2003 (Redmond, WA, EE. UU.) mientras que para el análisis estadístico se utilizó el programa Stata versión 4 (College Station, TX, EE. UU.)
ResultadosCaracterísticas epidemiológicas de la población estudiadaSe estudiaron 107 pacientes con AIJ, 71 de los cuales (66,3%) eran mujeres. La mediana de edad al diagnóstico fue 6,4 años (RIC 3,1-12,4) mientras que la mediana de tiempo de seguimiento fue 45,7 meses (RIC 28,8-92,4).
Los pacientes fueron clasificados según los criterios de la ILAR1 (tabla 1), siendo las formas clínicas más frecuentes la oligoarticular persistente (48 pacientes, 44,9%) y la poliarticular factor reumatoide negativo (26 niños, 24,3%).
Características demográficas de los pacientes estudiados con artritis idiopática juvenil
| Forma clínica | Frecuencia | Edad al diagnóstico (mediana, RIC) | Sexo (M/V) | Desarrollo de EA (%) |
|---|---|---|---|---|
| Oligoarticular persistente | 48 (44,9%) | 5,4 (3,1-10) | 33/15 | 22/48 (45,8) |
| Oligoarticular extendida | 12 (11,2%) | 5 (3-7,5) | 9/3 | 4/12 (33,3) |
| Poliarticular factor reumatoide negativo | 26 (24,3%) | 10 (2,4-12,9) | 20/6 | 15/26 (57,7) |
| Artritis relacionada con entesitis | 10 (9,3%) | 13,6 (8,4-14,4) | 4/6 | 8/10 (80) |
| Artritis psoriásica | 2 (1,9%) | 12 (11-13) | 1/1 | 0/2 (0) |
| Artritis sistémica | 8 (7,5%) | 5 (2,1-15) | 3/5 | 2/8 (25) |
| Artritis indiferenciada | 1 (0,9%) | 9,9 | 1/0 | 1/1 (100) |
| Total | 107 (100%) | 6,4 (3,1-12,4) | 71/36 | 52/107 (48,6) |
La dosis media de metotrexato fue de 15mg/m2/semana (±2,3) siendo la mediana de tiempo del tratamiento de 17,9 meses (RIC 12,8-36,6). En cuanto a la vía de administración, 63 pacientes (59,4%) recibieron MTX vía subcutánea. En todos los casos se administraron suplementos semanales de ácido fólico.
Frecuencia y tipo de efectos adversosDe los 107 pacientes estudiados, 52 (48,6%) desarrollaron EA (tabla 2). Seis niños (11,5%) presentaron más de un tipo de EA. La mediana de tiempo de tratamiento hasta la aparición de EA fue de 11,6 meses (RIC 4,3-17,9).
Tipo de efectos adversos registrados en la serie incluyendo su frecuencia, edad de aparición y tiempo transcurrido de tratamiento con metotrexato
| Efecto adverso | Frecuencia (%) | Edad en años (mediana, RIC) | Meses de tratamiento con MTX |
|---|---|---|---|
| EA gastrointestinales | 20 (34,4) | 8,4 (5,2-14) | 7 (4,2-13) |
| Vómitos | 11 (55) | 11,4 (6,3-14) | 11,2 (4,4-13,2) |
| Náuseas | 5 (25) | 14,8 (8-15) | 8,7 (3,2-14,1) |
| Dolor abdominal | 4 (20) | 2,8 (2,3-5,6) | 4,7 (4,2-6) |
| EA conductuales | 21 (36,2) | 8,3 (3,8-12,1) | 12 (3,2-35,5) |
| Inquietud/nerviosismo | 8 (38,1) | 8,1 (3,4-14,1) | 15,4 (3,5-33,6) |
| Vómitos anticipatorios | 7 (33,3) | 8,4 (3,8-11,4) | 12 (5-42,5) |
| Náuseas anticipatorias | 3 (14,3) | 10,5 (1,8-15,5) | 2 (1,4-39,3) |
| Llanto | 2 (9,5) | 4,5 (2,4-6,5) | 21,5 (3,2-39,9) |
| Irritabilidad | 1 (4,8) | 13,9 | 17,1 |
| EA hepáticos | 14 (24,1) | 9,5 (5,4-12,9) | 16,4 (10,4-22,2) |
| Hipertransaminasemia | 14 (100) | ||
| EA mucocutáneos | 1 (1,7) | 1 | 12 |
| Alopecia | 1 (100) | ||
| EA hematológicos | 1 (1,7) | 6,3 | 47,3 |
| Neutropenia | 1 (100) | ||
| EA infecciosos | 1 (1,7) | 9 | 18 |
| Varicela leve | 1 (100) |
El porcentaje indicado de cada categoría se refiere al total de pacientes que desarrollaron algún efecto adverso (EA) y no al total de la serie. Asimismo, el porcentaje representado de cada efecto adverso («vómitos» o «llanto») hace referencia a la proporción de pacientes que han presentado ese efecto dentro de la categoría correspondiente («EA gastrointestinales») y no del total de la serie.
Los EA más frecuentes fueron la aparición de trastornos conductuales y de alteraciones gastrointestinales, presentes en 21/107 (19,6%) y 20/107 (18,7%), respectivamente. El tercer EA fue el desarrollo de hipertransaminasemia, presente en 14 niños (13%); con un valor medio obtenido para ALT/GPT de 212UI/ml y para AST/GOT de 143UI/ml.
Los más infrecuentes, presentes en solo un paciente cada uno, fueron los EA mucocutáneos (alopecia), los hematológicos (neutropenia transitoria) y los infecciosos (varicela no complicada).
Factores de riesgo relacionados con el desarrollo de efectos adversosAnalizando la influencia de variables demográficas como el sexo y la edad se objetivó que una proporción similar de niñas (50,7%) y niños (44,4%) desarrollaron EA. Sin embargo, la mediana de edad al inicio del tratamiento de los pacientes que presentaron alguna forma de intolerancia a MTX fue mayor (8,7 años; RIC, 5,2-13,6) que la de los niños que no presentaron EA (4,9 años; RIC 2,6-10,9), siendo esta diferencia significativa (p=0,014). Al estratificar a los niños por edad se observó que la edad superior a los 6 años aumentaba significativamente el riesgo de desarrollar EA con el tratamiento (OR=3,5; IC95% 1,5-7,3).
Esta observación no se relacionaba con la duración del tratamiento. Los pacientes menores de 6 años recibieron MTX durante más tiempo, (23,3 meses [RIC 16-41]), que los mayores de 6 años (15,9 meses [RIC 10,4-25,4]) (p=0,01).
El análisis de las formas clínicas de AIJ no demostró diferencias en la frecuencia de EA.
A continuación, se analizaron variables relacionadas con el tratamiento, incluyendo la dosis empleada y la vía de administración. Las dosis de MTX no parecen guardar relación con el desarrollo de EA, ya que la dosis semanal utilizada en los pacientes que no presentaron intolerancia (15,8mg/m2) fue superior en aquellos que desarrollaron EA (13,9mg/m2), sin ser esta diferencia significativa. Tampoco se objetivaron diferencias en función de la vía de administración, ya que el 44,2% de los que recibieron tratamiento vía oral presentaron EA frente a un 52,4% de los que lo recibieron por vía subcutánea (p=0,41).
Se evaluaron diferentes modelos de regresión logística para analizar la asociación entre el desarrollo de EA y las variables mencionadas anteriormente (sexo, edad, clase ILAR de AIJ, dosis de MTX y vía de administración). El mejor modelo multivariable resultó ser aquel que incluía también la variable sexo, a pesar de que esta no alcanzó significación estadística en el análisis univariable. De acuerdo con el análisis multivariable, por cada año de incremento de la edad aumentaba el riesgo de desarrollar EA un 12% (OR 1,12; IC95% 1,02-1,21); el sexo masculino también asociaba un aumento del riesgo, aunque no alcanzaba niveles de significación estadística (OR 1,40; IC95% 0,6-3,2).
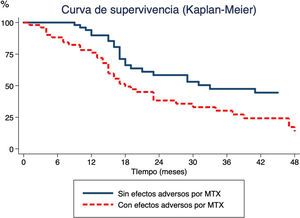
Por último, se estudió la relación existente entre el tiempo de administración de MTX y el desarrollo de EA (fig. 1). El análisis de supervivencia indicó que la probabilidad de suspender el tratamiento en pacientes que desarrollaban EA aumentaba con el tiempo, un 15% a los 6 meses, un 24% a los 12 meses y un 50% a los 18.
Tiempo desde inicio de terapia con metotrexato (MTX) hasta suspensión del MTX mediante el método Kaplan-Meier. La línea continua muestra el tiempo hasta la suspensión de MTX por enfermedad inactiva en pacientes que no han presentado efectos adversos en contraposición a la línea discontinua, que muestra el momento de suspensión del MTX en pacientes que han experimentado efectos adversos.
Muchos pacientes presentaron EA con MTX y precisaron cambios en el tratamiento. Veinte niños con enfermedad inactiva presentaron intolerancia digestiva o conducta anticipatoria. Al 85% (17/20) se les cambió la vía de administración de subcutánea a oral, con resolución del EA en 12/17 (70%). Los otros 3 pacientes (15%) recibían MTX vía oral por lo que se redujo la dosis, siendo esta medida eficaz en solo 1/3 (33,3%). Por tanto, las modificaciones resolvieron el EA en 13 niños (65%), suspendiéndose MTX en los 7 restantes. En la evolución, 2 de los 13 pacientes que respondieron al cambio de la vía de administración de MTX presentaron un nuevo EA (hipertransaminasemia) que motivó la suspensión definitiva del fármaco.
En 34/107 pacientes (31,8%) se suspendió MTX por EA (tabla 3). En este grupo se incluyen los 9 pacientes mencionados anteriormente y otros 25 niños. Los 3 principales EA que motivaron la suspensión fueron hipertransaminasemia (14/34; 41,2%), síntomas gastrointestinales (9/34; 26,5%) y síntomas conductuales (6/34; 17,7%).
Motivos de suspensión del tratamiento con metotrexato
| Motivos | Frecuencia (%) |
|---|---|
| Remisión de la enfermedad | 27 (42,2) |
| Recaída de la enfermedad | 3 (4,7) |
| Desarrollo de efectos adversos | 34 (53,1) |
| Hipertransaminasemia | 14 (41,2) |
| Síntomas gastrointestinales | 9 (26,5) |
| Síntomas conductuales/anticipatorios | 6 (17,7) |
| Infecciosos | 1 (2,9) |
| Mucocutáneos | 1 (2,9) |
| Hematológicos | 1 (2,9) |
| Otros | 2 (5,9) |
El porcentaje indicado de cada categoría se refiere al total de pacientes que suspendieron el tratamiento con metotrexato y no al total de la serie.
En los 34 pacientes a quienes hubo que suspender MTX por EA se aplicaron 4 estrategias, dependiendo de su situación clínica. En los pacientes que estaban en remisión con tratamiento de corta evolución (13/34, 38,2%) se inició un fármaco antirreumático modificador de la enfermedad no biológico, leflunomida en todos los casos. En pacientes con respuesta parcial a MTX antes del desarrollo de EA (9/34, 26,5%) se optó por introducir un fármaco biológico. En 6/34 (17,6%) se suspendió el tratamiento definitivamente por mantener una remisión prolongada, mientras que en los otros 6/34 se reintrodujo MTX una vez resuelto el EA.
En 3/107 (2,8%) se suspendió MTX por recaída de la enfermedad y no por EA, introduciendo en todos un fármaco biológico. En total 12 pacientes lo recibieron, 9 por EA y 3 por recaída, siendo el más utilizado cuando no existía afectación oftalmológica etanercept (83,3%); en 2 niños con uveítis se introdujo adalimumab.
En 27/107 (25,2%) se suspendió el MTX por remisión de la enfermedad.
Reintroducción de metotrexato tras la desaparición de efectos adversos. EvoluciónDurante el periodo de estudio se reintrodujo MTX en 10 pacientes a quienes se había suspendido (6/34 por EA, 4/27 por remisión). La dosis media utilizada fue 14,6mg/m2/semana (±4,5mg), similar a la empleada anteriormente, y la vía de administración fue mayoritariamente la subcutánea (70%).
La mitad de los pacientes (5/10, 50%) toleraron el MTX sin complicaciones mientras que el restante 50% presentó EA que motivaron su suspensión definitiva.
Suspensión del tratamiento y actividad de la enfermedadAl final del periodo de observación se suspendió MTX en un total de 64 pacientes (59,8%) después de una mediana de tratamiento de 21,6 meses (RIC 9,9-46,6). En el 42,2% (27/64) se hizo por remisión de la enfermedad, en el 4,7% (3/64) por recaída de la enfermedad, mientras que en el 53,1% restante (34/64) se realizó por EA.
Al finalizar el estudio, se evaluó la actividad de la enfermedad en los pacientes que recibían MTX en monoterapia. El 60% de los niños (65/107) cumplía los criterios de remisión propuestos por Wallace. El resto no cumplía estos criterios, bien por la presencia de actividad clínica (artritis o uveítis activas en el 15% y 7% respectivamente), bien por continuar presentando elevación de reactantes de fase aguda (proteína C reactiva o velocidad de sedimentación globular elevadas en el 19% y el 15% respectivamente).
DiscusiónEste estudio representa el primer análisis de la frecuencia y tipo de EA asociados al tratamiento con MTX en pacientes españoles diagnosticados de AIJ. Desde que en 1992 se demostró la eficacia de MTX en el tratamiento de la enfermedad9 representa el tratamiento sistémico de elección para la misma10. Su eficacia11 se observa no solo en la disminución del número de articulaciones inflamadas, sino también en una significativa mejoría de la calidad de vida relacionada con la salud de estos pacientes12. A pesar de ello, el número de publicaciones que han abordado los EA de MTX en pacientes con AIJ5,13–21 es escaso (tabla 4).
Frecuencia de los distintos tipos de efectos adversos asociados al tratamiento con metotrexato en pacientes con AIJ
| Autores y año | Frecuencia(%) | Gastrointestinales(%) | Hepáticos (%) | Hematológicos (%) | Mucocutáneos (%) | Infecciosos (%) | Conductuales (%) |
|---|---|---|---|---|---|---|---|
| Becker et al., 201013 | MTX dosis altas (>0,5mg/kg/sem) | NC | 56/126 (44) | NC | NC | NC | NC |
| MTX dosis bajas (≤0,5mg/kg/sem) | NC | 16/94 (17) | NC | NC | NC | NC | |
| Bulatovic et al., 201114 | Validación MISS 25/86 (29) | NC | NC | NC | NC | NC | NC |
| Aplicación MISS 150/297 (51) | Dolor 152/297 (51)Náuseas 191/297 (64)Vómitos 81/297 (27) | NC | NC | NC | NC | 172/297 (58) | |
| Fráňová et al., 20165 | 15/49 (31) | 16/49 (33) | 0/49 | 0/49 | 0/49 | 0/49 | 9/49 (18) |
| Klein et al., 201215 | MTX oral 58/259 (22) | 39/58 (67) | 7/58 (12) | 2/58 (3) | 0/58 | 10/58 (17) | 1/58 (2) |
| MTX sc 41/152 (33) | 26/41 (63) | 8/41 (20) | 1/41 (2) | 0/41 | 12/41 (29) | 0/41 | |
| Kocharla et al., 200916 | 30/198 (15) | NC | NC | 10/198 (5) | NC | NC | NC |
| Minden et al., 201517 | 323/828 (39) | 204/323 (63) | 29/323 (9) | NC | NC | 68/323 (21) | NC |
| Ortiz-Alvarez et al., 200418 | 37/89 (42) | NC | 13/89 (15) | 24/89 (27) | NC | NC | NC |
| Patil P et al., 201419 | 36/49 (73) | Náuseas 21/49 (43)Vómitos 36/49 (73) | NC | NC | NC | NC | NC |
| Van Dijkhuizen et al., 201620 | 73/179 (41) | Dolor 78/179 (44)Náuseas 103/179 (58)Vómitos 37/179 (21) | NC | NC | NC | NC | 110/179 (61) |
| Hosp 12 de Octubre | 52/107 (49) | Dolor 4/107 (4)Náuseas 5/107 (5)Vómitos 11/107 (10) | 14/107 (13) | 1/107 (1) | 1/107 (1) | 1/107 (1) | 21/107 (20) |
MISS: Methotrexate Intolerance Severity Score o Baremo de la severidad de la intolerancia a MTX; NC: no comunicado.
La frecuencia global de EA observados en pacientes españoles es comparable a la registrada en otras series. Entre un tercio y la mitad de los pacientes con AIJ que reciben MTX desarrollan EA5,13–21. El tipo de EA es también similar a lo publicado, siendo los más frecuentes las alteraciones conductuales, los gastrointestinales y, en tercer lugar, la hipertransaminasemia. En nuestro estudio se observó que la intolerancia digestiva (dolor abdominal, náuseas y vómitos), presente en el 20% de los pacientes, era menos frecuente que en otras series (21-73%). Estas diferencias se podrían explicar por la metodología utilizada, ya que solo se consideraron aquellos persistentemente asociados a la administración de MTX o cuya frecuencia y/o intensidad era significativa.
Otros EA como citopenias, alteraciones mucocutáneas e infecciones, son mucho menos frecuentes. Solo el 1% de los pacientes estudiados desarrollaron alopecia significativa o neutropenia, y ninguno tuvo una infección grave. Las complicaciones mucocutáneas y/o hematológicas del tratamiento son de las más conocidas, aunque todos los estudios coinciden en señalar su baja frecuencia5,15,18. En lo relativo a las infecciones, 2 series han determinado una frecuencia más elevada15,17 que la observada en nuestro centro; ambos estudios se basaron en registros alemanes que categorizaban los EA de acuerdo con medDRA (Medical Dictionary for Regulatory Activities), por lo que se registraban todas las infecciones incluyendo las banales. Un estudio basado en registros del seguro médico estadounidense Medicaid ha establecido que la tasa de infecciones que requieren hospitalización asociadas al tratamiento con MTX en pacientes con AIJ es 1,46 por 100 personas-año22.
Distintas variables pueden relacionarse con el desarrollo de EA, incluyendo la edad, el sexo, la forma clínica de AIJ, la dosis de MTX, su vía de administración, la suplementación con ácido fólico y factores culturales. Con respecto a la edad, nuestros datos indican que los mayores de 6 años al inicio del tratamiento desarrollaban intolerancia con una frecuencia significativamente mayor que pacientes más pequeños, independientemente de la dosis de MTX y del tiempo de tratamiento, lo que corroboran observaciones previas5,21. El sexo no parece contribuir al desarrollo de EA, excepto en un estudio que comunicó que la hipertransaminasemia era más frecuente en mujeres13. La forma clínica tampoco parece tener un papel determinante, aparte de la mayor frecuencia de alteraciones analíticas en pacientes con la forma sistémica16, lo que probablemente se debe a la enfermedad de base. La dosis utilizada genera más debate en la literatura. Fráňová et al.5 comunicaron una proporción similar de intolerancia a la registrada por otros autores20, a pesar de utilizar dosis de MTX un 40% superiores. Nuestra serie tampoco encontró relación entre el desarrollo de EA y la dosis usada. Otros autores, sin embargo, han comunicado una mayor frecuencia de intolerancia en pacientes con dosis más altas13,21. El efecto de la vía de administración también es objeto de debate. Factores como el dolor asociado a la inyección subcutánea no parecen contribuir significativamente23. Varios autores han comunicado una mayor frecuencia de intolerancia con la administración parenteral de MTX15,20,21, mientras que otros no encontraron diferencias24, como esta serie, o incluso observaron menos EA que con su administración oral25. Nuestro estudio no pudo abordar el impacto de la suplementación con ácido fólico/folínico vía oral porque se administró al 100% de los pacientes. Aunque algunos estudios pediátricos han observado que reduce la frecuencia de EA26, otros autores no lo han confirmado15,20. En cualquier caso, existe evidencia de práctica clínica y en adultos de que estos suplementos pueden disminuir los EA asociados a MTX, por lo que se recomienda administrarlos3,4. Finalmente, no cabe duda de que factores culturales pueden influir en la tolerancia a un tratamiento crónico. Así, es destacable que la alta frecuencia de alteraciones conductuales en estudios realizados en Holanda, que afectan hasta a un 60% de los enfermos14,20, no se observa en estudios realizados en otros países, incluido el nuestro, donde no supera el 20%5,15. Una revisión sistemática reciente analizó los posibles predictores asociados al desarrollo de EA, incluyendo variables clínicas, de laboratorio y genéticas, no encontrando ninguna que fuera aplicable en la práctica diaria27.
Una vez que los pacientes desarrollan EA se plantean distintas intervenciones, como la asociación de antieméticos, la terapia conductual, el cambio de la dosis o vía de administración, y la suspensión del tratamiento. La utilidad de la asociación de antieméticos para las náuseas/vómitos, particularmente ondansetrón, ha sido revisada recientemente28, no habiéndose evidenciado que sea efectivo. La terapia conductual ha demostrado menor eficacia que la administración subcutánea de MTX29. Ninguna de estas opciones se aplicó en nuestro centro. La tercera alternativa, la modificación del tratamiento, fue la más utilizada en nuestros pacientes y en otros estudios5,25, con resolución del EA en el 65% de los casos en nuestra serie. A la hora de tomar una decisión hay que considerar la situación clínica del paciente (remisión con tratamiento, refractariedad a MTX) y la gravedad o persistencia (recurrencia de hipertransaminasemia) del EA. Finalmente, los EA motivaron que hubiera que suspender MTX en el 35% de nuestros pacientes, destacando por su frecuencia la hipertransaminasemia y la clínica gastrointestinal.
En conclusión, MTX es un fármaco muy útil en el tratamiento de la AIJ cuyo uso viene limitado por la elevada frecuencia de EA asociados que, aunque no sean graves, determinan su interrupción.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.