La fibrosis quística puede cursar con inflamación de la mucosa intestinal y síndrome de hipercrecimiento bacteriano (SHB). Se ha argumentado que los probióticos actúan como inmunomoduladores, antiinflamatorios y reguladores de la microbiota. El objetivo del presente estudio es conocer la prevalencia de SHB en pacientes con fibrosis quística y tratar de optimizar la función intestinal mediante la administración de probióticos.
Pacientes y métodoFueron valorados 20 pacientes afectados de fibrosis quística, con una edad media de 10,33 años (rango, 5-17 años). El estudio del SHB se efectuó en 10 acientes mediante el test de hidrógeno espirado tras una sobrecarga de dextrosa al 20 %, a dosis de 2 g/kg. Tras la prueba se administró Lactobacillus rhamnosus LGG a dosis de 1011 ufc dos veces al día durante 4 semanas. La determinación de grasa, nitrógeno, agua y azúcares en las heces se efectuó antes y después del tratamiento mediante análisis de reflexión de infrarrojos (FENIR).
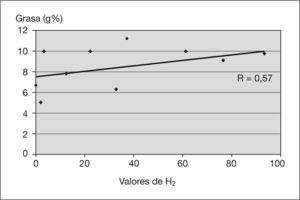
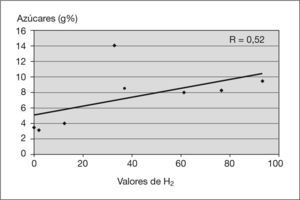
ResultadosCinco pacientes (50%) presentaron SHB. En los valores de H2 se detectó una correlación positiva con respecto a las cifras de esteatorrea (R=0,57) y de azúcares (R=0,52). Los valores del FENIR pretratamiento frente a postratamiento, expresados en gramos, fueron: grasa 6,2±3,3 frente a 4,9±2,1 (p<0,5), azúcares 6,7±3,6 frente a 5±2,6 (p<0,05) y nitrógeno 0,87 ( 0,27 frente a 0,91±0,14 (NS). En 13 pacientes (81,25 %) se evidenció una mejoría de la comodidad intestinal y del aspecto de las deposiciones, y en 9 pacientes (56,25 %) disminuyó el número de deposiciones.
ConclusionesEl tratamiento con probióticos mejora la función intestinal en los pacientes afectados de fibrosis quística desde el punto de vista clínico y bioquímico. Su administración podría ser pautada de una manera regular sobre todo en casos de SHB.
In some cases, cystic fibrosis may include intestinal inflammation and bacterial overgrowth. Probiotics are considered as immunomodulatory, anti-inflammatory and microbiotic regulator substances. The aim of our study is to determine the prevalence of bacterial overgrowth in cystic fibrosis patients and try to improve the intestinal function with the administration of probiotics.
Patients and methodWe examined 20 patients with cystic fibrosis (mean age 10.33, range 5 to 17 years). The expired hydrogen test with a 2 g/kg of 20 % dextrose overload was performed on 10 patients. After the test, Lactobacillus rhamnosus LGG 1011 CFU was administered twice daily for four weeks. Faecal near infrared spectroscopy (FENIR) of water, fat, nitrogen and sugar content in faeces was performed before and after probiotics administration.
ResultsFive patients (50 %) showed bacterial overgrowth. We obtained a positive correlation between the hydrogen test and steatorrhea (R=0.57) and sugar in faeces (R=0.52). The FENIR results pre-treatment vs post-treatment were: fat 6.2 g±3.3 g vs. 4.9 g±2.1 g (p<0.05), sugar 6.7 g±3.6 g vs. 5 g±2.6 g (p < 0.05) and nitrogen 0.87 g±0.27 g vs. 0.91 g ( 0.14 g (NS) respectively. Thirteen patients (81.25 %) had improved stool appearance and intestinal comfort and nine (56.25 %) decreased the number of daily stools.
ConclusionsProbiotics improved not only clinical but also biochemical intestinal function in cystic fibrosis patients. These could be given as a regular treatment in this type of patients and in those with bacterial overgrowth.
La fibrosis quística está causada por una anomalía de la proteína CFTR (Cystic Fibrosis Transmembrane Conductance). Esta mutación es responsable de unas secreciones pulmonares, biliares, pancreáticas y del tracto gastrointestinal más espesas y alcalinas. Además, se producen secreción deficiente de enzimas pancreáticas y bicarbonato, hipersecreción ácida gástrica, alteraciones de la motilidad intestinal y un componente anormal del moco que recubre los enterocitos. Se trata, también, de pacientes que reciben múltiples medicaciones: enzimas pancreáticas, inhibidores de la bomba de protones, ácido ursodesoxicólico y antibioterapia sistemática. Todo ello causa inflamación intestinal1,2, aumento de la permeabilidad intestinal3,4 y respuesta disminuida de los mecanismos de reparación de la mucosa5.
El síndrome de hipercrecimiento bacteriano (SHB) (bacterial overgrowth) es una condición en la que se evidencia un desequilibrio en la proporción fisiológica de bacterias intestinales. El SHB se define como un contenido de microorganismos superior a 106 ufc/ml en las muestras de fluido intestinal en los tramos altos del intestino delgado (duodeno-yeyuno-íleon)6. Las posibles consecuencias son: inflamación de la mucosa, aumento de la permeabilidad intestinal, desconjugación de sales biliares y malabsorción de nutrientes. Los síntomas clínicos pueden ser diarrea, dolor abdominal, flatulencia y distensión abdominal. Se ha comunicado recientemente que los pacientes con fibrosis quística, a causa de las alteraciones intestinales y de los factores de riesgo mencionados, están predispuestos a presentar un SHB7–9.
Los probióticos se definen como “microorganismos vivos que, cuando son ingeridos en suficiente cantidad, ejercen un efecto beneficioso sobre el organismo del consumidor”. Se recomiendan por sus propiedades inmunomoduladoras y antiinflamatorias, así como de control de la permeabilidad intestinal y de la microbiota para el tratamiento de distintas enfermedadesce:10–14. Los pacientes afectados de fibrosis quística, debido a los mecanismos fisiopatológicos que concurren en ella, serían candidatos idóneos para la administración de probióticos.
El objetivo del presente estudio piloto es, en primer lugar, conocer la prevalencia de SHB en nuestros pacientes afectados de fibrosis quística y, en segundo lugar, tratar de optimizar la función intestinal mediante la administración de probióticos.
PACIENTES Y MÉTODOFueron valorados 20 pacientes con fibrosis quística y con una edad media de 10,33 años (rango, 5–17 años). Sólo se incluyeron pacientes que no hubieran tomado antibióticos 30 días antes del inicio del estudio o durante su realización.
Estudio del síndrome de hipercrecimiento bacteriano mediante el test de hidrógeno espirado15,16Dicho test se realizó sólo en 10 pacientes (los que, por su edad, colaboraron en la ingestión de la solución de dextrosa). Tras el ayuno nocturno se administró una solución de dextrosa al 20 % a dosis de 2g/kg (dosis máxima 80g)17. Las recogidas de muestras de aliento para la determinación de H2 se efectuaron en el momento basal y a los 10, 20, 30, 40, 50, 60, 80, 100, 120 y 150min. La muestra se inyectó en el modelo de cromatografía de gas (Quin Tron MicroLyser DP), para la detección de H2. Los resultados se expresan en partes por millón (ppm). La calibración se efectúa con un gas estándar con 102ppm de H2. Los criterios17 para catalogar un SHB fueron los siguientes: un valor basal de más de 15ppm o bien un aumento de más de 10ppm sobre el dato basal en cualquier momento de la exploración. La respuesta máxima de hidrógeno se define como la diferencia entre la situación basal y la respuesta más elevada de hidrógeno espirado. El tiempo para la respuesta máxima se definió como el tiempo transcurrido desde el punto basal hasta alcanzar la concentración máxima de hidrógeno.
Administración de probióticosUna vez realizada la prueba se administró a los 20 pacientes el probiótico Lactobacillus rhamnosus LGG a dosis de 1011 ufc dos veces al día durante 4 semanas (Orsadin Plus, B&F Pediatrics, Suiza). Todos los pacientes mantuvieron durante este tiempo el mismo tratamiento habitual de su fibrosis quística.
FENIR: determinación de grasa, agua, azúcares (incluido almidón) y proteínasLa determinación de grasa, nitrógeno, agua y azúcares en las heces se efectuó antes y después del tratamiento con probióticos y se llevó a cabo con la utilización del análisis de la reflexión de infrarrojos (FENIR)18–20. Esta técnica se basa en la medición de las radiaciones en el espectro cercano de infrarrojos (FENIR 8820-Infrared Analyzer. Perten, Hamburgo, Alemania) difundido por la superficie de la muestra, es decir, en la relación entre matriz y sustrato; la reflexión de infrarrojos se difunde por la superficie fecal a una determinada longitud de onda. Los componentes medidos poseen unos determinados grupos funcionales (CH, NH, OH) que poseen bandas específicas de absorción en el infrarrojo cercano (700–2.500nm). Por ello, la respuesta espectroscópica (reflexión) a partir de una muestra fecal se relaciona con la concentración de los componentes (grupos funcionales). La correlación de la reflexión tomada a 12 longitudes de onda está determinada por un algoritmo computarizado. Los resultados normales20, expresados en g/100g de heces (con una cantidad de agua del 80–85 %), son los siguientes: menos del 5 % para la grasa, menos del 2 % para el nitrógeno, menos del 5 % para los azúcares y del 80–85 % para el agua.
Se obtuvo el consentimiento informado por parte de los pacientes o sus familiares, así como del comité ético del hospital para la realización del estudio.
RESULTADOSCinco pacientes (50 %) presentaron un test de H2 patológico que confirmaba un SHB. En el diagrama de dispersión entre los valores de H2 y las cifras de esteatorrea (fig. 1) se observó una línea de regresión positiva (R = 0,57). En el diagrama de dispersión entre los valores de H2 y las cifras de azúcares (fig. 2) se detectó una línea de regresión positiva (R = 0,52).
Los valores de FENIR antes y tras el tratamiento con probióticos se exponen en la tabla 1. Puede apreciarse una mejoría en las medias de esteatorrea, que no llegan a tener diferencias significativas. Sí se apreció una diferencia significativa para los datos de los azúcares antes y después del tratamiento con probióticos.
En 13 pacientes (81,25 %) se evidenció una mejoría de la comodidad intestinal y del aspecto macroscópico de las deposiciones, y en 9 casos (56,25 %) disminuyó el número de éstas.
DISCUSIÓNEn el presente estudio el 50 % de los pacientes presentó un SHB, prevalencia muy similar a la referida por otros autores8,9. Dicha hiperproliferación puede deberse a una insuficiente fermentación de un sustrato de hidratos de carbono endógenos, posiblemente las glucoproteínas, por parte de la flora aumentada del intestino delgado21. Los valores elevados en ayunas (15ppm de H2) así lo demuestran, dado que los valores de control en sujetos sanos son inferiores a 7 ppm22. Otro factor que ha sido implicado es el tránsito enlentecido de los hidratos de carbono complejos a través del intestino23. El aumento rápido del H2 tras la administración de la dextrina se debe a que el número elevado de bacterias del intestino proximal fermentan la glucosa de la dextrina antes de que ésta pueda ser absorbida.
En cuanto a los factores que predisponen a los pacientes a la presentación del SHB, se han implicado varios mecanismos. La insuficiencia pancreática puede condicionarlo dado que las secreciones pancreáticas poseen una actividad antimicrobiana intrínseca y participan en el control de la flora intestinal. Dicha actividad antimicrobiana es independiente de las enzimas pancreáticas que participan en la digestión y su actividad se debe a un polipéptido presente en las secreciones24,25. El consumo de suplementos pancreáticos no pueden aportar dicho efecto beneficioso porque no contiene el polipéptido antibactericida. Se sabe que las lisozimas del moco que recubre los enterocitos poseen efectos antimicrobianos y colaboran en los mecanismos de defensa. Estudios realizados en ratones “reserpinizados” (CFTR) han demostrado la existencia de una capa de moco más delgada de lo normal, con un descenso en la concentración de lisozimas y, además, un moco más espeso que queda atrapado en las criptas de las vellosidades. Asimismo, se ha visto que dicho moco puede servir de reservorio a las bacterias dado su menor aclarado secundario a una menor motilidad intestinal. El hecho de que exista una correlación positiva (R = 0,57) (fig. 1) entre los valores de H2 y las cifras de esteatorrea demuestra que el SHB es un factor implicado, y que puede contribuir a la malabsorción intestinal en estos pacientes. Un factor atribuible puede ser la malabsorción de sales biliares que se produciría tras su desconjugación por parte de las bacterias excesivas (SHB), lo que disminuye la reserva de bilis y contribuye a la malabsorción de grasa26. Se sabe que una de las causas del SHB es el exceso de azúcares no absorbidos en los tramos altos del intestino y, a su vez, el SHB causaría una malabsorción de monosacáridos. Nuestros datos demuestran que el SHB se correlaciona con las cifras de malaborción de grasa (fig. 1) y azúcares (fig. 2).
No obstante, dada la gran cantidad de variables que confluyen en estos pacientes, la interpretación del test de H2 tras la prueba de sobrecarga de dextrina debe ser tomada con prudencia a la hora de clasificar a los pacientes como afectados de SHB. El patrón de referencia futuro para el estudio del SHB será el cultivo del jugo duodenoyeyunal con determinación cuantitativa del ADN bacteriano.
La inflamación intestinal de los pacientes con fibrosis quística se ha evidenciado en pediatría sólo en dos estudios. Smyth et al1 comunican un aumento de proteínas inflamatorias, albúmina, inmunoglobulinas G y M, eosinófilos, proteína catiónica, neutrófilos, elastasa, IL-1β e IL-8 en lavados de jugo intestinal de niños afectados de fibrosis quística. Raia et al2 detectan un aumento del infiltrado de células mononucleares en la lámina propia de la mucosa duodenal, así como una expresión aumentada de IL-2, interferón gamma (INF-γ), IL-2R, ICAM-1 y receptores de la transferrina en dichos especímenes de la mucosa. Factores como la hipersecreción ácida gástrica, una alteración de la motilidad intestinal, un componente anormal del moco que recubre los enterocitos, la múltiple medicación, con enzimas pancreáticas, inhibidores de la bomba de protones, ácido ursodesoxicólico, antibioterapia sistemática, así como la existencia de un SHB, pueden conducir a un mecanismo inflamatorio crónico que, a su vez y en muchos casos, justificaría las alteraciones intestinales y los dolores que presentan estos pacientes.
Los probióticos están siendo empleados desde hace más de dos décadas en un intento de ayudar a restaurar la salud en determinados procesos de disfunción intestinal. Se ha demostrado que pueden actuar no sólo cambiando la microbiota intestinal, sino también actuando como inmunomoduladores por su capacidad de activación inmunitaria y antiinflamatoria1013. La Comisión Europea, a través del Life Sciences Institute, ha reglamentado su uso. En 1985, Gorbach y Goldin aislaron una nueva cepa de Lactobacillus rhamnosus que denominaron Lactobacillus GG (LGG), que ha resultado ser el probiótico con mayor frecuencia y mejor estudiado, con más de 250 publicaciones.
Sólo se han publicado dos trabajos en la bibliografía científica sobre el empleo de probióticos (LGG) en pacientes con fibrosis quística. En uno de ellos27, los autores demuestran un aumento de la concentración de los siguientes marcadores inflamatorios: calprotectina fecal y óxido nítrico rectal. Ambos parámetros mejoraron tras la administración de LGG a dosis de 5 × 109 ufc al día durante 4 semanas. Dichos autores relacionan la inflamación intestinal en estos pacientes con un SHB, lo que no fue estudiado ni demostrado. En el otro trabajo de los mismos autores28 se aportan datos sobre una mejoría de las exarcerbaciones pulmonares tras la administración de probióticos. Dichos resultados son indudablemente cuestionables, y se precisan nuevos estudios que los ratifiquen.
Nuestra hipótesis en este estudio piloto –según nuestro conocimiento es el primer estudio que se efectúa al respecto– es que la administración de probióticos podría optimizar la absorción, valorada mediante los datos bioquímicos de los marcadores de absorción en las heces (FENIR). Dicha mejora tendría que estar apoyada por una disminución de los mecanismos inflamatorios1,2 y de la permeabilidad intestinal3,4 implicados en la malabsorción intestinal y en la incomodidad intestinal que presentan estos pacientes. No existen publicaciones referentes a la acción de los probióticos sobre el SHB. Se sabe que una de las causas de SHB es el exceso de azúcares no absorbidos en los tramos altos del intestino, ya que actúan como sustrato dietético de la microbiota. Se sabe actualmente que la microbiota “beneficiosa” impide la translocación bacteriana de los gérmenes patógenos, produce factores antiinfecciosos, posee funciones estructurales de reparación intercelular de las uniones interepiteliales, disminuye la permeabilidad de la mucosa y estimula el sistema inmune de la mucosa y su activación, con un aumento en la secreción de IgA secretora29,30. Todo ello conllevaría una mejor absorción de los azúcares, al disminuir la inflamación de los enterocitos, y una disminución de la cantidad de microorganismos. A su vez, la desaparición del SHB disminuiría la inflamación y la desconjugación de sales biliares que conducen a un aumento de la esteatorrea. Independientemente del mecanismo implicado de la acción de los probióticos, una disminución del SHB y/o de la inflamación es un hecho evidente; en nuestros pacientes existe una optimización de la función intestinal manifestada en datos bioquímicos tras la administración de probióticos. Los pacientes refirieron, además, una mejoría clínica con disminución de las molestias abdominales y con mejora del aspecto y del número de las deposiciones.
En conclusión, el SHB es un cuadro frecuente en la fibrosis quística, y el tratamiento con probióticos puede plantearse como una alternativa al tratamiento descontaminante con antibióticos; también puede afirmarse que la administración de probióticos mejora la función intestinal en la fibrosis quística desde los puntos de vista clínico y bioquímico (FENIR). Por tanto, su administración podría ser pautada de una manera regular. No obstante, serán necesarios futuros estudios que confirmen y clarifiquen estos hallazgos.