Evaluar el impacto de la técnica sedoanalgésica en el dolor experimentado por el paciente.
MétodosEstudio transversal realizado en pacientes consecutivos con parálisis cerebral (PC) que se infiltraron con toxina botulínica A (OnabotA). Los pacientes fueron divididos en 4 grupos según la estrategia analgésica asignada: Grupo I, sin sedación o crema anestésica tópica; Grupo II, inhalación de óxido nitroso; Grupo III, sedación intravenosa profunda y Grupo IV, sedación ligera con benzodiacepinas. El dolor se evaluó con diferentes escalas según la edad del paciente. Los padres clasificaron su satisfacción con la comodidad de su hijo mediante una escala tipo Likert de 5 puntos. La variable primaria de eficacia fue la proporción de pacientes que experimentaron un nivel de dolor ≤2, según las escalas de dolor, en los diferentes grupos de estudio.
ResultadosDe los 124 pacientes incluidos en el estudio, 56 (45,2%) experimentaron un nivel de dolor ≤2. En el Grupo III, una proporción significativamente mayor de pacientes presentó un nivel de dolor ≤2, p<0,001, en comparación con todos los grupos de estudio, respectivamente. La inyección de OnabotA fue guiada por ultrasonografía en 109 (87,9%) pacientes y por referencia anatómica en 15 (12,1%).
ConclusiónEn los pacientes con PC tratados con infiltraciones de OnabotA, la estrategia sedoanalgésica tuvo un impacto significativo en el dolor experimentado por el sujeto. Seleccionar una estrategia analgésica apropiada es crucial para reducir el estrés asociado con la administración de inyecciones de OnabotA en niños con PC.
To evaluate the impact of the sedation-analgesia technique on the pain experienced by the patient.
MethodsThis cross-sectional study was conducted on consecutive patients with cerebral palsy (CP) who underwent infiltration with botulinum toxin A (BoTNA). The patients were divided into 4 different groups according to the analgesic strategy assigned: Group I, without sedation or topical anaesthetic cream; Group II, inhalation of nitrous oxide; Group III, deep intravenous sedation; and Group IV, light sedation with benzodiazepines. Pain was assessed with different scales depending on patient age. Parents were asked to rate their satisfaction with their child's comfort by using a 5-point Likert-type scale. The primary end-point was the proportion of patients that experienced a pain level equal or lower than 2, according to pain scales, in the different study groups.
ResultsOf the 124 patients included in the study, 56 (45.2%) experienced a pain level ≤2. In the Group III a significantly greater proportion of patients were classified with a pain level score ≤2, P<.001, as compared with all the study groups, respectively. The BoTNA injection was guided by ultrasonography in 109 (87.9%) patients, and by palpation in 15 (12.1%).
ConclusionThe results of this study suggested that, in patients with CP treated with BoTNA injections, the sedation-analgesic strategy had a significant impact on the pain experienced by the subject. Selecting an appropriate analgesic strategy is crucial for reducing the stress associated with the administration of BoTNA injections in children with CP.
La parálisis cerebral (PC) es un grupo de trastornos heterogéneos, no progresivos y permanentes de la postura y el control del movimiento1,2. La PC está asociada, tanto en neonatos prematuros como a término, con varios factores prenatales, perinatales y posnatales que incluyen preeclampsia y retraso del crecimiento intrauterino, parto prematuro, peso bajo al nacer, infección/inflamación, gestaciones múltiples, otras complicaciones del embarazo, dificultad respiratoria y trastornos genéticos2-5. La prevalencia de la PC es de 2 a 2,5 por 1.000 nacidos vivos2,6, y su incidencia puede estar aumentando debido a la mejoría en la atención neonatal y obstétrica4,7. Se han propuesto distintas clasificaciones basadas en la ubicación y la expresión clínica de las lesiones cerebrales8-11. La PC puede ser clasificada atendiendo a un enfoque topográfico o a un enfoque fisiológico12.
Aproximadamente, un 80% de los niños con PC tendrán espasticidad como principal alteración motora12. La espasticidad se puede definir como un incremento del tono muscular dependiente de la velocidad, asociado a un reflejo miotático exagerado y formando parte del síndrome de motoneurona superior13.
Entre los diferentes métodos para evaluar la PC infantil, el Sistema de clasificación de la función motora gruesa expandida y revisada (GMFCS) es de uso común14,15.
Debido a la naturaleza heterogénea de la PC, es necesario un enfoque terapéutico individualizado para cada paciente. Entre las diferentes opciones de tratamiento no quirúrgico, el uso de la toxina botulínica A (OnabotA) está recomendado en la práctica clínica estándar5,16-18 (nivel de evidencia A). La infiltración de OnabotA se ha recomendado como una opción terapéutica en el tratamiento del pie equino dinámico en niños con PC, para quienes no existe otra terapia conservadora que muestre una mejor eficacia (nivel de evidencia A)16.
La eficacia y la seguridad del tratamiento con OnabotA en el manejo de la espasticidad en los miembros superiores se ha establecido en niños con PC19,20. En estos pacientes, la OnabotA debe asociarse con programas de terapia ocupacional (recomendación fuerte, intervención con luz verde)18. Diversos estudios han demostrado la eficacia de OnabotA en el tratamiento de la espasticidad en las extremidades inferiores con mejoras en la deformidad y la marcha21-23.
En el contexto del logro de objetivos específicos, la OnabotA se utiliza bajo una amplia variedad de indicaciones, que incluyen la facilitación de estiramientos de fisioterapia y el tratamiento del dolor relacionado con espasmos, incluido el dolor postoperatorio24.
La administración de OnabotA en niños debe considerar 2 aspectos principales: la técnica para guiar la inyección y la estrategia sedoanalgésica. Varias técnicas están disponibles para guiar la inyección, incluida la referencia anatómica, los ultrasonidos, la electromiografía (EMG) o la estimulación eléctrica24.
Para reducir el dolor y la ansiedad en los niños que reciben infiltraciones intramusculares de OnabotA, es esencial la elección de un proceso de sedación y analgesia (PSA) adecuado.
Se ha demostrado la eficacia y buena tolerancia de la inhalación de la mezcla de oxígeno y óxido nitroso en la sedación y analgesia de infiltraciones intramusculares de OnabotA en niños25. Sin embargo, un protocolo analgésico con óxido nitroso y crema anestésica solo fue efectivo en el 50% de los niños26.
El desarrollo de un PSA operativo estándar podría ayudar a reducir el dolor y evitar la ansiedad que resulta de las infiltraciones.
El objetivo de este estudio fue evaluar el impacto de la técnica sedoanalgésica en el dolor experimentado por el paciente.
MétodosSe realizó un estudio transversal en pacientes con PC atendidos en la Unidad de Rehabilitación Infantil del Hospital Materno Infantil de Málaga, incluidos de forma consecutiva, que cumplieron los criterios de inclusión/exclusión y que fueron tratados con OnabotA entre noviembre de 2015 y junio de 2016.
El protocolo del estudio fue aprobado por el Comité Ético del Hospital. Todos los padres fueron informados en detalle de las características del estudio y proporcionaron su consentimiento por escrito. Se siguieron los principios éticos descritos en la Declaración de Helsinki y en la Buena práctica clínica.
Todos los participantes debían cumplir los siguientes criterios de inclusión: niños y adolescentes de 2 a 16 años programados para recibir infiltraciones de OnabotA para el tratamiento de la espasticidad. Los pacientes fueron excluidos si tenían alguna condición considerada como una contraindicación para el tratamiento con OnabotA (reacción alérgica, enfermedades de la unión neuromuscular, enfermedades neuropáticas periféricas, etc.); trastornos de la coagulación, intolerancia a la sedación o falta de voluntad para cumplir con las indicaciones del investigador y del protocolo.
Grupos de estudioSegún el PSA, los pacientes fueron asignados a 4 grupos: Grupo I, incluyó 2 poblaciones, sujetos que no recibieron ninguna estrategia de sedación y aquellos que recibieron una crema anestésica tópica aplicada en los sitios de infiltración previstos al menos 30min antes de la inyección; Grupo II, inhalación de óxido nitroso bajo la supervisión de un pediatra; Grupo III, sedación intravenosa profunda bajo la supervisión de un anestesiólogo y Grupo IV, sedación ligera con benzodiacepinas administradas por vía oral o rectal.
Los pacientes cooperadores, definidos como aquellos capaces de mantener o cambiar de postura para facilitar la precisión de la ubicación de infiltración de OnabotA, y tratados con menos de 4 puntos de infiltración, fueron asignados al Grupo I. Los Grupos II y IV incluyeron pacientes con colaboración pobre en infiltraciones previas que hacía imposible la correcta administración de OnabotA o aquellos pacientes tratados con más de 4 puntos de infiltración. El Grupo III incluyó pacientes con pobre colaboración en infiltraciones previas (como el Grupo II), más de 8 puntos de infiltración o infiltración de la musculatura profunda.
Nivel de sedaciónEl nivel de sedación se realizó según los puntos de infiltración (número de puntos y profundidad muscular), colaboración del niño y disponibilidad de recursos.
Evaluación de la gravedad de la espasticidadEl GMFCS y la escala modificada de Ashworth (EMA) se usaron para evaluar la gravedad de la espasticidad. La gravedad clasificada por el GMFCS describe longitudinalmente los cambios en la función motora gruesa dentro de un nivel de gravedad14,15. Este método clasifica las anomalías funcionales según una escala de 5 niveles. El Nivel I incluye pacientes que caminan sin restricciones; Nivel II, camina con limitaciones; Nivel III, camina utilizando un dispositivo manual auxiliar de la marcha; Nivel IV, automovilidad limitada, es posible que utilice movilidad motorizada; y Nivel V, transportado en silla de ruedas14,15.
La EMA es probablemente el método más comúnmente utilizado para medir la espasticidad en la práctica clínica y en la investigación27. Es una escala de 6 puntos que clasifica la resistencia de una extremidad relajada al estiramiento pasivo rápido27.
Evaluación del dolorPacientes menores de 3 añosEl dolor fue medido por un observador entrenado, mediante el uso de la escala de cara, piernas, actividad, llanto y consolabilidad (FLACC); una escala de dolor, validada, que oscila entre 0 y 10. Se basa en la observación de las expresiones faciales, movimiento de las piernas, grado de actividad, llanto y consolabilidad. Una puntuación elevada indica un mayor estrés28.
Pacientes de 3 a 7 añosEl dolor se evaluó con la escala de caras Wong-Baker (WBS), una de las diferentes escalas de caras que ha demostrado su utilidad en múltiples entornos pediátricos para la evaluación del dolor29. A los pacientes se les pidió que hicieran un círculo en la cara que mejor representaba su nivel de gravedad del dolor. Posteriormente, se pidió a los pacientes que calificaran la gravedad de su dolor en una escala visual analógica (EVA) de 100mm posicionada horizontalmente, con puntos extremos marcados como «sin dolor» y «peor dolor posible».
Pacientes de edad igual o mayor de 8 añosSe utilizó una EVA de Walco y Howite, en la que el dolor fue evaluado de la siguiente manera: 0, no dolor; 1-2, dolor leve; 3-6, dolor moderado, 7-8, dolor grave y 9-10, el dolor más intenso que he tenido nunca.
La figura 1 muestra la EMA, la escala numérica de Walco y Howite, la WBS y la escala FLACC.
Escala modificada de Ashworth, escala numérica de Walco y Howite, escala de caras de Wong-Baker y escala FLACC.
FLACC: Cara, piernas, actividad, llanto y consolabilidad.
Escala de Asworth modificada:
Es una escala subjetiva que valora de 0 a 4 el grado de espasticidad, que en adultos ha demostrado su fiabilidad (en su versión modificada) tanto en la espasticidad de los flexores del codo como en la espasticidad de los flexores plantares.
Valores:
0 No incremento de tono, normal.
1 Ligero incremento en tono, con resistencia mínima durante parte del movimiento articular.
1+ Presencia de enganche durante el recorrido articular.
2 Incremento moderado de tono a lo largo del movimiento articular.
3 Incremento marcado, difícil de completar el arco de movimiento.
4 Contractura fija.
Se indicó a los padres que mostraran la satisfacción con el bienestar de su hijo según el método de analgesia empleado mediante una escala tipo Likert de 5 puntos (1, muy en desacuerdo; 2, en desacuerdo; 3, indeciso, 4; de acuerdo; 5, muy de acuerdo). El cuestionario tenía las siguientes preguntas: [1] Creo que mi hijo ha tenido dolor; [2] Creo que la colaboración de mi hijo es apropiada; [3] La infiltración de OnabotA ha sido estresante para mi hijo; [4] Creo que mi hijo no considerará esta intervención como traumática.
Satisfacción del profesional con la sedaciónSe pidió a los médicos que indicaran su grado de satisfacción mediante una escala tipo Likert de 5 puntos (similar a la previa). El cuestionario tenía una pregunta: [1] La colaboración del paciente me ha permitido realizar la técnica.
Variables del estudioLas variables del estudio incluyeron: edad, sexo, PSA, técnica de infiltración (referencias anatómicas o ecografía), tipo de PC (espástica, distónica, atáxica y mixta), clasificación funcional de la PC, GMFCS, EMA, número de infiltraciones, dosis total de OnabotA, número de músculos infiltrados, nivel de dolor (según las diferentes escalas), satisfacción de los padres y satisfacción del médico con el PSA.
Variable primariaProporción de pacientes que experimentaron un nivel de dolor igual o inferior a 2, según las escalas de dolor, en los diferentes grupos de estudio.
Variables secundariasLas variables secundarias de eficacia incluyeron una comparación de los niveles de dolor entre los diferentes PSA. Otra variable secundaria fue la relación entre el nivel de dolor y las diferentes variables de estudio (GMFCS, dosis de OnabotA, número de infiltraciones, EMA, clasificación funcional de la PC y edad); el grado de satisfacción de los padres y el grado de satisfacción de los profesionales con el PSA.
Análisis estadísticoSe utilizó el programa estadístico MedCalc versión 18 (MedCalc Software bvba, Ostend, Bélgica; http://www.medcalc.org; 2018).
Antes de comenzar el estudio se determinó que eran necesarios un mínimo de 28 sujetos por grupo de estudio para identificar una diferencia igual o superior al 21% entre grupos, aceptando un error alfa de 0,05 y un error beta de 0,2. Los datos son presentados como número (porcentaje); media [desviación estándar (DE)]; media [intervalo de confianza del 95% (IC 95%)] o mediana (IC 95%), según corresponda.
Se analizó la distribución normal de los datos mediante el uso de una prueba de d’Agostino-Pearson. Si los datos seguían una distribución normal, en las variables cuantitativas, se utilizó el test de análisis de la varianza (ANOVA) de una vía para comparar las medias entre grupos. El análisis de la covarianza (ANCOVA) se utilizó para comparar las diferencias en el dolor entre los diferentes PSA, con la edad, el número de músculos infiltrados y el número de infiltraciones como covariables.
En aquellas variables que no seguían una distribución normal se utilizó el test de Kruskal-Wallis. Las variables categóricas fueron comparadas mediante el test de la Chi-cuadrado o el test exacto de Fisher, según correspondiera.
Para analizar la relación entre el dolor y las diferentes variables de estudio (GMFCS, dosis de OnabotA, número de infiltraciones, EMA y edad) se utilizó un análisis de regresión lineal. Para el análisis de regresión lineal se utilizó el coeficiente de correlación de Pearson (r).
Un valor de probabilidad p de 0,05 se consideró indicativo de significación estadística.
ResultadosCiento veinticuatro pacientes cumplieron los criterios de inclusión/exclusión: 32 (Grupo I); 33 (Grupo II); 29 (Grupo III) y 30 (Grupo IV).
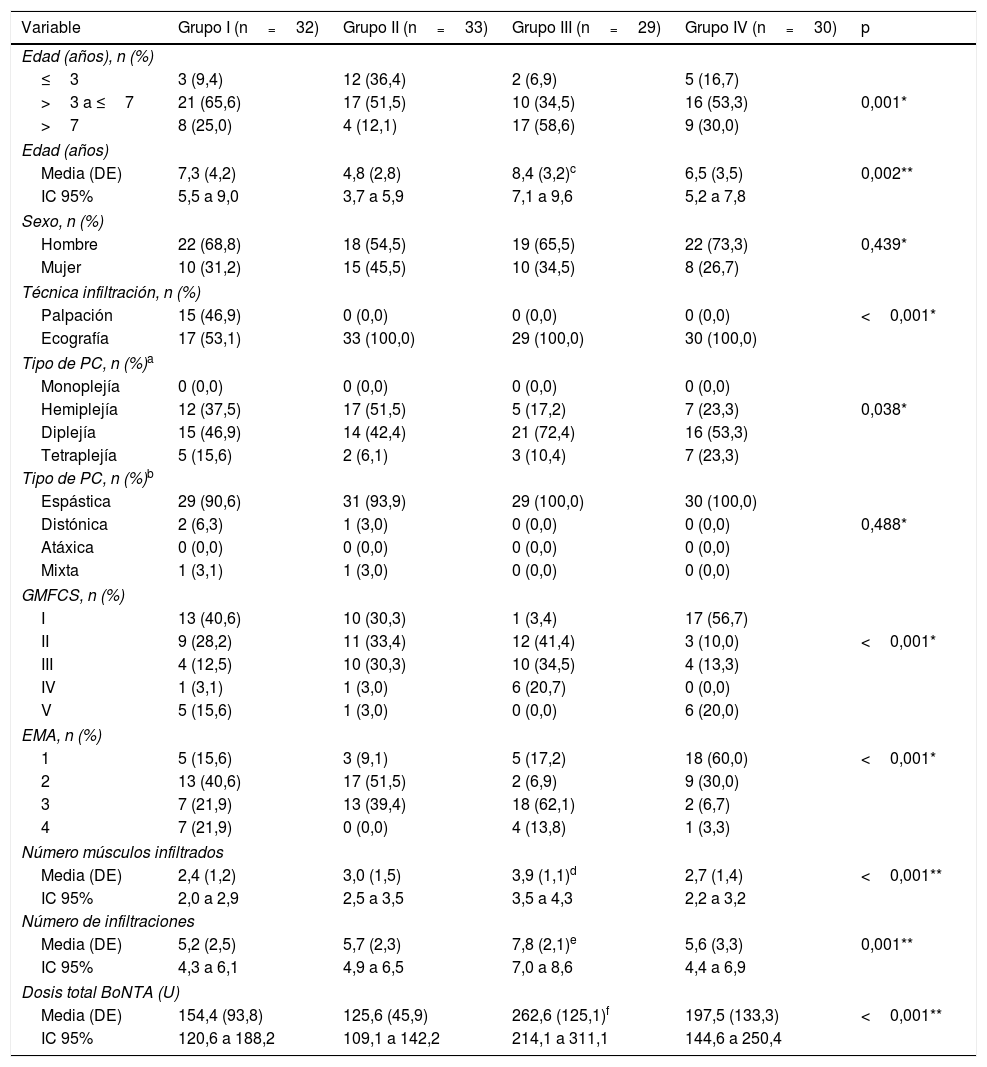
Las principales características demográficas y clínicas se presentan en la tabla 1.
Descripción de las características demográficas y clínicas de los pacientes incluidos en el estudio
| Variable | Grupo I (n=32) | Grupo II (n=33) | Grupo III (n=29) | Grupo IV (n=30) | p |
|---|---|---|---|---|---|
| Edad (años), n (%) | |||||
| ≤3 | 3 (9,4) | 12 (36,4) | 2 (6,9) | 5 (16,7) | |
| >3 a ≤7 | 21 (65,6) | 17 (51,5) | 10 (34,5) | 16 (53,3) | 0,001* |
| >7 | 8 (25,0) | 4 (12,1) | 17 (58,6) | 9 (30,0) | |
| Edad (años) | |||||
| Media (DE) | 7,3 (4,2) | 4,8 (2,8) | 8,4 (3,2)c | 6,5 (3,5) | 0,002** |
| IC 95% | 5,5 a 9,0 | 3,7 a 5,9 | 7,1 a 9,6 | 5,2 a 7,8 | |
| Sexo, n (%) | |||||
| Hombre | 22 (68,8) | 18 (54,5) | 19 (65,5) | 22 (73,3) | 0,439* |
| Mujer | 10 (31,2) | 15 (45,5) | 10 (34,5) | 8 (26,7) | |
| Técnica infiltración, n (%) | |||||
| Palpación | 15 (46,9) | 0 (0,0) | 0 (0,0) | 0 (0,0) | <0,001* |
| Ecografía | 17 (53,1) | 33 (100,0) | 29 (100,0) | 30 (100,0) | |
| Tipo de PC, n (%)a | |||||
| Monoplejía | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | |
| Hemiplejía | 12 (37,5) | 17 (51,5) | 5 (17,2) | 7 (23,3) | 0,038* |
| Diplejía | 15 (46,9) | 14 (42,4) | 21 (72,4) | 16 (53,3) | |
| Tetraplejía | 5 (15,6) | 2 (6,1) | 3 (10,4) | 7 (23,3) | |
| Tipo de PC, n (%)b | |||||
| Espástica | 29 (90,6) | 31 (93,9) | 29 (100,0) | 30 (100,0) | |
| Distónica | 2 (6,3) | 1 (3,0) | 0 (0,0) | 0 (0,0) | 0,488* |
| Atáxica | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | |
| Mixta | 1 (3,1) | 1 (3,0) | 0 (0,0) | 0 (0,0) | |
| GMFCS, n (%) | |||||
| I | 13 (40,6) | 10 (30,3) | 1 (3,4) | 17 (56,7) | |
| II | 9 (28,2) | 11 (33,4) | 12 (41,4) | 3 (10,0) | <0,001* |
| III | 4 (12,5) | 10 (30,3) | 10 (34,5) | 4 (13,3) | |
| IV | 1 (3,1) | 1 (3,0) | 6 (20,7) | 0 (0,0) | |
| V | 5 (15,6) | 1 (3,0) | 0 (0,0) | 6 (20,0) | |
| EMA, n (%) | |||||
| 1 | 5 (15,6) | 3 (9,1) | 5 (17,2) | 18 (60,0) | <0,001* |
| 2 | 13 (40,6) | 17 (51,5) | 2 (6,9) | 9 (30,0) | |
| 3 | 7 (21,9) | 13 (39,4) | 18 (62,1) | 2 (6,7) | |
| 4 | 7 (21,9) | 0 (0,0) | 4 (13,8) | 1 (3,3) | |
| Número músculos infiltrados | |||||
| Media (DE) | 2,4 (1,2) | 3,0 (1,5) | 3,9 (1,1)d | 2,7 (1,4) | <0,001** |
| IC 95% | 2,0 a 2,9 | 2,5 a 3,5 | 3,5 a 4,3 | 2,2 a 3,2 | |
| Número de infiltraciones | |||||
| Media (DE) | 5,2 (2,5) | 5,7 (2,3) | 7,8 (2,1)e | 5,6 (3,3) | 0,001** |
| IC 95% | 4,3 a 6,1 | 4,9 a 6,5 | 7,0 a 8,6 | 4,4 a 6,9 | |
| Dosis total BoNTA (U) | |||||
| Media (DE) | 154,4 (93,8) | 125,6 (45,9) | 262,6 (125,1)f | 197,5 (133,3) | <0,001** |
| IC 95% | 120,6 a 188,2 | 109,1 a 142,2 | 214,1 a 311,1 | 144,6 a 250,4 | |
BoNTA: toxina botulínica tipo A; DE: desviación estándar; EMA: Escala modificada de Ashworth; GMFCS: Sistema de clasificación de la función motora gruesa; IC 95%: intervalo de confianza del 95%; PC: parálisis cerebral.
El número de infiltraciones osciló entre 2 y 14 y el número de músculos infiltrados entre 1 y 7.
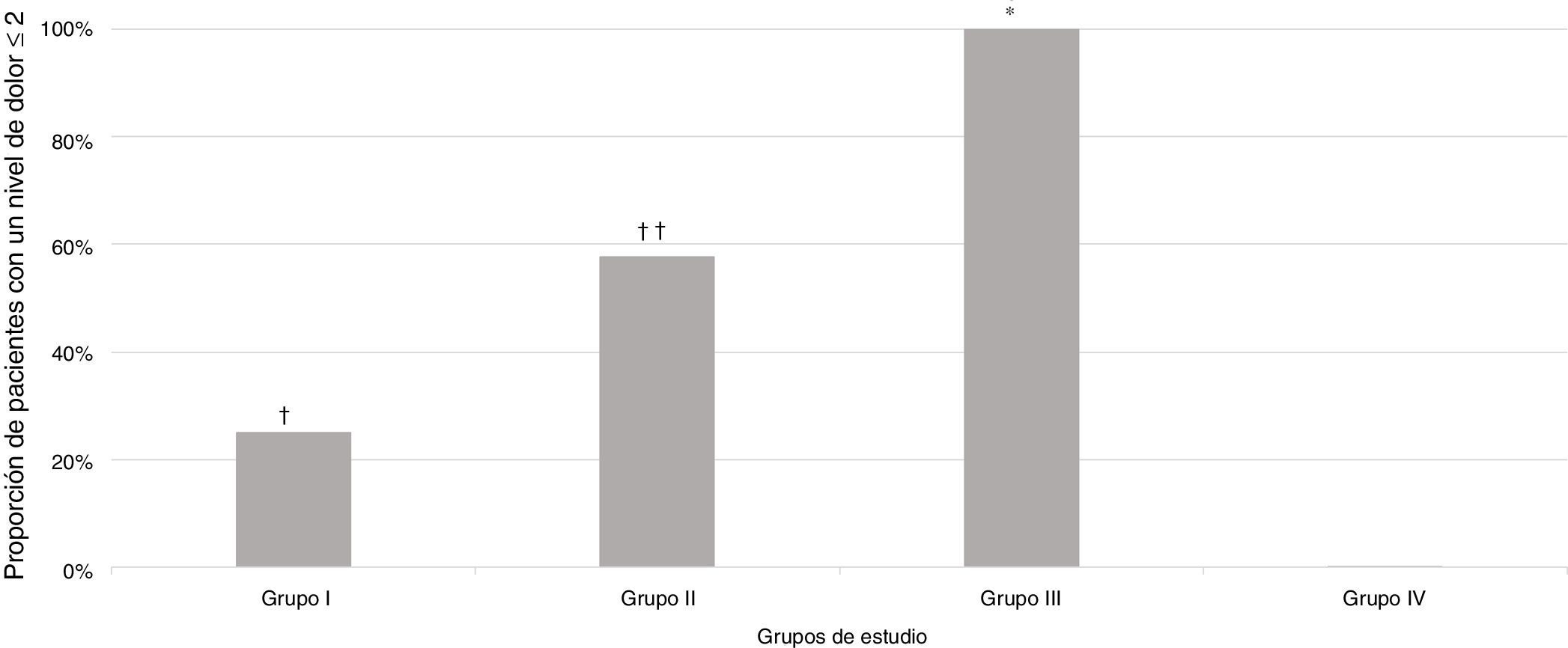
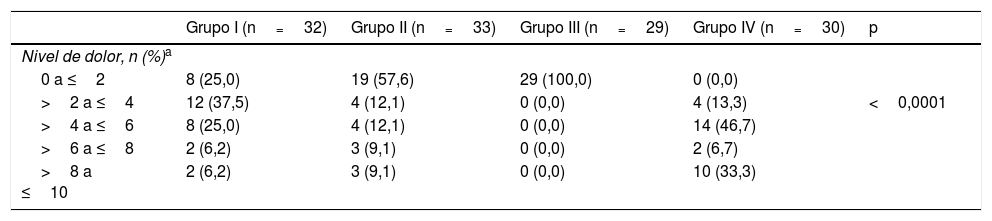
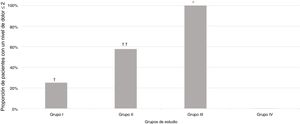
De los 124 sujetos incluidos en el estudio, 56 (45,2%) presentaron un nivel de dolor igual o inferior a 2 (tabla 2).
Proporción de pacientes que experimentaron un determinado nivel de dolor en los diferentes grupos de estudio
| Grupo I (n=32) | Grupo II (n=33) | Grupo III (n=29) | Grupo IV (n=30) | p | |
|---|---|---|---|---|---|
| Nivel de dolor, n (%)a | |||||
| 0 a ≤2 | 8 (25,0) | 19 (57,6) | 29 (100,0) | 0 (0,0) | |
| >2 a ≤4 | 12 (37,5) | 4 (12,1) | 0 (0,0) | 4 (13,3) | <0,0001 |
| >4 a ≤6 | 8 (25,0) | 4 (12,1) | 0 (0,0) | 14 (46,7) | |
| >6 a ≤8 | 2 (6,2) | 3 (9,1) | 0 (0,0) | 2 (6,7) | |
| >8 a ≤10 | 2 (6,2) | 3 (9,1) | 0 (0,0) | 10 (33,3) | |
Una proporción significativamente mayor de pacientes se clasificó con una puntuación del nivel de dolor igual o inferior a 2 en el Grupo III (sedación intravenosa profunda bajo la supervisión de un anestesiólogo), p<0,001, en comparación con todos los grupos de estudio, respectivamente (fig. 2).
Proporción de pacientes que experimentaron un nivel de dolor igual o inferior a 2, según las escalas de dolor, en los diferentes grupos de estudio.
† p=0,005 en comparación con el grupo de estudio.
†† p=0,01 en comparación con el Grupo I y 0,001 en comparación con el Grupo IV.
* p<0,001 en comparación con todos los grupos de estudio.
Las infiltraciones de OnabotA fueron guiadas mediante ecografía en 109 (87,9%) pacientes y por referencias anatómicas en 15 (12,1%). Dado que las inyecciones guiadas por referencias anatómicas fueron administradas solo en el Grupo I, se realizó una comparación del nivel de dolor (en ese grupo) entre los pacientes que recibieron la OnabotA guiada por ecografía o por referencias anatómicas. El dolor medio (DE) fue de 3,36 (0,76) y 5,19 (0,76) en los pacientes guiados por referencias anatómicas y por ecografía, respectivamente, p=0,1193.
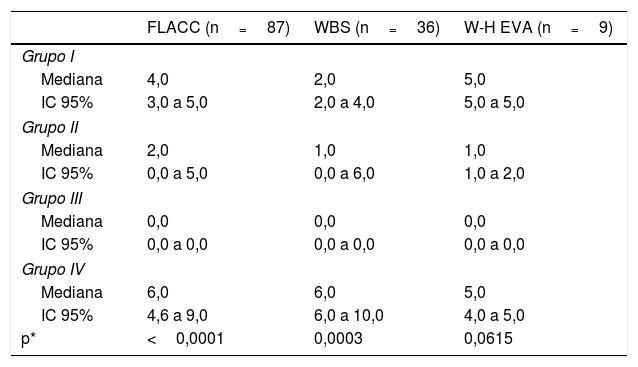
El dolor durante la administración de OnabotA fue significativamente menor en los niños que recibieron sedación intravenosa profunda bajo la supervisión de un anestesiólogo en comparación con aquellos que recibieron otras estrategias de sedación (tablas 3 y 4).
Comparación del nivel de dolor, según las diferentes escalas utilizadas en el estudio, y la técnica sedoanalgésica
| FLACC (n=87) | WBS (n=36) | W-H EVA (n=9) | |
|---|---|---|---|
| Grupo I | |||
| Mediana | 4,0 | 2,0 | 5,0 |
| IC 95% | 3,0 a 5,0 | 2,0 a 4,0 | 5,0 a 5,0 |
| Grupo II | |||
| Mediana | 2,0 | 1,0 | 1,0 |
| IC 95% | 0,0 a 5,0 | 0,0 a 6,0 | 1,0 a 2,0 |
| Grupo III | |||
| Mediana | 0,0 | 0,0 | 0,0 |
| IC 95% | 0,0 a 0,0 | 0,0 a 0,0 | 0,0 a 0,0 |
| Grupo IV | |||
| Mediana | 6,0 | 6,0 | 5,0 |
| IC 95% | 4,6 a 9,0 | 6,0 a 10,0 | 4,0 a 5,0 |
| p* | <0,0001 | 0,0003 | 0,0615 |
El número de exámenes es superior a 124 porque 8 sujetos realizaron tanto la escala FLACC como la WBS.
IC 95%: intervalo de confianza del 95%; FLACC: Cara, piernas, actividad, llanto y consolabilidad; WBS: Escala de caras de Wong-Baker; W-H EVA: Escala analógica visual de Walco y Howite.
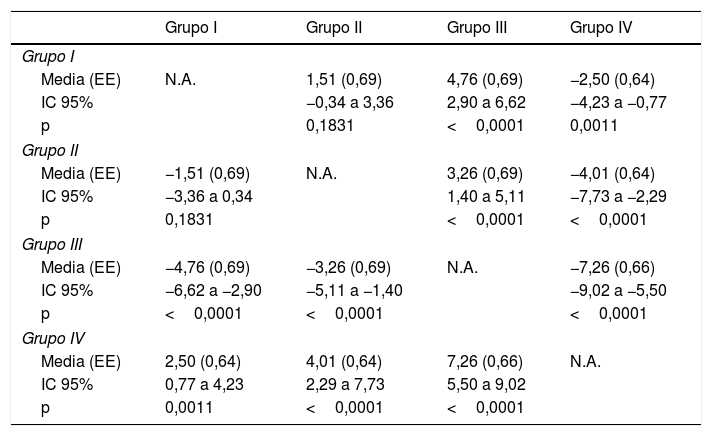
Diferencia media experimentada en dolor entre los diferentes grupos de estudio
| Grupo I | Grupo II | Grupo III | Grupo IV | |
|---|---|---|---|---|
| Grupo I | ||||
| Media (EE) | N.A. | 1,51 (0,69) | 4,76 (0,69) | −2,50 (0,64) |
| IC 95% | −0,34 a 3,36 | 2,90 a 6,62 | −4,23 a −0,77 | |
| p | 0,1831 | <0,0001 | 0,0011 | |
| Grupo II | ||||
| Media (EE) | −1,51 (0,69) | N.A. | 3,26 (0,69) | −4,01 (0,64) |
| IC 95% | −3,36 a 0,34 | 1,40 a 5,11 | −7,73 a −2,29 | |
| p | 0,1831 | <0,0001 | <0,0001 | |
| Grupo III | ||||
| Media (EE) | −4,76 (0,69) | −3,26 (0,69) | N.A. | −7,26 (0,66) |
| IC 95% | −6,62 a −2,90 | −5,11 a −1,40 | −9,02 a −5,50 | |
| p | <0,0001 | <0,0001 | <0,0001 | |
| Grupo IV | ||||
| Media (EE) | 2,50 (0,64) | 4,01 (0,64) | 7,26 (0,66) | N.A. |
| IC 95% | 0,77 a 4,23 | 2,29 a 7,73 | 5,50 a 9,02 | |
| p | 0,0011 | <0,0001 | <0,0001 | |
Los valores de p para las comparaciones por pares se calcularon con el análisis de covarianza (ANCOVA), con la edad, el número de infiltraciones y el número de músculos infiltrados como covariables.
EE: error estándar; IC 95%: intervalo de confianza del 95%; N.A.: no aplicable.
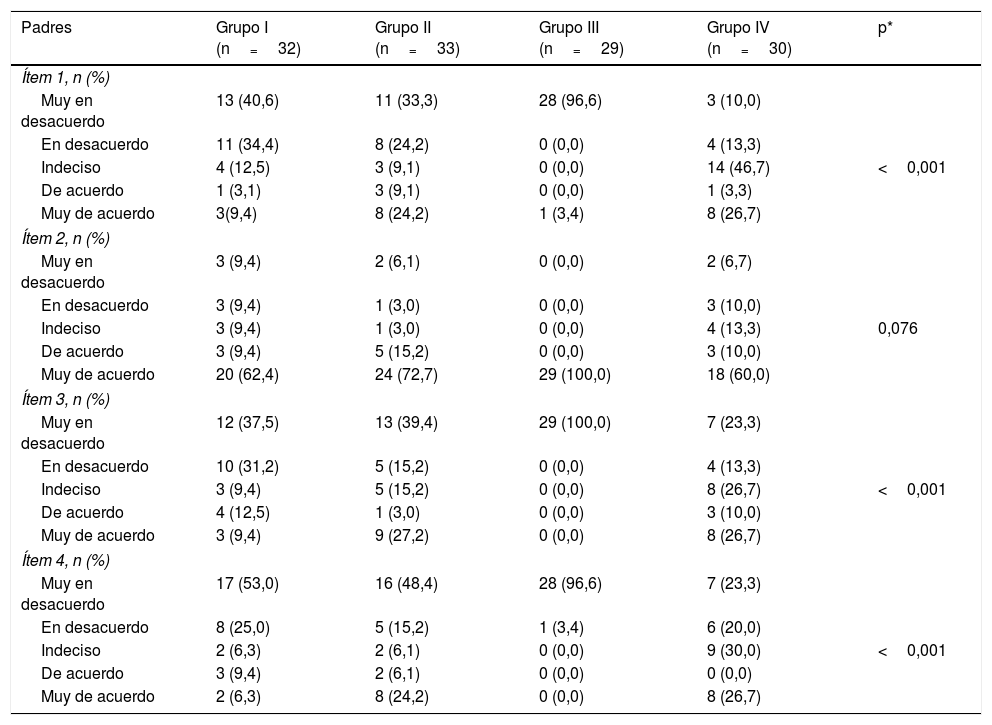
Con relación a la satisfacción de los padres, la proporción de sujetos que estaban «de acuerdo» o «muy de acuerdo» con el ítem «Creo que la colaboración de mi hijo es apropiada» osciló entre el 70% (Grupo IV) y el 100% (Grupo III), p=0,076 (tabla 5). Sin embargo, se observaron diferencias significativas en los otros ítems (tabla 5).
Comparación de la satisfacción de padres y profesionales con la sedación según el grupo de estudio
| Padres | Grupo I (n=32) | Grupo II (n=33) | Grupo III (n=29) | Grupo IV (n=30) | p* |
|---|---|---|---|---|---|
| Ítem 1, n (%) | |||||
| Muy en desacuerdo | 13 (40,6) | 11 (33,3) | 28 (96,6) | 3 (10,0) | |
| En desacuerdo | 11 (34,4) | 8 (24,2) | 0 (0,0) | 4 (13,3) | |
| Indeciso | 4 (12,5) | 3 (9,1) | 0 (0,0) | 14 (46,7) | <0,001 |
| De acuerdo | 1 (3,1) | 3 (9,1) | 0 (0,0) | 1 (3,3) | |
| Muy de acuerdo | 3(9,4) | 8 (24,2) | 1 (3,4) | 8 (26,7) | |
| Ítem 2, n (%) | |||||
| Muy en desacuerdo | 3 (9,4) | 2 (6,1) | 0 (0,0) | 2 (6,7) | |
| En desacuerdo | 3 (9,4) | 1 (3,0) | 0 (0,0) | 3 (10,0) | |
| Indeciso | 3 (9,4) | 1 (3,0) | 0 (0,0) | 4 (13,3) | 0,076 |
| De acuerdo | 3 (9,4) | 5 (15,2) | 0 (0,0) | 3 (10,0) | |
| Muy de acuerdo | 20 (62,4) | 24 (72,7) | 29 (100,0) | 18 (60,0) | |
| Ítem 3, n (%) | |||||
| Muy en desacuerdo | 12 (37,5) | 13 (39,4) | 29 (100,0) | 7 (23,3) | |
| En desacuerdo | 10 (31,2) | 5 (15,2) | 0 (0,0) | 4 (13,3) | |
| Indeciso | 3 (9,4) | 5 (15,2) | 0 (0,0) | 8 (26,7) | <0,001 |
| De acuerdo | 4 (12,5) | 1 (3,0) | 0 (0,0) | 3 (10,0) | |
| Muy de acuerdo | 3 (9,4) | 9 (27,2) | 0 (0,0) | 8 (26,7) | |
| Ítem 4, n (%) | |||||
| Muy en desacuerdo | 17 (53,0) | 16 (48,4) | 28 (96,6) | 7 (23,3) | |
| En desacuerdo | 8 (25,0) | 5 (15,2) | 1 (3,4) | 6 (20,0) | |
| Indeciso | 2 (6,3) | 2 (6,1) | 0 (0,0) | 9 (30,0) | <0,001 |
| De acuerdo | 3 (9,4) | 2 (6,1) | 0 (0,0) | 0 (0,0) | |
| Muy de acuerdo | 2 (6,3) | 8 (24,2) | 0 (0,0) | 8 (26,7) | |
| Profesionales | Grupo I | Grupo II | Grupo III | Grupo IV | p |
|---|---|---|---|---|---|
| Pregunta 1, n (%) | |||||
| Muy en desacuerdo | 1 (3,1) | 3 (9,1) | 0 (0,0) | 5 (16,7) | |
| En desacuerdo | 1 (3,1) | 0 (0,0) | 0 (0,0) | 4 (13,3) | |
| Indeciso | 3 (9,4) | 2 (6,1) | 0 (0,0) | 0 (0,0) | 0,005 |
| De acuerdo | 5 (15,6) | 4 (12,1) | 0 (0,0) | 3 (10,0) | |
| Muy de acuerdo | 22 (68,8) | 24 (72,7) | 29 (100,0) | 18 (60,0) | |
Ítem 1: Creo que mi hijo ha tenido dolor; Ítem 2: Creo que la colaboración de mi hijo es apropiada; Ítem 3: La infiltración de toxina botulínica A ha sido estresante para mi hijo; Ítem 4: Creo que mi hijo no considerará esta intervención como traumática; Pregunta 1: La colaboración del paciente me ha permitido realizar la técnica.
La proporción de casos en los que el médico estaba «de acuerdo» o «muy de acuerdo» con la frase «La colaboración del paciente me ha permitido realizar la técnica» osciló entre el 70% (Grupo IV) y el 100 (Grupo V) (tabla 5).
La tabla 6 muestra la correlación entre el grado de dolor y algunas de las variables del estudio. El dolor se correlacionó, de forma significativa, con la edad (r=−0,21, p=0,0299) (tabla 6).
Correlación entre el dolor (evaluado con las diferentes técnicas) y algunas de las diferentes variables de estudio (edad, número de músculos infiltrados, número de infiltraciones, Sistema de clasificación de la función motora gruesa, Escala modificada de Ashworth y clasificación topográfica de la parálisis cerebral)
| Variable | Nivel de dolor |
|---|---|
| Edad | |
| R | −0,21 |
| IC 95% | −0,38 a −0,02 |
| p | 0,0299 |
| NMI | |
| R | −0,04 |
| IC 95% | −0,21 a 0,14 |
| p | 0,6808 |
| NI | |
| R | −0,06 |
| IC 95% | −0,24 a 0,11 |
| p | 0,4765 |
| Dosis BoNTA | |
| R | −0,17 |
| IC 95% | −0,34 a 0,01 |
| p | 0,0603 |
| GMFCS | |
| R | −0,12 |
| IC 95% | −0,29 a 0,06 |
| p | 0,2038 |
| EMA | |
| R | 0,11 |
| IC 95% | −0,25 a 0,44 |
| p | 0,5478 |
| CGPC | |
| R | −0,09 |
| IC 95% | −0,26 a 0,09 |
| p | 0,3308 |
| Coeficiente de correlación múltiplea | |
| R | 0,39 |
| IC 95% | 0,18 a 0,59 |
| p | 0,0144 |
BoNTA: toxina botulínica A; CGPC: clasificación topográfica de la parálisis cerebral; EMA: Escala modificada de Ashworth; GMFCS: Sistema de clasificación de la función motora gruesa; IC 95%: intervalo de confianza del 95%; NI: número de infiltraciones; NMI: número de músculos infiltrados; R: coeficiente de correlación de Pearson.
Los resultados de este estudio muestran que en pacientes con PC tratados con OnabotA el protocolo de sedoanalgesia tiene un impacto significativo en el grado de dolor experimentado por el sujeto.
Aunque el modo en el que los niños reaccionan ante la ansiedad o procesos dolorosos difiere entre ellos de forma radical30, se ha publicado que en niños una analgesia inadecuada repercute de forma negativa sobre futuras experiencias con procesos dolorosos25,31. El recuerdo de un procedimiento médico doloroso previo puede disminuir el efecto de los medicamentos para reducir el dolor durante los procedimientos posteriores31; así, el recuerdo de un procedimiento dental previo doloroso predice informes de dolor para un procedimiento dental posterior32.
En los niños que requieren procedimientos dolorosos repetidos, el dolor experimentado durante el procedimiento inicial influye significativamente en las puntuaciones de dolor y la ansiedad con los procedimientos posteriores33.
Es difícil comparar los resultados de este estudio con los de otros autores.
Brochard et al.26 encontraron dolor por encima de 9 puntos en la escala CHEOPS en el 38% de los niños infiltrados con óxido nitroso+EMLA, necesitando una mayor analgesia para llevar a cabo el procedimiento; en nuestro estudio el óxido nitroso fue bastante efectivo para reducir el dolor en niños con PC tratados con OnabotA.
Los resultados de este estudio están en consonancia con los Gambart et al.34, que evaluaron el dolor en niños utilizando óxido nitroso y EMLA concluyendo que el protocolo de anestesia era insuficiente en uno de cada 2 niños (50%), incrementándose el dolor en número mayor de 8 infiltraciones.
Aunque el tratamiento con OnabotA es efectivo y, en términos generales, bien tolerado35, los padres pueden mostrar preocupación acerca del dolor asociado con el procedimiento36. De hecho, el dolor asociado a la infiltración se ha citado como causa de abandono de las infiltraciones de OnabotA en niños37.
En este estudio, el dolor fue significativamente diferente según el PSA seleccionado.
La proporción de padres que pensaban que el procedimiento era estresante para sus hijos era baja en los Grupos I y III, y relativamente baja en los otros 2 grupos de estudio. Esos hallazgos indican que una selección apropiada del PSA aumenta significativamente la satisfacción de los padres con el procedimiento.
Aunque la comodidad del paciente es importante, debe sopesarse contra el riesgo del paciente. Los niños con PC pueden tener un mayor riesgo de complicaciones de la anestesia general38,39; sin embargo, no se observaron efectos adversos en ninguno de los grupos de estudio.
Aunque la proporción de pacientes con dolor igual o inferior a 2 fue significativamente mayor en el grupo de anestesia general, la anestesia general puede no recomendarse para todos los pacientes. Además, es difícil realizar un acto anestésico para pacientes con necesidades especiales y una evaluación precisa del dolor agudo es difícil en niños con déficits cognitivos importantes27,34,39.
La colaboración del paciente ha permitido realizar la técnica en la mayoría de los pacientes en todos los grupos de estudio. Esto también concuerda con el hecho de que seleccionar un PSA apropiado es un tema clave.
No se observaron diferencias significativas en el dolor experimentado entre las inyecciones guiadas por ecografía o por referencia anatómica. Sin embargo, hay que mencionar que el estudio no se diseñó originalmente para evaluar el impacto de la técnica de guía sobre el dolor experimentado por el paciente. Este estudio tenía una potencia estadística del 40% para detectar una diferencia media de dolor de 1,8 con un nivel de significación de 0,05.
Se ha sugerido la importancia de la ecografía para la administración de las inyecciones de OnabotA en diferentes músculos23,24,40. Sin embargo, estos estudios estaban más centrados en la eficacia de la OnabotA que en el dolor experimentado durante el procedimiento.
Finalmente, entre las diferentes variables de estudio incluidas en el modelo, solo la edad se relacionó con el dolor. Este hallazgo puede estar relacionado con el hecho de que los pacientes cooperadores fueron asignados al Grupo I (anestesia tópica), mientras que aquellos con una mala colaboración en infiltraciones previas fueron asignados a anestesia general. Además, los pacientes incluidos en el Grupo III eran mayores que los incluidos en el Grupo II.
Limitaciones del estudioEste estudio tiene algunas limitaciones que deben tenerse en cuenta al interpretar los datos obtenidos. La primera limitación es que se trata de un estudio realizado en un solo centro, con un número limitado de pacientes. Para minimizar este hecho se realizó un cálculo del tamaño muestral antes de comenzar el estudio. La segunda limitación es que no se trataba de un estudio ciego. La persona responsable de obtener los resultados del dolor conocía el PSA utilizado. Esto podría haber llevado a algunos sesgos.
ConclusionesLos resultados de este estudio muestran la importancia de seleccionar un protocolo de sedoanalgesia adecuado para reducir el estrés asociado con las inyecciones de OnabotA en niños con PC.
FinanciaciónEl soporte para la asistencia en la redacción del texto fue financiado por Allergan S.A.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.