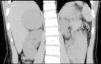
Los tumores corticosuprarrenales son infrecuentes en la infancia y comprenden únicamente el 0,2-0,5% de las neoplasias infantiles1,2. Aunque se han descrito tumores no funcionantes, la mayoría son funcionantes y se presentan clínicamente con virilización o síndrome de Cushing de forma aislada o en combinación. Presentamos el caso de una niña prepuberal con un tumor suprarrenal que se manifestó únicamente con una pubarquia prematura.
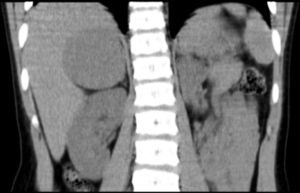
Niña de 7 años y 7 meses de edad, que consulta por pubarquia de inicio a los 7 años. Sin antecedentes personales ni familiares de interés. A la exploración presentaba talla de 136,1cm (+ 1,93 DE), índice de masa corporal (IMC) de 18,79kg/m2 (+0,64 DE) y presión arterial normal. Mostraba vello pubiano en estadio II-III de Tanner, con ausencia de desarrollo mamario. El resto de la exploración física fue normal. La edad ósea era de 12 años para una edad cronológica de 7 años y 7 meses (TW2RUS). Exploraciones complementarias realizadas: sistemático y bioquímica sanguínea normales. Hormona luteinizante (LH) 0,16 mU/ml (< 0,69), hormona foliculostimulante (FSH) 0,32 mU/ml (0,08-3,65), estradiol 10,87pg/ml (< 16), testosterona total 1,28ng/ml (0,06-0,2), dehidroepiandrosterona sulfato (DHEAS) 5,41μg/ml (0,18-1,60), androstendiona 7,40ng/ml (0,13-1,24), cortisol 12,98μg/100ml (9,4-26), cortisol en orina de 24 h 16,56μg/24h (26-135), hormona adrenocorticotropa (ACTH) 67,17pg/ml (< 59,3). Ritmo de cortisol y ACTH, normal. Test de ACTH: 17 OH progesterona basal 2,51ng/ml, 17 OH pregnenolona basal 0,99ng/ml, 11 desoxicortisol basal 2,8ng/ml; a los 60 min: 17 OH progesterona 8ng/ml, 17 OH pregnenolona 25ng/ml, 11 desoxicortisol 5,2ng/ml. Tomografía computarizada (TC) abdominal: masa retroperitoneal en la glándula suprarrenal derecha con diámetro transversal de 5,4×5cm, con impronta en pared posterior de la vena cava sin modificación de su calibre y morfología (fig. 1). Evolución: se realizó una intervención quirúrgica sin incidencias con resección total de la masa, que estaba bien encapsulada y tenía unas dimensiones de 6,0×6,5×6,0cm y un peso de 92g. El estudio anátomo-patológico fue compatible con un adenoma suprarrenal. La niña recibió corticoterapia perioperatoria en dosis de estrés. Se observó normalización de las cifras de testosterona total, androstendiona y DHEAS una semana tras la intervención quirúrgica, permaneciendo actualmente con controles hormonales normales.
La incidencia anual mundial de tumores adrenocorticales es de 0,3-0,8/millón de niños menores de 15 años3 y presenta una variabilidad importante entre las diferentes áreas geográficas, con una mayor incidencia en el sur de Brasil (3,4-4,2/millón de niños menores de 15 años)4,5. A pesar de su baja prevalencia, estos tumores han podido conocerse mejor en los últimos años gracias al Registro Internacional de Tumores Adrenocorticales4, y así se describe que la edad media de diagnóstico es de 3 años y la incidencia global es mayor en niñas (2,3:1)6. A pesar de que estos tumores pueden secretar varios tipos de hormonas, suelen predominar las manifestaciones clínicas de una de ellas. La virilización constituye la forma clínica de presentación más común (80%) y la cirugía es el procedimiento terapéutico más importante4. Los valores hormonales no solo son importantes para el diagnóstico, sino que son marcadores muy útiles en el seguimiento permitiendo detectar recidivas tumorales. En este caso, los valores hormonales se normalizaron una semana tras la resección quirúrgica, lo cual confirma que la resección fue curativa. El pronóstico es generalmente bueno en presencia de histología compatible con adenoma suprarrenal cuando este es completamente resecado como ocurrió en la paciente presentada6. La evolución del crecimiento y de la pubertad después de la resección de estos tumores ha sido pobremente descrita en la literatura y no ha sido totalmente esclarecido si esta exposición a dosis anormalmente elevadas de hormonas suprarrenales comprometerá la talla final adulta por fusión precoz de los cartílagos de crecimiento, existiendo datos contradictorios6–8. En este caso, debemos realizar una vigilancia estrecha del crecimiento y pubertad, y en un futuro se podrá describir la talla final y conocer si el patrón de crecimiento es similar a otros descritos previamente, con un catch-down en la progresión de la edad ósea y en la velocidad de crecimiento en los meses posteriores a la cirugía con un pronóstico adecuado de talla adulta8.