La esofagitis eosinofílica es una enfermedad emergente, crónica, mediada por el sistema inmune y caracterizada por síntomas de disfunción esofágica e inflamación con infiltración eosinofílica aislada en el esófago. Es más frecuente en varones y en sujetos atópicos y los síntomas varían con la edad: en niños pequeños se manifiesta con vómitos, dolor abdominal y problemas con la alimentación y en niños mayores y adolescentes con disfagia e impactación alimentaria. El diagnóstico se basa en la presencia de síntomas e inflamación esofágica con ≥ 15 eosinófilos/campo de gran aumento, tras descartar otras causas de eosinofilia esofágica. Sin tratamiento, la enfermedad suele persistir y puede evolucionar a formas fibroestenóticas más frecuentes en el adulto. Las opciones terapéuticas incluyen inhibidores de la bomba de protones, dieta de eliminación empírica y corticoides deglutidos. Tras el tratamiento de inducción es aconsejable la terapia de mantenimiento. La dieta es el único tratamiento que se dirige a la causa de la enfermedad, al identificar los alimentos desencadenantes. La respuesta a los tratamientos requiere la evaluación histológica, por la escasa concordancia entre los síntomas y la inflamación esofágica.
El manejo práctico de la esofagitis eosinofílica presenta desafíos debido, entre otras causas, a la falta de disponibilidad actual de fármacos específicos y a su abordaje con tratamientos dietéticos, en ocasiones, complejos. El presente documento, elaborado por el Grupo de Trabajo de Trastornos Gastrointestinales Eosinofílicos de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátricas, tiene como objetivo facilitar el abordaje diagnóstico y terapéutico de la esofagitis eosinofílica pediátrica, con base en las recientes guías de consenso basadas en la evidencia.
Eosinophilic oesophagitis is an emerging and chronic disorder mediated by the immune system, and is characterised by symptoms of oesophageal dysfunction and inflammation with isolated eosinophil infiltration in the oesophagus. It is more common in males and in atopic subjects, and the symptoms vary with age. In younger children, there is vomiting, abdominal pain and dietary problems, with dysphagia and food impaction in older children and adolescents. The diagnosis is based on the presence of symptoms and oesophageal inflammation with ≥ 15 eosinophils / high power field, and after ruling out other causes of oesophageal eosinophilia. Without treatment, the disease usually persists and can progress to fibrostenotic forms more common in adults. The treatment options included proton pump inhibitors, empirical elimination diets, and swallowed topical corticosteroids. Maintenance therapy is advisable after the induction treatment. Diet is the only treatment that is directed at the cause of the disease, on identifying the triggering food or foods. The response to the treatments requires a histological assessment due to the poor agreement between the symptoms and the oesophageal inflammation.
The practical management of Eosinophilic oesophagitis presents with challenges, due to, among other causes, the current lack of availability of specific drugs, and to its approach with, occasionally complex, diet treatments. The present document, prepared by the Working Group on Eosinophilic Gastrointestinal Disorders of the Spanish Society of Paediatric Gastroenterology, Hepatology and Nutrition, has as its objective to help in the diagnostic and therapeutic approach to paediatric eosinophilic oesophagitis, based on the recent evidence-based consensus guidelines.
La esofagitis eosinofílica (EoE) es una entidad emergente. Descrita como entidad clínico-patológica en los primeros años 901 su incidencia ha aumentado exponencialmente en las últimas décadas. En nuestro país, en edad pediátrica, se ha observado un aumento de incidencia anual del 19% entre los años 2002 y 20132 con una tasa de incidencia en 2017 de 10,6 casos por cada 100.000 habitantes/año y de prevalencia de 111 casos por cada 100.000 habitantes3.
La EoE constituye la causa más prevalente de esofagitis en pediatría y la etiología más frecuente de disfagia e impactación alimentaria en niños y adolescentes. Se trata de una enfermedad crónica que conlleva importante morbilidad y que puede incidir negativamente en la calidad de vida.
Desde el primer documento de consenso de diagnóstico y tratamiento de EoE publicado en el año 20074 se han elaborado nuevas guías, incorporando los avances en el diagnóstico y el tratamiento. La guía más reciente, publicada en 2017, ha sido elaborada con metodología basada en la evidencia y consensuada por sociedades científicas europeas del ámbito pediátrico y de adultos5.
La EoE es una enfermedad en evolución, cuyo manejo presenta desafíos debido, entre otras causas, a la falta de disponibilidad actual de fármacos específicos y a su abordaje con tratamientos dietéticos, en ocasiones, complejos.
El presente documento, elaborado por el Grupo de Trabajo de Trastornos Gastrointestinales Eosinofílicos de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátricas, tiene como objetivo facilitar el abordaje diagnóstico y terapéutico de la EoE pediátrica, con base en las recientes guías de consenso basadas en la evidencia.
DefiniciónLa EoE se define como una enfermedad local esofágica, crónica, mediada por el sistema inmune, caracterizada clínicamente por síntomas relacionados con disfunción esofágica e histológicamente por una inflamación predominante por eosinófilos. Se entiende como una entidad clínico-patológica, en la que los síntomas y la histología deben considerarse de forma conjunta5,6.
FisiopatologíaLa EoE está causada por una respuesta inmune no mediada por IgE a antígenos alimentarios, de forma principal, aunque no exclusiva. Un elemento esencial es la alteración de la barrera epitelial esofágica, que facilitaría la penetración de los alérgenos alimentarios, con estimulación de los linfocitos T helper 2 promovida por la linfopoyetina del estroma tímico (TSLP). Se producen citocinas proinflamatorias tales como la interleucina-13 (IL-13) y la eotaxina 3, que promueven el reclutamiento de los eosinófilos hacia el epitelio esofágico. Los eosinófilos se degranulan y liberan proteínas tóxicas, que favorecen la inflamación y, por último, la fibrosis a través de mediadores como el factor de crecimiento transformador β(TGF-β).
Se ha observado asociación familiar: entre un 5 y un 7% de los pacientes pediátricos tienen familiares de primer grado con EoE. Se han identificado variantes genéticas predisponentes, algunas ya reconocidas en otras formas de atopia (gen TSLP y gen CAPN14, calpaína 14) que podrían contribuir sinérgicamente con otras variantes más específicas (IL-4/KIF3A, interleucina 4/quinesina 3A) para la aparición de EoE. Sin embargo, los estudios epidemiológicos avalan que dicha asociación familiar se deriva sobre todo de la exposición a los mismos factores ambientales, con mucho menor peso de los factores genéticos. Estudios recientes han señalado que factores tempranos en la vida, como la fiebre materna, el parto prematuro, el parto por cesárea y el uso de antibióticos o supresores de ácido en la infancia, se asocian con mayor riesgo de EoE pediátrica.
DiagnósticoLa EoE se ha descrito en todas las razas y continentes, pero existe un ligero predominio entre los caucásicos. Es más frecuente en hombres que en mujeres (2,45: 1).
SíntomasLa presentación clínica de EoE puede variar según la edad de los niños y su capacidad para comunicar los síntomas. Se requiere un alto índice de sospecha de EoE porque los pacientes pueden desarrollar estrategias de adaptación en torno a la alimentación (tabla 1).
Síntomas de sospecha de esofagitis eosinofílica
| Lactantes y preescolares | Niños y adolescentes | Mecanismos compensatorios de la disfagia |
|---|---|---|
| Síntomas de reflujo gastroesofágicoNáuseasRegurgitacionesVómitosRechazo y aversión a alimentosFallo de medroDolor abdominalTos con la alimentación | DisfagiaImpactación alimentariaDolor retroesternal/torácicoVómitosPirosisDolor abdominalCarrasperaTos con la alimentación | Comer con trozos muy pequeñosComer lento, ayudándose con agua tras cada degluciónEvitar alimentos con ciertas texturasEn niños más pequeños: saltar tras la deglución para ayudar al paso del bolo |
Aumentan la sospecha diagnóstica de EoE: antecedentes personales de asma, dermatitis atópica, rinoconjuntivitis alérgica, sensibilización a aeroalérgenos, alergia alimentaria IgE mediada; antecedentes en familiares de primer grado de atopia o esofagitis eosinofílica; eosinofilia en sangre periférica.
En niños mayores y adolescentes los síntomas son más específicos (tabla 1). La impactación alimentaria puede ser el primer síntoma de presentación, puesto que la disfagia a sólidos puede ser intermitente.
La comorbilidad alérgica (dermatitis atópica, asma, rinoconjuntivitis, alergia alimentaria mediada por IgE) es más frecuente en pacientes con EoE que en la población general, lo que aumenta la sospecha diagnóstica.
EndoscopiaLa endoscopia digestiva alta es la primera prueba diagnóstica cuando se sospecha una EoE. Pueden observarse hallazgos endoscópicos característicos, pero no son patognomónicos.
Los hallazgos pueden ser de tipo inflamatorio: edema (con atenuación o pérdida de patrón vascular), exudados o placas blanquecinas, surcos longitudinales; y de tipo fibroestenótico: anillos concéntricos (traquealización) y estenosis. Los hallazgos fibroestenóticos son más frecuentes en adolescentes y adultos, que reflejan la progresión de la enfermedad hacia el remodelado esofágico. También se puede observar mucosa muy frágil con aspecto de papel crepe o esófago de calibre muy reducido7. El sistema de puntuación denominado endoscopic reference score (EREFS) sistematiza la descripción de los hallazgos endoscópicos, aunque los estudios sobre la concordancia con los datos histológicos han obtenido resultados conflictivos8.
La mucosa puede tener apariencia normal en un 10-30% de los casos, por lo que es imprescindible tomar biopsias esofágicas en todos los pacientes con sospecha diagnóstica.
HistologíaEl gold standard para el diagnóstico son los hallazgos de la biopsia esofágica que demuestran un aumento de eosinófilos intramucosos en el esófago. Las guías de consenso establecen un valor umbral (pico) de ≥ 15 eosinófilos/campo de gran aumento (eos/CGA) para diagnosticar la EoE. Otros hallazgos histológicos son: eosinófilos en sábana, microabscesos de eosinófilos, hiperplasia de la capa basal, edema intercelular o espongiosis, degranulación de los eosinófilos y elongación de las papilas del epitelio escamoso.
La infiltración eosinofílica del esófago puede ser parcheada, por lo que deben obtenerse biopsias del esófago proximal y distal (al menos 6 en total) para obtener un mayor rendimiento diagnóstico5,6. Al diagnóstico, se debe excluir la infiltración eosinofílica en estómago y duodeno mediante biopsias.
Criterios diagnósticosPara el diagnóstico se requiere la presencia de todos los criterios siguientes:
- •
Síntomas de disfunción esofágica.
- •
Inflamación esofágica eosinofílica, con ≥ 15 eosinófilos por campo de gran aumento (eos/CGA), que afecta solo al esófago.
- •
Exclusión de otras causas de eosinofilia esofágica (tabla 2).
Tabla 2.Enfermedades asociadas a eosinofilia esofágica
• Gastritis, gastroenteritis o colitis eosinofílica con afectación esofágica • Enfermedad por reflujo gastroesofágico • Acalasia y otros trastornos de dismotilidad esofágica • Síndrome hipereosinofílico • Enfermedad de Crohn con afectación esofágica • Infecciones (hongos, virus, parásitos) • Trastornos del tejido conectivo • Trastornos autoinmunes y vasculitis • Patologías dermatológicas con afectación esofágica (ejemplo: pénfigo) • Reacciones de hipersensibilidad a medicamentos • Esofagitis inducida por fármacos (antibióticos…) • Enfermedad de injerto contra huésped
En los recientes documentos de consenso, se establece que los inhibidores de la bomba de protones (IBP) corresponden a uno de los posibles tratamientos5,6. Por tanto, han dejado de considerarse como parte del proceso diagnóstico, y se elimina el término eosinofilia esofágica respondedora a IBP, ya que estos pacientes tienen las mismas características clínicas, endoscópicas, histológicas y genéticas que los no respondedores.
Historia naturalLa enfermedad no tratada suele asociarse a inflamación persistente y puede progresar a remodelación esofágica con desarrollo de estenosis, más frecuente en el adulto9. Aunque podrían existir diferentes fenotipos con distinta evolución, no se han identificado por el momento criterios clínicos, endoscópicos ni histológicos que los identifiquen.
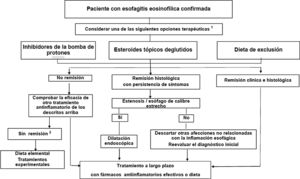
TratamientoLos objetivos del tratamiento incluyen la mejoría o resolución de los síntomas y la remisión de la actividad histológica para prevenir las complicaciones fibroestenóticas. Las últimas guías de consenso indican que tanto los IBP como las dietas de eliminación y los corticoides deglutidos pueden ser considerados como tratamiento de primera línea5 (fig. 1). La elección debe hacerse de modo individualizado para cada paciente. Tras el tratamiento de inducción de entre 8 a 12 semanas se debe hacer evaluación endoscópica e histológica, ya que los síntomas no presentan buena correlación con la actividad histológica.
Algoritmo terapéutico propuesto para la esofagitis eosinofílica.
Fuente: Tomado de Lucendo et al.5.
1 En pacientes con síntomas persistentes a pesar del tratamiento antinflamatorio la dilatación endoscópica debe ser considerada.
2 Remitir al paciente a un centro especializado en EoE.
Tras el tratamiento inicial, suele ser necesaria una terapia de mantenimiento, que es recomendable sobre todo en pacientes que presentan síntomas de recidiva rápidamente, con historia de impactación alimentaria o estenosis.
Inhibidores de la bomba de protonesLos IBP, además de su papel como inhibidores de la secreción ácida, han demostrado tener un efecto antiinflamatorio, reduciendo los niveles de citocinas tras la activación Th2. Se ha observado que los IBP bloquean la unión del transductor de señal y activador de la transcripción STAT6 al gen promotor de la eotaxina-3, disminuyen la traducción de dicha proteína10, restablecen la integridad de la mucosa esofágica dañada en estos pacientes11 y revierten el transcriptoma inflamatorio12.
En una revisión sistemática se observó una tasa de remisión histológica del 50% tras tratamiento con IBP en niños y adultos, sin apreciarse diferencias con relación al tipo de IBP13. En el primer estudio prospectivo de respuesta a IBP en población pediátrica (tras tratamiento con esomeprazol a 1mg/kg dosis 2veces al día durante 8 semanas) se obtuvo una tasa de remisión del 68,6% con una respuesta clínica del 80%14. En cuanto al mantenimiento de respuesta a largo plazo, tras un año de seguimiento, se ha demostrado en la población pediátrica hasta un 70% de remisión clínica e histológica con esomeprazol a 1mg/kg al día15.
Aunque la dosis óptima depende del fármaco (tabla 3), en general, se recomienda entre 1 y 2mg/kg al día en 2dosis para la inducción. Las dosis altas pueden asociarse a mayor tasa de respuesta. En el mantenimiento, dosis de 1mg/kg al día han demostrado ser eficaces, aunque deben intentar reducirse a la mínima dosis eficaz. Por el momento, no es posible predecir la respuesta a IBP, aunque recientemente se ha observado que podría estar relacionada con algunos polimorfismos del citocromo CYP2C19 y de STAT616.
Tratamiento con inhibidores de la bomba de protones en la esofagitis eosinofílica
| Dosis de inducción | Dosis de mantenimientoa | Preparados | Forma de administración | |
|---|---|---|---|---|
| Omeprazol / esomeprazol | 1 mg/kg por dosis, 2 dosis al día(máx 40 mg/12 h) | 1 mg/kg al día(máx 40 mg/día) | Comprimidos cápsulasb 20-40 mgSobres 10 mg | De 15 a 20 minutos antes de desayuno o cena |
| Lansoprazol | 0,75 mg/kg por dosis, 2 dosis al día (máx 30 mg/12 h) | 0,75 mg/kg al día (máx 30 mg/día) | Comprimidosc 15-30 mg |
En cuanto a la seguridad a largo plazo, aunque los estudios en adultos muestran una alta seguridad de su uso entre 5 y 12 años17, en la población pediátrica son escasos. No obstante, los efectos secundarios suelen ser leves, poco frecuentes y transitorios relacionados sobre todo con cefalea, diarrea y, en ocasiones, urticaria. Se ha descrito que podría aumentar el riesgo de infecciones gastrointestinales y respiratorias y de ferropenia con el uso prolongado.
Los IBP suelen mostrarse menos eficaces que los corticoides deglutidos, pero, dada su facilidad de administración y buen perfil de seguridad, constituyen una buena opción de tratamiento en la EoE pediátrica.
Tratamiento dietéticoEl tratamiento dietético es el único que se dirige a la causa de la enfermedad. El objetivo final es identificar qué alimento o alimentos desencadenan la inflamación esofágica y eliminarlos de la dieta a largo plazo. La estrategia incluye inducir la remisión clínica e histológica con una dieta más restrictiva inicial, seguida de una introducción secuencial de alimentos con controles clínicos y endoscópicos para identificar los alimentos causantes. La ventaja del tratamiento dietético radica en la posibilidad de mantener la remisión a largo plazo y evitar los posibles efectos adversos de los fármacos. Sin embargo, hay que tener en cuenta que podría conllevar un deterioro en la calidad de vida18, aunque no se dispone de ningún estudio cuyo objetivo primario haya sido evaluar el efecto en la calidad de vida a lo largo de un tratamiento dietético.
Es necesario valorar la viabilidad de la terapia dietética en pacientes que ya siguen dietas restrictivas por alergia a alimentos mediada por IgE. El tratamiento dietético requiere motivación por parte de los pacientes y sus familias; en general hay una peor adherencia a las dietas en los adolescentes.
Dieta elementalConsiste en evitar cualquier alimento y sustituirlo por una fórmula nutricionalmente completa con aminoácidos libres. Induce la remisión histológica en hasta 90% de los pacientes con EoE19. Su reducida palatabilidad, que obliga con frecuencia al uso de sonda nasogástrica, la escasa adhesión al tratamiento, la gran dificultad para el proceso de reintroducción de alimentos (con múltiples endoscopias), los efectos psicológicos y sociales y su alto coste limitan de forma importante su indicación.
Se recomienda solo durante periodos de tiempo limitados, en niños pequeños con EoE con gran afectación nutricional o con síntomas muy graves que imposibilitan la alimentación natural.
Dieta dirigida por pruebas de alergiaConsiste en excluir de la dieta aquellos alimentos con resultados positivos en las pruebas de alergia (PRICK, CAP/RAST o test del parche). Es la que menos eficacia global ha demostrado, solo alrededor del 45% de los pacientes responden, con resultados muy variables de unos centros a otros19. Las pruebas alérgicas disponibles presentan muy baja concordancia con los alimentos identificados tras eliminación y reintroducción con evaluación histológica20, tal y como ha sido recogido en un documento elaborado por miembros de la Academia Europea de Alergia e Inmunología Clínica21. Por ello, las dietas de eliminación dirigidas por pruebas alérgicas no se recomiendan en el tratamiento de la EoE pediátrica.
Dietas empíricasEn esta modalidad se eliminan los alimentos con más frecuencia relacionados con la EoE, de forma independiente a las pruebas alérgicas. Al principio, un grupo de investigadores americano ensayó la dieta de eliminación empírica de 6 grupos de alimentos (leche de vaca, huevo, trigo, soja, pescado-marisco y frutos secos), con una tasa de remisión histológica del 74% (tabla 4)22. Estos resultados han sido corroborados en estudios en nuestro país19,23.
Eficacia de la dietas empíricas utilizadas en el tratamiento de la esofagitis eosinofílica en estudios prospectivos
| Tipo de dieta | Población | Tasa de remisión histológica en % | Alimentos desencadenantes en % | |||
|---|---|---|---|---|---|---|
| Leche | Trigo/gluten | Huevo | Legumbres | |||
| Dieta de 6 alimentos | ||||||
| Kawalgalla et al. (2011, EE. UU)24Leche/trigo/huevo/soja/pescado y marisco/frutos secos | Niños | 74 | 74 | 26 | 17 | Soja 10 |
| Lucendo et al. (2013, España)23Leche/cereales/huevo/legumbres/pescado y marisco/frutos secos | Adultos | 72 | 62 | 29 | 26 | 24 |
| Dieta de 4 alimentos | ||||||
| Molina-Infante et al. (2014, España)25Leche de vaca/gluten/huevo/legumbres | Adultos | 54 | 50 | 36 | 31 | 18 |
| Kawalgalla et al. (2017, EE. UU.)26Leche/trigo/huevo/soja | Niños | 64 | 85 | 33 | 35 | |
| Dieta de 2 alimentosMolina-Infante et al. (2018, España)27Leche/gluten | Niños y adultos | 43 | 60 | 44 | - | - |
| Dieta sin lecheKliewer et al. (2019, EE. UU.)28 | Niños | 44 |
La reintroducción secuencial de cada uno de los 6 grupos de alimentos excluidos, bajo control endoscópico e histológico cada 8-12 semanas, permite identificar con certeza los alimentos causantes de la EoE en cada paciente24, pero obliga a dietas muy restrictivas y a un gran número de endoscopias. Además, en estos estudios se observó que hasta el 75% de los respondedores tenían solo 1 o 2 alimentos desencadenantes: los más frecuentemente implicados eran leche, seguida de gluten/huevo y, en menor medida, soja/legumbres (tabla 4). Por estos motivos la dieta empírica de 6 alimentos no se recomienda en la actualidad en el manejo dietético de la EoE.
Se han empleado dietas menos restrictivas, como la dieta de eliminación de 4 grupos de alimentos (leche, trigo, huevo y soja) con una eficacia de hasta el 64%25,26. Un estudio reciente evaluó la eficacia de un abordaje escalonado iniciado con la exclusión de 2alimentos (leche y gluten), ascendiendo a 4(leche, gluten, huevo y legumbres) si no había respuesta y finalmente a 6(eliminando además pescados/mariscos y frutos secos) con unas tasas de remisión en niños de un 40, 57 y 76%, respectivamente. En comparación con la dieta de eliminación inicial de 6grupos de alimentos, esta estrategia escalonada permitió reducir los procedimientos endoscópicos y el tiempo del proceso de diagnóstico en un 20%. Una ventaja adicional es que el 90% de los respondedores a una dieta empírica de 2 o 4 alimentos tenían solo uno o 2alimentos causantes. Estos pacientes son buenos candidatos para tratamiento dietético a largo plazo, al contrario de los que precisaron escalar a restricción de 6 alimentos, que tenían múltiples alimentos desencadenantes27.
La leche ha sido el alimento con más frecuencia implicado en la EoE pediátrica. Estudios preliminares han evaluado de manera prospectiva la eficacia de la eliminación exclusiva de la leche, con una tasa de remisión del 44% y un impacto positivo en la calidad de vida28.
A largo plazo, algunos estudios han confirmado el mantenimiento de la remisión histológica durante al menos 3-4 años sin necesidad de fármacos, pero con una tasa de abandono del tratamiento en torno al 50%26,29.
En resumen, las dietas empíricas menos restrictivas son las de elección en el manejo de la EoE: se recomienda empezar con la eliminación de 2alimentos y aumentar el nivel de restricción a 4en aquellos pacientes que no responden y siguen motivados para identificar los alérgenos responsables30.
Seguridad de las dietas de eliminaciónLas dietas de eliminación pueden afectar al consumo de macro y de micronutrientes. El seguimiento nutricional debe hacerse durante el proceso diagnóstico, sobre todo con las dietas más restrictivas y en pacientes con exclusión previa de múltiples alimentos por alergia mediada por IgE. Los suplementos con micronutrientes o fórmulas elementales son recomendables en estos casos para alcanzar los requerimientos nutricionales diarios31,32.
Se han publicado algunos casos de reacciones alérgicas moderadas-graves mediadas por IgE tras la reintroducción de alimentos previamente eliminados. Aunque estas reacciones son infrecuentes, se debe considerar la valoración por el alergólogo y la reintroducción controlada y segura, en especial en niños con alto riesgo atópico y tras eliminación prolongada33.
En el anexo b (material adicional en Internet) se detallan las dietas de eliminación de los alimentos desencadenantes más comunes, así como las estrategias de sustitución de los alimentos excluidos para mantener el equilibrio nutricional.
Corticoides tópicos deglutidosLa administración tópica de corticoides es la vía de elección frente a la sistémica. El propionato de fluticasona deglutido ha mostrado una eficacia similar a la prednisona oral en un ensayo clínico aleatorizado realizado en niños. Sin embargo, la formulación sistémica se asoció a efectos adversos significativamente más graves34. El uso de corticoides sistémicos solo debería considerarse en situaciones de urgencia con disfagia grave con pérdida de peso significativa o estenosis severas.
Diferentes metaanálisis confirman la eficacia de la terapia con esteroides tópicos, con una tasa de remisión histológica variable entre el 68% y el 76% de media para fluticasona y budesonida, respectivamente35. Los agentes más utilizados en los diferentes ensayos clínicos son la fluticasona nebulizada (en suspensión para inhalación en envase a presión) y la budesonida en suspensión viscosa. Las preparaciones viscosas ofrecen mayores tasas de remisión histológica que las nebulizadas, al conseguir un tiempo de contacto en la mucosa esofágica significativamente mayor, en especial en el esófago distal36.
En la práctica clínica actual, los corticoides utilizados consisten en formulaciones diseñadas para otras enfermedades como asma o rinitis. Las más utilizadas son la budesonida oral viscosa y la fluticasona líquida (tabla 5). Ha sido aprobado por la Agencia Europea del Medicamento el primer corticoide tópico específicamente diseñado para EoE en pacientes adultos. Se trata de comprimidos orodispersables de budesonida de 1mg. Su eficacia y seguridad quedaron demostradas en un ensayo clínico aleatorizado realizado en adultos, con unas tasas de remisión histológica superiores al 90% tanto en esófago proximal como distal37. En la actualidad este fármaco está comercializado en varios países de Europa, si bien no está todavía disponible en España.
Corticoides tópicos deglutidos en el tratamiento de la esofagitis eosinofílica
| Edad | Dosis de inducción | Dosis de mantenimiento | |
|---|---|---|---|
| Budesonida oral viscosa | <10 años>10 años | 0,5 mg/dosis (2 dosis al día)1 mg/dosis (2 dosis al día) | 0,5 mg/dosis (1 dosis al día)1 mg/dosis (1 dosis al día) |
| Fluticasona líquida | <10 años>10 años | 400μg/dosis (2 dosis al día)800μg/dosis (2 dosis al día) | 400μg/dosis (1 dosis al día)800μg/dosis (1 dosis al día) |
2 dosis al día: después del desayuno y antes de acostarse.
1 dosis al día: antes de acostarse.
No beber ni ingerir nada, no lavarse los dientes ni enjuagarse la boca 30-60 minutos tras la administración.
Budesonida: no ingerir pomelo ni zumo de pomelo porque inhibe el citocromo CYP3A, responsable del primer paso hepático.
Preparación de budesonida oral viscosa:
Fórmula preparada por el paciente antes de cada administración: budesonida suspensión para inhalación por nebulizador.
Dosis de 0,5mg: 1 ampolla (2ml) de budesonida 0,25mg/ml mezclada con 4-5 g de maltodextrina.
Dosis de 1mg: 1 ampolla (2ml) de budesonida 0,5mg/ml mezclada con 4-5 g de maltodextrina.
Fórmula magistral preparada en la farmacia: concentración 0,2mg/ml o 0,5mg/ml.
Fluticasona líquida oral:
Ampollas nasales de 400 microgramos de fluticasona ingeridas directamente por vía oral (preferiblemente liberar el contenido en la base de la lengua para garantizar mejor distribución del fármaco en esófago).
La dosis de inducción recomendada va a depender de si el niño es mayor o menor de 10 años y del corticoide utilizado (tabla 5).
En pacientes que responden a corticoides tópicos, la terapia a largo plazo es efectiva para mantener la remisión en una proporción de pacientes. Un estudio prospectivo en niños que respondieron a fluticasona nebulizada reveló que la administración a largo plazo de dosis similares a las de inducción condujo a una remisión sostenida en el 63% de los pacientes tras más de 2 años de seguimiento38. En los pacientes que han respondido al tratamiento de inducción, se recomienda seguir el mantenimiento con la mitad de la dosis inicial (tabla 5).
El tratamiento con corticoides tópicos parece tener un perfil de seguridad favorable sin efectos secundarios. La mayoría de los ensayos clínicos no mostraron diferencias respecto al placebo en cuanto a aparición de efectos adversos, a excepción de la candidiasis esofágica, observada en el 5-26% de los pacientes36,39, generalmente asintomática y diagnosticada de forma incidental en endoscopias de control.
Existe poca evidencia respecto al riesgo de supresión suprarrenal en niños inducida por el tratamiento a largo plazo con corticoides tópicos. La mayoría de los estudios son observacionales, con series cortas de pacientes40. Hasta que haya más información disponible, la monitorización de cortisol para prevenir la insuficiencia suprarrenal podría ser aconsejable para niños con EoE si reciben altas dosis de esteroides tópicos durante largos períodos o bien si reciben de forma concomitante corticoides por otras vías (oral, inhalada o nasal)5.
Dilatación esofágicaEn edad pediátrica, la estenosis suele ser inflamatoria y responde al tratamiento médico antiinflamatorio, por lo que la dilatación se reserva para casos muy seleccionados con estenosis esofágica grave que persiste tras dicho tratamiento.
Otros tratamientosHay muy pocos datos sobre el tratamiento de los pacientes refractarios a los 3tratamientos reseñados. La terapia combinada con IBP y corticoides podría ser útil en algunos casos, aunque la evidencia científica es escasa. Se ha estudiado la eficacia de anticuerpos monoclonales anti-IL-5 (mepolizumab y reslizumab), anti-IL13 y anti-IL-4 receptor α (dupilumab) en niños y adultos con EoE, de los que el dupilumab es el que ha mostrado mayor eficacia. El tratamiento biológico puede considerarse en casos de EoE refractaria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Carmen Alonso Vicente, Hospital Clínico Universitario de Valladolid.
Marina Álvarez Beltrán, Hospital Universitario Maternoinfantil Vall d’Hebron, Barcelona.
Josefa Barrio Torres, Hospital Universitario de Fuenlabrada, Madrid.
Patricia Barros García, Complejo Hospitalario Universitario de Cáceres, Cáceres.
Gemma Colomé Rivero, Hospital de Nens de Barcelona, Barcelona.
Francisco Javier Eizaguirre Arocena, Hospital Universitario Donostia, San Sebastián.
Beatriz Fernández Caamaño, Hospital Alvaro Cunqueiro, Vigo.
Enrique la Orden Izquierdo, Hospital Universitario Infanta Elena, Valdemoro, Madrid.
Rosaura Leis Trabazo, Hospital Clínico Universitario de Santiago-USC, Santiago de Compostela.
Helena Lorenzo Garrido, Hospital Universitario Basurto, Bilbao.
Enrique Medina Benítez, Hospital Universitario Doce de Octubre, Madrid.
Montserrat Montraveta Querol, Hospital Germans Trias i Pujol, Badalona.
Raquel Vecino López, Hospital Clínico Universitario, Madrid.